Стабильное получение лентивирусных векторов
Иллюстрации
Показать всеИзобретения касаются способов получения стабильной линии пакующих лентивирусы клеток (варианты), стабильной линии пакующих лентивирусы клеток, способа получения лентивирусных векторов, линии клеток-продуцентов и способа производства лентивирусных векторов. Представленные изобретения созданы с применением гибридной системы бакуло-AAV для стабильной экспрессии структурных и регуляторных лентивирусных белков. Такая система содержит бакуловирусный остов, содержащий кассету интеграции, фланкированную ITR AAV, в сочетании с плазмидой, кодирующей белок rep. Представленная система позволяет осуществлять стабильную интеграцию структурных и регуляторных белков ВИЧ-1 gag/pol и rev и получать первый промежуточный продукт, содержащий только структурные и регуляторные белки ВИЧ gag/pol и rev, используемый в качестве исходной точки для получения стабильных линий пакующих клеток, а также линий клеток-продуцентов. Изобретения могут быть использованы в генной терапии. 6 н. и 24 з.п. ф-лы, 6 ил., 6 табл., 6 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к получению лентивирусных векторов (LV) для генной терапии. Более конкретно, изобретение относится к стабильным линиям пакующих лентивирусы клеток и способам получения линий пакующих клеток с использованием гибридного бакуло-аденоассоциированного вирусного (AAV) вектора для стабильной интеграции структурных и регуляторных лентивирусных белков.
Уровень техники
После самого первого клинического испытания LV фазы I против СПИДа в 2001 контролирующими органами были рассмотрены результаты 38 испытаний фазы I-II и два испытания фазы II-III, в которых использовали основанные на ВИЧ LV в качестве носителей для доставки генов; три из них еще находятся на рассмотрении. Наибольшее количество испытаний включают моногенные расстройства, некоторые из которых встречаются с высокой частотой, такие как анемия Кули или большая β-талассемия (4 испытания). Далее следуют злокачественные опухоли и инфекционные болезни, главным образом инфекция ВИЧ-1. Обычно количество пациентов, набираемых для испытаний, ограничено в фазе I/II, но не ограничено в фазе III. Таким образом, существует неотложная необходимость в стабильных линиях пакующих клеток для 2-ого (основанного на LTR) и 3-его (основанного на SIN) поколения LV, чтобы обеспечить неотложную потребность в крупномасштабном получении LV для испытаний фазы III, которые, как следует надеяться, могут быть осуществлены в будущем в большом количестве. Получение LV, основанное на временных протоколах, в действительности, является непригодным для широкого применения с точки зрения безопасности, затрат и воспроизводимости.
Возрастающее количество доказательств свидетельствуют о том, что LV, совсем недавно разработанные вирусные интегрирующиеся векторы для генной терапии, широко применимы для трансдукции либо окончательно дифференцированных, либо делящихся клеток, идеальны для поддержания долговременной экспрессии трансгена и более безопасны, чем предполагали вначале. Опыт, накопленный при использовании гамма-ретровирусных векторов (γ-RV) на основе вируса лейкоза мышей Молони (MoMLV) в последние два десятилетия, привел к быстрому прогрессу в создании LV-систем доставки, разработка которых началась в связи с необходимостью преодолеть неспособность ретровируса трансдуцировать неделящиеся клетки. В частности, создание самоинактивируемых (SIN) векторов для переноса делает более вероятными планы широкого применения LV в клинических испытаниях на человеке [1], при условии расширения и оптимизации такого эффективного способа производства. Однако в отличие от γRV, который может быть продуцирован несколькими коммерчески доступными линиями пакующих клеток человека и мыши, LV в настоящее время получают не только со степенью чистоты для исследований, но также со степенью чистоты, соответствующей стандарту GMP, почти исключительно в результате временной трансфекции. Такая методика является дорогостоящей, ее трудно стандартизовать и масштабировать, и она требует многочисленных подтверждающих тестов в ходе выполнения. Кроме того, риск появления компетентных по репликации лентивирусов (RCL), вероятно возникающих в результате рекомбинации между вирусными последовательностями в пакующей конструкции и конструкции вектора для переноса, является редким, но более вероятным событием в ходе временной продукции, чем в ходе стабильной продукции.
Разработка стабильной линии пакующих клеток для LV, эквивалентной линии пакующих ретровирусы клеток, оказалась более медленной и более трудной, так как, в отличие от гамма-ретровируса, экспрессия лентивирусных белков, таких как env, протеаза и некоторые вспомогательные белки, является токсичной для клеток человека. Чтобы преодолеть такую проблему, вспомогательные гены, присутствующие в наиболее ранних вариантах пакующих клеток, затем в последних поколениях были удалены. Основанные на SIV- и ВИЧ линии пакующих LV клеток первого поколения получали из прикрепляющихся клеток либо Vero обезьян, либо COS, HeLa и 293 человека [2-5], сконструированных с использованием лентивирусных геномов, несущих несколько важных модификаций, таких как удаление сигнала упаковки. Ген gp120 env и большинство вспомогательных генов, фактически сохранялись. Получаемый титр LV был очень низким [2-5], и что более важно, возможное применение таких векторов неизбежно ограничено T-клетками CD4+ для способов направленной против СПИДа генной терапии. Позже gp120 env заменили гликопротеидом, полученным из вируса везикулярного стоматита (VSV-G) и все вспомогательные гены были удалены, поскольку, как было доказано, они являются необязательными для эффективной продукции LV. Чтобы предотвратить токсичность, также описанную для VSV-G, его экспрессию при определенных условиях индуцировали, используя множество различных систем, таких как Tet, экдизон, Rev и сочетание Tet и кумата [20]. Подобным образом, чтобы снизить токсический эффект вирусной протеазы во время клональной селекции, описана экспрессия гена gag-pol, обусловленная Tet и сочетанием лекарственных средств доксициклина и кумата [7]. Во всех таких системах гены gag-pol, rev и env были интегрированы посредством временной трансфекции плазмидной ДНК с последующим отбором с использованием лекарственных средств и клонированием клеток.
Одной важной проблемой при использовании действительно стабильной линии пакующих клеток является выбор наилучших носителей для доставки вирусных генов. Большинство исследователей интегрировали гены gag-pol, rev и env посредством временной трансфекции плазмидной ДНК с последующим отбором с использованием лекарственных средств и клонированием клеток [7-10]. Известно, что такая методика страдает таким недостатком, что с течением времени возникает сайленсинг генов и утрата генов [11], что также может ставить под угрозу долговременную стабильность пакующего клона.
Альтернативные носители для доставки генов раскрыты в частности в случае линии пакующих клеток STAR [12] и в случае недавно разработанной линии пакующих клеток GPRG-TL-20 [6], в которых гены gag, pol и rev были интегрированы в клетки HEK293T с помощью MLV-челночных векторов. Две копии регистрируемого гена gag-pol были стабильно интегрированы в STAR, тогда для GPRG-TL-20 [6] подобная информация отсутствует. В отличие от STAR, где осуществляли трансфекцию гена env, в GPRG-TL-20 все сохраняемые вирусные гены были введены посредством SIN-MLV.
Существует несколько систем, которые обеспечивают стабильную интеграцию чужеродного генома в клетки-хозяева. Palombo с соавторами, 1998 [13], описывают гибридный бакуловирусный-AAV-вектор для специфичной интеграции в клетки-хозяева. Такой вектор, по-видимому, является очень эффективным, если он содержит ген rep в том же гибридном бакуловирусном-AVV-векторе. В указанной публикации нет упоминания о конструкции согласно настоящему изобретению, не говоря уже о предложении использовать систему такого вида для продуцирования LV.
На протяжении последних почти двух десятилетий было предпринято несколько попыток создания стабильных линий клеток, пакующих LV. Несмотря на различные раскрытые методики на сегодняшний день ни одна из таких линий пакующих клеток еще не используется в клинических испытаниях и не вышла на рынок. Поэтому существует необходимость в новых системах для крупномасштабного получения LV, которые являются эффективными с точки зрения производительности и являются безопасными, рентабельными и воспроизводимыми.
Сущность изобретения
Настоящее изобретение относится к области получения LV. Проходит несколько клинических испытаний генной терапии с использованием LV в качестве носителей для доставки генов. Во всех таких испытаниях получение LV еще основано на временных протоколах.
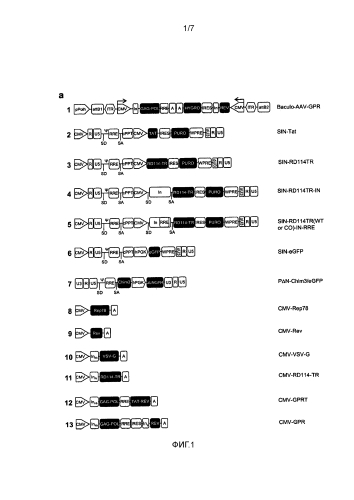
Настоящее изобретение относится к новой методике создания основанной на ВИЧ-1 линии пакующих клеток. Такая методика основана на применении гибридного вектора, содержащего бакуловирусный остов, включающий в себя кассету интеграции, фланкированную ITR AAV, так называемой гибридной системы бакуло-AAV, в сочетании с плазмидой, кодирующей белок rep. Такая система позволяет получать стабильную интеграцию структурных белков ВИЧ-1 gag/pol и rev. Система согласно настоящему изобретению включает в себя a) гибридный вектор бакуло-AAV, отличающийся тем, что он содержит две кассеты экспрессии, одна из которых кодирует лентивирусные гены gag и pol, а другая кодирует лентивирусный rev и маркер селекции, и b) плазмиду, кодирующую белок rep. Предложенная система представляет собой новый и обладающий преимуществами путь доставки структурных и регуляторных белков ВИЧ-1, чтобы стабильно и эффективно сконструировать клетки-хозяева с такими лентивирусными белками. Используя такую систему, получили первый промежуточный продукт, содержащий только структурные и регуляторные белки ВИЧ-1 gag/pol и rev, применимый в качестве исходной точки для получения линий пакующих клеток 2-ого и 3-его поколения, содержащих, соответственно, регуляторный белок (tat) и представляющий интерес белок оболочки или только белок оболочки, а также линий клеток-продуцентов, также содержащих вектор для переноса.
Первый промежуточный продукт несет две копии рекомбинантной пакующейся конструкции бакуло-AAV, экспрессирующей гены ВИЧ-1 gag-pol и rev в трехцистронной конфигурации. Такой промежуточный продукт был назван PK-7 и упоминается как PK-7 в примерах. Геномной интеграции пакующегося вектора бакуло-AAV способствовала временная экспрессия белка AAV rep78, который, как известно, необходим для ITR-опосредованной интеграции вектора AAV [14]. Показано, что такой первый промежуточный продукт обладает неожиданной генетической стабильностью в течение 1 года культивирования, что свидетельствует о непрерывной продукции функционального LV после временной трансфекции оставшихся генетических элементов. Кроме того, в таких клетках не наблюдали явления сайленсинга. Кроме того, благодаря точному картированию сайта интеграции двух тандемно интегрированных пакующих векторов AAV в некодирующей межгенной транскрипционно активной области, авторы получили аргумент в пользу безопасности и против возможной активации опасных генов, мРНК которых может быть включена в LV и в конечном итоге в клетки-хозяева, являющиеся мишенями.
Из первого промежуточного продукта могут быть получены стабильные линии пакующих клеток 2-ого и 3-его поколения. В частности, согласно настоящему изобретению линия пакующих клеток 3-его поколения может быть получена в результате стабильной интеграции в первый промежуточный PK-7 представляющего интерес белка оболочки, такого как ретровирусные env MLV 4070, env RD114 или env GALV или их производные. Стабильную интеграцию можно получить, используя доставку SIN-LV, но можно использовать и другие носители для доставки генов. Авторы изобретения получили соответствующую линию пакующих клеток, называемую в примере PK-7-RD, посредством интеграции химерного белка оболочки RD114-TR, который содержит внеклеточный и трансмембранный домены оболочки, полученные из эндогенного ретровируса кошачьих, и цитоплазматический хвост env MLV 4070 [15]. Интеграцию химерного белка оболочки RD114-TR получали с использованием доставки SIN-LV.
Чтобы получить линии клеток-продуцентов 2-ого и 3-его поколения SIN-Tat, SIN-Env и вектор переноса или только SIN-Env и вектор переноса, соответственно, интегрировали в результате последовательной доставки. В принципе, интеграция одного вектора за один раз, хотя требует много времени, но снижает риск гомологичной рекомбинации и тем самым образование RCL.
Разработанная пакующая система на основе применения гибридного вектора бакуло-AAV для стабильной экспрессии лентивирусных gag-pol и rev была названа «MolPack», поэтому линия клеток-продуцентов 2-ого поколения, разработанная с использованием такой системы и содержащая RD114-TR и tat в качестве белка оболочки и регуляторного белка, соответственно, и вектор переноса, кодирующий Chim3 в качестве терапевтического гена, названа в примерах RD2-MolPack-Chim3.
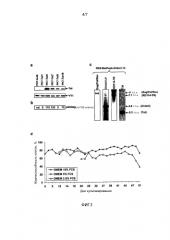
Примечательно, что титр LV, полученный из клонов RD2-MolPack-Chim3, был более чем на 2-log выше, чем титр LV, полученных из контрольных клеток HEK293T, что свидетельствует о том, что RD2-MolPack-Chim3 образует более функциональные LV по сравнению с эквивалентными LV, получаемыми с использованием временного протокола, при наличии дополнительного преимущества продуцирования стабильной линией клеток-продуцентов, которая является экономически эффективной и безопасной.
Основные положения изобретения
Согласно первому аспекту изобретения предлагается система для стабильной экспрессии лентивирусных структурных и регуляторных белков, состоящая из:
i) гибридного вектора, содержащего бакуловирусный остов, который содержит кассету интеграции, фланкированную ITR AAV, включающую в себя две кассеты экспрессии, при этом первая кассета экспрессии кодирует лентивирусные гены gag и pol, а вторая кассета экспрессии кодирует лентивирусный rev и селектируемый маркер, и
ii) экспрессирующей плазмиды, содержащей открытую рамку считывания (ORF) Rep AAV под контролем промотора.
Предпочтительно две кассеты экспрессии гибридного вектора находятся в ориентации хвост-к-хвосту, и каждая кассета управляется конститутивным промотором и поли-A, предпочтительно промотор выбран из CMV, CMV IE, PGK, SV40, eF1α SFFV и RSV, более предпочтительно промотором является промотор CMV IE.
Согласно предпочтительному аспекту изобретения селектируемый маркер выбран из гена резистентности к гигромицину, канамицину, неомицину или зеомицину, более предпочтительно селектируемым маркером является ген резистентности к гигромицину.
Предпочтительно селектируемый маркер клонируют ниже участка внутренней посадки рибосомы (IRES).
Предпочтительно белок rep AAV выбран из rep78 или rep68. Более предпочтительно белком rep является rep78.
Согласно другому аспекту изобретения предлагается полустабильная линия пакующих лентивирусы клеток, состоящая из клеток, стабильно экспрессирующих лентивирусные gag pol и rev, отличающаяся тем, что такие клетки содержат стабильно интегрированную в их геном, по меньшей мере, одну копию кассеты интеграции, фланкированную ITR AAV, включающую в себя две кассеты экспрессии, при этом первая кассета экспрессии кодирует лентивирусные гены gag и pol, а вторая кассета экспрессии кодирует лентивирусный rev и селектируемый маркер.
Предпочтительно клеткой является линия клеток человека, предпочтительно выбранная из HEK293, HEK293-T, HEK293-SF, TE671, HT1080 или HeLa, более предпочтительно линией клеток является HEK293-T.
Предпочтительно две кассеты экспрессии находятся в ориентации хвост-к-хвосту, и каждая кассета управляется конститутивным промотором и поли-A; предпочтительно промотор выбран из CMV, CMV IE, PGK, SV40, eF1α, SFFV и RSV, более предпочтительно конститутивным промотором является промотор CMV IE.
Согласно предпочтительному аспекту изобретения селектируемый маркер выбран из гена резистентности к гигромицину, канамицину, неомицину, зеомицину; более предпочтительно селектируемым маркером является ген резистентности к гигромицину. Более предпочтительно селектируемый маркер клонируют ниже IRES.
Предпочтительно белок rep AAV выбран из rep78 или rep68. Более предпочтительно белком rep является rep78.
Согласно другому аспекту изобретения предлагается способ получения стабильной линии клеток, пакующих лентивирусы, включающий в себя:
i) получение гибридного вектора (A), содержащего бакуловирусный остов, содержащий кассету интеграции, фланкированную ITR AAV, включающую в себя две кассеты экспрессии, при этом первая кассета экспрессии кодирует лентивирусные гены gag и pol, а вторая кассета экспрессии кодирует лентивирусный rev и селектируемый маркер; и
ii) получение экспрессирующей плазмиды (B), содержащей ORF rep AAV под контролем промотора;
iii) трансфекцию клеток экспрессирующей плазмидой B и затем инфекцию клетки гибридным вектором A;
iv) культивирование клеток в присутствии антибиотика для селекции;
v) получение клеток, стабильно экспрессирующих белки sing gag, pol и rev;
vi) интеграцию гена env в таких клетках;
vii) культивирование клеток, чтобы получить линию клеток, стабильно экспрессирующих белки gag, pol, rev и env.
Согласно другому аспекту изобретения предлагается способ получения стабильной линии клеток, пакующих лентивирусы, включающий в себя:
i) получение гибридного вектора (A), содержащего бакуловирусный остов, содержащий кассету интеграции, фланкированную ITR AAV, включающую в себя две экспрессирующих кассеты, при этом первая кассета экспрессии кодирует лентивирусные гены gag и pol, а вторая кассета экспрессии кодирует лентивирусный rev и селектируемый маркер; и
ii) получение экспрессирующей плазмиды (B), содержащей ORF rep AAV под контролем промотора;
iii) трансфекцию клетки экспрессирующей плазмидой B и затем инфекцию клетки гибридным вектором A;
iv) культивирование клеток в присутствии антибиотика для селекции;
v) получение клеток, стабильно экспрессирующих белки gag, pol и rev;
vi) интеграцию лентивирусного гена tat в таких клетках;
vii) культивирование клеток для получения линии клеток, стабильно экспрессирующих белки gag, pol, rev и tat;
viii) интеграцию гена env в таких клетках;
ix) культивирование клеток для получения линии клеток, стабильно экспрессирующих белки gag, pol, rev, tat и env.
Предпочтительно две кассеты экспрессии гибридного вектора находятся в ориентации хвост-к-хвосту, и каждая кассета экспрессии управляется конститутивным промотором и поли-A; предпочтительно промотор выбран из CMV, CMV IE, PGK, SV40, eF1α, SFFV и RSV, более предпочтительно конститутивным промотором является промотор CMV IE.
Предпочтительно геном tat является tat ВИЧ-1.
Согласно предпочтительному аспекту изобретения селектируемый маркер выбран из гена резистентности к гигромицину, канамицину, неомицину, зеомицину; предпочтительно селектируемым маркером является ген резистентности к гигромицину, более предпочтительно селектируемый маркер клонируют ниже IRES.
Предпочтительно ген env интегрируют в клетки-хозяева с использованием вектора AAV, ретровирусного вектора, стабильной интеграции плазмиды или гомологичной рекомбинации. Согласно более предпочтительному аспекту ген env интегрируют, используя лентивирусный SIN-вектор.
Предпочтительно ген env выбран из env MLV 4070, env D114, химерного белка оболочки RD114-TR, химерного белка оболочки RD114pro, бакуловирусного env GP64 или env GALV или их производных; более предпочтительно геном env является ген, кодирующий химерный белок оболочки RD114-TR.
В предпочтительном варианте предлагается лентивирусный SIN-вектор, содержащий кассету экспрессии, содержащую от 5'- к 3'-концу промотор CMV, интрон β-глобина, содержащий элемент RRE в своей последовательности, и ORF RD114-TR для стабильной интеграции химерного белка оболочки RD114-TR.
Предпочтительно белок rep AAV выбран из rep78 или rep68. Более предпочтительно белком rep является rep78.
Согласно другому аспекту изобретения предлагается стабильная линия клеток, пакующих лентивирусы, содержащая стабильно интегрированные в их геном:
i) по меньшей мере, одну копию кассеты интеграции, фланкированную ITR AAV, включающую в себя две кассеты экспрессии, при этом первая кассета экспрессии кодирует лентивирусные гены gag и pol, а вторая кассета экспрессии кодирует лентивирусный rev и селектируемый маркер;
ii) по меньшей мере, одну копию env.
Согласно тому же аспекту изобретения указанная выше стабильная линия пакующих лентивирусы клеток дополнительно содержит, по меньшей мере, одну копию гена HIV-1-tat, стабильно интегрированную в их геном.
Предпочтительно клеткой является линия клеток человека, предпочтительно линия клеток выбрана из HEK293, HEK293-SF, HEK293-T, TE671, HT1080 или HeLa, более предпочтительно линией клеток является HEK293-T.
Предпочтительно две кассеты экспрессии в кассете интеграции находятся в ориентации хвост-к-хвосту, и каждая кассета управляется конститутивным промотором и поли-A; предпочтительно промотор выбран из CMV, CMV IE, PGK, SV40, eF1α, SFFV и RSV, более предпочтительно конститутивным промотором является промотор CMV IE.
Согласно предпочтительному аспекту изобретения селектируемый маркер выбран из гена резистентности к гигромицину, канамицину, неомицину, зеомицину; предпочтительно селектируемым маркером является гигромицин, более предпочтительно селектируемый маркер клонируют ниже IRES.
Предпочтительно ген env интегрируют в клетки-хозяева, используя вектор AAV, ретровирусный вектор, стабильную интеграцию плазмиды или гомологичную рекомбинацию. Согласно более предпочтительному аспекту ген env интегрируют, используя лентивирусный SIN-вектор.
Предпочтительно ген env выбран из env MLV 4070, env RD114, химерного белка оболочки RD114-TR, химерного белка оболочки RD114-pro, бакуловирусного env GP64 или env GALV или их производных, более предпочтительно геном env является ген, кодирующий химерный белок оболочки RD114-TR.
Согласно другому аспекту предлагается способ получения лентивирусных векторов, включающий в себя:
i) культивирование стабильной линии пакующих лентивирусы клеток, содержащих стабильно интегрированную в их геном, по меньшей мере, одну копию кассеты интеграции, фланкированной ITR AAV, включающую в себя две кассеты экспрессии, при этом первая кассета экспрессии кодирует лентивирусные гены gag и pol, а вторая кассета экспрессии кодирует лентивирусный rev и селектируемый маркер; и, по меньшей мере, одну копию env;
ii) встраивание в стабильную линию пакующих клеток вектора переноса.
Предпочтительно две кассеты экспрессии находятся в ориентации хвост-к-хвосту, и каждая кассета экспрессии управляется конститутивным промотором и поли-A; предпочтительно промотор выбран из CMV, CMV IE, PGK, SV40, eF1α, SFFV и RSV, более предпочтительно конститутивным промотором является промотор CMV IE.
Предпочтительно селектируемый маркер выбран из гена резистентности к гигромицину, канамицину, неомицину, зеомицину; более предпочтительно селектируемым маркером является ген резистентности к гигромицину. Более предпочтительно селектируемый маркер клонируют ниже IRES.
Предпочтительно ген env выбран из env VSV-G, env MLV 4070, env RD114, химерного белка оболочки RD114-TR, химерного белка оболочки RD114pro, бакуловирусного env GP64 или env GALV или их производных, более предпочтительно геном env является ген, кодирующий RD114-TR.
Согласно другому аспекту настоящего изобретения предлагается линия клеток-продуцентов, содержащих стабильно интегрированные в их геном:
i) по меньшей мере, одну копию кассеты интеграции, фланкированную ITR AAV, включающую в себя две кассеты экспрессии, при этом первая кассета экспрессии кодирует лентивирусные гены gag и pol, а вторая кассета экспрессии кодирует лентивирусный rev и селектируемый маркер;
ii) по меньшей мере, одну копию гена env;
iii) вектор переноса.
Согласно тому же аспекту изобретения указанная выше стабильная линия пакующих лентивирусы клеток дополнительно содержит лентивирусный ген tat, стабильно интегрированный в их геном.
Предпочтительно клеткой является линия клеток человека, предпочтительно выбранная из HEK293, HEK293-T, TE671, HEK293-SF, TE671, HT1080 или HeLa, более предпочтительно линией клеток является HEK293-T.
Предпочтительно две кассеты экспрессии в кассете интеграции находятся в ориентации хвост-к-хвосту, и каждая кассета управляется конститутивным промотором и поли-A; предпочтительно промотор выбран из CMV, CMV IE, PGK, SV40, eF1α, SFFV и RSV, предпочтительным конститутивным промотором является промотор CMV IE.
Согласно предпочтительному аспекту изобретения селектируемый маркер выбран из гена резистентности к гигромицину, канамицину, неомицину, зеомицину; более предпочтительно селектируемым маркером является гигромицин, более предпочтительно селектируемый маркер клонируют ниже IRES.
Предпочтительно ген env интегрируют в клетки-хозяева, используя вектор AAV, ретровирусный вектор, стабильную интеграцию плазмиды или гомологичную рекомбинацию. Согласно более предпочтительному аспекту ген env интегрируют, используя лентивирусный SIN-вектор.
Предпочтительно ген env выбран из env MLV 4070, env RD114, химерного белка оболочки RD114-TR, химерного белка оболочки RD114-pro, бакуловирусного env GP64 или env GALV или их производных, более предпочтительно геном env является ген, кодирующий химерный белок оболочки RD114-TR.
Согласно другому аспекту предлагается способ получения лентивирусных векторов, включающий в себя культивирование линии клеток-продуцентов, содержащих стабильно интегрированных в геном:
i) по меньшей мере, одну копию кассеты интеграции, фланкированную ITR AAV, включающую в себя две кассеты экспрессии, при этом первая кассета экспрессии кодирует лентивирусные гены gag и pol, а вторая кассета экспрессии кодирует лентивирусный rev и селектируемый маркер;
ii) по меньшей мере, одну копию env;
iii) по меньшей мере, одну копию вектора переноса, кодирующего представляющие интерес ген.
Предпочтительно две кассеты экспрессии находятся в ориентации хвост-к-хвосту, и каждая кассета экспрессии управляется конститутивным промотором и поли-A; предпочтительно промотор выбран из CMV, CMV IE, PGK, SV40, eF1α, SFFV и RSV, более предпочтительно конститутивным промотором является промотор CMV IE.
Предпочтительно селектируемый маркер выбран из гена резистентности к гигромицину, канамицину, неомицину, зеомицину; более предпочтительное селектируемым маркером является ген резистентности к гигромицину. Более предпочтительно селектируемый маркер клонируют ниже IRES.
Предпочтительно ген env выбран из env VSV-G, env MLV 4070, env RD114, химерного белка оболочки RD114-TR, химерного белка оболочки RD114pro, бакуловирусного env GP64 или env GALV или их производных, более предпочтительно геном env является ген, кодирующий RD114-TR.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Подробное описание предпочтительных признаков и вариантов осуществления изобретения будет приведено с использованием неограничивающих примеров.
Изобретение может быть применено на практике специалистом в данной области, который будет использовать, если не указано иное, обычные методики химии, молекулярной биологии, микробиологии, рекомбинантной ДНК и иммунологии. Все указанные методики раскрыты и подробно описаны в общедоступной литературе. См., например, J. Sambrook, E. F. Fritsch, andT. Maniatis, 1989, Molecular Cloning: A Laboratory Manual, Second Edition, Books 1-3, Cold Spring Harbor Laboratory Press; Ausubel, F.M. et al. (1995 and periodic supplements; Current Protocols in Molecular Biology, ch. 9, 13, and 16, John Wiley & Sons, New York, N.Y.); Current Protocols in Immunology, ch. 12, John Wiley & Sons, New York, N.Y.); B. Roe, J. Crabtree, and A. Kahn, 1996, DNA Isolation and Sequencing: Essential Techniques, John Wiley & Sons; J. M. Polak and James O'D. McGee, 1990, In Situ Hybridization: Principles and Practice; Oxford University Press; M. J. Gait (Editor), 1984, Oligonucleotide Synthesis: A Practical Approach, Irl Press; and, D. M. J. Lilley and J. E. Dahlberg, 1992, Methods of Enzymology: DNA Structure Part A: Synthesis and Physical Analysis of DNA Methods in Enzymology, Academic Press. Все указанные публикации включены в виде ссылки.
Гибридная бакуло-AAV-система
Настоящее изобретение относится к новой методике создания основанной на ВИЧ-1 линии пакующих клеток. Оптимизация системы продуцирования LV является одной из важнейших проблем, которую необходимо решить для разработки генной терапии на основе LV-методики. Несмотря на растущее количество клинических испытаний, в которых используют такую методику, LV в таких испытаниях все еще получают, используя протоколы временной трансфекции. Таким образом, получение LV все еще является очень дорогостоящим и неподходящим для большего количества пациентов. По этой причине было предпринято множество попыток разработать стабильные линии пакующих клеток для LV. Одной из важных проблем при разработке стабильной линии пакующих лентивирусы клеток является выбор правильного носителя для конструирования клеток-хозяев. Во многих случаях клетки-хозяева конструировали, используя плазмиды, но в таких случаях также наблюдали нестабильность генома и явление сайленсинга генов. В двух других случаях использовали ретровирусные векторы, чтобы стабильно интегрировать гены gag/pol и rev. Ни одну из разработанных до настоящего времени стабильных линий пакующих клеток не использовали в клинических испытаниях.
Методика согласно настоящему изобретению основана на использовании системы стабильной экспрессии лентивирусных структурных и регуляторных белков, состоящей из гибридного вектора, содержащего бакуловирусный остов, который содержит кассету интеграции, фланкированную ITR AAV, включающую в себя две кассеты экспрессии, при этом первая кассета экспрессии кодирует лентивирусные гены gag и pol, а вторая кассета экспрессии кодирует лентивирусный rev и селектируемый маркер; вместе с экспрессирующей плазмидой, содержащей ORF rep AAV под контролем промотора. Присутствие бакуловирусного остова позволяет хозяину принимать большую и сложную кассету интеграции, содержащую две кассеты экспрессии, кодирующие несколько разных белков. Полученный пакующий вектор бакуло-AAV позволяет конструировать клетки-хозяева с белками gag, pol и rev, которые необходимы для стабильной и эффективной продукции LV посредством только одного события инфекции.
Геномную интеграцию пакующего вектора бакуло-AAV получали в результате временной экспрессии белка rep AAV. Такая система позволила осуществлять интеграцию векторов AAV в некодирующую межгенную транскрипционно активную область, тем самым исключая активацию опасных генов, мРНК которых может быть включена в LV и в конечном итоге в клетки-хозяева, являющиеся мишенями.
Предложенная система представляет собой новый и обладающий преимуществами путь доставки структурных белков ВИЧ-1, чтобы стабильно и эффективно конструировать клетки-хозяина со структурными и регуляторными лентивирусными белками. В предпочтительном варианте две кассеты экспрессии, включенные в пакующую конструкцию бакуло-AAV, находятся в ориентации хвост-к-хвосту, и каждая кассета экспрессии управляется конститутивным промотором и поли-A, предпочтительно промотор выбран из CMV, CMV IE, PGK, SV40, eF1α, SFFV и RSV, более предпочтительно промотором является промотор CMV IE. Согласно предпочтительному аспекту изобретения селектируемый маркер, включенный в пакующий AAV-вектор, выбран из гена резистентности к гигромицину, канамицину, неомицину, зеомицину; предпочтительно маркером является ген резистентности к гигромицину; более предпочтительно селектируемый маркер клонирован ниже IRES.
Геномную интеграцию пакующего вектора бакуло-AAV получали в результате временной экспрессии белка rep AAV для ITR-опосредованной интеграции AAV-вектора. В предпочтительном варианте белок rep выбран из rep78 и rep68, более предпочтительно белком является rep78.
С использованием указанной системы можно получать клетки, сконструированные для стабильной экспрессии белков ВИЧ-1 gag/pol и rev, которые авторы изобретения назвали полустабильной линией пакующих клеток. В частности, в настоящем изобретении раскрыты и заявлены такие сконструированные клетки и их применение для получения линий пакующих клеток 2-ого и 3-его поколения, содержащих структурные и регуляторные белки и представляющий интерес белок оболочки, и линии клеток-продуцентов, также содержащих вектор переноса, а также способ получения стабильных линий пакующих клеток.
Полустабильная линия пакующих клеток
Полустабильная линия пакующих клеток согласно настоящему изобретению состоит из клеток-хозяев, несущих, по меньшей мере, одну копию рекомбинантной пакующей конструкции бакуло-AAV, экспрессирующей гены ВИЧ-1 gag-pol и rev. Геномную интеграцию пакующего вектора бакуло-AAV получили в результате временной экспрессии белка rep AAV, чтобы получить ITR-опосредованную интеграцию AAV-вектора. Предпочтительно две кассеты экспрессии находятся в ориентации хвост-к-хвосту, и каждая кассета экспрессии управляется конститутивным промотором и поли-A, предпочтительно промотор выбран из CMV, CMV IE, PGK, SV40, eF1α, SFFV и RSV. Более предпочтительно конститутивным промотором является промотор CMV IE.
Согласно предпочтительному аспекту изобретения селектируемый маркер выбран из гена резистентности к гигромицину, канамицину, неомицину, зеомицину; предпочтительно селектируемым маркером является ген резистентности к гигромицину, более предпочтительно селектируемый маркер клонируют ниже IRES.
Предпочтительно белок rep AAV выбран из rep78 и rep68. Более предпочтительно белком rep является rep78. Линии клеток-хозяев, которые могут быть сконструированы для получения полустабильной линии пакующих клеток, представляют собой линии клеток, выбранные из HEK293, HEK293-T, HEK293-SF, TE671, HT1080 или HeLa, более предпочтительно линией клеток является HEK293-T.
Такая полустабильная линия пакующих клеток подходит для получения большого разнообразия LV с разными env и разными векторами для переноса в полустабильной системе продуцирования. Поэтому она дает большое преимущество с точки зрения более эффективной продукции лентивирусных векторов, так как позволяет снизить затраты, она не требует использования плазмидной ДНК со степенью чистоты, соответствующей стандарту GMP, кодирующей gag-pol и rev, и при этом снижен риск образования RCL на фоне событий рекомбинации между плазмидами в ходе временной трансфекции.
Показано, что полустабильная линия пакующих клеток согласно настоящему изобретению обладает неожиданной генетической стабильностью в течение 1 года культивирования, что свидетельствует о непрерывной продукции функционального LV после временной трансфекции оставшихся генетических элементов. Кроме того, по сути, не наблюдается явление сайленсинга, и титр и инфекционность лентивирусных частиц, получаемых с использованием такого промежуточного продукта, сохраняются неизменными спустя 1 год. Такие данные были подтверждены как в присутствии, так и в отсутствие давления отбора. Следует отметить, что сопоставимые данные в отношении стабильности интеграции кассеты, опосредованной ITR AAV, в литературе отсутствуют. Единственная соответствующая информация относится к тому, что полученная из костного мозга человека линия подобных фибробластам клеток (клетки Раддла Детройт 6), инфицированных AAV дикого типа серотипа 2 (AVV-2), сохраняла вирусные последовательности в латентном состоянии в течение, по меньшей мере, 47 и 118 пассажей [16, 17]. Как показано в примерах, полустабильная линия пакующих клеток согласно настоящему изобретению сохранялась в течение, по меньшей мере, 102 пассажей.
Стабильная линия пакующих клеток
Настоящее изобретение относится к способу получения стабильной линии пакующих лентивирусы клеток. Такой способ основан на применении пакующей конструкции бакуло-AAV для стабильной интеграции, по меньшей мере, одной копии кассеты интеграции, содержащей две кассеты экспрессии, одна из которых кодирует лентивирусные гены gag и pol, а вторая кодирует лентивирусный rev и селектируемый маркер. Стабильную интеграцию такой кассеты получают в результате коэкспрессии белка rep, который обеспечивает возможность ITR-опосредованной стабильной интеграции в клетку-хозяина. Затем сконструированные таким образом клетки-хозяева культивируют в присутствии антибиотика и затем клонируют. Полученная полустабильная линия пакующих клеток является исходной точкой для создания линии пакующих лентивирусы клеток 2-ого и 3-его поколения. В частности, стабильную линию пакующих клеток 3-его поколения получают дополнительной интеграцией требуемого белка env. Стабильную линию пакующих клеток 2-ого поколения получают, сначала интегрируя белок Tat ВИЧ-1 и затем требуемый белок оболочки.
Белок оболочки и tat ВИЧ-1 могут быть стабильно интегрированы в клетки-хозяева с использованием вектора AAV, ретровирусного вектора, стабильной интеграции плазмиды или гомологичной рекомбинации. Предпочтительно белки оболочки и tat ВИЧ-1 интегрируют в клетку-хозяина, используя вектор ВИЧ-SIN. Можно использовать несколько видов белка оболочки, таких как env MLV 4070, env RD114, химерный белок оболочки RD114-TR, химерный белок оболочки RD114-pro, бакуловирусный env GP64 или env GALV или их производные. Более предпочтительно геном env является ген, кодирующий химерный белок оболочки RD114-TR.
Чтобы получить стабильную интеграцию белка оболочки RD114-TR, сначала разрабатывали SIN-конструкцию, содержащую BamHI-BamHI-фрагмент, полученный из плазмиды pCMV-RD114-TR, несущей ORF RD114-TR под контролем промотора CMV. Такая конструкция не образовывала белка RD114-TR. Неожиданным открытием при конструировании LV SIN-RD114-TR было установление того, что интрон β-глобина должен быть обязательно включен между промотором CMV и ORF RD114-TR. В общем, большинство кассет экспрессии клеточных и вирусных генов, ограниченных контекстом SIN-LV, лишены интронных элементов из-за риска сплайсинга между SD вектора SA интрона и п