Способ идентификации нативных пар фрагментов днк или рнк, присутствующих в одних и тех же живых клетках
Иллюстрации
Показать всеИзобретение относится к биотехнологии, а именно к способу селективного подавления амплификации в ходе ПЦР фрагментов ДНК. Добавляют в реакционную смесь блокирующий олигонуклеотид в концентрации, которая превышает концентрацию праймеров, используемых для ПЦР, не менее чем в 2 раза. 3′-концевая последовательность блокирующего олигонуклеотида служит для его отжига на 3′-участок фрагмента ДНК, амплификация которого должна быть подавлена, и имеет длину, обеспечивающую ее эффективную гибридизацию на 3′-участок фрагмента ДНК при температуре отжига праймера, используемого в ПЦР. 5′-концевая последовательность блокирующего олигонуклеотида служит матрицей для достройки нового 3′-конца для указанного фрагмента ДНК, где новая 3′-концевая последовательность не имеет комплементарности с предполагаемыми матрицами и исключает дальнейшее участие этого фрагмента в амплификации в качестве затравки. Предложенное изобретение позволяет провести селективное подавление амплификации с высокой эффективностью. 4 з.п. ф-лы, 6 табл., 2 пр., 8 ил.
Реферат
Область изобретения
Данное изобретение относится к области молекулярной биологии и иммунологии, в частности, к технологии идентификации пар фрагментов молекул ДНК или РНК, которые присутствуют в одних и тех же клетках, например, нативных пар фрагментов генов тяжелых и легких цепей антител или нативных пар фрагментов генов альфа- и бета-цепей Т-клеточных рецепторов.
Предшествующий уровень техники
Антитела и Т-клеточные рецепторы (ТКР) - оружие адаптивного иммунитета, способное избирательно узнавать специфические антигены - представляют собой бесценный источник средств для биологических исследований и медицинского применения (Leavy О., 2010, Nat Rev Immunol, 10, 297; Schumacher T.N., 2002, Nat Rev Immunol, 2, 512-519).
Антитело состоит из двух пар полипептидных цепей: тяжелых Н (Heavy) с молекулярным весом около 50000 и легких L (Light) - около 25000, соединенных соединены друг с другом дисульфидными связями.
Т-клеточный рецептор также представляет собой гетеродимер, состоящий из пары различных полипептидных цепей - α и β (либо γ и δ для γδ Т клеток) - с молекулярным весом около 50000. α- и β-цепи соединены между собой дисульфидной связью.
Н-, L-, α- и β-цепи имеют сходный план строения и относятся к одному суперсемейству белков - иммуноглобулинов. Каждая цепь имеет константный (С) и вариабельный (V) районы. Вариабельные участки Н- и L-цепей (для антител) либо α- и β-цепей (для ТКР) выполняют функцию специфического распознавания и связывания антигенов и образуют активные центры. Благодаря симметричной структуре иммуноглобулина, каждая молекула антитела имеет два центра связывания с антигеном: в V-доменах тяжелых и легких цепей каждой пары. Таким образом, функциональной единицей антитела или ТКР, то есть частью, определяющей специфичность и обеспечивающей связывание антигена, является в случае антитела пара Н- и L-цепей, а в случае ТКР - пара α- и β-цепей.
Гены, кодирующие структуру одной полипептидной цепи антитела или ТКР, разделены на 2 или 3 сегмента (V/J или V/D/J) и расположены в одном участке хромосомы в определенном порядке. Согласно структуре каждого из сегментов гены, кодирующие синтез Н- и L-цепей антител и α- и β-цепей ТКР, объединены в семейства. Число таких семейств может насчитывать несколько десятков. Так, например, для вида homo sapiens, количество семейств генов β-цепи ТКР - более 50, количество семейств генов тяжелой цепи антител - более 60.
В процессе созревания лимфоцита фрагменты случайным образом рекомбинируют в один ген. Для различных цепей антител или ТКР число вариантов комбинаций достигает значений от тысяч до десятков тысяч. Кроме того, в процессе сборки происходит относительно случайная достройка и укорачивание соединяемых сегментов, что резко увеличивает число возможных комбинаций. Дальнейшее разнообразие активных центров возникает за счет объединения вариабельных районов пар цепей, составляющих эти центры. Таким образом, благодаря сборке V-гена из сегментов и формированию активных центров из разных цепей, может создаваться более 1015 теоретических вариантов уникальных по своей структуре участков молекул антител и ТКР, формирующих впоследствии репертуар антител и ТКР (Arstila, T.P. et al. Science 2000, 288, 1135).
Анализ репертуара ТКР и антител важен для фундаментальных исследований адаптивного иммунитета в норме и патологии (Miles J.J., et al., 2011, Immunol Cell Biol, 89, 375-387).
В течение десятилетий велся поиск эффективного способа идентификации их функциональных единиц - нативных пар тяжелых и легких цепей антител или альфа- и бета-цепей ТКР.
С этой целью были разработаны различные подходы. Одним из них стало получение гибридом (Schwaber J., et al., 1973, Nature, 244, 444-447): клеточная линия, секретирующая антитела, образуется путем слияния антителообразующей клетки лимфоидной ткани иммунизированного животного и клетки плазмацитомы, находящейся на сходной стадии дифференцировки. Полученная в результате гибридома наследует от одной родительской клетки способность к секреции антител определенной специфичности, а от другой (клетки плазмацитомы) - способность к неограниченному росту in vitro. Отобранные по специфичности гибридомы могут быть использованы как для идентификации ативных пар тяжелых и легких цепей антител, так и для продукции моноклональных антител.
Другой технологией является ПЦР с одиночных клеток (Lagerkvist A.C., et al. 1995 Biotechniques, 18, 862-869; Babcook J.S., 1996, Proc Natl Acad Sci USA, 93, 7843-7848; Meijer P.J., et al., 2006, J Mol Biol, 358, 764-772). Метод основан на молекулярном клонировании участков ДНК либо кДНК вариабельных участков иммуноглобулинов, полученных из одного единственного лимфоцита, например из отсортированных клеток кролика или мыши, продуцирующих специфические антитела.
Также применяется спаривание молекул на основе частоты их встречаемости (Reddy S.T., et al., 2010, Nat Biotechnol, 28, 965-969). Данный метод, как и в предыдущем случае, включает иммунизацию с последующей изоляцией клеток, продуцирующих специфические антитела, и получением кДНК вариабельных участков иммуноглобулиновых цепей. Далее для определения репертуара вариабельных участков цепей антител используются высокопроизводительные методы секвенирования и биоинформатический анализ. В данном методе выявление пар α- и β-цепей производится на основе простого анализа относительной частоты встречаемости наиболее представленных молекул, что может быть применимо лишь для нескольких наиболее представленных пар в образце.
Кроме того, нативные пары цепей ТКР или антител могут быть найдены после культивирования клонов лимфоцитов (Lagerkvist A.C., et al., 1995, Biotechniques, 18, 862-869), а также с помощью сортировки антиген-специфичных популяций Т-клеток (Trautmann L, et al., 2005, J Immunol, 175, 6123-6132) или В-клеток (Franz В., et al., 2011, Blood, 118, 348-357).
Все перечисленные методы позволяют выявлять нативные пары тяжелых и легких цепей антител или альфа- и бета-цепей ТКР, однако только для ограниченного числа клонов и по одной или несколько пар за один трудоемкий эксперимент.
Идентификация нативных пар цепей ТКР или антител для сложной смеси лимфоцитов с высокой точностью и высокой производительностью долгое время оставалась невыполнимой задачей.
Одним из высокопроизводительных решений является использование так называемых дисплейных технологий. При использовании метода фагового дисплея (Smith, G.P., 1985, Science, 228, 1315-1317) в геном бактериофагов встраивают ген гибридного белка, представляющего собой продукт объединения фрагментов тяжелой и легкой цепей антитела и поверхностного белка фаговой частицы. Фрагменты тяжелой и легкой цепей антитела оказываются экспонированными на поверхности вирусных частиц. Отбор фаговых частиц производится на основе сродства фрагментов антител к антигену. Как правило, для получения фагового дисплея используется фаг М13, и фрагменты антител экспрессируют в виде гибридных белков с белками оболочки фага pIII, pIV и pVIII (Benhar, I., Pastan, I., 1994, Protein Eng., 7, 1509-1515). Из отобранных фаговых частиц затем выделяют фаговую кДНК и определяют нуклеотидную последовательность фрагментов антител. На основе этой последовательности в дальнейшем создают полноразмерные рекомбинантные антитела (Luginbuhl, B., et al., 2006, J. Mol. Biol., 363, 75-97; Krebber, A., et al., 1997, J. Immunol. Methods, 201, 35-55; Maynard, J., Georgiou, G., 2000, Annu. Rev. Biomed. Eng. 2, 339-376.9; Winter, G. et al., 1994, Annu. Rev. Immunol., 12, 433-455). Одним из видов дисплея в эукариотах является дрожжевой дисплей. Для экспонирования рекомбинантных фрагментов антител на поверхности дрожжевых клеток создают гибридные белки, состоящие из антитела или его фрагментов и субъединицы агглютинина Aga2p, которая ковалентно соединена при помощи двух дисульфидных связей с агглютинином Aga1, заякоренным в клеточной стенке дрожжевой клетки (Boder, Е.Т. et al., 2000, Proc. Natl. Acad. Sci., 97, 10701-10705; Boder, E.T., Wittrup, K.D. 1998, Biotechnol. Prog., 14, 55-62; Boder, E.T., Wittrup, K.D. 1997, Nat. Biotechnol., 15, 553-557, Siegel R.W. 2009, Methods Mol. Biol., 504, 351-383). Фаговые и дрожжевые дисплейные технологии, хотя и эффективны для выделения антиген-специфичных антител (Hoogenboom H.R. et al., 1991, Nucleic Acids Res, 19, 4133-4137; Marks J.D. et al., 1991, J Mol Biol, 222, 581-597; Bowley D.R. et al., 2009, Proc Natl Acad Sci USA, 106, 1380-1385), но основываются на случайных спариваниях молекул и не предоставляют информацию о нативности найденных пар.
Еще один потенциально высокопроизводительный подход основан на амплификации и сборке фрагментов генов тяжелых и легких цепей антител в фиксированных клетках (Embleton M.J., 1992, Nucleic Acids Res, 20, 3831-3837; Chapal N., 1997, Biotechniques, 23, 518-524). При этом подходе, клетки предварительно фиксируются, после чего в них проводится ОТ-ПЦР с использованием набора праймеров, с последующим объединением посредством лигирования или достраивания удлинением, также в пределах фиксированных клеток. Однако применение данного подхода на практике оказалось малопригодным для анализа. Подход не позволяет детектировать нативные пары цепей антител или ТКР для сложных смесей клеток, вероятно по причинам низкой эффективности реакций в фиксированных клетках, а также высокого фона от соединяемых фрагментов генов цепей из разных клеток.
Недавно была опубликована технология для идентификации нативных пар цепей антител (DeKosky B.J. et al., Nature Biotechnology, 2013). В этой технологии, В-лимфоциты исходно распределяют по многолуночной плашке, содержащей микробусины, несущие поли-Т олигонуклеотиды. Затем клетки лизируют, и содержащаяся в них мРНК, в том числе мРНК, кодирующая легкие и тяжелые цепи иммуноглобулинов, гибридизуется на бусины. Затем бусины извлекают из плашки и помещают в эмульсию «вода в масле», в которой проводится обратная транскрипция, ПЦР и слияние фрагментов по методу «перекрывания-удлинения» (overlap extension) (Но S.N., et al., 1989, Gene, 77, 51-59). Выход реакции представляет собой сложную смесь продуктов ПЦР, в которой присутствуют как спаренные в ходе эмульсионной ОТ-ПЦР молекулы А-Б, так и неспаренные одиночные молекулы А и Б, амплифицированные с генетического материала разных клеток.
Авторами настоящего изобретения показано, что дальнейшая ПЦР амплификация, необходимая для подготовки образца для секвенирования по предложенной технологии, приводит к неспецифическому спариванию одиночных молекул А и Б из разных клеток, и таким образом исходная информация о нативных парах цепей теряется.
Таким образом, идентификация нативных пар цепей ТКР или антител для сложной смеси лимфоцитов с высокой точностью и высокой производительностью остается нерешенной задачей. Создание таких технологий востребовано для и диагностики и терапии заболеваний, а также фундаментальных исследований. Настоящим изобретением предлагается оригинальный способ подавления неспецифического спаривания одиночных молекул А и Б из разных клеток с использованием нового метода ПЦР-блокировки.
Краткое описание изобретения
Настоящее изобретение относится к способу идентификации нативных пар фрагментов нуклеиновых кислот (ДНК или РНК), присутствующих в одних и тех же живых клетках.
Способ настоящего изобретения включает:
(1) амплификацию и физическое спаривание целевых фрагментов А и Б, проводимое в эмульсии;
(2) внеэмульсионную ПЦР-амплификацию спаренных целевых фрагментов в присутствии олигонуклеотидов, блокирующих спаривание фрагментов, ранее не спаренных в одной капле в эмульсии на стадии (1).
Стадия (1) метода состоит из следующих шагов: (а) получение эмульсии «вода в масле», в которой клетки заключены в каплях водной фазы; (б) амплификации целевых фрагментов А и Б, проводимую в эмульсии; (в) физическое спаривание целевых амплифицированных фрагментов А с целевыми амплифицированными фрагментами Б, находящимися в одной капле. В преимущественных воплощениях шаги (б) и (в) происходят одновременно в ходе амплификации в эмульсии.
Стадия (2) метода состоит из следующих шагов: (г) выделение фракции нуклеиновых кислот, содержащих спаренные фрагменты, из эмульсии; (д) амплификация целевых спаренных фрагментов в присутствии олигонуклеотидов, блокирующих спаривание фрагментов, ранее не спаренных в одной капле в эмульсии в ходе шага (в);
В преимущественных воплощениях метод так же включает стадию (3) секвенирование полученных ПЦР-ампликонов.
В одном из воплощений указанный способ относится к идентификации двух различных фрагментов ДНК (фрагменты А и Б), находящихся в одной клетке. Например, указанный способ относится к идентификации фрагментов молекул ДНК, кодирующих альфа-цепь (фрагмент А) и бета-цепь (фрагмент Б) Т-клеточного рецептора, присутствующих в геноме одной клетки и представляющих функциональную единицу Т-клеточного рецептора. Указанный способ так же относится к идентификации фрагментов молекул ДНК, кодирующих тяжелую цепь (фрагмент А) и легкую цепь (фрагмент Б) антитела, присутствующих в геноме одной клетки и представляющих функциональную единицу антитела.
В другом воплощении указанный способ относится к идентификации двух фрагментов различных молекул РНК (фрагменты А и Б), синтезирующихся в одной клетке. Например, указанный способ относится к идентификации фрагментов молекул мРНК, кодирующих альфа-цепь (фрагмент А) и бета-цепь (фрагмент Б) Т-клеточного рецептора, коэкспрессирующихся в одной клетке и представляющих функциональную единицу Т-клеточного рецептора. Указанный способ также относится к идентификации фрагментов молекул мРНК, кодирующих тяжелую цепь (фрагмент А) и легкую цепь (фрагмент Б) антитела, коэкспрессирующиеся в одной клетке и представляющих функциональную единицу антитела.
Способ настоящего изобретения позволяет проводить массовую идентификацию пар фрагментов А и Б в популяции живых или фиксированных клеток.
В некоторых воплощениях, стадия (б) способа настоящего изобретения (амплификация целевых фрагментов А и Б, проводимая в эмульсии) осуществляется с помощью эмульсионной ПЦР, где матрицей служат целевые фрагменты ДНК.
В других воплощениях, стадия (б) способа настоящего изобретения осуществляется с помощью эмульсионной обратной-транскрипции-ПЦР (ОТ-ПЦР), где матрицей служат целевые фрагменты РНК.
В некоторых воплощениях, стадия (в) способа настоящего изобретения (физическое спаривание целевых амплифицированных фрагментов А с целевыми амплифицированными фрагментами Б, находящимися в одной капле) осуществляется с помощью технологии «перекрывания-удлинения» (overlap extension). В других воплощениях эта стадия осуществляется с помощью лигирования, амплификации на бусинах или рекомбинации.
В преимущественных воплощениях стадия (д) настоящего изобретения осуществляется в ходе одной или нескольких последовательных ПЦР. Настоящее изобретение отличается тем, что на этой стадии используется оригинальный способ селективного подавления амплификации неспаренных целевых амплифицированных фрагментов А и неспаренных целевых амплифицированных фрагментов Б, полученных на стадии (а) и присутствующих в смеси нуклеиновых кислот. Подавление неспецифической амплификации неспаренных фрагментов А и Б является неотъемлемой и принципиальной составляющей этой стадии.
Селективное подавление амплификации неспаренных целевых фрагментов достигается за счет добавления в реакционную смесь блокирующего олигонуклеотида. Блокирующий олигонуклеотид содержит:
(а') 3'-концевую последовательность, комплементарную последовательности 3'-концевого участка фрагмента ДНК, амплификация которого должна быть подавлена;
(б') 5'-концевую последовательность, служащую матрицей для достройки нового 3'-конца для указанного фрагмента ДНК, где новая 3'-концевая последовательность не имеет комплементарности с предполагаемыми матрицами и исключает дальнейшее участие этого фрагмента в амплификации в качестве затравки.
Изобретенный новый тип ПЦР-блокировки позволяет, после проведения эмульсионных реакций, селективно амплифицировать библиотеку спаренных в эмульсии фрагментов генов. Суть изобретения состоит в том, что селективное подавление участия в ПЦР неспаренных фрагментов позволяет преимущественно амплифицировать целевые пары фрагментов, ранее успешно спаренные в пределах капель в эмульсии, по сравнению с амплификацией пар фрагментов, способных к нецелевому спариванию уже после выделения смеси нуклеиновых кислот из эмульсии.
Краткое описание фигур
Фиг. 1 показывает поэтапную схему получения спаренных альфа- и бета-цепей ТКР. Эмульгированные белые клетки крови разрушаются при кратковременном нагревании до 62°С; вышедшая из клеток мРНК альфа- и бета-цепей ТКР подвергается обратной транскрипции при 50°С со специфичными праймерами, после чего в каждой капле осуществляется реакция амплификации с последующем спариванием методом перекрывания-удлинения. Продукты реакции извлекаются из эмульсии, и представляющие интерес спаренные молекулы селективно амплифицируются, в то время как аплификация неспаренных молекул блокируется.
Фиг. 2 показывает схему получения спаренных альфа- и бета-цепей ТКР в пределах эмульсионной капли. Вышедшая из клеток мРНК альфа- и бета-цепей ТКР подвергается обратной транскрипции при 50°С со специфичными праймерами, после чего в каждой капле осуществляется реакция амплификации с последующем спариванием методом перекрывания-удлинения.
Фиг. 3. показывает схему ПЦР-блокировки. Представляющие интерес спаренные молекулы селективно амплифицируются, в то время как амплификация неспаренных молекул блокируется.
Фиг. 4. Пост-эмульсионная реакция амплификации спаренных молекул ТКР, полученных в одной эмульсии, содержащей все праймеры (αβ), либо объединенных после получения в двух отдельных эмульсиях, одна из которых содержит праймеры для амплификации альфа-цепей ТКР, а другая - бета-цепей ТКР (α+β после ОТ-ПЦР, то есть контроль случайных реакций перекрывания-удлинения после высвобождения из эмульсии), либо полученных в двух отдельных эмульсиях, одна из которых содержит праймеры для амплификации альфа-цепей ТКР, а другая - бета-цепей ТКР и объединенных после обратной транскрипции (α+β после ОТ, то есть контроль случайных реакций перекрывания-удлинения за счет слияния капель эмульсии). Все реакции проводили с или без использования ПЦР-блокировки.
Фиг. 5. показаны результаты эксперимента по подбору концентрации блокирующих олигонуклеотидов в эмульсионных реакциях с живых клеток. Показаны результаты второй пост-эмульсионной амплификации спаренных альфа- и бета-цепей ТКР. Предшествующая первая пост-эмульсионная амплификация проводилась в присутствии 0, 0.2, 0.4, 0.8, 1.6, 3.2, 6.4 или 12.8 мкМ каждого блокирующего олигонуклеотида; указанная амплификация проводилась, в одном случае, с продукта полной эмульсионной реакции, проводившейся в присутствии праймеров для амплификации и реакции перекрывания-удлинения и альфа, и бета-цепей ТКР (а); в другом случае указанная амплификация проводилась со смеси продуктов, полученной после объединения двух отдельных эмульсий, каждая из которых содержала праймеры для амплификации и перекрывания-удлинения либо альфа-, либо бета-цепей (б).
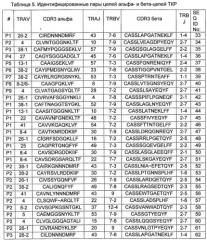
Фиг. 6 представлена иллюстрация образования 400 теоретически наиболее вероятных пар из 20 альфа-цепей CDR3 и 20 бета-цепей CDR3, которые были преимущественно представлены в контрольной реакции. Показан процент каждой из наблюдаемых пар среди всех обнаруженных пар в эмульсии (а) и контрольной без-эмульсионной реакции (б). Вычтены случайные спаривания, ожидаемые исходя из частоты встречаемости. Показаны круговые диаграммы спаривания альфа- и бета-цепей ТКР, созданные с помощью Circos (Krzywinski М., et al., 2009, Genome Res., 19, 1639-1645). Размеры сегментов указывают на представленность варианта цепи в контроле, ширина лент соотносится с числом прочтений данной пары в указанной эмульсии. Идентифицированные нативные пары обозначены номерами (Р1-Р6) (см. Пример 1, Табл. 3).
Фиг. 7 показан результат проточного флуоресцентного сортинга (FACS - Fluorescence-activated cell sorting) CD8+ HLA-A*02-CMV (NLV пептид)-специфифичных Т-клеток. Показана популяция клеток CD8+. Из 20 млн. мононуклеарных клетое периферической крови было отсортировано более 100000 Т-клеток интересующей субпопуляции (область R1). Область R1 содержит 3,8% из CD8+ Т-клеток и 1,7% всех клеток. Чистота отсортированной популяции более 97%.
Фиг. 8 иллюстрирует селективное подавление ПЦР амплификации с олигонуклеотидного праймера в присутствии блокирующего олигонуклеотида.
Подробное описание изобретения
Настоящее изобретение относится к способу идентификации двух различных фрагментов нуклеиновых кислот, присутствующих в одних и тех же живых клетках.
Схематическое изображение способа отображено на Фиг. 1-3.
Способ настоящего изобретения включает:
Стадию (1): амплификацию и физическое спаривание целевых фрагментов А и Б, проводимое в эмульсии;
Стадию (2) внеэмульсионную ПЦР-амплификацию спаренных целевых фрагментов в присутствии олигонуклеотидов, блокирующих спаривание фрагментов, ранее не спаренных в одной капле в эмульсии на стадии (1).
В преимущественных воплощениях метод так же включает стадию (3) секвенирование полученных ПЦР-ампликонов.
В одном из воплощений указанный способ относится к идентификации двух различных фрагментов ДНК (фрагменты А и Б), находящихся в одной клетке. В другом воплощении указанный способ относится к идентификации двух фрагментов различных молекул РНК (фрагменты А и Б), синтезирующихся в одной клетке. Например, указанный способ относится к идентификации фрагментов молекул ДНК и мРНК, кодирующих альфа- цепь (фрагмент А) и бета-цепь (фрагмент Б) Т-клеточного рецептора, присутствующих в одной клетке и представляющих функциональную единицу Т-клеточного рецептора. Указанный способ также относится к идентификации фрагментов молекул мРНК, кодирующих тяжелую цепь (фрагмент А) и легкую цепь (фрагмент Б) антитела, присутствующих в одной клетке и представляющих функциональную единицу антитела.
Способ настоящего изобретения позволяет проводить массовую идентификацию пар фрагментов А и Б в популяции живых или фиксированных клеток. В частности, способ настоящего изобретения позволяет идентифицировать нативные пары альфа- и бета-цепей Т-клеточных рецепторов и тяжелых и легких цепей антител, представляющие собой функциональные единицы, в образцах крови. Способ востребован в исследованиях адаптивного иммунитета и создании функциональных моноклональных антител и ТКР для клинических и научных приложений.
Как здесь используется термин «нативная пара» означает пару альфа- и бета-цепей Т-клеточного рецептора, либо пару тяжелых и легких цепей антитела, экспрессируемых в одном и том же лимфоците живого организма и составляющих соответственно функциональную единицу - Т-клеточный рецептор либо антитело, соответственно.
Как здесь используется термин «функциональная единица» означает пару Н- и L-цепей антител или альфа и бета-цепей ТКР, которые определяют специфичность и обеспечивают связывание антигена с антителом или ТКР, соответственно.
Стадия 1. Амплификация и физическое спаривание целевых фрагментов А и Б, проводимое в эмульсии
А) Получение эмульсии клеток
Ключевым требованием для успешного применения указанного способа является получение репрезентативной библиотеки ДНК или кДНК фрагментов А и Б, спаренных в процессе эмульсионной реакции, полученной, из клеток, каждая из которых изолирована в отдельной капле минимального объема, достаточного для проведения ПЦР (Фиг. 1).
Важными качествами, позволяющими успешно применить эмульсию для нужд данного изобретения, являются ее стабильность (в т.ч. и при изменении температуры в ходе ПЦР), интактность по отношению к клеткам, заключенным в капли, и способность формировать капли эффективного объема. Под термином «эффективный объем» подразумевается объем капли, достаточный для того, чтобы вместить клетку и, объем реакционной смеси, по крайней мере, сравнимый с объемом клетки. В предпочтительных воплощениях, «эффективный объем» достаточен для того, чтобы вместить клетку и объем реакционной смеси, который больше объема клетки по крайней мере в 2 раза, предпочтительно по крайней мере в 5 раз, например в 10 и более раз, чаще всего в 20 и более раз.
Существуют различные технические решения для получения эмульсии клеток «вода в масле», отвечающей указанным требованиям и пригодной для дальнейшего проведения ПЦР (ОТ-ПЦР).
Предпочтительным вариантом получения эмульсии клеток является приготовление эмульсии типа «вода в масле», в которой клетки и все реагенты для ПЦР (или ОТ-ПЦР) заключены в капли воды. Критическим компонентом в этой композиции является сурфактант (эмульгатор), необходимый для стабилизации водных капель в масляной фазе.
Одним из подходов является приготовление эмульсии типа «агароза в масле». В этом случае компоненты водной фазы (клетки и все реагенты для ПЦР либо ОТ-ПЦР) заключены в капли из легкоплавкой агарозы, которая способна сохранять жидкое агрегатное состояние при температуре выше 16°С, тем самым обеспечивая, эффективное протекание реакции в эмульсии (Zhang H et al, Anal Chem. 2012 Apr 17;84(8):3599-606; Leng X, Yang CJ., Methods Mol Biol. 2013;949:413-22; Zhi Zhu et al., Lab Chip, 2012, 12, 3907-3913).
В некоторых вариантах реализации данного изобретения в качестве масляной дисперсионной среды при приготовлении эмульсии может использоваться фторуглеродное масло. Предпочтительными эмульгаторами, применяющимися для стабилизации водных капель в фторуглеродном масле являются сурфактанты - производные перфторполиэфира (ПФПЭ):
Krytox (DuPont) (С. Holtze, А. С. Rowat, J. J. Agresti, J. В. Hutchison, F. E. Angile, C. H. J. Schmitz, S. Koster, H. Duan, K. J. Humphry, R. A. Scanga, J. S. Johnson, D. Pisignano, D. A. Weitz, Lab Chip 2008, 8, 1632-1639.),
полиэтиленгликоль - ПФПЭ (J. Clausell-Tormos, D. Lieber, J. C. Baret, A. EI-Harrak, O. J. Miller, L. Frenz, J. Blouwolff, K. J. Humphry, S. Koster, H. Duan, C. Holtze, D. A. Weitz, A. D. Griffiths, C. A. Merten, Chem. Biol. 2008, 15, 427-437.),
гексаэтиленгликоль-ПФПЭ (D. J. Holt, R. J. Payne, W. Y. Chow, C. Abell, J. Colloid Interface Sci. 2010, 350, 205-211).
В других вариантах реализации настоящего изобретения в качестве масляной дисперсионной среды при приготовлении эмульсии может использоваться углеводородное (минеральное) масло. Известны следующие системы сурфактантов, применяемые для стабилизации водных капель в минеральном масле:
- 4.5% Span-80, 0.4% Tween 80, 0.05% Triton X-100 (Williams et al., Nat Methods, vol.3 no.7, 545-550)
- 73% Tegosoft DEC, 7% ABIL WE (Schutze et al., Anal. Biochem. 2011 March 1; 410(1):155-7)
- 3% ABIL-EM90 (Schaerli Y et al, 2009 Anal Chem 81:302-306);
- 2% ABIL-EM90, 0.05% Triton X-100 (Hatch AC et al., 2011, Lab Chip 11:3838-3845)
В некоторых вариантах реализации данного изобретения (амплификация ДНК) в качестве водного компонента эмульсии используется реакционная смесь для ПЦР, в которую помещают клетки.
В других вариантах реализации данного изобретения (амплификация РНК) в качестве водного компонента эмульсии используется смесь для ОТ-ПЦР, в которую помещают клетки.
Составы реакционных смесей и ферменты для ПЦР и ОТ-ПЦР хорошо известны из уровня техники и доступны в виде коммерческих наборов реактивов. Особенности реакционных смесей, используемых для реализации данного изобретения описаны подробно в разделе «Б) Эмульсионная ПЦР либо ОТ-ПЦР», ниже. Примеры конкретных смесей приведены в разделе «Примеры».
В некоторых вариантах реализации изобретения для приготовления эмульсии клеток могут использоваться живые клетки непосредственно сразу после выделения из биологического материала. Например, для осуществления предлагаемого способа идентификации нативных пар тяжелых и легких цепей антител или пар альфа- и бета-цепей Т-клеточных рецепторов могут быть использованы мононуклеарные клетки периферической крови (МКПК), полученные при центрифугировании цельной крови в градиенте плотности фиколл-урографин.
В других вариантах реализации изобретения для приготовления эмульсии клеток могут использоваться клетки, подвергшиеся процедуре заморозки. В предпочтительном варианте для заморозки клеток используется среда с добавлением сыворотки и DMSO. Перед приготовлением эмульсии клетки необходимо разморозить и отмыть от криоконсервационной среды. Соответствующие протоколы хорошо известны и описаны например, в (Kreher et al. (2003) Journal of Immunological Methods 278:79-93, Reimann, et al. (2000) Clin. Diagn. Lab. Immunol. 7:352-359, and Romeu et al. (1992) J. Immunol. Methods 154:7-10.) В других вариантах реализации изобретения для приготовления эмульсии клеток могут использоваться клетки, подвергшиеся процедуре фиксации. Предпочтительным вариантом фиксации клеток является фиксация формальдегидом. Перед приготовлением эмульсии клетки необходимо отмыть от фиксирующего реагента.
Важным параметром, влияющим на качество приготовляемой эмульсии, является количество клеток, добавляемое в реакцию. При добавлении в реакцию слишком малого числа клеток становится невозможным получить детектируемое количество целевых спаренных фрагментов А-Б. При добавлении в реакцию избыточного числа клеток увеличивается вероятность попадания нескольких клеток в одну каплю эмульсии. Те мне менее, концентрация клеток при различных вариантах реализации изобретения может варьировать в широких пределах и составлять от 100 штук до 100 миллионов штук и более на 100 мкл водной фазы приготовляемой эмульсии. В предпочтительном варианте реализации изобретения, концентрация клеток составляет от 10 тысяч до 1 миллиона штук на 100 мкл водкой фазы приготовляемой эмульсии.
Эмульсия готовится путем перемешивания масляного компонента и водного компонента, например в соотношении 9:1. Перемешивание происходит, например, при температуре 25°С. Варианты приготовления эмульсии хорошо известны из уровня техники. В некоторых воплощениях заявленного способа для перемешивания масляного (смесь масла и эмульгаторов) и водного (смесь реагентов для ПЦР/ОТ-ПЦР и клеток) компонентов эмульсии используются микрофлюидные чипы, представляющие собой организованную систему микроканалов в объеме тонкой твердой подложки из стекла, кремния или полимеров (Eric Brouzes et al., 2009, PNAS, vol. 106, no. 34, 14195-14200; Zeng et al., Anal. Chem. 2010, 82, 3183-3190; Zhang et al., Anal. Chem. 2012, 84, 3599-3606). В других воплощениях заявленного способа для достижения этой цели используется механическое перемешивание компонентов эмульсии с помощью магнитной мешалки и магнитного якоря (Williams et al., Nat Methods, vol.3 no.7, 545-550; Dekosky BJ et al., Nat Biotechnol. 2013 Jan 20;31(2):166-9; Shao et al., PLoS One. 2011;6(9):e24910).
После перемешивания масляного и водного компонентов, подготовленная эмульсия распределяется по пробиркам для ПЦР-амплификации, количество которых зависит от объема реакционной смеси.
Б) Эмульсионная ПЦР либо ОТ-ПЦР
В некоторых воплощениях, стадия амплификации целевых фрагментов А и Б, проводимая в эмульсии клеток, способа настоящего изобретения осуществляется с помощью эмульсионной ПЦР, где матрицей служат целевые фрагменты ДНК. В других воплощениях стадия амплификации целевых фрагментов А и Б, проводимая в эмульсии клеток, осуществляется с помощью эмульсионной обратной-транскрипции-ПЦР (ОТ-ПЦР), где матрицей служат целевые фрагменты РНК.
Для выделения из клеток, изолированных в каплях эмульсии, фракции нуклеиновых кислот (ДНК/РНК) могут применяться различные технические решения. В некоторых вариантах реализации способа изобретения возможно использование технологии лазерного фотолизиса клеток (М. Не, J. S. Edgar, G. D. М. Jeffries, R. М. Lorenz, J. P. Shelby, D. Т. Chiu, Anal. Chem. 2005, 77, 1539-1544). В других вариантах реализации способа предлагаемого изобретения возможно использование технологии температурного лизиса клеток. Авторами изобретения показано, что при нагревании эмульсии, содержащей живые мононуклеарные клетки периферической крови, до температуры 65°С и инкубации при такой температуре в течение более 30 секунд, например, в течение 2 минут, происходит разрушение клеток внутри капель эмульсии и выход нуклеиновых кислот (ДНК/РНК) в реакционную среду.
Во варианте реализации предлагаемого изобретения, в котором в качестве матрицы для синтеза целевых фрагментов используется РНК, стадия (б) настоящего способа начинается с процесса обратной транскрипции. Обратная транскрипция представляет собой синтез одноцепочечной кДНК на матрице РНК и обеспечивает переход от нестабильных молекул РНК к более стабильным молекулам кДНК.
В этом случае, в преимущественном варианте воплощения предлагаемого изобретения, в составе реакционной смеси на стадии (б) настоящего способа должен присутствовать ингибитор РНКаз, например, ингибитор RNAsin плацентарного или рекомбинантного происхождения или ванадил-рибозидный комплекс - неспецифический ингибитор РНКаз широкого спектра действия.
Синтез первой цепи кДНК на матрице РНК происходит при участии фермента РНК-зависимой ДНК-полимеразы (обратной транскриптазы). Для проведения реакции обратной транскрипции могут использоваться различные коммерчески доступные препараты термостабильных обратных транскриптаз, способных сохранять свою активность после инкубации реакционной смеси при 65°С в течение 2 минут, например, обратная транскриптаза MMLV (Евроген) или Superscript III (Invitrogen).
Амплификация целевых фрагментов А и Б на матрице ДНК или кДНК происходит при участии фермента - ДНК-зависимой ДНК-полимеразы. Для проведения амплификации могут использоваться различные коммерчески доступные препараты термостабильных ДНК-полимераз, например, полимераза Encyclo (Евроген). Для амплификации кДНК, ключевым свойством используемой ДНК-полимеразы является способность работать в одном и том же буфере с обратной транкриптазой, так как реакция происходит в пределах эмульсии, не оставляя возможности для замены реакционного буфера.
Для проведения амплификации целевых фрагментов А и Б на матрице ДНК или кДНК на стадии (б) настоящего способа необходимо присутствие в составе реакционной смеси по крайней мере двух пар специфических праймеров (прямого и обратного) - для амплификации фрагмента «А» (праймеры «а») и для амплификации фрагмента «Б» (праймеры «б»).
Праймеры - синтетические олигонуклеотиды, комплементарные последовательностям ДНК на левой и правой границах амплифицируемого фрагмента и ориентированные таким образом, что достраивание новой цепи ДНК проходит только между ними. В результате ПЦР происходит многократное увеличение числа копий (амплификация) специфического фрагмента ДНК или кДНК.
Один из пары праймеров обозначается термином «прямой», а второй - «обратный». Для нужд настоящего изобретения термином «прямой праймер» обозначен праймер, который повторяет последовательность кодирующей цепи ДНК, а термином «обратный праймер» - праймер, который комплементарен кодирующей цепи. Как здесь используется «кодирующая цепь ДНК» обозначает цепь идентичную мРНК, а комплементарная ей цепь используется как матрица при транскрипции.
Во варианте реализации предлагаемого изобретения, в котором в качестве матрицы для синтеза целевых фрагментов используется РНК, два обратных праймера кроме того служат для затравки синтеза первой цепи кДНК на матрице РНК. Два прямых праймера служат для ПЦР-амплификации целевых фрагментов А и Б.
Оптимальные концентрации праймеров в реакционной смеси варьируют в пределах 0.1-1 мкМ, как правило, в пределах 0.2-0.5 мкМ.
В вариантах осуществления настоящего изобретения, в которых проводится идентификация нескольких пар фрагментов нуклеиновых кислот, присутствующих в одних и тех же живых клетках, на стадии (б) предлагаемого способа используются смеси прямых и обратных праймеров, специфичных к парам исследуемых целевых фрагментов.
Помимо нуклеиновых кислот (ДНК/РНК) - матриц для синтеза целевых фрагментов А и Б, ферментов, осуществляющих этот синтез (обратной транскриптазы, ДНК-полимеразы) и праймеров в состав реакционной смеси заявленного способа вводят следующие компоненты:
- смесь дезоксирибонуклеотидтрифосфатов четырех типов (dATP, dTTP, dGTP, dCTP). Концентрация dNTP может варьировать от 0.2 мМ до 0.6 мМ для каждого dNTP, причем все четыре dNTPs должны использоваться в эквивалентных концентрациях для минимизации ошибок присоединения. В предпочтительном варианте реализации изобретения используется концентрация dNTP 0.6 мМ.
- реакционный буферный раствор, в котором используемые ферменты сохраняют функциональность. Состав буферного раствора зависит от того, какие именно ферменты используются для ПЦР или ОТ-ПЦР.
Как здесь используется, термин "функциональный" означает, что фермент может функционировать для указанного испытания или задачи. Например, термин "функциональный", используемый для описания ДНК полимеразы означает, что она способна осуществлять синтез на подходящей ДНК или РНК-матрице.
Реакция амплификации целевых фрагментов А и Б проводится с использованием специализированного оборудования - амплификаторов, согласно температурному режиму, показанному в таблице 1.