Способ количественного определения n-нитрозодиметиламина и n-нитрозодиэтиламина в крови методом капиллярной газовой хроматографии
Иллюстрации
Показать всеИзобретение относится к области аналитической химии и касается способа количественного определения N-нитрозаминов (N-нитрозодиметиламина и N-нитрозодиэтиламина) в крови. Сущность способа заключается в том, что производят отбор пробы крови, подготовку ее к анализу и количественное определение нитрозоамина в пробе методом газохроматографического анализа. При этом подготовку пробы производят путем добавления к ней гидроксида калия при соотношении 1 объемная часть пробы к 1,6 массовой части гидроксида калия, с последующей отгонкой дистиллята с помощью водяного пара и введением в дистиллят гидроксида калия при соотношении 1 объемная часть дистиллята к 1,6 массовой части гидроксида калия. Далее смесь дистиллята и гидроксида калия помещают в замкнутую систему дозатора равновесного пара, где в изотермических условиях осуществляют термостатирование, преимущественно в течение 20 мин, для установления фазового равновесия. Производят отбор газовой фазы над дистиллятом и вводят ее в капиллярную колонку газохроматографа, далее осуществляют газохроматографическое разделение N-нитрозодиметиламина и N-нитрозодиэтиламина. Количество каждого указанного вещества устанавливают по градуировочному графику. 2 з.п. ф-лы, 4 табл.
Реферат
Изобретение относится к медицинским токсикологическим исследованиям, в частности к санитарной токсикологии, и может быть использовано для количественного определения N-нитрозаминов (N-нитрозодиметиламина и N-нитрозодиэтиламина) в биологической жидкости - в крови.
Из Патента РФ №2159423 известен способ измерения количества нитрозосоединений в окружающей среде, в частности в крови, заключающийся в том, что готовят пробу, измеряют дозу γ-облучения, полученную пробой, отделяют азотсодержащие ионы, определяют концентрацию предшественников нитрозосоединений, при этом пробу предварительно очищают путем применения буфер-осадителя от компонентов, влияющих на оптическую плотность пробы, с возможностью получения пробы, содержащей только предшественников нитрозосоединений, затем определяют величину pH пробы, дополнительно измеряют дозу β-облучения и по содержанию предшественников нитрозосоединений, величинам доз γ и β облучений и величине pH определяют концентрацию S, O, N, C-нитрозосоединений. Причем после введения буфер-осадителя осуществляют центрифугирование с последующей фильтрацией пробы.
Недостатком известного способа являются высокие трудозатраты на пробоподготовку. А, кроме того, для этого известного способа характерна неспецифичность и неселективность, ввиду использования колориметрического метода.
Также известен способ определения нитрозаминов, заключающийся в обработке анализируемой пробы крови бромистым водородом в среде ледяной уксусной кислоты с последующей обработкой полученного раствора индикаторной смесью - [нафтил-(1)]-этилендиаммониумдихлоридом в сульфаниловой кислоте, и спектрофотометрировании образующихся при этом окрашенных продуктов. Недостатком известного способа является низкая чувствительность - 2-3 мкг/мл. Неспецифичность и неселективность колориметрического метода [Eisenbrand G, Prenssmann R. New methode zur. Kolorimetrischen Bestiming von Nitrosaminen nach Spaltung der Nitrogruppe mit wassewrstoff in Eisessig/Arrneimitt forschung, 1970, 20, 1513.]
Из уровня техники известен способ количественного определения нитрозаминов в пробе крови, заключающийся в последовательной обработке анализируемой пробы раствором пиридина, раствором сульфата меди (II), раствором гидрохинона, раствором перекиси водорода при pH среды 7,1-7,9 с последующим спектрофотометрированием интенсивности окраски образующихся при этом продуктов реакции [Авторское свидетельство СССР №615398]. Этот способ позволяет проводить определение нитрозоаминов в интервале 1*10-13-1*10-11 М с пределом обнаружения (1,0±0.7)*10-13 М.
Еще известен способ количественного определения нитрозоаминов путем последовательной обработки анализируемой пробы раствором 1,2,4-триацетоксибензола (пирогаллола «А»), раствором перекиси водорода при pH среды 8,0-10,0 с последующим измерением оптической плотности полученного раствора, который позволяет проводить определение нитрозоаминов в интервале 10*10-15-1*1011 М с пределом обнаружения ((1,0±0,6)*10-15 М [Авторское свидетельство СССР №979970]. Чувствительность известного способа возросла в 2,5 раза по сравнению с известными способами.
Недостатками указанных выше способов являются следующие:
- большие затраты времени на исследования ввиду сложности выполнения пробоподготовки;
- высокая трудоемкость выделения N-нитрозодиметиламина из биосреды;
- неспецифичность и неселективность метода.
Наиболее близким по технической сущности к предлагаемому изобретению является способ определения N-нитрозодиметиламина в биологической среде (крови) газохроматографическим методом с термоэнергетическим детектором, описанный Pylypiw НМ Jr., Zimmerman F, Harrington GW, et al. 1985. Apparatus for trace determination of volatile N-nitrosamines in small samples. Anal Chem 57:2996-2997. В пробу крови объемом 2 см3 добавляют серную кислоту и антивспениватель. Затем проводят экстракцию образцов крови хлористым метиленом в экстракторе. Биологические образцы концентрируют и анализируют методом газовой хроматографии с термоэнергетическим детектором. Предел обнаружения N-нитрозодиметиламина в биологической среде составил 0,1 мкг/л.
Недостатком указанного способа является высокая трудоемкость выделения N-нитрозодиметиламина из биосреды и невозможность определения N-нитрозодиэтиламина. При этом для осуществления этого процесса используется дорогостоящее оборудование - термоэнергетический детектор.
Технический результат, достигаемый предлагаемым способом, заключается в расширении спектра определения нитрозоаминов в крови, в повышении чувствительности и точности при одновременном упрощении стадии пробоподготовки.
Указанный технический результат достигается предлагаемым способом количественного определения N-нитрозодиметиламина и N-нитрозодиэтиламина в крови методом капиллярной газовой хроматографии, включающим отбор пробы крови, подготовку ее к анализу и количественное определение нитрозоамина в пробе методом газохроматографического анализа, при этом новым является то, что подготовку пробы крови к анализу производят путем добавления к ней гидроксида калия при соотношении 1 объемная часть пробы к 1,6 массовой части гидроксида калия, с последующей отгонкой дистиллята с помощью водяного пара и введением в дистиллят гидроксида калия при соотношении 1 объемная часть дистиллята к 1,6 массовой части гидроксида калия, далее смесь дистиллята и гидроксида калия помещают в замкнутую систему дозатора равновесного пара, где в изотермических условиях осуществляют термостатирование для установления фазового равновесия, затем производят отбор газовой фазы над дистиллятом и выполняют введение этой фазы в капиллярную колонку газохроматографа, далее осуществляют газохроматографическое разделение N-нитрозодиметиламина и N-нитрозодиэтиламина, а количество каждого указанного вещества устанавливают по градуировочному графику.
Газохроматографическое разделение N-нитрозодиметиламина и N-нитрозодиэтиламина осуществляют с использованием газового хроматографа с термоионным детектором на капиллярной колонке DB-624 - 30m*0,32mm*0,25µm, при температурном режиме: колонка - от 50°C-200°C; испаритель - 200°C; детектор - 250°C; расход газа-носителя - азота - 20 см3/мин, с делением потока 1:14,3.
Термостатирование смеси в дозаторе равновесного пара осуществляют в течение 20 минут.
Поставленный технический результат достигается за счет следующего.
Следует пояснить, что для повышения полноты извлечения N-нитрозаминов из крови методом анализа равновесной паровой фазы были проведены исследования по изучению влияния различной массы щелочи на эффективность выщелачивающей способности изучаемых соединений из биосреды (кровь). Связывание азотсодержащих органических соединений с белками крови зависит от pH среды. Органические азотсодержащие вещества основного характера связываются с белками при pH выше их изоэлектрической точки (кровь имеет pH=7,35…7,40). N-нитрозоамины (N-нитрозодиметиламин и N-нитрозодиэтиламин) относятся к группе веществ с основными свойствами, поэтому хорошо экстрагируются из щелочной среды при pH=10-11. При этих значениях pH происходит разрушение связей белковых веществ крови с N-нитрозаминами [Токсикологическая химия: учебник для вузов / под ред. Плетеневой. 2-е изд., испр. - М.: ГЭОТАР-Медиа, 2006. - 512 с.].
Однако экспериментальным путем было установлено, что не все щелочи подходят для того, чтобы обеспечить полноту извлечения нитрозаминов из крови. И только гидроксид калия подходит больше всего для достижения этой цели. Но причем он должен быть введен в пробу крови в точно заявленной дозировке, чтобы обеспечить одновременно и высокую точность определения и высокую чувствительность.
При пробоподготовке после отгонки дистиллята производился последующий нагрев смеси дистиллята с гидроксидом калия в дозаторе равновесного пара (преимущественно, в течение 20 минут) до установления фазового равновесия. При этом при отработке оптимальных условий подготовки биопробы (крови) к газофазному анализу учитывали такие параметры, как температура и давление, создаваемые в замкнутой гетерогенной системе жидкость-газ. Для исключения влияния изменений температуры и общего давления на точность газофазного анализа при количественных измерениях применяли технику пневматического парофазного дозирования биопроб в капиллярную колонку хроматографа дозатором DANI HSS 86.50 HEAD SPACE SAMPLER.
Цикл дозирования представляет собой механические операции, выполняемые дозатором DANI HSS 86.50 HEAD SPACE SAMPLER для переноса газовой фазы из дозатора равновесного пара (виалы) в газохроматографическую колонку. В процессе исследований были отработаны оптимальные параметры цикла дозирования газовой фазы в дозаторе (перед вколом в хроматографическую колонку): температура термостата - 80°C; узла дозирования - 130°C; переходной линии - 135°C; время инкубации - 25 мин; расход газа-носителя - 60 мл/мин; оптимальное давление наддува - 0,2 bar.
Кроме того, вышеуказанные операции, по-видимому, обеспечивают снижение нижнего предела обнаружения и повышение чувствительности определений N-нитрозодиметиламина (НДМА) и N-нитрозодиэтиламина (НДЭА) в крови за счет их концентрирования с помощью метода дистилляции летучих нитрозаминов из крови водяным паром и последующим газохроматографическим анализом равновесной паровой фазы, оптимально подобранных параметрах газохроматографического анализа равновесной паровой фазы (параметры цикла дозирования проб крови с помощью дозатора равновесного пара, масса щелочи), температуры нагрева парообразователя и колбы с биосредой.
Для повышения эффективности извлечения летучих N-нитрозоаминов из крови гидроксид калия массой 8 г добавляли и в биосреду и отогнанный дистиллят при температуре паробразователя t=100±5°C и круглодонной колбы с биосредой t=80±5°C.
Экспериментальным путем были также подобраны оптимальные условия хроматографического процесса для четкого разделения пиков НДМА и НДЭА от пиков других соединений на аппаратно-программном комплексе "Кристалл 5000" с применением стандартных образцов. В процессе исследований были апробированы следующие капиллярные колонки различной длины и толщины пленки неподвижной фазы: DB-624, HP-FFAP, HP-Plot/U, HP-VOC. Качественное разделение N-нитрозаминов (N-нитрозодиметиламина и N-нитрозодиэтиламина) с близкими по физико-химическими свойствам соединениями было достигнуто на капиллярной колонке серии DB-624 - 30m*0,32mm*0,25µm, при температурном режиме: колонка - от 50-200°C; испаритель - 200°C; детектор - 250°C; расход газа-носителя - азота - 20 см3/мин, с делением потока 1:14,3. Это позволило расширить спектр определения нитрозоаминов в крови (два компонента вместо одного в прототипе) и повысить чувствительность и точность их определения.
Таким образом, благодаря совокупности и последовательности указанных операций предлагаемого способа, их режимам и обеспечивается высокая степень точности и чувствительности.
Для осуществления предлагаемого способа проводят следующие операции в нижеуказанной последовательности:
- проводят отбор пробы крови в количестве примерно 5 см3;
- в перегонную колбу объемом 100 см3 добавляли 5 см3 образца крови и сухого гидрооксида калия (8 г);
- с помощью водяного пара, образуемого в парообразователе, отгоняли дистиллят;
- дистиллят, сконденсированный в холодильнике, собирали в объеме 5 см3 в коническую колбу-приемник;
- в отогнанный объем дистиллята добавляли 8 г сухого гидроксида калия и помещали смесь в замкнутую систему (виала V=20 см3) дозатора равновесного пара, далее смесь нагревали до установления фазового равновесия, в частности, в течение 20 минут;
- после установления фазового равновесия при оптимальных параметрах цикла дозирования проб крови (температура термостата - 80°C, узла дозирования - 130°C, переходной линии - 135°C, время инкубации - 25 мин, расход газа-носителя - 60 мл/мин, оптимальное давление наддува - 0,2 bar) газовая фаза вводилась в капиллярную колонку газового хроматографа через испаритель и анализировалась в условиях: термоионный детектор (ТИД), капиллярная колонка DB-624 - 30m*0,32mm*0,25µm, температурный режим: колонка - от 50-200°C; испаритель - 200°C; детектор - 250°C; расход газа-носителя 1 (азот) - 1,4 см3/мин; расход газа-носителя 2 (азот) - 20 см3/мин;
- количественное содержание N-нитрозодиметиламина и N-нитрозодиэтиламина устанавливали по градуировочным графикам, которые традиционно строятся посредством использования отобранных у контрольной группы детей проб крови (дети проживают на экологически безопасной территории и их пробы крови не содержат нитрозамины) и стандартных растворов N-нитрозодиметиламина и N-нитрозодиэтиламина.
Градуировочный график строится следующим образом.
Сначала осуществляют приготовление исходного раствора. Для этого в мерную пробирку объемом 10 см3 дозатором добавляют бидистиллированную воду в объеме 2 см3, вводят микрошприцем по 2 мм3 N-нитрозаминов (N-нитрозодиметиламин, N-нитрозодиэтиламин) (вводят по отдельности в одну мерную колбу. Строят отдельно график для первого и для второго соединения). Весовое содержание компонентов в исходном растворе составляет (с учетом плотности и содержания основного вещества): N-нитрозодиметиламин - 1,005 мг/см3, N-нитрозодиэтиламин - 0,942 мг/см3. Срок хранения раствора 12 часов.
Затем готовят рабочий раствор. В мерную пробирку объемом 2 см3, содержащую бидистиллированную воду в объеме 1,0 см3, вводят дозатором 20 мм3 исходного раствора N-нитрозаминов. Массовая концентрация N-нитрозодиметиламина в рабочем растворе для градуировки составляет 0,02 мг/см3 и N-нитрозодиэтиламина - 0,0188 мг/см3. Срок хранения раствора 5 часов.
Приготовление градуировочных растворов. Градуировочные растворы N-нитрозаминов готовят в мерных пробирках объемом 5 см3. Для этого в каждую пробирку дозатором вносят по 5 см3 крови и добавляют исходный раствор для градуировки в соответствии с таблицей 1 и тщательно перемешивают.
Градуировочную характеристику, выражающую зависимость площади хроматографического пика (Гц·с) от массовой концентрации N-нитрозоаминов (мг/дм3) в крови, устанавливают по 5 сериям измерений по 5 концентрациям каждого вещества в каждой серии для каждого диапазона в соответствии с таблицей 1.
Исследуемый образец крови в объеме 5 см3 помещают в перегонную колбу объемом 100 см3, добавляют гидрооксид калия (8 г) и с помощью водяного пара, образуемого в парообразователе, отгоняют дистиллят. Дистиллят, сконденсированный в холодильнике, собирают в объеме 5 см3 в коническую колбу-приемник. Затем в отогнанный объем дистиллята добавляют щелочь-гидроксид калия и помещают в замкнутую систему (виала V=20 см3) дозатора равновесного пара. После установления фазового равновесия в изотермических условиях газохроматографически измеряют равновесную концентрацию N-нитрозоаминов в газовой фазе над исследуемым дистиллятом.
Для получения достоверных результатов анализ каждой градуировочной смеси проводят не менее 2-х раз. Процедуру повторяют аналогично для каждого градуировочного раствора. На полученной хроматограмме определяют площади пиков компонентов и по средним результатам из 5 серий строят градуировочную характеристику.
Отработка оптимальных газохроматографических параметров для определения N-нитрозаминов в крови осуществлялась с использованием аппаратно-программного комплекса на базе газового хроматографа "Кристалл-5000" с термоионным детектором (ТИД). Высокая эффективность метода достигнута путем подбора оптимальных условий газохроматографического анализа: термоионный детектор (ТИД), капиллярная колонка DB-624 - 30m*0,32mm*0,25µm, температурный режим: колонка - от 50-200°C; испаритель - 200°C; детектор - 250°C; расход газа-носителя 1 (азот) - 1,4 см3/мин; расход газа-носителя 2 (азот) - 20 см3/мин.
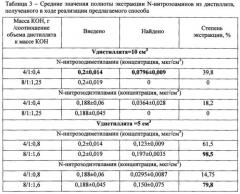
В ходе лабораторных испытаний были проведены исследования по изучению полноты экстракции из образца крови изучаемых соединений с использованием различной массы щелочи-гидроксида калия. Полученные результаты представлены в таблице 2.
Экспериментальным путем установлено, что полнота извлечения N-нитрозоаминов из крови с добавлением гидроксида калия в количестве 8 г в объем крови 5 см3 (соотношение объема крови к массе щелочи 1:1,6 соответственно) и газохроматографическим анализом равновесной паровой фазы составила для N-нитрозодиметиламина - 98% и N-нитрозодиэтиламина - 77% (таблица 2).
С целью повышения степени экстракции N-нитрозоаминов из крови в процессе изучения полноты экстракции были проведены дополнительные исследования по выделению изучаемых соединений из биологической жидкости методом перегонки с водяным паром (отгон различного объема дистиллята V=5 см3 и 10 см3) и газохроматографическим анализом равновесной паровой фазы. В условиях сравнительно низкой температуры летучие N-нитрозоамины, имеющие основной характер, удается разделить перегонкой с водяным паром, меняя pH среды, и в щелочной среде эти соединения перегоняются без разложения, что позволяет получить их в чистом виде. Указанные опыты проводили следующим образом.
Исследуемый образец крови в объеме 5 см3 помещали в перегонную колбу объемом 100 см3, добавляли гидрооксид калия (8 г) и с помощью водяного пара, образуемого в парообразователе, отгоняли дистиллят. Дистиллят, сконденсированный в холодильнике, собирали в объеме 5 см3 или 10 см3 в коническую колбу-приемник. Затем в отогнанный объем дистиллята добавляли щелочь - гидроксид калия (4 г или 8 г) и помещали в замкнутую систему (виала V=20 см3) дозатора равновесного пара. После установления фазового равновесия в изотермических условиях газохроматографически измеряли равновесную концентрацию N-нитрозоаминов в газовой фазе над исследуемым дистиллятом.
Средние значения полноты экстракции N-нитрозоаминов с добавлением различной массы гидроксида калия в объем дистиллята представлены в таблице 3.
Экспериментальным путем установлено, что при извлечении летучих N-нитрозоаминов (N-нитрозодиметиламин, N-нитрозодиэтиламин) из биологической среды - крови, с добавлением гидрооксида калия массой 8 г в 5 см3 крови методом дистилляции с водяным паром и добавлением 8 г щелочи в объем дистиллята 5 см3 при температуре паробразователя t=100±5°C и круглодонной колбы с кровью t=80±5°C и последующим газохроматографическим анализом равновесной паровой фазы, степень экстракции для N-нитрозодиметиламина составила 98,5% и N-нитрозодиэтиламина - 79,8% (таблица 3). Это доказывает, что только при выдерживании соотношения 1 объемная часть пробы крови к 1,6 массовой части гидроксида калия и при одновременном соотношении 1 объемная часть дистиллята к 1,6 массовой части гидроксида калия будет обеспечена высокая степень экстракции нитрозоаминов из пробы крови, а значит высокая точность и чувствительность.
Учитывая, что не любая щелочь пригодна для определения N-нитрозоаминов в крови, в процессе исследований для извлечения N-нитрозоаминов из крови предлагаемым способом при выборе щелочи применяли гидроксид калия и гидроксид натрия. Прецизионность анализа и эффективность извлечения N-нитрозаминов из крови устанавливали экспериментально способом «введено-найдено» с применением стандартных растворов. Средние значения полноты экстракции N-нитрозодиметиламина и N-нитрозодиэтиламина из крови методом анализа равновесной паровой фазы при п=5 (п - число проб) и с вероятностью р=0,95 показали, что при использовании гидроксида калия полнота извлечения составила для N-нитрозодиметиламина - 98,5% и N-нитрозодиэтиламина - 79,8%; а при использовании гидроксида натрия лишь для N-нитрозодиметиламина - 35% и N-нитрозодиэтиламина - 29%.
Таким образом, результаты исследований доказывают, что благодаря совокупности и последовательности операций предлагаемого способа, их режимам и достигается высокая степень точности и чувствительности определения N-нитрозодиметиламина и N-нитрозодиэтиламина в крови методом дистилляции с водяным паром и газохроматографическим анализом равновесной паровой фазы.
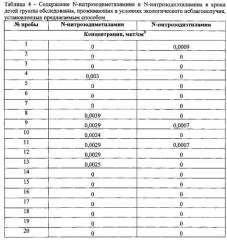
При проведении исследований также проводили анализы проб крови у детей (группа обследования), проживающих в условиях экологического неблагополучия с возможным влиянием N-нитрозаминов на организм ребенка. Пробы крови обрабатывали предлагаемым способом и по калибровочному (градуировочному) графику определяли содержание компонентов в пробах крови детей. Полученные результаты приведены в таблице 4.
Исследования показали, что предлагаемый способ позволяет с высокой степенью точности и чувствительности выполнять определение N-нитрозоаминов (N-нитрозодиметиламина и N-нитрозодиэтиламина) в крови в диапазоне концентраций от 0,002 до 0,1 мкг/см3 (концентрация N-нитрозодиэтиламина в крови детей (таблица 4) определена на уровне нижнего предела определения, который составляет для предлагаемого способа 0,00048 мкг/см3), при погрешности способа 23,4% и при оптимальных параметрах газохроматографического анализа и пробоподготовки. Установлено, что наибольшая степень извлечения N-нитрозоаминов из крови достигается при использовании при реализации предлагаемого способа дистилляции летучих N-нитрозаминов из биологической среды (кровь) с водяным паром и последующим газохроматографическим анализом равновесной паровой фазы в щелочной среде при рН=10-11 и составила для N-нитрозодиметиламина 98,5%, для N-нитрозодиэтиламина - 79,8%.
1. Способ количественного определения N-нитрозодиметиламина и N-нитрозодиэтиламина в крови методом капиллярной газовой хроматографии, включающий отбор пробы крови, подготовку ее к анализу и количественное определение нитрозоамина в пробе методом газохроматографического анализа, отличающийся тем, что подготовку пробы крови к анализу производят путем добавления к ней гидроксида калия при соотношении 1 объемная часть пробы к 1,6 массовой части гидроксида калия, с последующей отгонкой дистиллята с помощью водяного пара и введением в дистиллят гидроксида калия при соотношении 1 объемная часть дистиллята к 1,6 массовой части гидроксида калия, далее смесь дистиллята и гидроксида калия помещают в замкнутую систему дозатора равновесного пара, где в изотермических условиях осуществляют термостатирование для установления фазового равновесия, затем производят отбор газовой фазы над дистиллятом и выполняют введение этой фазы в капиллярную колонку газохроматографа, далее осуществляют газохроматографическое разделение N-нитрозодиметиламина и N-нитрозодиэтиламина, а количество каждого указанного вещества устанавливают по градуировочному графику.
2. Способ по п. 1, отличающийся тем, что газохроматографическое разделение N-нитрозодиметиламина и N-нитрозодиэтиламина осуществляют с использованием газового хроматографа с термоионным детектором на капиллярной колонке DB-624 - 30m*0,32mm*0,25µm, при температурном режиме: колонка - от 50°C-200°C; испаритель - 200°C; детектор - 250°C; расход газа-носителя - азота - 20 см3/мин, с делением потока 1:14,3.
3. Способ по п. 1, отличающийся тем, что термостатирование смеси в дозаторе равновесного пара осуществляют в течение 20 минут.