Способ оценки состояния здоровья женщин при прогнозировании физиологического и осложненного течения беременности на ранних сроках гестации
Иллюстрации
Показать всеИзобретение относится к микроэкологии и иммунологии и может использоваться для интегральной оценки состояния здоровья женщин при прогнозировании физиологического и осложненного течения беременности на ранних сроках гестации. Способ заключается в оценке состояния микробиоценоза слизистых открытых полостей, регистрации степени нарушения микробиоценоза конкретного биотопа слизистых независимо от его локализации как показателя общей реактивности макроорганизма у беременных женщин. В зависимости от полученного результата судят о состоянии здоровья беременных и прогнозируют физиологическое или осложненное течение беременности: физиологическое течение беременности при регистрации I или II степени микробиоценоза слизистых открытых полостей, отсутствии индикации возбудителей урогенитальных инфекций и отсутствии клинических проявлений невынашивания; осложненное течение беременности при регистрации I или II степени микробиоценоза слизистых открытых полостей, отсутствии индикации возбудителей урогенитальных инфекций и наличии клинических проявлений невынашивания неинфекционного генеза, заканчивающегося рождением плода; осложненное течение беременности при регистрации III или IV степени микробиоценоза слизистых открытых полостей, отсутствии индикации возбудителей урогенитальных инфекций и отсутствии клинических проявлений невынашивания (продромальный период инфекционного процесса и угрожающий выкидыш); иммунологическое отторжение плода при регистрации III или IV степени микробиоценоза слизистых открытых полостей, индикации возбудителей урогенитальных инфекций и наличии клинических проявлений невынашивания (начавшийся выкидыш). 1 ил., 9 табл., 3 пр.
Реферат
Изобретение относится к микроэкологии и иммунологии и может использоваться для интегральной оценки состояния здоровья женщин при прогнозировании физиологического и осложненного течения беременности.
Реактивность организма - способность организма отвечать на воздействия внешней среды изменением своей жизнедеятельности, что обеспечивает его адаптацию к различным условиям обитания. Резистентность тесно связана с реактивностью организма, представляя собой одно из основных ее следствий и выражений. Реализация механизмов резистентности организма обеспечивается, как правило, не одним каким-либо органом или системой, а взаимодействием комплекса различных органов и физиологических систем, включая все звенья регуляторных процессов. Резистентность организма может определяться относительно стабильными свойствами различных органов, тканей и физиологических систем, в т.ч. не связанных с активными реакциями на данное воздействие. Значительные колебания индивидуальной резистентности могут быть связаны с особенностями реактивности организма во время его взаимодействия с повреждающим агентом. Резистентность может понижаться при недостатке, избытке или качественной неадекватности биологически значимых факторов (питания, двигательной активности, трудовой деятельности, информационной нагрузки и стрессовых ситуаций, различных интоксикаций, экологических факторов и др.). В формирования резистентности решающее значение имеют активные защитно-приспособительные реакции, направленные на сохранение гомеостаза при потенциально вредных воздействиях факторов внешней среды или неблагоприятных сдвигах во внутренней среде организма. Эффективность таких реакций и, следовательно, степень резистентности к различным факторам зависит от врожденных и приобретенных индивидуальных особенностей организма. Резистентность изменяется в процессе онтогенеза, причем ее возрастная динамика по отношению к различным воздействиям неодинакова, однако в целом она оказывается наиболее высокой в зрелом возрасте и снижается по мере старения организма. Различают неспецифическую и специфическую резистентность. Под неспецифической резистентностью понимают способность организма противостоять воздействию разнообразных по своей природе факторов. Специфическая резистентность характеризует высокую степень противодействия организма воздействию определенных факторов или их близких групп, устойчивость против различных болезнетворных воздействий [1].
Основой формирования различных гестационных осложнений является влияние неблагоприятных факторов, среди которых наибольшее значение имеют стресс, преморбидный фон, факторы инфекционной природы, гормональные нарушения, генетическая составляющая и т.д. Однако при наличии одних и тех же факторов риска развитие патологических состояний реализуется не во всех случаях. С другой стороны, патологические состояния при беременности развиваются не только у женщин группы высокого риска (при наличии отягощенного соматического или акушерско-гинекологического анамнеза), но и у практически здоровых женщин, поскольку беременность в ряде случаев является триггером патологических процессов.
Существующие способы прогнозирования гестационных осложнений обладают рядом недостатков. Использование ряда способов прогнозирования исходов беременности предполагается только во второй половине гестации (при полностью сформировавшейся плаценте, визуализации плодово-плацентарного кровообращения, угрозе позднего выкидыша или преждевременных родов), что не всегда позволяет осуществлять превентивные меры по предотвращению формирования патологических состояний [2, 3, 4, 5, 6]. Ряд способов прогнозирования исхода беременности связан с их использованием в отношении определенного контингента женщин, что существенно сужает круг обследуемых и снижает ценность разработанных технологий. Так, известны способы прогнозирования исхода беременности у женщин с привычным невынашиванием и высоким перинатальным риском [7], способы прогноза ранних репродуктивных потерь при наличии угрозы прерывания беременности [8, 9], инфекционного фактора [10, 11], имеющегося прерывания беременности в анамнезе [12], способы прогнозирования осложнений беременности и развития перинатальной патологии у пациенток с тромбофилией [13], ВИЧ-инфицированных женщин [14], а также при беременности, индуцированной вспомогательными репродуктивными технологиями в связи с лечением бесплодия [15], что уже само по себе чаще всего является условием для отнесения пациенток в группу риска по неблагоприятным исходам беременности. Вышеперечисленные факторы как изолированно, так и в сочетании друг с другом могут обусловливать нарушения процессов имплантации и плацентации, а также гемодинамические сдвиги, опосредующие в итоге нарушения в системе «мать-плацента-плод». Узконаправленный подход к прогнозированию исходов беременности, ограниченный либо конкретным патологическим состоянием, либо применением способа прогноза у определенного контингента женщин, не дает возможности оценить риск реализации гестационных осложнений в целом, что является наиболее востребованным как у пациенток с отягощенным акушерским анамнезом, так и у первобеременных женщин.
В связи с этим наиболее ценными являются безопасные (неинвазивные или малоинвазивные) способы прогнозирования исходов беременности, позволяющие вне зависимости от вида патологии и на ранних сроках гестации дифференцировать физиологическое и осложненное течение беременности.
Задачей изобретения является разработка способа оценки состояния здоровья женщин при прогнозировании физиологического и осложненного течения беременности на ранних сроках гестации.
Поставленная задача изобретения реализуется таким образом, что состояние здоровья женщин оценивают в зависимости от состояния микробиоценоза конкретного биотопа слизистых открытых полостей независимо от локализации в соответствии с разработанной методикой оценки и в зависимости от регистрируемой степени нарушения микробиоценоза как показателя общей реактивности макроорганизма, судят о состоянии здоровья женщин и прогнозе физиологического или осложненного течения беременности.
В настоящее время накоплен большой фактический материал о роли микрофлоры в жизнедеятельности человека и в формировании его реактивности и антиинфекционной резистентности. Нормальная микрофлора способствует поддержанию необходимого барьерного уровня слизистых оболочек, кожи и образует первую линию защиты от инфекций, а также выполняет ряд других важных функций в организме человека. Изменения в видовом составе микрофлоры не только свидетельствуют о нарушении бактериального равновесия в разных микробиотопах, но и являются показателями функциональных и анатомических повреждений определенных структурно-физиологических мест организма [16]. Микробиоценоз является весьма чувствительным индикатором, реагирующим количественными и качественными изменениями на любые сдвиги внешней и внутренней среды [17]. Известно, что исследование микрофлоры организма - это высокоинформативный и доступный метод оценки состояния здоровья человека, коррелирующий с другими клиническими и лабораторными показателями. Установлено, что в процессе развития человека наблюдаются определенные критические периоды, когда на антигенное воздействие иммунная система дает неадекватный или парадоксальный ответ [18]. Было показано, что каждому периоду критического развития иммунной системы детей соответствует определенная микрофлора кишечника. При этом во всех периодах отмечается угнетение индигенной микрофлоры и увеличение УПМ [19].
Любое заболевание, по сути, является следствием нарушенного гомеостаза. Дисбиотические нарушения появляются задолго до клинических проявлений болезни и являются отражением иммунологической реактивности макроорганизма. В этой связи микрофлора является его важнейшим фактором и патологию любой локализации следует рассматривать в связи с состоянием микробиоценозов. Изменения качественного и количественного состава микрофлоры толстой кишки в виду иммуностимулирующей функции индигенной микрофлоры, в свою очередь, ведет к снижению иммунологической реактивности организма [20, 21]. В связи с этим возникает вопрос, что является первичным: либо процесс начинается с изменения микрофлоры и ведет к развитию иммунодефицита, отражаясь на течении основной болезни, либо снижение иммунологической реактивности макроорганизма под влиянием неблагоприятных факторов среды провоцирует развитие дисбактериоза. С современных позиций нарушения нормальной микрофлоры состояние иммунного статуса и проявление болезни рассматривается в единстве, причем роль пускового механизма в каждом конкретном случае может принадлежать любому из этих компонентов триады: дисбактериозу, иммунному статусу и патологическому процессу. Дисбактериоз может быть следствием развития иммунодефицитов или сопровождать болезнь [19]. В свете взаимообусловленности микроэкологических и иммунологических сдвигов макроорганизма актуальным являются работы по экологической иммунологии. Микроэкологические подходы к пониманию их развития могут явиться отправной точкой создания новых методов лечения. Человеку свойственен только ему присущий микроэкологический гомеостаз, поэтому возможны и другие проявления микроэкологического кризиса. Отсутствие четкого разграничения между условным патогеном и комменсалом дает основание полагать, что неограниченная колонизация организма любым видом бактерий, способным выживать в организме человека, может приводить к развитию патологии. Ведущую роль в развитии таких осложнений играет, по-видимому, не вирулентность самого возбудителя, а состояние иммунологической реактивности организма. Так, у иммунокомпрометированных лиц слабовирулентные или авирулентные микроорганизмы (кандиды и пневмоцисты) могут вызвать тяжелые и часто фатальные поражения. Разнообразные неблагоприятные воздействия вызывают изменения иммунного ответа и поэтому могут влиять на качественные и количественные характеристики микробиоценозов открытых полостей. Инфекции могут быть вызваны как нормальной эндогенной микрофлорой, так и экзогенными микроорганизмами, колонизирующими больных в процессе нахождения в клинике. Антибиотики, подавляющие анаэробную микрофлору ЖКТ, увеличивают риск последующей колонизации как УПМ, так и патогенной микрофлорой. Во взаимоотношениях макроорганизма с его микрофлорой в неблагоприятных условиях, вызванных различными воздействиями на организм (например, стресс) или на микробиоту (массивная антибиотикотерапия), симбиоз может превращаться в отношения взаимной агрессии. При этом оба участника обладают достаточным потенциалом, чтобы нанести друг другу существенный ущерб или «расчистить дорогу» для внедрения в организм настоящих патогенных микроорганизмов. Является доказанным фактом, что нарушение экологического баланса и возникновение дисбактериозов приводят не только к увеличению возможности заражения “официальными” патогенами, но и возникновению инфекционного заболевания, вызываемого представителями как факультативной, так и облигатной части нормальной микрофлоры [19]. В настоящее время возрастает удельный вес инфекционных заболеваний, этиологическими агентами которых являются условно-патогенные микроорганизмы (УПМ) нормальной микрофлоры человеческого организма, такие как стафилококки, стрептококки, эшерихии, серрации, клебсиеллы, энтеробактеры, протеи. Приобретение ими патогенных свойств в определенной степени обусловлено появлением у них островков патогенности (ОП). Под ОП принято понимать фрагменты DNA размерами от 1 до 10 kb («островки») или от 10-20 до 200 kb («острова»), включающие дискретные гены вирулентности и обнаруживаемые только у патогенных микроорганизмов. Указанные фрагменты DNA отличаются от «core genome» по содержанию % G+C, как правило, фланкированы малыми прямыми нуклеотидными повторами (DR - directly repead) и часто ассоциированы с 3′ областью локусов различных транспортных RNA (tRNA). Детерминанты ОП способны распространяться среди родственных видов бактерий при конъюгации, трансдукции или трансформации. Такая мобильность ОП связана с тем, что они могут входить в состав бактериофагов, транспозонов или плазмид. Именно интеграция, стабилизация и экспрессия генов вирулентности, входящих в состав ОП, и лежит в основе формирования новых свойств, в том числе вирулентных у родственных непатогенных видов бактерий различных таксономических групп [22]. Регистрация и нарастание инфицированности УПМ при дисбактериозах являются объективными критериями их выраженности. Следовательно, дисбактериоз - любые качественные и количественные изменения типичной для данного биотопа микрофлоры человека и животных, возникающие в результате воздействия на макро- и микроорганизм различных факторов экзогенного и эндогенного характера, влекущие за собой клинические проявления со стороны макроорганизма или являющиеся следствием каких-либо патологических процессов в организме. Дисбиоз - микробиологический дисбаланс в организме, который со временем проявляет себя местными симптомами, а затем и общими нарушениями, которые отягощают течение различных заболеваний. Дисбактериозы различной локализации, как правило, обусловлены микроэкологическими и иммунологическими нарушениями, способствующими развитию инфекционных процессов. Патогенность отдельных видов бактерий зависит от наличия или отсутствия представителей других видов [23]. Поэтому при оценке микробиоценозов слизистых необходимо учитывать количество и видовой состав как микроорганизмов, свободно располагающихся в просвете, так и адгезированных к эпителиальным поверхностям (пристеночная область).
Микробиоценоз открытых полостей макроорганизма - динамическая микроэкологическая система, компонентами которой являются макроорганизм, его микрофлора (совокупность типичных для определенного биологического вида и конкретного биотопа ассоциаций микроорганизмов) и окружающая среда, характеризующаяся способностью к саморегуляции, которая является интегральной частью организма («дополнительным органом») хозяина и местного иммунитета, в частности, и выполняет или регулирует многочисленные функции макроорганизма. Показатели состояния микробиоценозов отражают состояние реактивности макроорганизма - способность организма отвечать на воздействия внешней среды изменением своей жизнедеятельности, что обеспечивает его адаптацию к различным условиям обитания. Слизистые открытых полостей макроорганизма представляют собой единую систему. Состояние микробиоценоза и барьерной функции слизистых можно оценивать по выраженности колонизационной резистентности (КР) открытых полостей организма - физиологический феномен - способности микрофлоры и макроорганизма в кооперации защищать экосистему слизистых от патогенных микроорганизмов.
Оценку микробиоценоза слизистых открытых полостей беременных и небеременных женщин проводили согласно методологии, изложенной в пособии, утвержденном Учебно-методическим объединением (24), а также согласно новой медицинской технологии (25).
Заявляемое изобретение подтверждается на следующих примерах.
Пример 1. Оценка состояния здоровья женщин по состоянию микробиоценоза влагалища при физиологическом течении беременности и невынашивании.
Проведено клинико-лабораторное обследование 101 беременной с невынашиванием беременности (I-я группа - 75 беременных с начавшимся выкидышем, но пролонгированной беременностью и II-я группа - 26 пациенток с прервавшейся беременностью) и 20 здоровых беременных (с физиологическим течением гестационного процесса), а также 81 клинически здоровой небеременной пациентки. Оценку микробиоценоза влагалища (Вл) проводили согласно методологии, изложенной в пособии, утвержденном Учебно-методическим объединением (24), а также согласно новой медицинской технологии (25).
При оценке микробиоценоза влагалища (Вл) выявлено, что во всех группах беременных пристеночная и просветная флора не была идентична по своему составу и представлена как типичными бактериями-эубиотами, так и условно-патогенной микрофлорой (УПМ). Необходимо заметить, что наибольшее значение в развитии дисбиотических нарушений имеют пристеночные микроорганизмы, которые адгезированы к стенке слизистой.
Микробиоценоз Вл у беременных в I триместре характеризовался большой вариабельностью количественных и качественных показателей микроорганизмов во всех обследованных группах. Однако в основной группе (пациентки с невынашиванием беременности) отмечены более выраженные дисбиотические нарушения, которые проявлялись в снижении частоты выявляемости и интенсивности колонизации бифидобактерий. Так, частота встречаемости бифидобактерий у пациенток с начавшимся выкидышем (I-я группа) была в 2 раза ниже, чем в группе контроля (интенсивность колонизации в просветной области составляла 3,7±1,1 lg КОЕ/г и 5,0±0,5 lg КОЕ/г соответственно, а в пристеночной области - 3,5±1,1 lg КОЕ/г и 4,6±0,5 lg КОЕ/г соответственно) и была практически нулевой как в просветной, так и в пристеночной области в группе беременных с нарушенной беременностью. Кроме того, у пациенток с невынашиванием беременности отмечено и снижение интенсивности колонизации лактобацилл в пристеночной области Вл. Следовательно, у беременных основной группы отмечено достоверное (p<0,05) снижение как частоты встречаемости, так и степени колонизации индигенной флоры по сравнению с группой здоровых беременных (табл.1, 2).
На фоне снижения частоты выделения индигенной флоры у беременных I-й группы нарастала частота выделения штаммов УПМ. У беременных основной группы был выявлен более широкий спектр УПМ, чем в группе контроля. Анализ индивидуальных данных показал, что в 72% случаев наблюдалось формирование 3-5-компонентных ассоциаций УПМ, в то время как 3-компонентные ассоциации в группе контроля имели место только в 15% случаев. У 36% обследованных I-й группы и у всех беременных II-й группы наблюдалось значительное повышение интенсивности колонизации просветной и пристеночной областей Вл УПМ до 5-7 lg КОЕ/г .Так, средняя интенсивность колонизации в просветной области у беременных I-й группы составляла 4,5±1,0 lg КОЕ/г и во II-й группе - 5,2±0,5 lg КОЕ/г. В пристеночной области Вл интенсивность колонизации у беременных I-й группы составляла 6,7±0,9 lg КОЕ/г и во II-й группе - 5,5±0,5 lg КОЕ/г, в то время как у женщин с нормально протекающей беременностью средняя интенсивность колонизации УПМ в просветной и пристеночной областях Вл не превышала нормативных значений, составляя 3,3±0,5 lg КОЕ/г и 4,0±0,5 lg КОЕ/г соответственно. Наиболее выраженные изменения отмечены в группе беременных с прервавшейся беременностью (II-я группа). Эти изменения характеризовались высокой частотой в клинически значимых концентрациях представителей УПМ, являющихся основными возбудителями воспалительных заболеваний гениталий. Пептострептококки как в просветной, так и в пристеночной области встречались достоверно (p<0,05) чаще, чем в I-й группе и в группе контроля. Отмечена высокая частота встречаемости коагулазоотрицательных стафилококков в пристеночной области во II-й группе по сравнению с I-й группой (p<0,05) и отсутствие этих возбудителей в группе контроля.
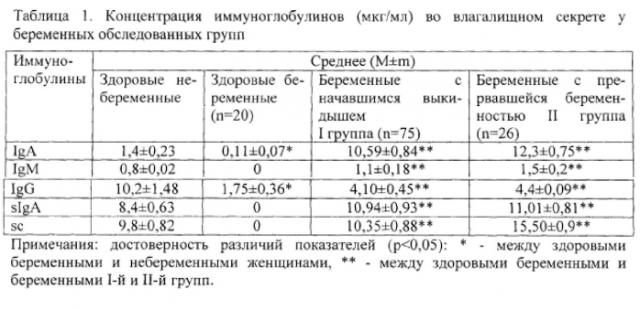
Оценивался иммуноглобулиновый статус слизистой Вл (IgG, IgM, IgA, sIgA, sc) у клинически здоровых беременных и беременных с невынашиванием (табл. 1). У клинически здоровых беременных (группа контроля) имелось достоверное (p<0,05) снижение всех классов иммуноглобулинов по сравнению с клинически здоровыми небеременными женщинами, что свидетельствует о наличии иммуносупрессии мукозального иммунитета при беременности. У клинически здоровых беременных во влагалищном секрете были выявлены более высокие уровни IgG, чем IgA (1,75±0,36 мкг/мл и 0,11±0,07 мкг/мл соответственно), a sIgA и sc не определялись, что согласуется с данными других авторов. Анализ иммунного статуса у беременных с невынашиванием выявил выраженное отличие в показателях гуморального звена иммунитета во Вл по сравнению со здоровыми беременными (группа контроля). В секрете Вл у беременных с невынашиванием беременности имело место достоверное (p<0,05) увеличение уровней всех классов Ig, причем наиболее выраженные изменения касались IgA, sIgA и sc. Учитывая, что основная роль в противоинфекционной защите слизистых принадлежит sIgA, достоверное его увеличение у беременных с невынашиванием по сравнению со здоровыми беременными свидетельствует о напряжении локального иммунитета, что может быть объяснено активацией воспалительного процесса Вл.
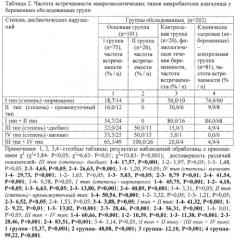
Анализ проведенных исследований (табл. 2, 3) показал, что в группе беременных с начавшимся выкидышем (I-я группа) первая и вторая степени дисбактериоза Вл регистрировались в 18,7% и 16,0% случаев соответственно.
У остальных беременных этой группы имели место дисбиотические нарушения третьей (32,0%) и четвертой (33,3%) степеней. Во II-й группе (пациентки с прервавшейся беременностью) дисбиотические нарушения во Вл наблюдались в 100% случаев (третьей степени и четвертой степени по 50,0%). Корреляционный анализ микробиологических и иммунологических показателей биотопа Вл не выявил достоверной корреляционной зависимости между количеством УПМ и концентрациями IgA, sIgA, IgM и sc. Вместе с тем наблюдалась обратная корреляция уровней IgG и содержания УПМ в секрете Вл при дисбиотических нарушениях II-IV степени (r=-0,37; r=-0,31; r=-0,29 соответственно; p<0,05). В силу того что секреторный IgG проходит через плацентарный барьер и участвует в противоинфекционной защите плода, его резкое снижение при увеличении концентрации УПМ может привести к развитию внутриутробной инфекции (ВУИ).
Таким образом, у клинически здоровых женщин превалируют I и II типы (степени) микробиотопа влагалища (табл. 2); выявление у них III и IV типов микробиотопа влагалища может рассматриваться как маркер продромального периода инфекционного процесса и угроза невынашивания плода. При нормально (физиологически) протекающей беременности: I или II тип (степень) микробиотопа влагалища - благоприятный прогностический признак - нормальное развитие плода; выявление у них III и IV типов микробиотопа влагалища свидетельствует о иммунологическом раздражении (угрожающий выкидыш). При невынашивании беременности с начавшимся выкидышем: III или IV типы (степени) микробиотопа влагалища - неблагоприятный прогностический признак - начало иммунологического отторжения плода; выявление I или II типов (степеней) микробиотопа влагалища указывает на неинфекционный генез невынашивания, но тем не менее является благоприятным прогностическим признаком - роды завершатся рождением плода.
При проведении терапии установление степени нарушений микробиоценоза влагалища повышает информативность оценки ее эффективности за счет выявления механизмов ее лечебного эффекта: при клинической эффективности проводимой терапии регистрировался переход к показателям нормально протекающей беременности - выявлялись I или II типы (степени) микробиотопа влагалища; продолжение регистрации у части больных III и IV типов микробиотопа влагалища указывало на необходимость продолжения лечения невынашивания беременности.
Пример 2. Оценка состояния здоровья женщин по состоянию микробиоценоза ротоглотки при физиологическом течении беременности и невынашивании
Проведено клинико-лабораторное обследование 121 беременной в первом триместре с невынашиванием беременности (I-я группа - 75 беременных с начавшимся выкидышем, но пролонгированной беременностью и II-я группа - 26 пациенток с прервавшейся беременностью) и 20 здоровых беременных (с физиологическим течением гестационного процесса). Оценку микробиоценоза ротоглотки проводили согласно методологии, изложенной в пособии, утвержденном Учебно-методическим объединением (24).
Для оценки микробиоценоза пристеночной и просветной областей полости рта проведено микробиологическое исследование соскобов с ЗСГ (пристеночная область) и слюны (просветная область). При изучении микробиоценоза полости рта отмечено, что пристеночная и просветная флора, как и микрофлора Вл, не идентичны по своему составу. В I-й группе беременных β-гемолитический стафилококк в слюне не высевался, а в пристеночной области полости рта его определяли в 1,3% случаев в концентрации 4,0±0,4 lg КОЕ/г. В то же время лактобациллы и актиномицеты не выявлялись в пристеночной области ротоглотки и высевались в слюне у 4,0% пациенток в концентрации 5,0±0,2 lg КОЕ/г и у 1,3% беременных в концентрации 4,0±0,2 lg КОЕ/г соответственно. Кроме того, пептострептококки достоверно (р<0,05) чаще встречались в слюне, чем в пристеночной области ротоглотки, и составляли 21,3% случаев (концентрация 4,2±0,5 lg КОЕ/г) и 13,3% случаев (концентрация 4,5±1,0 lg КОЕ/г) соответственно, а золотистый стафилококк, наоборот, достоверно чаще (p<0,05) встречался в пристеночной области, чем в слюне, частота выявления которого составляла 30,0% случаев (концентрация 4,8±0,4 lg КОЕ/г) и 16,0% случаев (концентрация 4,3±0,5 lg КОЕ/г) соответственно. Микробиологическое исследование у пациенток II-й группы показало, что β-гемолитический стрептококк и энтерококки не высевались в слюне, но выявлялись у 15,4% пациенток (концентрация 4,5±1,0 lg КОЕ/г) и у 3,8% беременных (концентрация 4,2±0,7 lg КОЕ/г) в пристеночной области полости рта, а лактобациллы определялись только в слюне (в 3,8% случаев при интенсивности колонизации 4,8±0,1 lg КОЕ/г).
У всех беременных преобладающей микрофлорой ротоглотки и слюны являлись представители индигенной флоры: α-гемолитические стрептококки и непатогенные нейссерии, выделявшиеся у беременных различных групп в 93,3-100% случаев. Средние значения частоты встречаемости α-гемолитического стрептококка у беременных I-й группы составляли в слюне 93,3% (интенсивность колонизации 6,0±0,6 lg КОЕ/г), во II-й группе - 100% (интенсивность колонизации 8,4±0,2 lg КОЕ/г) и в контрольной группе - 95,0% (интенсивность колонизации 6,0±0,5 lg КОЕ/г), в пристеночной области - в 93,3%; 100%; 95,0% соответственно в количестве 6,7±0,5 lg КОЕ/г; 7,9±0,4 lg КОЕ/г и 7,0±0,2 lg КОЕ/г соответственно. УПМ ротоглотки беременных I-й группы была преимущественно представлена грибами рода Candida, пептострептококками и золотистым стафилококком, выделявшимися в 8,0%,13,3% и 30,7% случаев в количестве 4,7±0,9 lg КОЕ/г; 4,5±0,5 lg КОЕ/г и 4,8±0,4 lg КОЕ/г соответственно. Частота выделения кандид и золотистого стафилококка из образцов слюны беременных этой группы составляла 12,0% и 16,0% случаев в количестве 4,7±0,3 lg КОЕ/г и 4,3±0,5 lg КОЕ/г соответственно, и пептострептококков - 21,3% случаев в количестве 4,2±0,5 lg КОЕ/г. Частота выявления других УПМ (β-гемолитический стрептококк, эпидермальный стафилококк, коринебактерии, пропионибактерии, кишечная палочка, клебсиелла) в полости рта была незначительной и колебалась от 1,3 до 4% случаев. У пациенток с прервавшейся беременностью в ротоглотке и слюне преимущественно выявляли α-гемолитический стрептококк (7,9±0,4 lg КОЕ/г и 8,4±0,2 lg КОЕ/г соответственно) и непатогенные нейссерии (7,9±0,7 lg КОЕ/г и 7,9±0,4 lg КОЕ/г соответственно), значительно превышающие нормативные показатели, а также золотистый стафилококк и грибы рода Candida. В пристеночной области золотистый стафилококк выявляли в 46,2% случаев в концентрации 4,5±0,1 lg КОЕ/г и в слюне у 30,8% беременных в концентрации 4,8±0,2 lg КОЕ/г. Грибы рода Candida в пристеночной области и слюне определяли в 15,4% и 15,4% случаев в концентрации 4,8±0,2 lg КОЕ/г и 4,5±0,2 lg КОЕ/г соответственно. Кишечная палочка высевалась только в пристеночной области полости рта у 3,8% беременных при интенсивности колонизации 4,2±0,7 lg КОЕ/г. В группе контроля спектр УПМ был значительно уже, чем у пациенток I-й группы: преимущественно выделяли грибы рода Candida и золотистый стафилококк - в ротоглотке у 10% и 25% обследованных в количестве 4,4±0,4 lg КОЕ/г и 3,4±1,5 lg КОЕ/г, а в слюне - у 10% и 20% обследованных в количестве 4,4±0,4 lg КОЕ/г и 4,4±0,6 lg КОЕ/г. Пептострептококки и коринебактерии выявляли у 5-10% обследованных в небольшом количестве (2,0±0,3 lg КОЕ/г и 3,7±0,2 lg КОЕ/г в пристеночной области и 3,8±0,1 lg КОЕ/г и 4,5±0,2 lg КОЕ/г в слюне соответственно). У беременных с начавшимся выкидышем (I-я группа) отмечен более широкий спектр УПМ в просветной и пристеночной областях по сравнению с группой контроля. У 45,3% обследованных наблюдалось формирование 3-5-компонентных ассоциаций УПМ. В отличие от биотопа Вл популяционный уровень УПМ в пристеночной области полости рта был достоверно (р<0,05) ниже и не превышал 4-5 lg КОЕ/г. Средняя интенсивность колонизации в ротоглотке у беременных I-й группы составляла 4,3±0,4 lg КОЕ/г, во II-й группе - 4,5±0,5 lg КОЕ/г, а средняя интенсивность колонизации в пристеночной области Вл у беременных I-й и II-й групп составляла 6,7±0,9 lg КОЕ/г и 5,5±0,5 lg КОЕ/г соответственно. В отличие от контрольной группы выявляли такие микроорганизмы, как β-гемолитический стрептококк и кишечную палочку, которые не являются нормальными представителями микробиоценоза полости рта, и повышенное содержание пептострептококков (р<0,05). Кроме того, высевались и микроорганизмы, которые отсутствовали в группе контроля: эпидермальный стафилококк, пропионибактерии, актиномицеты и клебсиеллы.
У пациенток с прервавшейся беременностью в отличие от пациенток с начавшимся выкидышем, но сохраненной беременностью отмечена достоверно (р<0,05) более высокая частота встречаемости в клинически значимой концентрации золотистого стафилококка, β-гемолитического стрептококка, кишечной палочки и грибов рода Candida.
Следовательно, у пациенток с осложненным течением беременности выраженные дисбиотические нарушения в полости рта проявляются расширением спектра и увеличением количественного содержания УПМ.
У здоровых беременных имелось достоверное (р<0,05) снижение всех классов lg по сравнению со здоровыми небеременными женщинами, что свидетельствует о иммуносупрессии при беременности (табл. 4). В слюне sIgA и sc были доминирующими (sIgA - 8,95±1,59 мкг/мл; sc - 16,04±2,37 мкг/мл; IgG - 2,49±0,38 мкг/мл). Имело место достоверное снижение sIgA, sc в слюне у беременных с невынашиванием беременности по сравнению со здоровыми беременными, что позволяет предположить истощение локального иммунитета, связанного с наличием длительно текущего хронического воспалительного процесса в полости рта.
Подтверждением этого может являться наличие у каждой четвертой женщины с невынашиванием хронического тонзиллита (19,8%). Для биотопа полости рта выявлена обратная корреляционная связь уровня IgA и содержания УПМ в этой области при дисбиотических нарушениях I-III степени (r=-0,27; r=-0,24; r=-0,28 соответственно; р<0,05), аналогичная связь имела место и для sIgA - при дисбиозе I степени (r=-0,21; р<0,05), а более выраженная обратная корреляция уровней sIgA и УПМ была при дисбиозах полости рта II-III степени (r=-0,34; r=-0,32 соответственно; р<0,05).
Нормоценоз в группе беременных с начавшимся выкидышем (табл. 5, 6) встречался лишь в 12,0% случаев, в группе контроля - у 40%, а у беременных с прервавшейся беременностью нормоценоз не встречался вообще. В остальных случаях имели место дисбиотические нарушения различной степени выраженности. При наличии дисбиотических нарушений в полости рта 21,5% беременных основной группы и 16,7% женщин группы контроля страдали хроническим тонзиллитом.
При нормально (физиологически) протекающей беременности: I или II тип (степень) микробиотопа (табл. 5) задней стенки глотки - благоприятный прогностический признак - нормальное развитие плода; выявление у них III и IV типов микробиотопа задней стенки глотки свидетельствует о иммунологическом раздражении (угрожающий выкидыш). При невынашивании беременности с прервавшейся беременностью: III или IV типы (степени) микробиотопа задней стенки глотки - неблагоприятный прогностический признак - начало иммунологического отторжения плода; выявление I или II типов (степеней) микробиотопа задней стенки глотки указывает на неинфекционный генез невынашивания, но тем не менее является благоприятным прогностическим признаком - роды завершатся рождением плода.
При проведении терапии установление степени нарушений микробиоценоза задней стенки глотки повышает информативность оценки ее эффективности за счет выявления механизмов ее лечебного эффекта: при клинической эффективности проводимой терапии регистрировался переход к показателям нормально протекающей беременности - выявлялись I или II типы (степени) микробиотопа задней стенки глотки; продолжение регистрации у части больных III и IV типов микробиотопа задней стенки глотки указывало на необходимость продолжения лечения невынашивания беременности.
Пример 3. Оценка состояния здоровья женщин по состоянию микробиоценоза кишечника при физиологическом течении беременности и невынашивании
Проведено клинико-лабораторное обследование 121 беременной в первом триместре с невынашиванием беременности (I-я группа - 75 беременных с начавшимся выкидышем, но пролонгированной беременностью и II-я группа - 26 пациенток с прервавшейся беременностью) и 20 здоровых беременных (с физиологическим течением гестационного процесса). Оценку микробиоценоза кишечника проводили согласно методологии, изложенной в пособии, утвержденном Учебно-методическим объединением (24).
Для оценки состояния микробиоценоза кишечника у беременных проведено бактериологическое исследование количественных и качественных показателей микроорганизмов в фекалиях в обследуемых группах. Полученные данные свидетельствуют о том, что во всех обследованных группах микробиоценоз кишечника был представлен преимущественно кишечной палочкой, лактобациллами и бифидобактериями. Однако частота встречаемости при равной степени колонизации была достоверно (р<0,05) ниже у беременных основной группы и составляла: для кишечной палочки, лактобацилл, бифидобактерий в контрольной группе до 90% случаев (интенсивность колонизации 8,5±1,6 lg КОЕ/г; 5,7±0,5 lg КОЕ/г; 8,7±1,2 lg КОЕ/г соответственно); у беременных I-й группы - 76,0%; 74,7%; 76,0% случаев (интенсивность колонизации 8,4±0,3 lg КОЕ/г; 5,0±0,4 lg КОЕ/г; 8,0±0,5 lg КОЕ/г) соответственно, а у беременных II-й группы - только 69,2%; 69,2%; 73,1% случаев (интенсивность колонизации 7,7±0,4 lg КОЕ/г; 4,7±0,2 lg КОЕ/г; 7,5±0,3 lg КОЕ/г) соответственно. Вторую по значимости группу микроорганизмов составляли пептострептококки, энтерококки и клостридии, выявлявшиеся у беременных I-й группы в 29,3-30,7% случаев при интенсивности колонизации 6,7±1,0 lg КОЕ/г - для пептострептококков, 7,0±0,4 lg КОЕ/г - для энтерококков и 4,0±0,5 lg КОЕ/г - для клостридий. Во II-й группе частота встречаемости пептострептококков и клостридий составила 30,8-34,5% при интенсивности колонизации 7,0±0,6 lg КОЕ/г для пептострептококков и 4,5±0,1 lg КОЕ/г - для клостридий. Частота выявления бактероидов достигала 18,7% при интенсивности колонизации 4,7±0,9 lg КОЕ/г в I-й группе и 26,9% при интенсивности колонизации 5,6±0,8 lg КОЕ/г во II-й группе.
Встречаемость слабоферментирующей и гемолизирующей кишечной палочки золотистого стафилококка, клебсиелл и актиномицет в обеих группах колебалась от 1,3% до 11,5% случаев в количестве 5,9±0,2 lg КОЕ/г - 7,5±0,5 lg КОЕ/г. Однако частота встречаемости кишечной палочки со слабо выраженными ферментативными свойствами и клебсиелл была достоверно выше (p<0,05) у беременных с прервавшейся, чем у беременных с сохраненной беременностью.
В группе контроля также преобладали кишечная палочка, лактобациллы и бифидобактерии. Перечисленные микроорганизмы выявлялись в 90% случаев в количестве 8,5±1,6 lg КОЕ/г; 5,7±0,5 lg КОЕ/г и 8,7±1,2 lg КОЕ/г соответственно.
Частота обнаружения пептострептококков у беременных контрольной группы практически не отличалась от показателей I-й и II-й группы, составляя 25% при интенсивности колонизации 5,8±0,2 lg КОЕ/г. Вместе с тем высеваемость энтерококков и клостридий у здоровых беременных контрольной группы не превышала 5% при количественном содержании 6,0±0,6 lg КОЕ/г и 4,7±0,4 lg КОЕ/г соответственно.
Золотистый стафилококк, слабоферментирующая и гемолизирующая кишечные палочки выделялись у