Способы лечения дегенеративных состояний костей
Иллюстрации
Показать всеИзобретение относится к медицине и касается способа лечения пациента, страдающего дегенеративным костным заболеванием, которое может быть охарактеризовано потерей минеральной плотности костей (BMD), при этом дегенеративное костное заболевание представляет собой остеопению или остеопороз, включающего: образование пустоты в локализованном участке неповрежденной кости у пациента, у которого было диагностировано дегенеративное костное заболевание, с помощью очистки дегенерированного костного материала и, необязательно, удаления части дегенерированного костного материала локализованного участка кости, являющейся неповрежденной до этапа образования пустоты; и по меньшей мере частичное заполнение образованной пустоты материалом для регенерации костей, содержащим сульфат кальция, способным быть резорбируемым и вызывать формирование костной ткани, обеспечивающим образование нового недегенерированного костного материала по всему объему по меньшей мере части пустоты, которая заполнена материалом для регенерации костей, при этом материал для регенерации костей является текучим при заполнении образованной пустоты. Изобретение позволяет осуществлять селективное замещение дегенеративного костного материала в локализированных участках костей материалом для регенерации костей, который резорбируется организмом в течение времени и замещается вновь сформированным здоровым костным материалом. 16 з.п. ф-лы, 9 табл., 34 ил., 5 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способам лечения пациентов, страдающих от дегенерацией костей, например остеопении и остеопороза. В частности, изобретение предусматривает способы лечения пациентов, страдающих дегенерацией костей путем замещения хотя бы части дегенерированного костного материала.
УРОВЕНЬ ТЕХНИКИ
Минеральная плотность костей (BMD) является общепринятым термином, характеризующим количество кальцинированной ткани, приходящееся на квадратный сантиметр кости. Понятно, что данный термин не характеризует степень истинную плотность (в виде соотношения массы на объем материала), но скорее используется для передачи информации о твердости кости и восприимчивости кости к перелому. Как правило, BMD рассчитывается с помощью таких способов, как двухэнергетическая рентгеновская абсорбциометрия (или DEXA-сканирование), ультразвук и количественная компьютерная томография (QCT). Из вышеупомянутых способов DEXA-сканирование часто рассматривается как наиболее надежный способ оценки BMD. Например, ультразвуковое исследование имеет ограничения при оценке пяточной кости и непригодно для прямом выявлении участков, наиболее часто подверженных переломам вследствие остеопороза, таких как тазобедренный сустав и позвоночник. QCT, как правило, используют для обследования позвоночника; ее следует проводить в соответствии со строгими правилами в лабораториях для обеспечения приемлемой степени воспроизводимости. Другие испытательные способы оценки BMD включают однофотонную абсорбциометрию (SPA), двухфотонную абсорбциометрию (DPA), цифровую рентгенографию (DXR) и одноэнергетическую рентгеновскую абсорбциометрию (SEXA).
BMD является крайне важной физической характеристикой, поскольку она может является индикатором восприимчивости к переломам. У большинства взрослого населения BMD достигает пика в возрасте около 30-35 и имеет тенденцию к медленному снижению после этого возраста. Снижение BMD возникает вследствие уменьшения образования новых костных клеток, так что резорбция существующих костных клеток организмом превосходит степень образования новых костных клеток.
Фиг.1 (доступная по ссылке http://courses.washington.edu/bonephys/opbmd.html) иллюстрирует типичное снижение BMD (показано в мг/см2) у взрослых и демонстрирует вариативность снижения в зависимости от расы и пола. Менопауза у женщин является крайне значимым событием в связи с BMD, поскольку снижение BMD значительно ускоряется в течение периода времени после менопаузы. Таким образом, женщины с наступившей менопаузой, как правило, получают содействие в проведении регулярной оценки BMD для оценки необходимости проведения лечения и типа лечения. Национальная Организация Остеопороза (США) рекомендует проведение тестирования BMD для следующих категорий: все женщины в возрасте от 65 лет и старше вне зависимости от факторов риска; более молодые женщины с наступившей менопаузой с одним или более факторами риска; женщины с наступившей менопаузой с переломами (для подтверждения диагноза и определения степени серьезности заболевания); женщины с дефицитом эстрогена с клинически определенным риском возникновения остеопороза; пациенты с вертебральными расстройствами; пациенты, проходящие или планирующие пройти долговременный курс лечения глюкокортикоидами (стероидами); пациенты с первичным гиперпаратиреозом; пациенты, проходящие мониторинг в целях определения ответа или эффективности примененной лекарственной терапии, направленной на лечение остеопороза; пациенты с длительными пищевыми расстройствами.
Сниженная BMD, как правило, рассматривается в отношении остеопении и остеопороза, а существование данных состояний определяется в зависимости от количества баллов пациента, рассчитанных при проведении тестирования в целях определения BMD, в частности Т-балла, полученного при проведении DEXA-сканирования. Т-балл, полученный на основе проведенного DEXA-сканирования, является нормализованной величиной, демонстрирующий отношение BIVID пациента к среднему показателю взрослых людей с пиковыми значениями BMD. Нормализованное значение выражается в рамках стандартных отклонений от среднего значения. Таким образом значение Т-балла 0 является индикатором отсутствия отличия значения BMD по сравнению со средним взрослым, отрицательное значение Т-балла является индикатором значения BMD ниже среднего, а положительное значение Т-балла является индикатором того, что значение BMD находится выше среднего. Т-балл является нормализованной величиной в связи с тем, что среднее значение обладает вариативностью в связи с зависимостью от расы и пола. Т-балл различных костей одного человека также может иметь различные значения. В целом, кость с Т-баллом, значение которого больше -1, рассматривается в качестве входящей в нормальный диапазон (хотя отрицательное значение балла все же является индикатором того, что значение BMD лежит ниже нормализованного среднего значения). Состояние остеопении, как правило, рассматривается в качестве присущего кости со значениями Т-балла от -1 до -2,5. Состояние остеопороза, как правило, рассматривается в качестве присущего кости со значениями Т-балла менее -2,5.
BMD может коррелировать со степенью прочности кости и, таким образом, может является показателем риска возникновения перелома. В целом, считается, что риск возникновения перелома увеличивается с каждым стандартным отклонением ниже нормальных значений. У пожилых людей перелом костей (в частности переломы тазобедренного сустава или позвоночника) могут коррелировать с увеличенными показателями смертности. Таким образом, увеличение BMD может являться целью медицинского вмешательства у пациентов, страдающих остеопенией и/или остеопорозом, поскольку BMD может коррелировать с возрастающим риском возникновения перелома. Несмотря на то, что были испробованы различные виды вмешательств, в данной области все еще сохраняется потребность в способах лечения, способных эффективно увеличивать BMD.
Лечение и профилактика разрушения костей (то есть снижения BMD) может принимать различные формы. Предотвращение, как правило, начинается в детстве с помощью физических упражнений и правильного питания, которое включает достаточные количества кальция и витамина D, поскольку была доказана необходимость совмещения физических упражнений и питания для максимизации развития BMD. Это является важным, поскольку было доказано замедление снижения BMD с возрастом при более высоком уровне BMD в пиковом возрасте.
При наличии состояний остеопении и остеопороза доступно большое количество различных способов лечения. Лечение женщин после наступления менопаузы может замедлить наступление и/или развитие дегенерации костей. Таким же образом, селективные модуляторы эстрогеновых рецепторов (SERM), такие как ралоксифен, могут использоваться для симулирования высоких уровней эстрогена в организме и, таким образом, замедлять убыль костной ткани. Может быть назначен кальцитонин, являющийся материалом, естественно вырабатываемым клетками щитовидной железы. Кальцитонин действует непосредственно на остеокласты (через кальцитониновые рецепторы на поверхности клеток), осуществляя модификацию остеокластов и, таким образом, останавливает резорбцию костей. Бисфосфонаты, такие как этидронат (DIDRONEL®), памидронат (AREDIA®), алендронат (FOSAMAX®), ризедронат (ACTONEI,), золедронат (ZOMETA® или RECLAST) и ибандронат (BONIVA®) могут увеличивать прочность костей путем увеличения плотности минерализации и снижения резорбции костей. Все бисфосфонаты связаны с пирофосфатом, являющимся побочным продуктом клеточного метаболизма и естественным циркулирующим в крови и моче ингибитором минерализации. Несмотря на то, что пирофосфаты не могут проникать в кости (в связи с тем, что выстилающие клетки уничтожают пирофосфат с помощью щелочной фосфатазы), бисфосфонаты могут проникать в кости (и прикрепляться очень крепко) в связи с химическим замещением в соединениях. Несмотря на то, что такие лекарства могут обладать некоторой пользой, недавние исследования показали, что долговременное использование бифосфонатов может увеличить риск спонтанных переломов подвертела и диафиза бедренной кости (то есть атипичных переломов). Деносумаб (PROLIA®) является другим фармацевтическим препаратом, недавно допущенным Управлением по контролю качества пищевых продуктов и лекарственных средств (США) для проведения инъекций дважды в год у пациентов, страдающих остеопорозом с высоким риском возникновения переломов, или у пациентов, не переносящих другие виды лечения. Деносумаб является полностью человеческим моноклональным антителом, которое связывает RANK-лиганд и воздействует на естественный процесс костного метаболизма организма. Несмотря на то, что долговременные эффекты от использования данного антитела еще не известны, врачи были предупреждены о необходимости проведения мониторинга пациентов с неблагоприятными реакциями, такими как остеонекроз челюсти, атипичные переломы и задержка в сращивании переломов. Далее, поскольку данное антитело вносит изменения в иммунную систему организма, было получено доказательство того, что использование данного антитела может увеличить риск возникновения серьезной инфекции у пациента. Еще один препарат, терипаратид (FORTE0®), является рекомбинантным паратиреоидным гормоном (rPTH), который обладает парадоксальным воздействием, заключающимся в увеличении костной массы путем изменения паттерна выработки в сторону естественного, паратиреоидного гормона организма (PTH), и, таким образом, изменяет скелетальный эффект оценки постоянного уровня РТН, что может приводить к увеличению ломкости костей, потери кальция и остеопорозу. С помощью активации различных путей костного метаболизма rPTH увеличивает количество активных остеобластов, снижает степень естественно запрограммированной смерти остеобластных клеткок и отбирает контурные клетки для действия в качестве остеобластных клеток. Данный препарат, по-видимому, оказывает широкое воздействие на формирующие кости остеобластные клетки и максимально стимулирует их чрезмерную активность. Исследования на крысах, направленные на изучение безопасности применения, показали вероятное увеличение риска возникновения остеосаркомы, связанной с использованием rPTH. Таким образом, в данной области сохраняется потребность в способах лечения, которые не требуют долговременного использования препаратов с вероятностью эффектов, которые, являясь непредусмотренными, могут еще и являться вредоносными.
Нефармацевтические способы лечения, как правило, используются только после возникновения перелома. Например, переломы (в частности, позвоночные) могут лечиться с помощью немедленной фиксации, при этом полиметилметакрилатный цемент (как правило, называемый «костным цементом») или похожий нерассасывающийся материал вводится в перелом для перманентного усиления и «фиксации» кости на месте. Несмотря на то, что такие способы лечения могут быть направлены на лечение существующего перелома, неестественные физические свойства (то есть жесткость, модуль упругости кости и так далее) кости после проведения лечения, как считается, увеличивают вероятность перелома смежной кости, в частности, в том случае, если смежная кость подвергнута остеопорозу в продвинутой стадии. Сверх того, результатом данного способа лечения не является образование естественной кости в переломе, но, скорее, функционирование в качестве подвергающихся резорбции заменителей кости.
Несмотря на наличие фармацевтических и хирургических способов лечения дегенерации костей и переломов, в данной области остается потребность в дополнительных способах лечения, способных увеличить BMD в ключевых участках в целях снижения риска возникновения переломов и сопутствующих рисков для здоровья, включая смерть. В частности, окажется полезным и наличие средств для лечения, нацеленных на определенные участки скелета с высоким риском возникновения переломов за счет, в частности, формирования нового, здорового (то есть нормального) костного материала. К данным способам лечения не будут применяться текущие ограничения, существующие в данной области.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает улучшение костной структуры у пациентов, находящихся в состоянии, характеризующемся дегенерацией костной ткани, таком как остеопения или остеопороз. В частности, данное изобретение позволяет осуществлять селективное замещение дегенеративного костного материала в локализированных участках костей материалом для регенерации костей, который ресорбируется организмом в течение времени и замещается вновь сформированным костным материалом. Благоприятно, что вновь сформированный костный материал является костным материалом, который естественен по отношению к пациенту в смысле, что он не является костным трансплантатом (например кадаверной костью) или нерастворимым костным заменителем (например, костным цементом). Более того, вновь сформированный костный материал не является дегенеративным по своей природе, а является здоровым костным материалом в смысле того, что костный материал (который может включать непосредственно окружающие части кости) обладает характеристиками, такими как BMD и сопротивление на сжатие, которые делают вновь сформированный костный материал, в некоторых вариантах осуществления данного изобретения, по существу аналогичным костному материалу у среднего, здорового 30-летнего человека (то есть при возрасте, в котором BMD, как правило, находится на пике). В других вариантах осуществления данного изобретения вновь сформированная кость может характеризоваться как улучшенная по сравнению с костью, находящейся под воздействием остеопении или остеопороза. Такое улучшение, кроме того, может характеризоваться по определенной шкале, такой как связь с Т-баллом, полученном на основе проведенного DEXA-сканирования.
В определенных вариантах осуществления, данное изобретение, таким образом, может быть направлено на способ лечения пациента, страдающего дегенерацией костей. В частности, способ может включать формирование пустоты в локализованном участке кости, например, путем проведения механической санации дегенеративного костного материала или, другим образом, путем разрушения дегенеративного костного материала для формирования пустоты (полости). Необязательно часть дегенеративного костного материала может быть удалена для образования пустоты. В некоторых вариантах осуществления данного изобретения дегенеративный костный материал может оставаться в пустоте, но, в связи с дегенеративным состоянием костного материала, данный материал не занимает значительного объема в образующейся пустоте. Данный способ далее может включать хотя бы частичное заполнение сформированной пустоты материалом для регенерации костей.
В определенных вариантах осуществления данного изобретения дегенеративное состояние кости, в частности, может быть выбрано из группы, включающей остеопению и остеопороз. В то время, как пациент, проходящий лечение, может страдать любым заболеванием, вызывающим дегенерацию костей, термины остеопения и остеопороз могут рассматриваться для, в целом, описания пациентов, страдающих любым заболеванием, вызывающим снижение BMD, в рамках которого значение Т-балла, подсчитанного при проведении DEXA-сканирования, ниже определенного уровня. Например, поскольку наличие остеопении технически определяется в тех случаях, когда значение Т-балла сканируемого участка кости меньше -1,0, и поскольку наличие остеопороза технически определяется в тех случаях, когда значение Т-балла сканируемого участка кости меньше -2,5, данные клинические термины (и настоящие способы их лечения) могут рассматриваться в качестве применимых при лечении дегенерации костей вне зависимости от первичного состояния, вызывающего потерю костей (будь то потеря потеря костей в связи со старением или побочный эффект определенного первичного заболевания или медицинского лечения (например, лечение стероидами).
В определенных вариантах осуществления данного изобретения материал для регенерации костей, используемый в соответствии с данным изобретением, может включать остеоиндуктивный материал, остеокондуктивный материал, остеогенный материал, материал, способствующий образованию костной ткани, или остеофильный материал. Предпочтительно материал для регенерации костей включает сульфат кальция. В следующих вариантах осуществления данного изобретения материал для регенерации костей может включать фосфат кальция. В других вариантах осуществления данного изобретения материал для регенерации костей может включать гранулы трикальцийфосфата. В определенных вариантах осуществления данного изобретения материал для регенерации костей может включать комбинацию всех трех типов материалов. В некоторых вариантах осуществления данного изобретения материал для регенерации костей может включать материал, обладающий трехфазным профилем резорбции in vivo.
Материал для регенерации костей может быть охарактеризованным как материал, который вызывает формирование нового, недегенеративного костного материала в образовавшейся пустоте. В частности, недегенеративный костный материал может обладать плотностью, по существу идентичной плотности нормальной кости (то есть кости обычного здорового 30-летнего человека), в частности, кости из того же участка. В частности, это может быть охарактеризовано в связи с Т-баллом, измеряемым с помощью двухэнергетической рентгеновской абсорбциометрии (DEXA). Предпочтительно часть кости, включая вновь сформированный костный материал, имеет Т-балл, значение которого больше -1,0, больше -0,5 или, по меньшей мере, равно 0.
В определенных вариантах осуществления данного изобретения материал для регенерации костей может характеризоваться обеспечивающим осуществление ремоделирования локализованного участка кости в течение времени, которое, по существу, идентично времени для нормальной кости. В частности, возникновение костного метаболизма может быть выявлено в локализованном участке кости (после проведения имплантации материала для регенерации костей внутри пустоты), первоначально обладающем значением Т-балла более 2,0, при этом значение Т-балла постепенно снижается с течением времени до значения от около 0 до около 2. Предпочтительно, подвергнутый костному ремоделированию локализованный участок кости поддерживает значение Т-балла более около 0 в течение времени от 1 года после образования нового костного материала.
В дальнейших вариантах осуществления данного изобретения материал для регенерации костей может характеризоваться в качестве стимулирующего образование нового костного материала с, по сути, нормальной степенью BMD в участке кости, смежном с образовавшейся пустотой. Это может быть охарактеризовано как градиентный эффект, который описывается далее здесь.
Кость, подвергнутая образованию пустоты, может являться любой костью, дегенеративна по своей природе и может рассматриваться в качестве участка, выбранного для лечения в соответствии с данным изобретением (например, для предотвращения возникновения переломов в будущем). В некоторых вариантах осуществления данного изобретения кость может быть выбрана из группы, включающей тазобедренный сустав, бедренную кость, позвонки, лучевую кость, локтевую кость, плечевую кость, большую берцовую кость и малоберцовую кость.
В дальнейших вариантах осуществления, данное изобретение, в частности, может быть охарактеризовано как обеспечивающее способ увеличения BMD в локализованном участке кости. Данный способ может включать формирование пустоты в локализованном участке кости и, необязательно, удаление содержимого расчищенного костного материала. Данный способ далее может включать хотя бы частичное заполнение сформированной пустоты материалом для регенерации костей таким образом, что новый костный материал образуется внутри пустоты, при этом плотность образованного костного материала больше, чем плотность костного материала, первоначально присутствующего в пространстве пустоты. Предпочтительно, увеличение BMD обеспечивается за счет образованного костного материалом со значением Т-балла, которое хотя бы на 0,5 единиц больше, чем значение Т-балла нативного костного материала до удаления с образованием пустоты. Могут быть отмечены даже большие улучшения относительно значения Т-балла, как описано далее здесь. В определенных вариантах осуществления данного изобретения Т-балл нативного костного материала до удаления в целях образования пустоты может составлять менее около -1,0, а образованный костный материал может обладать значением Т-балла более -1,0 или хотя бы около -0,5. Данное изобретение далее обладает преимуществом, заключающимся том, что увеличение BMD может поддерживаться в течение времени от около 1 года со времени образования нового костного материала.
В других дальнейших вариантах осуществления, данное изобретение может характеризоваться как обеспечивающее способ создания желаемого профиля BMD в локализованном участке кости. Как описано здесь далее, способы данного изобретения неожиданно не только увеличивают качество кости в локализованном участке кости, подвергнутой лечению, но также могут улучшать определенный профиль BMD, при этом BMD в локализованном участке значительно увеличивается с последующим постепенным возвратом нормальной, по сути, степени плотности. Способ данного изобретения может включать образование пустоты в локализированном участке кости и хотя бы частичное заполнение образованной пустоты материалом для регенерации костей таким образом, что новый костный материал образуется внутри пустоты в течение времени и хотя бы часть материала для регенерации костей ресорбируется. Предпочтительно, большая часть материала для регенерации костей ресорбируется. Профиль BMD в локализованном участке кости может является таким, что Т-балл увеливается от первоначального значения, составляющего менее -1, что подтверждается измерениями, проводимыми до образования пустоты, до максимального значения, равного, по меньшей мере, 5 в течение определенного промежутка времени начиная от момента заполнения пустоты материалом для регенерации костей. После этого Т-балл в локализованном участке кости может снижаться в течение какого-то времени до значений от около -0,5 до около 2,0 (то есть лежать, практически в нормальном диапазоне).
В других дальнейших вариантах осуществления настоящее изобретение может быть охарактеризовано как предусматривающее способы обеспечения степени костного метаболизма в локализованном участке дегенеративной кости, по сути идентичной степени костного метаболизма нормальной кости. Согласно вышеизложенному, способы данного изобретения неожиданно могут применяться для полного восстановления качества кости в локализованном участке кости, подвергающейся лечению. Другими словами, кость, находящаяся в дегенеративном состоянии, заменяется материалом для регенерации костей, а образованный новый естественный костный материал является не дегенерированным, а, по сути, нормальным костным материалом. Таким образом, кость в локализованном участке может быть охарактеризована как подвергнутая костному ремоделированию с переходом от дегенеративного костного материала к нормальному костному материалу. Как более полно описано ниже, ремоделирование костей не относится к естественному процессу, спонтанно осуществляющемуся в организме, но относится к манипулятивному восстановлению качества костей путем осуществления способов данного изобретения. В частности, данный способ может включать образование пустоты в локализованном участке кости и хотя бы частичное заполнение образованной пустоты материалом для регенерации костей, обеспечивая, таким образом, образование нового костного материала в образованной пустоте. Предпочтительно костный материал в локализованном участке до образования пустоты обладает значением Т-балла менее -1, что говорит о наличии дегенераии кости, при этом новый костный материал, появляющийся в результате проведения ремоделирования, обладает значением Т-балла более -1,0 (более предпочтительно, более 0), что говорит о том, что кость в локализованном участке была ремоделирована и, по сути, идентична нормальной кости.
В других дальнейших вариантах осуществления, данное изобретение может быть охарактеризовано как предусматривающее способы восстановления высоты позвонков или коррекции ангулярной деформации в позвонке, подвергнутом перелому (в частности, в позвонке, пораженном остеопенией или остеопорозом) с помощью стимулирования роста нового костного материала, который, по сути, идентичен нормальной кости. Данный способ может включать формирование пустоты в участке перелома, которая может включать механическое увеличение пространства в области перелома и, необязательно, удаление содержимого костного материала в участке перелома. Данный способ далее может включать хотя бы частичное заполнение образованной пустоты материалом для регенерации костей, так что новый костный материал образуется внутри пустоты с течением времени. Предпочтительно новый костный материал обладает значением Т-балла, подтверждающим то, что новый костный материал является, по сути, идентичным нормальной кости (например, значением Т-балла от -0,5 или от 0).
В других дальнейших вариантах осуществления настоящее изобретение может быть охарактеризовано как предусматривающее способы улучшения качества кости в локализованном участке кости. Как описано здесь, качество кости может быть охарактеризовано относительно измеряемых характеристик, таких как BMD, сопротивление на сжатие и сопротивление к переломам. Таким образом, способы улучшения качества кости могут быть подтверждены улучшением одной или нескольких из этих характеристик (а также с помощью других измеряемых характеристик, которые могут является полезными для определения качества костей). В некоторых вариантах осуществления данного изобретения данный способ может включать замену объема дегенерированного костного материала из локализованного участка кости, обладающего значением Т-балла менее 1,0 вновь образованным, естественным костным материалом, так что тот же локализованный участок кости обладает значением Т-балла более -1,0 (предпочтительно от -0,5 до 0 и более). В дальнейших предпочтительных вариантах осуществления данного изобретения Т-балл локализованного участка кости после проведения процедуры по данному изобретению может превосходить значение Т-балла дегенерированной кости на 1,0 единицу и более. В определенных вариантах осуществления данного изобретения замещение дегенерированного костного материала может включать образование пустоты в локализованном участке кости и хотя бы частичное заполнение образованной пустоты материалом для регенерации костей, образуя, таким образом, новый естественный костный материал в образованной пустоте.
В других аспектах данное изобретение может предусматривать различные материалы для применения в способах лечения дегенерированного костного материала. Такие материалы, в частности, могут применяться в комбинации, например, в виде набора, для обеспечения легкости выполнения различных способов данного изобретения. Таким образом, данное изобретение может быть охарактеризовано как предусматривающее набор для применения при замещении дегенерированного костного материала в локализованном участке кости материалом для регенерации костей, который стимулирует образование нового костного материала, который, по сути, идентичен нормальной кости.
В некоторых вариантах осуществления данного изобретения набор в соответствии с данным изобретением может включать одно или несколько канюлированных сверл, направляющую проволоку, рабочую канюлю, санирующий зонд, количество материала для регенерации костей, подходящее для заполнения пустоты в локализованном участке кости и устройство для инъецирования, предназначенное для доставки материала для регенерации костей. В дальнейших вариантах осуществления данного изобретения набор в соответствии с данным изобретением может включать инструментальный сгибатель, подходящий для изменения геометрии зонда (то есть любое устройство, которое может быть использовано для отбивания костного материала или удаления омертвевших тканей, или набивания и заполнения материала в пустоту другим способом) в целях соответствия анатомическим особенностям пустоты в локализованном участке кости. В частности, зондирующее устройство может включать головку заданной формы для соответствия анатомии пустоты в локализованном участке кости. Другими словами, зонд может быть предварительно изогнутым на определенный угол (или множество углов с помощью нескольких сгибаний). В дальнейших вариантах осуществления данного изобретения набор в соответствии с данным изобретением может включать один или несколько протекторов тканей, канюлированный обтуратор, направляющую проволоку, сверло, гибкую рабочую канюлю, обтуратор рабочей канюли, санирующий зонд и отсасывающее/ирригирующее устройство. Наб ор далее может включать набор инструкций в любой форме, подходящей для обучения, иллюстрирования, описания или демонстрации в другой форме того, как следует использовать различные компоненты набора для лечения пациента, страдающего дегенерацией костей.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Здесь приводятся ссылки на различные представленные графические изображения относящиеся к описанному в целом изобретению, при этом:
Фиг.1 является графиком, иллюстрирующим типичное снижение BMD (мг/см2) всего тазобедренного сустава в зависимости от возраста, пола и национальности;
Фиг.2а является снимком нормальной кости, сделанным сканирующим электронным микроскопом;
Фиг.2b является снимком подверженной остеопорозу кости, сделанным сканирующим электронным микроскопом;
Фиг.3a-3i являются радиографическими изображениями, иллюстрирующими инъецирование материала для регенерации костей в пустоту, образованную в проксимальной части бедренной кости пациента в от медиальном до латеральном положении в соответствии с одним вариантом осуществления данного изобретения;
Фиг.4 является детальным рентгеновским снимком проксимальной части бедренной кости, иллюстрирующим варианты осуществления данного изобретения, при этом могут быть образованы заполненные пустоты различной формы и размеров для заполнения материалом для регенерации костей;
Фиг.5а-5с являются иллюстрациями, демонстрирующими выбранные этапы хирургической процедуры по замещению дегенерированного костного материала в дистальном отделе лучевой кости пациента в соответствии с одним вариантом осуществления данного изобретения;
Фиг.6а-6с иллюстрируют выбранные этапы хирургической процедуры по замещению дегенерированного костного материала в позвонке пациента в соответствии с одним вариантом осуществления данного изобретения;
Фиг.7а-7е являются изображениями, полученными с помощью сканирующей электронной микроскопии, демонстрирующими изменения с течением времени в материале для регенерации костей, использованном в качестве имлантата в соответствии с одним вариантом осуществления данного изобретения, при этом такие изменения обеспечивают контролируемый рост нового костного материала;
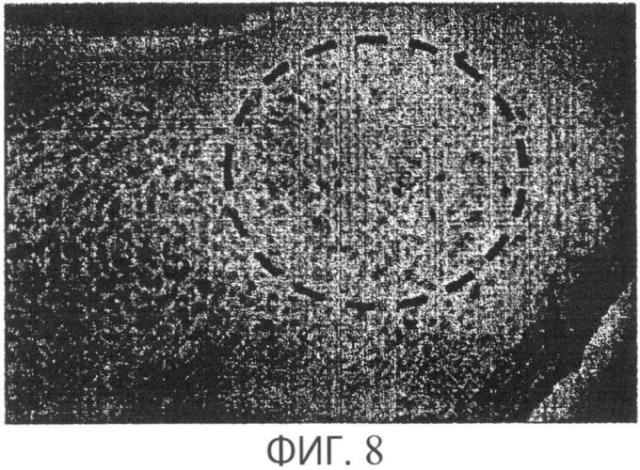
Фиг.8 демонстрирует 13-недельный макроскопический образец в прокисмальном отделе плечевой кости собаки после введения трансплантата из материала для регенерации костей в соответствии с настоящим изобретением и демонстрирует образование плотной губчатой кости даже за пределами границ первоначального повреждения;
Фиг.9 является графическим представлением примерного профиля BMD, который может быть выявлен в локализованном участке кости в соответствии с одним вариантом осуществления данного изобретения;
Фиг.10 является графиком, демонстрирующим ремоделирование кости в локализованном участке кости, демонстрирующим изменение BMD от остеопорозной модели к модели, по сути, идентичной нормальной кости;
Фиг.11 иллюстрирует инструмент для защиты тканей, который может использоваться при осуществлении способа в соответствии с вариантом осуществления данного изобретения;
Фиг.12 иллюстрирует канюлированный обтуратор, который может использоваться при осуществлении способа в соответствии с вариантом осуществления данного изобретения;
Фиг.13 иллюстрирует направляющую проволоку, которая может использоваться при осуществлении способа в соответствии с вариантом осуществления данного изобретения;
Фиг.14 является увеличенным изображение головки сверла, которое может использоваться при осуществлении способа в соответствии с вариантом осуществления данного изобретения;
Фиг.15 иллюстрирует рабочую канюлю, которая может использоваться при осуществлении способа в соответствии с вариантом осуществления данного изобретения;
Фиг.16 иллюстрирует обтуратор рабочей канюли, который может использоваться при осуществлении способа в соответствии с вариантом осуществления данного изобретения;
Фиг.17 иллюстрирует санирующий зонд, который может использоваться при осуществлении способа в соответствии с вариантом осуществления данного изобретения;
Фиг.18 иллюстрирует отсасывающее/ирригирующее устройство, которое может использоваться при осуществлении способа в соответствии с вариантом осуществления данного изобретения;
Фиг.19 иллюстрирует 180' рабочую канюлю, которая может использоваться при осуществлении способа в соответствии с вариантом осуществления данного изобретения;
Фиг.20 является рентгеновским снимком, демонстрирующим введение санирующего зонда, используемого при создании пустоты в проксимальной части бедренной кости в соответствии с одним вариантом осуществления данного изобретения;
Фиг.21 является рентгеновским снимком, демонстрирующим трансплантатный материал, заполняющий образованную пустоту in situ в соответствии с одним вариантом осуществления данного изобретения;
Фиг.22 является графиком, демонстрирующим среднюю пиковую нагрузку, наблюдаемую среди пар кадаверных бедренных костей, исследованных на сопротивление переломам после образования пустоты и ее заполнения материалом для регенерации костей в соответствии с одним вариантом осуществления изобретения;
Фиг.23 является рентгеновским снимком проксимальной части бедренной кости до проведения инъецирования материала для регенерации костей в способе в соответствии с одним вариантом осуществления изобретения;
Фиг.24 является изображением того же участка проксимальной части бедренной кости, показанного на Фиг.23, до проведения инъецирования материала для регенерации костей, полученным с помощью компьютерной томографии;
Фиг.25 является рентгеновским снимком проксимальной части бедренной кости, изображенной на Фиг.23, во время проведения операции в течение процесса инъецирования материала для регенерации костей в соответствии с данным изобретением;
Фиг.26 является рентгеновским снимком левой бедренной кости, изображенной на Фиг.23, спустя 6 недель после лечения, осуществленного по способу в соответствии с одним вариантом осуществления данного изобретения;
Фиг.27 является изображением левой бедренной кости, изображенной на Фиг.23, спустя 12 недель после лечения, осуществленного по способу в соответствии с одним вариантом осуществления данного изобретения, полученным с помощью компьютерной томографии;
Фиг.28 является изображением подвергнутой лечению левой бедренной кости, изображенной на Фиг.23 спустя 24 недели после лечения, полученным с помощью компьютерной томографии;
Фиг.29 является графиком, включающим данные по курсу продолжительностью до двух лет, демонстрирующим средние значения Т-балла шейки бедра подвергнутого лечению тазобедренного сустава пациентов, прошедших лечение в соответствии с определенными вариантами осуществления данного изобретения;
Фиг.30 является графиком, включающим данные по курсу продолжительностью до двух лет, демонстрирующим средние значе