Фармацевтическая композиция для лечения астении и/или синдрома хронической усталости
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к фармакологии, а именно к фармацевтическим композициям для лечения различных состояний, связанных с недостаточностью энергетического потенциала, являющегося следствием патологического процесса. Фармацевтическая композиция для коррекции симптомов лечения астении и/или синдрома хронической усталости как изолированно, так и при различных заболеваниях и/или пре и/или постморбидных состояниях у млекопитяющих, характеризующаяся тем, что в качестве активных компонентов содержит 2-этилтиобензимидазол гидробромид и/или его фармацевтически приемлемую соль и левокарнитин в терапевтически эффективных количествах. 3 з.п. ф-лы, 15 табл., 3 ил., 4 пр.
Реферат
Изобретение относится к области медицины, в частности к фармакологии, а именно к фармацевтическим композициям для лечения различных состояний, связанных с недостаточностью энергетического потенциала, являющегося следствием патологического процесса.
Бемитил был синтезирован и изучен на кафедре фармакологии Военно-медицинской Академии в 1970-х годах под руководством профессора В.М. Виноградова. В эксперименте было установлено (Бобков Ю.Г. и соавт., 1981 и др.), а затем в клинических исследованиях подтверждено (Лосев А.С. и соавт., 1990; Смирнов А.В. и соавт., 1990; Строганов В.П. и соавт., 1990; Шахназаров А.С. и соавт., 1990; Сытник С.И., Пастушенков В.А., 1993), что уже при однократном применении Бемитил существенно повышает физическую работоспособность животных и ускоряет ее восстановление после предельных нагрузок, особенно в осложненных условиях (высотная гипоксия, перегревание, марш-броски и т.д.).
При курсовом применении действие Бемитила нарастает в первые 3-5 дней, а затем устойчиво поддерживается на достигнутом уровне (Смирнов А.В., 1993; Бобков Ю.Г. и соавт., 1993), превосходя по скорости и выраженности эффекта действие пирацетама и пиридитола (Александровский Ю.А. и соавт., 1988).
В эксперименте было выявлено гепатозащитное действие Бемитила (Александрова А.И. и соавт., 1988), получены положительные результаты в лечении острых цереброваскулярных расстройств в модели черепно-мозгового кровоизлияния (Плотникова Т.М. и соавт., 1993), репаративный эффект по отношению к слизистой оболочке тонкой кишки при экспериментальном перитоните (Староконь П.М., Ларин Ю.Н., 1999).
Были описаны также и следующие способности Бемитила -
- увеличивать активность антиокислительных ферментов, особенно супероксиддисмутазы (Катков В.Ф. и соавт., 1989, Шахназаров А.С. и соавт., 1990);
- инактивировать гидропероксид in vitro эффективнее глутатиона (Диже А.А. и соавт., 2002);
- препятствовать снижению содержания восстановленного глутатиона, SH-групп, активности глутатионредуктазы, глутатионпероксидазы печени при острой гипоксии в эксперименте и усиливать синтез антиоксидантных ферментов глутатионовой системы (Зарубина И.В., Миронова О.П., 2002);
- индуцировать активность цитохрома Р-450 смешанного типа, увеличивая суммарное содержание цитохрома Р-450 в микросомах и монооксигеназную активность (Сорокина Е.А. и соавт., 2002);
- снижать уровень лактата крови у больных (Леоско В.А и соавт., 1996) и интенсивность ПОЛ, определяемую непрямым антирадикальным путем (Плотников М.Б. и соавт., 1988, 1990);
- способствовать регенерации печени после частичной гепатэктомии в эксперименте (Гайворонская В.В. и соавт., 2002);
- оказывать антимутагенный эффект (Дурнев А.Д. и соавт., 1988).
Была выдвинута гипотеза, согласно которой в основе механизма действия Бемитила (2-этилтиобензимидазола гидробромида) и его аналогов - производных 2-тиобензимидазола - лежит активация синтеза РНК в разных клетках, приводящая к усилению синтеза белка. Такое действие может быть обусловлено их взаимодействием с геномом, вероятно, вследствие структурного сходства бензимидазола с пуриновыми основаниями - аденином и гуанином (Смирнов А.В., 1993; Смирнов А.В. и соавт., 1994). Этот эффект не является органо- или тканеспецифичным, однако он всегда более выражен в тех органах и тканях, в которых активно протекают процессы синтеза РНК и, следовательно, белка.
Любопытно, что среди лекарственных препаратов, производных бензимидазола - множество средств самого разнообразного применения, с разной лечебной направленностью: с антипсихотической (пимозид), актопротекторной (Бемитил, этомерзол), антиаритмической (мибефрадил, ритмидазол), противоязвенной (омепразол, гастрозол, пантопразол), противоаллергической (астемизол), урикозурической (иртемазол), антигельминтной (мебендазол, тиабендазол). Представлена и группа производных бензимидазола (фенбендазол, оксафендазол, парбендазол, триклабендазол), применяемых в ветеринарии в качестве антигельминтных средств. Означает ли это, что все они стимулируют синтез белка?
Интересно, что сам имидазол, как показано в эксперименте на модели миокардиальной ишемии (Smith E.F. е.а., 1980), обладает кардиопротективным действием благодаря специфическому ингибированию тромбоксан-А2-синтетазы. Последняя, являясь коронароконстриктором и нарастая в активности при ишемии, может вызывать дальнейшее ухудшение коронарного кровотока по принципу «порочного круга».
А.В. Смирнов и В.Ю. Ганчо (1990) показали, что усиление синтеза белка происходит в основном в головном мозге, чем они объясняли улучшение памяти при использовании Бемитила.
Так или иначе, но установлено, что для поддержания высокого уровня обмена, как и физической работоспособности, необходимо активное протекание в печени и почках глюконеогенеза, обеспечивающего утилизацию молочной кислоты и ресинтез глюкозы при различных состояниях с ее высокой продукцией, например при усиленной мышечной деятельности. Ферменты глюконеогенеза относятся к достаточно коротко живущим белкам, и их обновление идет постоянно.
Усиление синтеза именно этих ферментов является тем компонентом в механизме действия Бемитила, который наиболее важен для повышения физической работоспособности. Кроме того, Бемитил и его аналоги активируют синтез белков, обеспечивающих характерный для данных препаратов эффект экономизации: уменьшение потребления кислорода и теплопродукции, снижение расходования энергетических ресурсов, в том числе на единицу выполненной работы.
Другая гипотеза механизма действия Бемитила выдвинута Ю.Г. Бобковым и соавторами (1993) и подчеркивает способность препарата в эксперименте «ускорять переход супероксид-радикала и других свободных радикалов в молекулярный кислород с последующим его прямым использованием в метаболическом цикле за счет активации антиокислительных ферментов - СОД, каталазы, глутатионпероксидазы». Оставим этот механизм на совести авторов.
Хотя Бемитил является эффективным средством восстановительно-репаративного, реабилитационного действия и при самых различных патологических состояниях он купирует астению, повышает работоспособность, возможно использование его и при острой гипоксии.
Любопытно, что в современной тренирующей методике интервальной гипокситерапии, при которой у пациентов создается искусственная гипоксическая гипоксия с профилактической (прекондиционирование) и лечебной целью, предусмотрено использование, скажем, «корректоров методики». В модельных опытах с такой своеобразной «лечебной» гипоксией Бемитил проявил себя надежным протектором, «стимулируя развитие адаптивных метаболических сдвигов в мозге, сердце, печени, почках и скелетной мускулатуре» (Zarubina I.V., 2001).
Были получены обнадеживающие данные в клинике, свидетельствующие об антигипоксическом эффекте Бемитила для предотвращения повреждения миокарда при остром инфаркте, в связи с операциями на сердце с искусственным кровообращением, при хронической гипоксии плода у беременных с гестозами, при хронической дыхательной недостаточности и вирусном гепатите (Лобзин Ю.В., Смирнов А.В., 1993; Шевченко Ю.Л. и соавт., 1995; Семиголовский Н.Ю. и соавт., 1995, 1996, 1998; Леоско В.А. и соавт., 1996; Рябинин Г.Б. и соавт., 1999).
В клинике Бемитил использовали и при нервно-мышечных заболеваниях (прогрессирующей миодистрофии, атрофической миотонии и вторичных амиотрофиях). Было отмечено увеличение мышечной силы, креатинового индекса, снижение продуктов ПОЛ, ферментемии (Лобзин B.C., Пустозеров В.Г., 1993). Есть некоторые основания рассчитывать и на церебропротекторные свойства Бемитила, поскольку другие бензимидазоловые производные в эксперименте (модели с перевязкой сонных артерий, гравитацией) оказались по данным Л.М. Гаевой и Т.Н. Щербаковой (1994) в этом аспекте даже активнее кавинтона, пирацетама, фенибута и ГОМК.
Бемитил применяют для повышения и восстановления работоспособности, в том числе в экстремальных условиях (тяжелые нагрузки, гипоксия, перегревание и т.д.); для ускорения и упрочения развития адаптации к воздействию различных экстремальных факторов; для лечения астенических расстройств различной природы (при неврастении, соматических заболеваниях, после тяжелых инфекций и интоксикаций, в пред- и послеоперационном периоде при хирургических вмешательствах и др.); в комплексной терапии последствий черепно-мозговой травмы, менингитов, энцефалитов, нарушений мозгового кровообращения, а также при ухудшении памяти.
Наблюдения применения Бемитила у больных острым инфарктом миокарда относятся к 1994-1995 годам (Семиголовский Н.Ю., 1995, 1996, 1998). Препарат назначали больным дважды в сутки - утром и днем из опасения избыточного психостимулирующего его действия в ночные часы.
Пациенты, получавшие Бемитил, были несколько активнее, "бодрее". Наблюдалось "гипотермическое" действие препарата - температура тела у больных на 5-6 сутки заболевания иногда оказывалась ниже 36.0оС, что соответствует описанию свойств Бемитила (Смирнов А.В., 1993, Бобков Ю.Г. и соавт., 1993 и др.) и в целом характерно для производных тиомочевины (Пастушенков Л.В., 1968; Урюпов О.Ю., 1969).
Препарат не проявлял сколь-либо заметного антиангинального и антиаритмического действия. Динамика ферментной активности при его использовании не отличалась достоверно от контрольной, исключая статистически значимое снижение АлАТ на 3-4 сутки инфаркта (р<0.05), по сравнению с контрольным показателем. Последнее соответствует наблюдениям Ю.В. Лобзина и А.В. Смирнова (1993) о гепатопротекторных свойствах Бемитила.
Исследование протекторной активности препарата выявило и его гипокоагуляционные свойства у больных ОИМ, на что указывает достоверное снижение в основной группе среднего протромбинового индекса на протяжении всего времени наблюдения (р<0.01-0.05) и среднего содержания фибриногена - на 5-6 сутки ОИМ (р<0.05). Была отмечена также быстрая редукция стрессорной гипергликемии под влиянием Бемитила, что совпадает с описанием его действия при других состояниях (М.Д. Машковский, 1993) и, возможно, подразумевает необходимость субстратной поддержки лечения этим антигипоксантом.
Ускоренное снижение исходно достоверно повышенного среднего систолического показателя ЭКГ (р<0.05) совпадает с данным Л.А. Новикова (1994) об инотропной активности Бемитила.
В эксперименте была показана способность Бемитила, этомерзола и яктона ускорять регенерацию печени после частичной гепатэктомии (выявлено ускорение прироста массы печени, увеличение содержания в ней нуклеиновых кислот и гликогена, улучшение функционального состояния, что проявляется снижением уровня билирубина в крови и уменьшением длительности гексеналового сна). Репаративная активность этих средств превосходила эффект комбинации стимуляторов регенерации, производных пуриновых и пиримидиновых оснований, рибоксина и оротата калия (Гайворонская В.В. и соавт., 2002).
Карнитин
Международное непатентованное название препарата - левокарнитин (Levocarnitine). Карнитина хлорид выпускается в 10%-ном растворе для инъекций (1 мл содержит 100 мг вещества).
Вещество впервые выделил из фарша B.C. Гулевич (1905), но лишь в 1959 году Frits установил ведущую роль карнитина в процессе β-окисления жирных кислот. В 1969 году была идентифицирована физиологическая форма карнитина, представленная L-карнитином.
В организме человека содержится 20-25 г этого вещества, из которых около 98% находится в скелетных мышцах и миокарде. Потребность в L-карнитине взрослого человека составляет 200-500 г в день. Наибольшее количество его содержится в баранине (190 мг/100 г) и в авокадо. Биосинтез L-карнитина проходит в основном в печени (из лизина и метионина при участии восстановленного железа и кофакторов синтеза витаминов С, В6, В3), а основными потребителями его являются сердечная и скелетные мышцы. Любопытно, что цинга вызывает дефицит карнитина в мышечной ткани при неизменной его концентрации в печени, почках и плазме.
Антигипоксические свойства карнитина доказаны L. Karen с сотрудниками (1987) и А.Л. Караевым и соавторами (1991). Карнитин относится к препаратам, активно влияющим на метаболические процессы. Помимо антигипоксического он оказывает анаболическое, антитиреоидное, стимулирующее жировой обмен, регенерирующее действие.
Препарат восстанавливает щелочной резерв крови, не влияет на свертывающую систему крови, уменьшает образование кетокислот, повышает устойчивость тканей к влиянию токсичных продуктов распада, активизирует аэробные процессы и угнетает анаэробный гликолиз, стимулирует и ускоряет репаративные процессы.
Он оказывает жиромобилизующее действие - включает жирнокислотный метаболический шунт, активность которого не лимитирована кислородом, поэтому карнитин эффективен при острой гипоксии мозга, миокарда и при других критических состояниях.
З.А. Суслина и соавторы (2003) изучали антиоксидантное действие L-карнитина при лечении дисциркуляторной энцефалопатии на фоне сахарного диабета. Препарат L-карнитина (2 г ежедневно) дополнительно к базисной терапии повышал резистентность липопротеинов сыворотки крови пациентов к перекисному окислению, что свидетельствует о его антиоксидантных свойствах. Авторами отмечено гипогликемизирующее действие L-карнитина: его использование позволило уменьшить дозу сахароснижающих препаратов на 42%. На фоне лечения L-карнитином у обследованных больных отмечено улучшение абстрактного и практического мышления и памяти. Полученные результаты позволили авторам рекомендовать включение L-карнитина в комплекс лечения больных с сосудистыми заболеваниями головного мозга.
Препарат обладает нейротрофическим действием: показано, что карнитин тормозит развитие апоптоза, ограничивает зону поражения и восстанавливает структуру нервной ткани. Имеются и другие сведения об эффективности препарата при дисциркуляторной энцефалопатии, различных травматических и токсических поражениях головного мозга, при острых нарушениях мозгового кровообращения - ишемическом инсульте, транзиторной ишемической атаке. Назначают препарат в остром, подостром и восстановительном периодах.
Многими авторами было выявлено снижение уровня карнитина в миокарде при различных заболеваниях сердца - от ишемической болезни, включая инфаркт миокарда, до кардиомиопатий, гипертонической болезни, клапанных пороков и застойной сердечной недостаточности (Spagnoli L.G. е.а., 1982; Bohles Н. е.а., 1986; Regitz V. е.а., 1990).
Y. Masumura с соавторами (1990) показали, что дефицит карнитина в миокарде в основном касается свободного карнитина, в то время, как показатели общего карнитина часто остаются нормальными за счет увеличения связанного карнитина в виде эфира в основном длинноцепочечного. V. Regitz с соавторами (1990) отметил прямую (хотя и не линейную) связь дефицита карнитина со снижением фракции выброса левого желудочка - особенно низким его уровень был у пациентов с фракцией выброса ниже 30%. A A. Patel с соавторами (1990) обнаружил прогностическую значимость снижения содержания карнитина в миокарде, наблюдая в течение 5 лет 40 больных, из которых у 18 «карнитиндефицитных» летальность составила 33,3% в отличие от 22 больных с нормальным уровнем карнитина с летальностью 4,6%.
Одной из причин карнитинового дефицита в миокарде считают выход его в плазму при ишемии с последующим вымыванием. Так P. Rizzon и соавторы (1989) обнаружили первоначальное нарастание плазматической концентрации карнитина в первые 48 часов после острого инфаркта миокарда, a G.L. Battels и W.J. Remme (1990) зафиксировали снижение свободного карнитина в плазме после электрокардиостимуляции предсердий в группе больных, испытавших при этом ишемию миокарда в отличие от пациентов без ишемии или с безлактатной ишемией. Дефицит карнитина в миокарде в результате ишемического повреждения клеток затрудняет перенос жирных кислот в митохондрии и приводит к их накоплению в цитоплазме (Порядин Г.В., 1997; Lopaschuk G., 2000).
В 1979 году L.H. Opie предложил использовать карнитин при ишемии миокарда. По данным А.И. Толейкис и соавт. (1986), карнитин в эксперименте при ишемии миокарда оказывал протективный эффект, восполняя возникающий дефицит (A.L. Shug, 1978), что подтвердили и в клинике у больных стенокардией и застойной недостаточностью кровообращения (Савчук В.И. и соавт., 1991; Белозеров Ю.М., 1992; Kamikawa е.а., 1984; Cherchi е.а., 1985; Fernandez С. е.а., 1985; Orlando G., Rusconi С, 1986; Cacciatore L. е.а., 1991; Borchard U. е.а., 1994 и др.). обычной дозировкой было 2 г в день в течение 1-6 месяцев. Авторами отмечено снижение потребности больных в нитратах, увеличение антиангинального действия бета-адреноблокаторов и антагонистов кальция, увеличение переносимости нагрузок.
Положительный эффект карнитина был отмечен и у больных острым инфарктом миокарда, включая его осложненное течение: кардиогенный шок и нарушения сердечного ритма (Rebuzzi A.G. е.а., 1984; Chiariello G. е.а., 1986; Rizzon Р. е.а., 1989; Davini Р. е.а., 1992; Corbucci G.G., Lettieri В, 1992; Corbucci G.G., Loche F., 1993). Препарат вводили внутривенно - до 21 г в первые часы заболевания и перорально (до 6 г в день на протяжении 30 дней). Было выявлено уменьшение зоны некроза и 12-месячной летальности, стабилизация гемодинамики, антиаритмическое действие препарата, увеличение сократительной способности миокарда и экскреции с мочой жирных кислот. При кардиогенном шоке применение препарата способствовало ликвидации ацидоза и снижению летальности с 80 до 50% (Corbucci G.G., Loche F., 1993).
При лечении хронической сердечной недостаточности изучали эффективность ежедневного перорального приема 2 г L-карнитина на протяжении 1,5-12 месяцев (Ghidini О. е.а., 1988; Fernandez С, 1991; Borchard U. е.а., 1994). Авторы отмечали у больных субъективное улучшение, увеличение сократимости миокарда, снижение потребляемых доз сердечных гликозидов, диуретиков, вазодилататоров, антиаритмиков и нитратов.
Показано также назначение препарата в качестве кардиопротектора при лечении цитостатиками, особенно антрациклинового ряда. По данным Г.А. Лазаревой и соавт. (2002), карнитин уменьшает выраженность изменений иммунологических функций при отравлениях гемолитическим ядами (фенилгидразин).
Препарат используют также при ишемической болезни сердца, различных кардиомиопатиях, ожирении, сахарном диабете, в спортивной медицине. Существуют современные рекомендации по использованию цинк-карнитина (по 150 мг дважды в день) с целью профилактики и лечения язвенной болезни, повышения эффективности эррадикации H. pylori (Arakawa Т. е.а., 1990; Nishiwaki Н. е.а., 1999).
Описан синдром карнитинового дефицита (Гринио Л.П., 1988; Karpati G. е.а., 1975; Ware A.L. е.а., 1978 и др.), проявляющийся мышечными болями, почечной и сердечной недостаточностью. Известно, что кардиомиопатии у детей относятся к тяжелым заболеваниям миокарда с непрерывно прогрессирующим течением и тяжелым прогнозом с высокой смертностью (Леонтьева И.В., 2001). Системная форма первичной карнитиновой недостаточности клинически проявляется тяжелой гипогликемией, почечной недостаточностью и энцефалопатией по типу синдрома Рейе (Белозеров Ю.М., 1992). Определенный эффект при этом дает заместительная терапия карнитином.
В педиатрии показаниями для использования препарата являются: последствия родовой травмы и асфиксии; гипотрофия и гипотония новорожденных; респираторный дистресс-синдром новорожденных; выхаживание недоношенных новорожденных, находящихся на полном парентеральном питании, и детей, которым производится гемодиализ; синдромокомплекс, сходный с синдромом Рейе (гипогликемия, гипокетонемия, кома), развивающийся у детей на фоне приема вальпроевой кислоты; дефицит массы тела у детей и подростков до 16 лет; пропионовая и др. "органические" ацидемии, первичный (генетический) дефицит карнитина.
Препарат используется также при анорексии, гипотрофии, задержке роста у детей. Карнитин повышает секрецию и ферментативную активность пищеварительных соков (желудочного и кишечного), улучшает усвоение пищи. Он снижает избыточную массу тела и уменьшает содержание жира в мускулатуре.
С другой стороны, вторичная приобретенная недостаточность карнитина развивается при активном его выведении (гемодиализ, прием вальпроевой кислоты), при избыточном расходовании (ишемические поражения, травма, выздоровление, беременность), при нарушениях поступления с пищей (парентеральное питание, мальабсорбция, кишечные заболевания), при нарушении реабсорбции в почках (хроническая почечная недостаточность).
Препарат повышает порог резистентности к физической нагрузке, приводит к ликвидации посленагрузочного ацидоза и, как следствие, восстановлению работоспособности после длительных истощающих нагрузок. Он увеличивает запасы гликогена в печени и мышцах, способствует более экономному его использованию.
Препарат назначают самостоятельно или в комплексной терапии.
При внутривенном введении спустя 3 часа карнитин уже не обнаруживается в крови. Он легко проникает в печень, миокард, медленнее - в мышцы. Выводится почками преимущественно в виде ацильных эфиров.
Карнитин вводят внутривенно капельно медленно (не более 60 капель в минуту!). Перед введением каждые 100 мг препарата карнитина хлорида (1 мл 10%-ного раствора) растворяют в 50 мл изотонического раствора NaCl или 5%-ного раствора глюкозы.
В остром периоде заболевания в первые 3 дня карнитин вводят по 10-14 мг/кг массы тела больного, в последующие дни - по 7 мг/кг массы тела. Общий курс лечения 7-10 дней. При необходимости через 10-12 дней проводят повторный курс по 7 мг/кг веса в течение 3-5 дней.
При остром инфаркте миокарда препарат используют в суточной дозе 100-200 мг/кг в 4 приема или в виде непрерывной внутривенной инфузии в течение 48 часов с последующим снижением дозы в 2 раза. Больным, находящимся на хроническом гемодиализе, вводят 2 г однократно сразу после завершения очередного сеанса.
При назначении препарата в подостром и восстановительном периодах дисциркуляторной энцефалопатии и различных поражениях головного мозга больным вводят по 0,5-1,0 г карнитина хлорида один раз в сутки в течение 3-5 дней. При необходимости через 12-14 дней назначают повторный курс.
Использование карнитина при гемодиализе позволяет нивелировать отклонения в липидном спектре крови (снижает уровень триглицеридов и холестерина, увеличивает содержание липопротеидов высокой плотности), снижает частоту гипотензии и нарушений сердечного ритма, способствует увеличению количества эритроцитов и гемоглобина, позволяет снизить дозу эритропоэтина.
Что касается побочных действий, то при назначении карнитина возможны аллергические реакции. В случае быстрого внутривенного введения возможно появление болей по ходу вен, проходящих при снижении скорости введения. При диабете у людей, получающих инсулин и пероральные гипогликемизирующие средства, возможно развитие гипогликемии. Описывают также болевые ощущения в эпигастральной области, диспептические явления, мышечную слабость.
Глюкокортикоиды способствуют накоплению карнитина в тканях (кроме печени), другие анаболики усиливают его эффект.
Противопоказаний за исключением повышенной индивидуальной чувствительности к препарату не описано.
Как и было сказано, вещества родственные этилтиобензимидазолу широко описаны, в том числе и в патентах RU 1251374, применение 2-этил-меркаптобензимидазола бромида в качестве психотропного средства, обладающего актопротекторным психоэнергизирующим и антигипоксическим действием.
RU 2061686, применение в фармацевтических композициях производных 2-этилтиобензимидазола гидробромида и гидрохлорида, проявляющих слабую транквилизирующую активность.
RU 2157684, лекарственное средство, относящееся к группе актопротекторов, оказывающих умеренное психостимулирующее действие, в котором активным ингредиентом является 2-этил-меркаптобензимидазола гидробромид, применяемое для лечения системной красной волчанки. Как соединение, обладающее антигипоксической активностью, используют при пограничных психиатрических расстройствах, когда показана стимуляция психических и физических функций.
RU 2188012, применение 2-этил-меркаптобензимидазола бромида при лечении больных первичным биллиарным циррозом в качестве иммуномодулирующего средства, действующего на клеточное звено иммунитета и способствующего повышению эффективности других, применяемых в комплексной терапии циррозов, препаратов направленного действия.
RU 2173144, применение актопротекторов, содержащих в качестве активного ингредиента производное 2-этилтиобензимидазола гидробромида моногидрата, для лечения миодистрофии Дюшенна-Беккера.
Это производное вследствие структурного сходства с пуриновыми основаниями аденином и гуанином усиливает синтез митохондриальных ферментов, повышает энергетический потенциал мышечной ткани и стимулирует окислительно-восстановительные процессы. Увеличение энергетического потенциала мышечной ткани способствует активации синтеза белков и ферментов, что приводит к снижению проницаемости мембран миоцитов, способствует регенерации мышц, замедлению миодистрофического процесса.
RU 2017483, применение лекарственного средства, содержащего 2-этилтиобензимидазола гидробромида моногидрата, в качестве средства, повышающего устойчивость организма к гипоксии и восстанавливающего работоспособность при выполнении тяжелых физических нагрузок и при воздействии неблагоприятных факторов, а также для устранения полипрагмазии, для профилактики профессиональной тугоухости; RU 2019161 для профилактики острых приступов глаукомы при геомагнитных бурях.
RU 2138263, применение 2-этилтиобензимидазола гидробромида для лечения гипоталамо-гипофизарной недостаточности у женщин с использованием эффекта повышения устойчивости мозга к асфиксии и циркуляторной гипоксии, что проявляется выраженным увеличением мозгового кровообращения, улучшением кислородного снабжения мозга, а также эффектом торможения деградации энергетических функций митохондрий нейроглиальных клеток.
В качестве ближайшего аналога может быть указан препарат бемактор (Терра Медика Нова, №4 ′98 НОВОСТИ ФАРМАЦИИ "Бемактор" - новый препарат для общемедицинской практики). Препарат вызывает выраженный противоастенический эффект и ускоряет процесс выздоровления при различных заболеваниях. Бемактор выпускался в виде таблетированной формы (производство «ICN-Октябрь»). Однако выпуск его прекращен с 1999 г. Он недоступен для врачей и пациентов. Как написано в рекомендации по применению, его используют пероральный прием по 250-500 мг в течение 2-3 или 5-7 дней (но не более 10-12 дней из-за возможности избыточного психоактивирующего действия).
При создании изобретения ставилась задача поиска лекарственного средства, способного оказывать сочетанное биологическое действие в условиях энергетической недостаточности в организме.
Задача решается новой комбинацией двух агентов, активирующих системы энергообеспечения функционирования метаболических процессов, и при этом никак не пересекающихся друг с другом в плане воздействия на механизмы активации. На основе данной комбинации была разработана фармацевтическая композиция для лечения астении и/или синдрома хронической усталости как изолированно, так и при различных заболеваниях и/или пре- и/или постморбидных состояниях у млекопитающих, характеризующаяся тем, что в качестве активных компонентов содержит 2-этилтиобензимидазол и/или его фармацевтически приемлемую соль и левокарнитин в терапевтически эффективных количествах.
Приемлемые терапевтически эффективные количества составляют для 2-этилтиобензимидазола и/или его фармацевтически приемлемых солей 50-250 мг, Левокарнитина 150-750 мг.
В качестве фармацевтически приемлемых солей возможно использование, например, таких солей, как гидробромид этилтиобензимидазола (бемитил), гидрохлорид 2-этилтиобензимидазола.
Фармацевтическая композиция может содержать целевые добавки для придания удобной для приема лекарственной формы. В частности, она может содержать наполнители, выбранные из группы сахаров, заменителей сахара, заменителей вкуса, дезинтегрирующих агентов, разрыхлителя, ароматизатора, при следующих соотношениях, мас.%:
| Этилтиобензимидазола гидробромид | 5,46-15,15 |
| Левокарнитин | 21,86-44,55 |
| Наполнитель, выбранный из группы сахаров | 9,09-42,62 |
| Наполнитель, выбранный из группы заменителей сахара | 9,09-16,39 |
| Наполнитель, выбранный из группы маскирующие вкус | 2,42-6,56 |
| Наполнитель, выбранный из группы дезинтегрирующих компонентов | 1,21-4,37 |
| Наполнитель, выбранный из группы заменителей разрыхляющих агентов | 1,21-2,19 |
| Наполнитель, выбранный из группы ароматизаторов | 0,30-0,55 |
В качестве наполнителя группы сахаров могут быть использованы, например: лактоза, глюкоза, сахароза, фруктоза, циклодекстрин.
В качестве наполнителя группы заменителей сахара могут быть использованы, например, маннит, ксилит, сорбит, изомальтит, фруктоолигосахариды.
В качестве наполнителя группы маскирующие вкус могут быть использованы сок лимона, мед, стевиозиды, мальтол и др.
В качестве наполнителя группы дезинтегрирующих компонентов могут быть использованы, например, натрия кроскармеллоза, крахмал, микрокристаллическая целлюлоза, агар, желатин.
В качестве наполнителя группы заменителей разрыхляющих агентов могут быть использованы, например, натрия крахмал гликолят, силикатированная микрокристаллическая целлюлоза.
В качестве наполнителя группы ароматизаторов могут быть использованы пищевые ароматизаторы.
Композиция может быть представлена в твердой лекарственной форме. Примером такой формы являются таблетки для рассасывания.
Композиции по изобретению применяются для лечения астении и/или синдрома хронической усталости как изолированно, так и при различных заболеваниях и/или пре и/или постморбидных состояниях путем введения лекарственного препарата путем введения от пяти и до двадцати дней при необходимости с повторным применением перерыва продолжительностью 2 или более дней.
Технический результат: агенты могут значительно усилить эффекты друг друга, в том числе связанные с энергообеспечением функционирования метаболических процессов и соответственно улучшить состояние пациентов при самых различных заболеваниях или внеморбидных состояниях. При комбинировании наблюдается усиление антиастенического, антистрессорного действия, повышается физическая и умственная работоспособность, значительно увеличивается антигипоксический эффект.
Использование комбинации в виде быстродействующей рассасываемой таблетки позволяет избежать таких побочных эффектов Этилтиобензимидазола как кумулятивный эффект и повышенный психоактивирующий эффект, что может рассматриваться как дополнительный результат.
Возможность осуществления изобретения может быть продемонстрирована следующими ниже представленными примерами.
Пример 1. Таблетки, мас.%:
| Этилтиобензимидазола гидробромид | 10 |
| Левокарнитин | 30 |
| Лактоза | 34 |
| Ксилит | 16 |
| Мальтит | 4,7 |
| Микрокристаллическая целлюлоза | 2.9 |
| Натрия крахмал гликолят | 2,1 |
| Ароматизатор ментоловый | 0,3 |
Пример 2. Капсулы, мас.%:
| Этилтиобензимидазол | 15,15 |
| Левокарнитин | 21,86 |
| Маннит | остальное |
Пример 3. Таблетки для рассасывания, мас.%:
| Этилтиобензимидазола гидробромид | 5,46 |
| Левокарнитин | 44,55 |
| Мальтит | 49 |
| Сахаринат натрия | 0,09 |
Пример 4. Фармакологическая активность
Целью настоящего исследования было изучить влияние повторного введения комбинации бемитила с левокарнитином на двух моделях синдрома хронической усталости у мышей. В качестве первой модели использовался синдром физической усталости, вызванный повторными физическими нагрузками. В качестве второй модели использовался синдром усталости, вызванный повторным стрессом у мышей.
В качестве вещества для сравнения использовался рибоксин.
Методы исследования
4.1. Экспериментальные животные.
Все эксперименты проводились в соответствии с принципами работы с лабораторными животными (Principles of Animal Care, директива 86/609/EEC) согласно Хельсинкской декларации. Закупка животных и проведение опытов были сделаны на основании соответствующей лицензии от Комитета по этике (Министерство Сельского хозяйства Эстонской республики). Все лица, осуществляющие уход за животными и проводившие эксперименты, обладают персональными лицензиями, позволяющими проводить опыты на животных. При проведении экспериментов были предприняты все усилия, чтобы минимизировать количество животных и их страдания.
Все эксперименты были проведены на 120 мышах самцах линии C57BL/6. Животные были закуплены в фирме Harlan (Англия). Средний возраст животных в момент прибытия в виварий Биомедицинского центра Тартуского университета был 6 недель (120 мышей). По прибытии, животные были помещены на 2 недели на карантин в виварий Биомедицинского центра Тартуского университета. После чего животные были перенесены в виварий Института Фармакологии (комната номер 3028). Животные содержались в пластиковых клетках (5 мышей в клетке) размерами 25 см × 45 см × 12 см (Ш×Д×В) без ограничения в пище и воде, с 12-часовым световым циклом (свет включается автоматически в 8.00). Клетки с животными находились в специальных климатических контейнерах (Scanbur, Дания). Контейнеры снабжены фильтрами НЕРА для очистки воздуха и имеют 24-часовой мониторинг влажности и температуры воздуха. Относительная влажность в контейнерах поддерживается в пределах 50±2%, температура 22±1°С. Доступ к животным разрешен только персоналу, имеющему соответствующую лицензию. Чистка клеток и обеспечение кормом и водой проводятся один раз в сутки. Корм животных: гранулированный R70 (Lactamin, Stockholm, Швеция). Животные находились в климатических контейнерах в течение 1 недели до начала опытов. Были проведены 2 серии опытов и в каждой серии использовалось 60 мышей. В первой серии опытов изучалось действие веществ на синдром усталости, вызванный повторной физической нагрузкой (плавание в бассейне). Во второй серии опытов изучалось действие веществ на развитие поведенческого синдрома, вызванного стрессорным воздействием (хронический вариабельный стресс). Для опытов с повторными физическими нагрузками были взяты мыши в возрасте 8-8,5 недель, для опытов, где использовался вариабельный стресс, возраст мышей был 10-10,5 недель.
В первой серии опытов масса тела мышей к началу эксперимента составляла 22,7±0,3 г (n=60), во второй серии опытов масса мышей составляла 23,1±0,2 г (n=60).
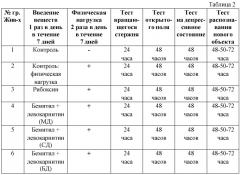
Все исследуемые вещества вводились в виде суспензии в 1% крахмальном клейстере с помощью желудочного зонда один раз в сутки днем (12.00-13.00) в течение 7 дней. Растворы веществ приготавливались ежедневно непосредственно перед началом введения. Дозы исследуемых веществ приведены в таблице 1.
Дозы исследуемых веществ, применявшиеся в исследованиях, и их обозначения в тексте отчета.
Синдром физической усталости, вызванный повторной физической нагрузкой.
Перед началом опытов животных кодировали и разделили на 6 групп по 10 животных в каждой с помощью программы рандомизации.
Приведены группы животных, исследуемые вещества и схема проведения эксперимента. Указано время после последнего введения исследуемых веществ
Методика физических нагрузок
Физическая нагрузка у мышей проводилась 2 раза в день. Для этого использовался бассейн размерами 25×12×25 см, заполненный водой (25°С). Животные помещались в бассейн и находились в воде в течение 6 мин. Нагрузка проводилась утром с 8.00 до 11.00 и вечером с 17.00 до 20.00 на всех животных за исключением первой контрольной группы мышей. Во время последнего сеанса плавания в бассейне измерялось время, в течение которого животные при плавании находились в неподвижном состоянии. Одновременно в опыте использовались 4 одинаковых бассейна и сеансы плавания записывались на видеопленку. Анализ поведения проводился на основании видеозаписи сотрудником, не знако