Способ ускорения восстановления скелетных мышц от атрофии после длительной алкогольной интоксикации
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к физиологии и может быть использовано для устранения негативного последствия атрофии скелетных мышц, вызванной длительной алкогольной интоксикацией. Способ включает введение животным смеси аминокислот с разветвленной боковой цепью из L-лейцина, L-изолейцина, L-валина до восстановления структуры и размеров быстрых мышечных волокон, при этом соотношение L-лейцина, L-изолейцина, L-валина в смеси равно 2:1:1 соответственно. Длительность введения смеси аминокислот с разветвленной боковой цепью составляет 30 дней. Суточная доза вводимой смеси аминокислот с разветвленной боковой цепью составляет 0,8 г/кг. Использование изобретения позволяет ускорить восстановление площади поперечного сечения мышечных волокон и мышечной массы. 2 з.п. ф-лы, 4 ил.
Реферат
Изобретение относится к медицине, более точно к физиологии, и может найти применение при разработке средств устранения негативного последствия атрофии скелетных мышц, вызванной длительной алкогольной интоксикацией.
Алкогольная миопатия является более распространенным мышечным заболеванием, чем наследственная миодистрофия Беккера, или Дюшена [1], и ведет к потере 20% мышечной массы [2]. Восстановления клинических и морфологических свойств мышц не наблюдалось даже через 5 лет после прекращения приема алкоголя [3]. Известно, что степень алкоголь-индуцированной мышечной атрофии пропорциональна продолжительности времени потребления алкоголя [2], однако механизм, который регулирует этот процесс, до сих пор неизвестен. Снижение белкового синтеза в скелетных мышцах животных и человека после употребления алкоголя было показано ранее [4, 5, 6, 7]. Кроме того, было показано, что быстрые мышцы страдают от вызванного алкоголизацией снижения белкового синтеза в большей степени, чем медленные [8]. Снижение белкового синтеза и инициации трансляции - обратимый процесс у алкоголизированных крыс [9]. Фосфорилирование сигнального анаболического пути mTOR у этих животных снижается [10], также как и уровень фосфорилирования киназ p70S6 и rpS6 [11]. Внутрибрюшинное введение алкоголя самцам крыс увеличивает общее содержание мРНК Е3-лигаз атрогина-1 и MuRF-1 (убиквитинирующих белки) в m. gastrocnemius [12], в то время как протеолиз остается неизменным [13]. Поэтому можно полагать, что снижение мышечной массы при злоупотреблении алкоголем является результатом снижения белкового синтеза [14]. Применение алкоголя может существенно затормозить процесс восстановления размеров мышечных волокон и функциональных характеристик мышц из-за ингибирования анаболических сигнальных путей. В имеющейся литературе мы не обнаружили способа ускорения восстановления скелетных мышц от атрофии после длительной алкогольной интоксикации.
Имеются исследования по влиянию острой алкогольной интоксикации на белковый синтез. Так, в работе Lang СН и соавторов (2010 г.), показано, что увеличение содержания ВСАА не подходит для улучшения (предотвращения) катаболического эффекта на белковый синтез при острой (т.е. не продолжительной) алкогольной интоксикации [20]. Т.е. анаболического эффекта на мышцы при введении ВСАА и приеме алкоголя в этом эксперименте авторами не было обнаружено. В следующей работе было показано, что введение алкоголя после одноразового физического упражнения снижает работоспособность и белковый синтез в мышцах даже на фоне введения различных белковых добавок (Parr Е.В. и соавторы 2014). Т.е. никакого улучшения при введении этих добавок на фоне приема алкоголя также не обнаружено [21].
В связи с изложенным мы считаем, что заявленное изобретение не имеет аналога того же назначения, т.е. прототипа.
Технической задачей настоящего изобретения является создание способа быстрого и полного восстановления размеров мышечных волокон скелетных мышц после длительной алкогольной интоксикации.
Эта техническая задача решается тем, что предложен способ восстановления скелетных мышц при их атрофии после длительной алкогольной интоксикации, характеризующийся тем, что животным вводят смесь аминокислот с разветвленной боковой цепью из L-лейцина, L-изолейцина, L-валина до восстановления структуры и размеров быстрых мышечных волокон, при этом соотношение L-лейцина, L-изолейцина, L-валина в смеси равно 2:1:1 соответственно.
Длительность введения смеси аминокислот с разветвленной боковой цепью составляет 30 дней.
Суточная доза вводимой смеси аминокислот с разветвленной боковой цепью составляет 0,8 г/кг.
Мы предположили, что ускорить белковый синтез, а значит и восстановление скелетных мышц от атрофии, вызванной алкогольной интоксикацией можно методом введения аминокислот в восстановительный период. Хорошо известно, что лейцин как наиболее часто используемый представитель семейства аминокислот с разветвленной боковой цепью является стимулятором сигнального пути mTOR/p70S6K [15]. Ранее было также показано, что промежуточный продукт метаболизма лейцина β-гидрокси-метилбутират подавляет проявления апоптоза в условиях инактивации мышц [16]. Мы предположили, что введение аминокислот может эффективно инициировать синтез белка и, как следствие, ускорять восстановление площади поперечного сечения мышечных волокон и мышечной массы после удаления алкоголя из рациона животных.
Для интенсификации процессов восстановления белкового синтеза после приема алкоголя крысами в настоящей работе нами была использована добавка смеси аминокислот с разветвленной боковой цепью (ВСАА). Известно, что аминокислоты стимулируют те этапы белкового синтеза, которые в наибольшей степени страдают при хроническом употреблении алкоголя. В то же время было показано, что введение аминокислот при острой алкогольной интоксикации не ведет к стимулированию инициации трансляции по сравнению с контрольными животными [17]. Поэтому важнейшим условием начала восстановительного процесса под действием аминокислот является применение этого метода на фоне отсутствия алкоголя в организме. В отличие от предыдущих работ, в нашей работе алкоголь вводился не короткое, а длительное время, что вызвало атрофию скелетной мышцы. Мы использовали аминокислоты (ВСАА) не во время, а после прекращения приема алкоголя и обнаружили положительный эффект от введения ВССА.
Смесь аминокислот (ВСАА) широко применяется в спорте для ускорения (усиления) анаболических процессов для повышения мышечной массы, а также для ускорения репарации мышц после физической нагрузки, находится в свободной продаже и не является лекарственным препаратом. Феномен усиления анаболических процессов в мышцах при введении аминокислот был отмечен во множестве статей. Так, B. Saltin в 2001 г. отмечал положительный эффект введения ВСАА на белковый метаболизм скелетных мышц, если вводить аминокислоты после, но не во время физической нагрузки [18]. Ra SG с соавторами в 2013 г. также отмечали положительный эффект введения ВСАА на скелетные мышцы при интенсивной повреждающей нагрузке [19]. И таких работ достаточно много.
Недостатков этого известного способа не выявлено, т.к. не известны свидетельства какого-либо негативного воздействия введения ВСАА на организм.
Материалы, подтверждающие воспроизводимость способа
Эксперимент проводился в соответствии с правилами биомедицинской этики и был одобрен комиссией по биоэтике ИМБП РАН (протокол №265 от 5 марта 2009 г.). Животные содержались в виварии при 22°C и получали корм и воду ad libitum. Использовали 28 самцов крыс Wistar массой 180-200 г. Протокол эксперимента был разработан на основе протокола Lang [22]. За неделю до начала эксперимента животные начали получать агаровые кубики. Крысы были разделены на 4 группы по 7 животных в каждой. Контрольные животные (Контроль) получали агаровые кубики. Животные групп Алк, Восст и Восст+АК получали алкоголь (этанол) в течение 16 недель. Среднее потребление алкоголя крысами было 25 г/кг/день. В течение первых 6 недель объем потребления алкоголя увеличивался от 20 до 35 г/кг/день, но после 9-й недели он снизился до 21 г/кг/день. После 16 недель эксперимента была проведена эутаназия животных групп Контроль и Алк овердозой нембутала, а из рациона крыс групп Восст и Восст + АК был исключен алкоголь и животные восстанавливались в течение 30 дней на обычном рационе кормления для лабораторных крыс. При этом животные группы Восст+АК получали аминокислоты в количестве 0,8 г/кг/день с питьевой водой. После окончания 20-й недели эксперимента была проведена эутаназия животных групп Восст и Восст+АК. Была выделена и заморожена в жидком азоте медиальная икроножная мышца (М. gastrocnemius medialis), которая хранилась при температуре -85°C до момента анализа.
Протокол введения алкоголя. Все время введения алкоголя питьевые емкости содержали раствор 10% этилового спирта. Крысы также получали агаровые кубики с алкоголем. Количество алкоголя в агаровых блоках постепенно увеличивали с 10% (первая неделя) до 40% (четвертая неделя). Содержание этанола в агаровых кубиках оставалось постоянным с 4 по 16 неделю. Потребление этанола оценивалось каждый день по количеству потребленной воды со спиртом и оставшихся несъеденными кубиков. Иммуногистохимический анализ мышечных проб. Поперечные срезы проб мышечной ткани (7 микрон) делали в криостате при -200°C.
Для выявления изоформ тяжелых цепей миозина (ТЦМ), ядер и дистрофиназамороженные мышечные срезы оттаивали при комнатной температуре. Далее образцы 60 мин инкубировали во влажной камере при +37°C с первичными антителами (1:30 для антител против быстрых (NCL - MHCf) и медленных изоформ (NCL - MHCs) ТЦМ, 1:20 для антител против дистрофина (NCL - Dys 2 Novocastra Laboratories, Великобритания). Затем срезы промывали PBS 3 раза по 5 мин, добавляли вторичные антитела, конъюгированные с Alexa Fluor goat anti mouse IgG (Molecular probes) 1:400 и инкубировали в темноте 60 мин при комнатной температуре. При окраске образцов, меченных антителами к дистрофину, в раствор вторичных антител добавляли DAPI из расчета 1 мкг на миллилитр раствора антител. После отмывки вторичных антител в PBS срезы заключали в среду, стабилизирующую флуоресцентную метку.
Окрашивание на BrdU. Ядра делящихся клеток визуализировали путем иммуногистохимического выявления включения бромодезоксиуридина (BrdU) в них. Бромодезоксиуридин вводили животным внутрибрюшинно за 12 часов до забоя. Для выявления ядер, меченых BrdU криостатные срезы мышц толщиной 7 мкм фиксировали в спиртовом растворе уксусной кислоты (90% этанола, 5% уксусной кислоты, 5% воды) в течение 30 мин при комнатной температуре, после чего три раза по 5 минут промывали в PBS. После этого наносили раствор нуклеазы с мышиными моноклональными антителами против BrdU (Amersham Bioscienses) и инкубировали 1 час при 37°C. Срезы инкубировали в течение часа в биотинилированных овечьих антителах против иммуноглобулинов мыши (в разведении 1:200), а затем в стрептавидине, конъюгированном с пероксидазой хрена (Amersham Bioscienses) (1:100) при комнатной температуре. После каждой инкубации срезы промывали в PBS 3 раза в течение 5 минут. Затем срезы обрабатывали раствором DAB в PBS с 0,01 - М имидазолом и 3% перекисью водорода в течение 8 минут, обезвоживали, проводя через батарею спиртов возрастающей концентрации, и заключали в канадский бальзам. Подсчитывали число ядер, с включенным BrdU, приходящихся на одно мышечное волокно. При этом в число меченых ядер могли входить делящиеся ядра клеток-миосателлитов, клеток соединительной или сосудистой ткани. Исследования проводили с помощью флюоресцентного микроскопа Leica (Германия), анализ изображений проводили с помощью программного обеспечения Leica. При определении площади поперечного сечения мышечных волокон (ППС MB) анализировали не менее 100 мышечных волокон, при измерении числа миоядер - не менее 200 MB. BrdU+ ядра подсчитывали во всех полях зрения.
Определение содержания рибосомальных киназ. Проба m. gastrocnemius medialis (10-15 мг) была гомогенизирована в 100 мкл буфера содержащего 50 мМ Трис-HCl (рН 8,0), 150 мМ NaCl, 0,1% ДДС-Na, 10 мМ ЭДТА, 50 мМ бета-глицерофосфат, 0,5 мМ DTT, 5 мМ ЭГТА, 10 мкг/мл апротинин, 10 мкг/мл леупептин, 1 мМ PMSF, 50 мМ NaF, 1 мМ Na3V04, 10 мкг/мл пепстатин; 0,1% Тритон Х-100. Образцы нормировались относительно уровня GAPDH, содержащегося в той же пробе. Электроперенос белков производился в буфере (25 мМ Трис pH 8,3, 192 мМ глицин, 20% метанола, 0,04% ДДС-Na) на нитроцеллюлозную мембрану. После отмывки мембраны в PBS-TWEEN наносились первичные антитела против phospho-p70S6k (Santa Cruz; 1:2000) либо phospho-p90 RSK (Abeam; 1:1000). Использовали вторичные антитела козы против иммуноглобулинов мыши (Bio-Rad США 1:50000) и против иммуноглобулинов кролика (Santa Cruz, 1:1000). Анализ белковых полос производился с помощью денситометра GS-800 (BioRad). Для каждой группы были подсчитаны М±m (средняя ± стандартная ошибка). Достоверность различий между группами определялась по непарному t - критерию Стьюдента при вероятности нулевой гипотезы р<0,05.
Результаты
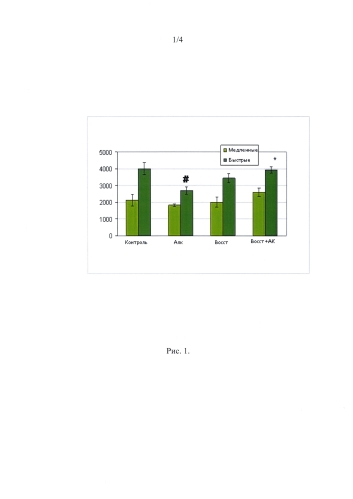
Масса животных и размеры мышечных волокон. За 16 недель потребления алкоголя животные существенно прибавили в весе. Динамика массы была одинаковой у животных, потреблявших алкоголь и сахар. После 16 недель приема алкоголя у крыс происходило достоверное уменьшение ППС быстрых волокон в m. gastrocnemius medialis на 32%. Атрофии медленных волокон вследствие приема алкоголя у крыс не наблюдалось (Рис. 1). Четыре недели восстановления не привели к существенному увеличению ППС MB II типа в группе Восст, в то же время, введение аминокислот во время восстановления (группа Восст+АК) привело к увеличению ППС MB II типа до уровня контроля (Рис. 1).
Пролиферация. Число ядер делящихся клеток (ядер с включенным BrdU) в группе Алк снижалось на 12% по сравнению с контрольной группой (Рис. 2). В то же время в группах Восст и Восст+АК число пролиферирующих ядер было увеличено на 23 и 25% по сравнению с группой Алк (р<0,05). В группе Восст + АК оно существенно превышало даже уровень контроля (р<0.05) (Рис. 2).
Миоядра. Число миоядер в группе Алк снизилось на 25% по сравнению с группой Контроль (р<0.05) (Рис. 3) и не различалось между группами Восст и Восст+АК.
Анаболические маркеры. Для анализа сигнальных механизмов, которые ведут к снижению ППС MB II типа после потребления алкоголя и восстановления ППС волокон после введения аминокислот мы исследовали содержание фосфорилированных рибосомальных киназ p-p70S6K и р-p90RSK в m. gastrocnemius medialis крыс. Akt-mTOR-S6K известен как главный путь регуляции белкового синтеза на уровне инициации трансляции. Содержание фосфорилированной p70S6k в нашем эксперименте не различалось между группами. В то же время, существует альтернативный путь регуляции белкового синтеза - через p90RSK. Как показано на рис. 4, потребление алкоголя существенно снижало уровень фосфорилированной p90RSK (на 25%, р<0.05) по сравнению с группой Контроль. Четырехнедельное восстановление не привело к повышению уровня р-p90RSK и достоверное отличие от уровня контроля сохранялось. Однако в группе Восст + АК уровень фосфорилированной p90RSK не отличался от контроля.
В настоящей работе мы исследовали действие приема аминокислот на восстановительные процессы в быстрой m. gastrocnemius medialis крыс после 16 недель потребления алкоголя. Из рациона крыс групп Восстановление и Восст+Аминокислоты был исключен алкоголь, который до этого им вводился 16 недель (методику введения алкоголя см. выше). Животные восстанавливались в течение 30 дней на обычном рационе кормления для лабораторных крыс. При этом животные группы Восст+Аминокислоты получали ВСАА в количестве 0,8 г/кг/день с питьевой водой. Состав аминокислот: смесь аминокислот с разветвленной боковой цепью состояла из L-лейцина, L-изолейцина, L-валина, Соотношение L-лейцина, L-изолейцина, L-валина в смеси равно 2:1:1 соответственно.
Мы полагали, что введение аминокислот может компенсировать ряд патологических изменений, характерных для алкоголь-индуцированной миопатии. Мы обнаружили существенное снижение ППС MB II типа в gastrocnemius Алк группы (Рис. 1), которое ранее также было показано как в модельных экспериментах на крысах, так и у пациентов с хроническим алкоголизмом [3, 23]. Снижение размеров мышечных волокон может быть связано как с изменением пула миоядер (которое может изменяться в результате апоптоза и зависеть от интенсивности слияния клеток-миосателлитов), так и со снижением фосфорилирования киназ сигнального анаболического каскада. В группе Алк мы обнаружили существенное снижение количества мышечных ядер, расположенных внутри границы дистрофинового слоя (миоядер) (Рис. 3). Аналогичное снижение количества миоядер в результате апоптоза было показано и ранее при развитии алкогольной интоксикации у крыс [24]. Мы также обнаружили тенденцию к снижению пролиферативной активности в группе Алк (Рис. 2). Аналогичное снижение пролиферативной активности при добавлении алкоголя к культуре ткани было показано ранее в эксперименте in vitro [25]. В то же время снижения фосфорилирования p70S6K в нашем эксперименте не наблюдалось. Эти результаты расходятся с данными Lang et al. [13], которые в аналогичной модели алкогольной интоксикации крыс обнаружили снижение этого показателя вместе со снижением уровня фосфорилирования и других компонентов каскада mTOR. Эти различия в результатах могли быть связаны с возможными различиями в чувствительности крыс Sprague-Dawley и Wistar к алкогольной интоксикации. Что касается уровня фосфорилирования p90RSK, то мы впервые продемонстрировали достоверное снижение этого параметра у крыс в результате хронического потребления этанола. Поэтому снижение площади поперечного сечения мышечных волокон у животных группы Алк может быть связано как с уменьшением миоядерного числа и интенсивности пролиферации клеток-предшественников, так и со снижением уровня фосфорилирования p90RSK.
В течение 30 суток после прекращения потребления алкоголя достоверного увеличения площади поперечного сечения быстрых волокон и количества миоядер по сравнению с группой Алк выявлено не было, при этом не было достоверных отличий и от контрольной группы (Рис. 1, 3). Это же касается и уровня фосфорилирования p90RSK (Рис. 4). Использование аминокислот с разветвленной боковой цепью привело к полному восстановлению площади поперечного сечения волокон в группе Восст+АК (Рис. 1). Хорошо известно, что лейцин, как наиболее часто используемый представитель семейства аминокислот с разветвленной боковой цепью, является стимулятором сигнального пути mTOR/p70S6K [15]. Но мы не обнаружили каких-либо изменений в уровне фосфорилирования p70S6K у крыс, получавших смесь аминокислот с разветвленной боковой цепью. Ранее было показано, что после однократной алкогольной интоксикации комплекс mTOR демонстрировал резистентность к действию лейцина [26]. Поэтому стимулирующее влияние аминокислотной смеси на восстановление размеров волокон быстрого типа в нашем эксперименте не может рассматриваться как следствие стимуляции mTOR.
Пролиферативные процессы у восстанавливающихся животных протекали более интенсивно по сравнению с группой Алк, и в группе Восст+АК превышали значения контрольной группы. Мы не обнаружили изменения интенсивности пролиферации в m. gastrocnemius medialis при восстановлении с введением и без введения аминокислот. Однако само по себе число ядер с включенным BrdU, отражая общие пролиферативные процессы (в основном пролиферация клеток-миосателлитов) не дает представления об интенсивности слияния миосателлитов с волокнами и пополнении пула миоядер. Из литературы известно, что в ряде случаев (при тяжелых мышечных и системных заболеваниях и при гравитационной разгрузке) мышечная атрофия сопровождается уменьшением количества миоядер на волокно при соответствующем развитии апоптотических процессов в миоядрах [27, 28]. Существует предположение, что при атрофии скелетной мышцы возрастающая скорость протеолиза и снижение синтеза белка уравновешивается потерей миоядер, апоптозом или некрозом, т.е. снижение необходимости в синтезе белка ведет к сокращению числа миоядер [29]. Ранее было показано, что промежуточный продукт метаболизма лейцина β-гидрокси-метилбутират подавляет проявления апоптоза в условиях инактивации мышц [16]. Мы предполагали, что использование аминокислот с разветвленной боковой цепью может привести к снижению интенсивности апоптотической гибели миоядер после хронической алкогольной интоксикации. Однако мы не обнаружили достоверных отличий в числе миоядер между группами с введением и без введения аминокислот.
Вывод: применение ВСАА (состав аминокислот: смесь аминокислот с разветвленной боковой цепью состояла из L-лейцина, L-изолейцина, L-валина. Соотношение L-лейцина, L-изолейцина, L-валина в смеси равно 2:1:1 соответственно) эффективно восстанавливает размеры быстрых мышечных волокон после атрофии, вызванной алкогольной интоксикацией.
Введение в виде ВСАА (состав аминокислот: смесь аминокислот с разветвленной боковой цепью состояла из L-лейцина, L-изолейцина, L-валина. Соотношение L-лейцина, L-изолейцина, L-валина в смеси равно 2:1:1 соответственно) - также полностью восстанавливает содержание фосфорилированной p90RSK и не оказывает существенного влияния на пролиферативные процессы в m. gastrocnemius и число миоядер при восстановлении после хронического потребления алкоголя.
Список цитируемой литературы
1. Preedy V.R., Adachi J., Ueno Y., и др. Alcohol-fed skeletal muscle myopathy: definitions, features, contribution of neuropathy, impact and diagnosis. // Eur J Neurol. / V. 8(6). P. 677-687. 2001.
2. Martin F., Ward K., Slavin G., и др. Alcohol-fed skeletal myopathy, a clinical and pathological study. // Q J Med./V. 55(218). P.: 233-251. 1985.
3. Estruch R, Sacanella E, Fernandez-Solà J, и др. Natural history of alcohol-fed myopathy: a 5-year study.// Alcohol Clin Exp Res./ V. 22(9): 2023-2028. 1998.
4. Lang C.H., Frost R.A., Kumar V., Vary T.C. Impaired myocardial protein synthesis induced by acute alcohol intoxication is associated with changes in eIF4F. //Am J Physiol Endocrinol Metab. - 2000. - V. 279(5). - P. 1029-1038.
5. Reilly M.E., Mantle D., Richardson P.J., и др. Studies on the time-course of ethanol's acute effects on skeletal muscle protein synthesis: comparison with acute changes in proteolytic activity. // Alcohol Clin Exp Res. / V. 21(5). P. 792-798. 1997.
6. Расу P.J., Preedy V.R., Peters T.J., Read M., Halliday D. The effect of chronic alcohol ingestion on whole body and muscle protein synthesis--a stable isotope study. // Alcohol Alcohol. / V. 26(5-6). P. 505-513. 1991.
7. Preedy V.R., Macallan D.C., Griffin G.E., и др. Total contractile protein contents and gene expression in skeletal muscle in response to chronic ethanol consumption in the rat. // Alcohol. / V. 14(6). P. 545-549. 1997.
8. Shenkman B.S., Kozlovskaya I.B., Kuznetsov S.L., и др. Plasticity of skeletal muscle fibres in space-flown primates. // J Gravit Physiol. / V. 1(1). P. 64-66. 1994.
9. Peters T.J., Martin F., Ward K. Chronic alcohol-fed skeletal myopathy - common and reversible. // Alcohol. / V. 2(3). - P. 485-489. 1985.
10. Lang C.H., Frost R.A., Deshpande N., и др. Alcohol impairs leucine-mediated phosphorylation of 4E-BP1, S6K1, eIF4G, and mTOR in skeletal muscle. // J Physiol Endocrinol Metab. / V. 285(6). P. 1205-1215. 2003.
11. Kumar V., Frost R.A., Lang C.H. Alcohol impairs insulin and IGF-I stimulation of S6K1 but not 4E-BP1 in skeletal muscle. // Am J Physiol Endocrinol Metab. / V. 283(5). P. 917-928. 2002.
12. Pruznak AM, Nystrom J, Lang CH. Direct central nervous system effect of alcohol alters synthesis and degradation of skeletal muscle protein. // Alcohol Alcohol./ V. 48(2): 138-45. 2013.
13. Lang С.H., Kimball S.R., Frost R.A., and Vary Т.C. Alcohol myopathy: impairment of protein synthesis and translation initiation. // Int. J. Biochem. Cell. Biol. / V 33, 457-473. 2001.
14. Vary T.C., Frost R.A., Lang CH. Acute alcohol intoxication increases atrogin-1 and MuRF1 mRNA without increasing proteolysis in skeletal muscle.// Am J Physiol Regul Integr Comp Physiol. / V. 294(6). P. 1777-1789. 2008.
15. Yang S. and Goldspink G. Different roles of the IGF-I Ec peptide (MGF) and mature IGF-I in myoblast proliferation and differentiation// FEBS Lett./ V. 522. 156-160. 2002.
16. Hao Y., Jackson J.R., Wang Y., и др. beta-Hydroxy-methylbutyrate reduces myonuclear apoptosis during recovery from hind limb suspension-induced muscle fiber atrophy in aged rats. // Am J Physiol Regul Integr Comp Physiol./ V. 301: R 701-715. 2011.
17. Sneddon A.A., Koll M., Wallace M.C, и др. Acute alcohol administration inhibits the refeeding response after starvation in rat skeletal muscle. // Am J Physiol Endocrinol Metab. // V. 284(5). P. 874-882. 2003.
18. Eva Blomstrand, Bengt Saltin. BCAA intake affects protein metabolism in muscle after but not during exercise in humans. American Journal of Physiology - Endocrinology and MetabolismPublished 1 August 2001 Vol. 281no. 2, E365-E374.
19. Ra SG, Miyazaki T, Ishikura K, Nagayama H, Komine S, Nakata Y, Maeda S, Matsuzaki Y, Ohmori H. Combined effect of branched-chain amino acids and taurine supplementation on delayed onset muscle soreness and muscle damage in high-intensity eccentric exercise. J Int Soc Sports Nutr. 2013 Nov 6; 10(l):51. doi: 10.1186/1550-2783-10-51.
20. Lang CH, Lynch CJ, Vary TC. Alcohol-induced IGF-I resistance is ameliorated in mice deficient for mitochondrial branched-chain aminotransferase. J Nutr. 2010 May;140(5): 932-938.
21. Evelyn B. Parr, Donny M. Camera, José L. Areta, Louise M. Burke, Stuart M. Phillips, John A. Hawley, Vernon G. Coffey. Alcohol Ingestion Impairs Maximal Post-Exercise Rates of Myofibrillar Protein Synthesis following a Single Bout of Concurrent Training. Published: February 12, 2014 DOI: 10.1371 / journal. PlosOne. 0088384.
22. Lang C.H., Frost R.A., Svanberg E., Vary T.C. IGF-I/IGFBP-3 ameliorates alterations in protein synthesis, eIF4E availability, and myostatin in alcohol-fed rats. // Am J Physiol Endocrinol Metab. / V. 286(6). - P. 916-926. 2004.
23. Preedy V.R. and Peters T.J. The effect of chronic ethanol ingestion on protein metabolism in type-I- and type-II-fire-rich skeletal muscles of the rat. // Biochem. J. / V. 254: 631-639. 1988
24. Fernandez-Sola J., Nicolas J.-M., Fatjo F., and Garcia G. Evidence of apoptosis in chronic alcoholic skeletal myopathy // Hum. Pathol. / V. 34(12): 1247-1252. 2003.
25. Garriga J, Adanero E, Fernández-Solá J. и др. Ethanol inhibits skeletal muscle cell proliferation and delays its differentiation in cell cultures // Alcohol Alcoholism / V. 35 (3): 236-241. 2000.
26. Hong-Brown LQ, Brown CR, Kazi AA, и др. Rag GTPases and AMPK/TSC2/Rheb mediate the differential regulation of mTORCl signaling in response to alcohol and leucine.// Am J Physiol Cell Physiol / V. 302: C1557-C1565. 2012.
27. Reimann J., Irintchev A., Wernig A. Regenerative capacity and the number of satellite cells in soleus muscles of normal and mdx mice. // Neuromuscul Disord. / V. 10(4-5): 276-282. 2000.
28. Smith H.K., Maxwell L.. Martyn J.A., Bass J.J. Nuclear DNA fragmentation and morphological alterations in adult rabbit skeletal muscle after short-term immobilization. // Cell Tissue Res. / V. 302(2): 235-241. 2000.
29. Teixeira C.E., Duarte J.A. Changes in cross sectional area per myonucleus on mice soleus muscle during one week of hindlimb suspension reinforce the concept of myonuclear domain. // Arch Exerc Health Dis. / V. 2(1): 76-80. 2011.
Краткое описание чертежей
Рис. 1
Площадь поперечного сечения медленных и быстрых мышечных волокон m. gastrocnemius.
∗ - отличие от группы Алк. существенно при р<0,05;
# - отличие от группы Контроль существенно при р<0,05.
Рис. 2
Количество ядер с включенным BrdU (на поперечном срезе мышечной ткани).
∗ - отличие от гр. Алк. существенно при р<0,001;
# - отличие от гр. Контроля существенно при р<0,05.
Рис. 3
Количество миоядер, приходящихся на одно волокно (на поперечном срезе мышечной ткани).
∗ - отличие от контроля существенно при р<0,05.
Рис. 4
Содержание p-90RSK в gastrocnemius muscles.
∗ - отличие от контроля существенно при р<0,05.
1. Способ восстановления скелетных мышц при их атрофии после длительной алкогольной интоксикации, характеризующийся тем, что животным вводят смесь аминокислот с разветвленной боковой цепью из L-лейцина, L-изолейцина, L-валина до восстановления структуры и размеров быстрых мышечных волокон, при этом соотношение L-лейцина, L-изолейцина, L-валина в смеси равно 2:1:1.
2. Способ по п. 1, отличающийся тем, что длительность введения смеси аминокислот с разветвленной боковой цепью составляет 30 дней.
3. Способ по п. 1, отличающийся тем, что суточная доза вводимой смеси аминокислот с разветвленной боковой цепью составляет 0,8 г/кг.