Лекарственные средства, связанные с дипептидами
Иллюстрации
Показать всеИзобретение относится к самоотщепляющемуся неферментативным способом дипептидному элементу, который может быть связан с известными лекарственными средствами через амидную связь. Дипептид спонтанно отщепляется от лекарственного средства в физиологических условиях посредством реакции, запускаемой химической нестабильностью. Соответственно дипептидный элемент обеспечивает средство связывания различных соединений с известными лекарственными средствами, где соединения в последующем высвобождаются из лекарственного средства через заданный период времени воздействия физиологических условий. Например, дипептид может быть связан с активным участком лекарственного средства для образования пролекарства и/или дипептид может содержать депо-полимер для секвенирования инъецируемой композиции, содержащей комплекс, в участке введения. 3 н. и 16 з.п. ф-лы, 4 табл., 3 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает приоритет предварительной заявки на патент США № 61/139227, поданной 19 декабря 2008 года, описание которой полностью включено в настоящее описание путем ссылки.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Часто желательно продление времени высвобождения инъецированного лекарственного средства для увеличения длительности его действия или уменьшения его токсических эффектов. Препаративные формы, которые легко растворимы в жидкостях организма, обычно быстро абсорбируются и обеспечивают внезапное увеличение количества доступного лекарственного средства, в отличие от более желательного и постепенного высвобождения фармакологически активного продукта. Кроме того, хотя многочисленные лекарственные средства на основе пептидов могут применяться в качестве высокоэффективных лекарственных средств, они обычно имеют относительно короткую длительность действия и переменный терапевтический индекс.
Предпринимались разнообразные попытки для обеспечения контролируемого и длительного высвобождения фармацевтических соединений, но ранее описанные методики не имели успеха в преодолении всех проблем, связанных с технологией, таких как достижение оптимального продленного времени высвобождения, максимизации устойчивости и эффективности, снижения токсичности, максимизации воспроизводимости при получении и устранение нежелательных физических, биохимических или токсикологических эффектов, вызываемых нежелательными матричными материалами. Соответственно, существует потребность в препаративных формах, которые продлевают период полувыведения существующих фармацевтических средств и улучшают их терапевтический индекс.
Механизмы обеспечения длительного высвобождения и увеличенного терапевтического индекса включают секвенирование молекул в участке инъекции или применение пролекарственных производных форм фармацевтического средства, где пролекарственное производное предназначено для задержки начала действия и продления периода полувыведения лекарственного средства. Отсроченное начало действия имеет преимущество в том, что оно обеспечивает возможность системного распределения пролекарства перед его активацией. Соответственно, введение пролекарств устраняет осложнения, вызванные пиковыми активностями после введения и увеличивает терапевтический индекс исходного лекарственного средства.
Распознавание рецепторов и последующая обработка агонистов пептидов и белков представляет собой первичный путь разрушения многих лекарственных средств на основе пептидов и белков. Таким образом, связывание пептидного лекарственного вещества со своим рецептором приведет к биологической стимуляции, но также будет способствовать дальнейшему снижению фармакологического эффекта, вызванного пептидом/белком, за счет ферментативной деградации пептида или белка. В соответствии с настоящим описанием, существующие фармацевтические соединения могут модифицироваться для предотвращения их взаимодействия с их соответствующим рецептором. Конкретнее, как описано в настоящей заявке, лекарственные средства могут быть модифицированы связыванием самоотщепляющимся неферментативным способом дипептида с лекарственным средством для образования комплекса, который функционирует или в качестве депо-композиции для локализации лекарственного средства в участке инъекции для высвобождения контролируемым образом, или в качестве пролекарства, которое распределяется по всему организму, но неспособно взаимодействовать со своим рецептором.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В соответствии с одним вариантом осуществления, изобретение относится к самоотщепляющемуся неферментативным способом дипептидному фрагменту, который может быть ковалентно связан с лекарственным средством, где дипептид (и любое соединение, связанное с дипептидом), высвобождается из лекарственного средства через заданный период времени после воздействия физиологических условий. Преимущественно, скорость отщепления зависит от структуры и стереохимии дипептидного элемента, а также от прочности нуклеофила, присутствующего на дипептиде, который вызывает отщепление и образование дикетопиперазина или дикетоморфолина. В одном варианте осуществления изобретение относится к комплексу, содержащему известное лекарственное средство и дипептид структуры A-B, где A представляет аминокислоту или гидроксильную кислоту и B представляет N-алкилированную аминокислоту, которая связана с лекарственным средством посредством образования амидной связи между B и амином лекарственного средства. Аминокислоты дипептида выбирают так, чтобы неферментативное химическое расщепление A-B из лекарственного средства продуцировало дикетопиперазин или дикетоморфолин и восстановленное нативное лекарственное средство.
В одном варианте осуществления изобретение относится к инъецируемой депо-композиции, содержащей комплекс, имеющий общую структуру A-B-Q, где
A представляет аминокислоту или гидроксильную кислоту;
B представляет N-алкилированную аминокислоту;
Q представляет амин, несущий лекарственное средство; где дипептид A-B, кроме того, содержит депо-полимер, связанный с боковой цепью A или B, и указанный дипептид связан с Q посредством образования амидной связи между A-B и амином Q. Депо-полимер выбран так, чтобы иметь достаточный размер, чтобы комплекс A-B-Q эффективно секвестировался в участке инъекции или был иным образом неспособен взаимодействовать с его мишенью (например, рецептором). Химическое отщепление A-B от Q ведет к продукции дикетопиперазина или дикетоморфолина и высвобождает активное лекарственное средство у пациента контролируемым образом в течение заданного периода времени после введения.
В другом варианте осуществления пролекарственные производные известных фармацевтических средств получают для продления биологического периода полувыведения пептида или белка на основании стратегии ингибирования распознавания пролекарства соответствующим рецептором. Пролекарства, раскрытые в настоящем описании, в конечном счете превращаются в структуры, которые могут распознаваться рецептором, где скорость этого химического превращения определяет время начала и длительность биологического действия in vivo. Молекулярная конструкция, раскрытая в настоящей заявке, основана на внутримолекулярной химической реакции, которая не зависит от дополнительных химических добавок или ферментов.
Пролекарственное производное получают ковалентным связыванием дипептидного элемента с активным участком лекарственного средства посредством амидной связи. В одном варианте осуществления дипептид ковалентно связан с лекарственным средством в положении, которое препятствует способности лекарственного средства взаимодействовать с соответствующим рецептором или кофактором. В одном варианте осуществления дипептидный элемент связан с N-концом биоактивного пептида. Последующее удаление дипептида в физиологических условиях и в отсутствие ферментативной активности, восстанавливает активность полипептида.
В одном варианте осуществления изобретение относится к пролекарству, имеющему общую структуру A-B-Q. В данном варианте осуществления, Q представляет лекарственное средство, включая, например, биоактивный пептид. В одном варианте осуществления, Q выбран из группы ядерных гормонов, состоящих из тиреоидного гормона, эстрогена, тестостерона и глюкокортикоида, а также их аналогов, производных и конъюгатов, и A-B представляет дипептидное пролекарство, связанное с Q посредством амидной связи. Конкретнее, в одном варианте осуществления, A представляет аминокислоту или гидроксильную кислоту, и B представляет N-алкилированную аминислоту, связанную с Q посредством образования амидной связи между A-B и амином Q. В соответствии с одним вариантом осуществления, полупериод (t1/2) химического отщепления A-B от Q составляет по меньшей мере от примерно 1 часа до примерно 1 недели в PBS (солевом растворе с фосфатным буфером) в физиологических условиях. Кроме того, в одном варианте осуществления, Q содержит аминокислотную последовательность, и A, B или аминокислота Q, к которой присоединен A-B, представляет некодируемую аминокислоту, и химическое отщепление A-B от Q имеет полноту по меньшей мере примерно 90% в пределах от примерно 1 до примерно 720 часов в PBS в физиологических условиях.
В одном варианте осуществления, A и B выбраны для ингибирования ферментативного отщепления дипептида A-B от Q ферментами, обнаруживаемыми в сыворотке млекопитающих. В одном варианте осуществления, A и/или B выбраны так, чтобы полупериод отщепления A-B от Q в PBS в физиологических условиях составлял не более чем вдвое больше полупериода отщепления A-B от Q в растворе, содержащем протеазу DPP-IV (т.е. отщепление A-B от Q не происходит со скоростью более чем вдвое выше, в присутствии протеазы DPP-IV и физиологических условий относительно идентичных условий в отсутствие фермента). В одном варианте осуществления, A и/или B представляет аминокислоту в D-стереоизомерной конфигурации. В некоторых иллюстративных вариантах осуществления, A представляет аминокислоту в D-стереоизомерной конфигурации, и B представляет аминокислоту в L-стереоизомерной конфигурации. В некоторых иллюстративных вариантах осуществления, A представляет аминокислоту в L-стереоизомерной конфигурации, и B представляет аминокислоту в D-стереоизомерной конфигурации. В некоторых иллюстративных вариантах осуществления, A представляет аминокислоту в D-стереоизомерной конфигурации, и B представляет аминокислоту в D-стереоизомерной конфигурации.
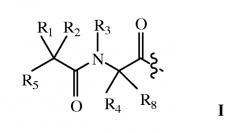
В одном варианте осуществления дипептидный элемент, связанный с лекарственным средством, содержит соединение, имеющее общую структуру формулы I:
где
R1, R2, R4 и R8 независимо выбраны из группы, состоящей из H, C1-C18 алкила, C2-C18 алкенила, (C1-C18 алкил)OH, (C1-C18 алкил)SH, (C2-C3 алкил)SCH3, (C1-C4 алкил)CONH2, (C1-C4 алкил)COOH, (C1-C4 алкил)NH2, (C1-C4 алкил)NHC(NH2 +)NH2, (C0-C4 алкил)(C3-C6 циклоалкила), (C0-C4 алкил)(C2-C5 гетероцикла), (C0-C4 алкил)(C6-C10 арил)R7, (C1-C4 алкил)(C3-C9 гетероарила) и C1-C12 алкил(W1)C1-C12 алкила, где W1 представляет гетероатом, выбранный из группы, состоящей из N, S и O, или R1 и R2 вместе с атомами, к которым они присоединены, образуют C3-C12 циклоалкил или арил; или R4 и R8 вместе с атомами, к которым они присоединены, образуют C3-C6 циклоалкил;
R3 выбран из группы, состоящей из C1-C18 алкила, (C1-C18 алкил)OH, (C1-C18 алкил)NH2, (C1-C18 алкил)SH, (C0-C4 алкил)(C3-C6)циклоалкила, (C0-C4 алкил)(C2-C5 гетероцикла), (C0-C4 алкил)(C6-C10 арил)R7 и (C1-C4 алкил)(C3-C9 гетероарила), или R4 и R3 вместе с атомами, к которым они присоединены, образуют 4, 5 или 6-членное гетероциклическое кольцо;
R5 представляет NHR6 или OH;
R6 представляет H, C1-C8 алкил, или R6 и R2 вместе с атомами, к которым они присоединены, образуют 4, 5 или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из H и OH.
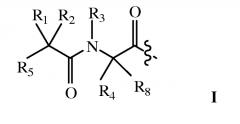
В другом варианте осуществления дипептидный элемент, связанный с лекарственным средством, содержит соединение, имеющее общую структуру формулы I:
где
R1, R2, R4 и R8 независимо выбраны из группы, состоящей из H, C1-C18 алкила, C2-C18 алкенила, (C1-C18 алкил)OH, (C1-C18 алкил)SH, (C2-C3 алкил)SCH3, (C1-C4 алкил)CONH2, (C1-C4 алкил)COOH, (C1-C4 алкил)NH2, (C1-C4 алкил)NHC(NH2 +)NH2, (C0-C4 алкил)(C3-C6 циклоалкила), (C0-C4 алкил)(C2-C5 гетероцикла), (C0-C4 алкил)(C6-C10 арил)R7, (C1-C4 алкил)(C3-C9 гетероарила) и C1-C12 алкил(W1)C1-C12 алкила, где W1 представляет гетероатом, выбранный из группы, состоящей из N, S и O, или R1 и R2 вместе с атомами, к которым они присоединены, образуют C3-C12 циклоалкил; или R4 и R8 вместе с атомами, к которым они присоединены, образуют C3-C6 циклоалкил;
R3 выбран из группы, состоящей из C1-C18 алкила, (C1-C18 алкил)OH, (C1-C18 алкил)NH2, (C1-C18 алкил)SH, (C0-C4 алкил)(C3-C6)циклоалкила, (C0-C4 алкил)(C2-C5 гетероцикла), (C0-C4 алкил)(C6-C10 арил)R7 и (C1-C4 алкил)(C3-C9 гетероарила), или R4 и R3 вместе с атомами, к котором они присоединены, образуют 4, 5 или 6-членное гетероциклическое кольцо;
R5 представляет NHR6 или OH;
R6 представляет H, C1-C8 алкил, или R6 и R1 вместе с атомами, к которым они присоединены, образуют 4-, 5- или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из водорода, C1-C18 алкила, C2-C1S алкенила, (C0-C4 алкил)CONH2, (C0-C4 алкил)COOH, (C0-C4 алкил)NH2, (C0-C4 аклкил)OH и галогена.
ПОДРОБНОЕ ОПИСАНИЕ
Определения
При описании и составлении формулы изобретения будет использоваться следующая терминология в соответствии с изложенными ниже определениями.
Используемый в настоящем описании термин «примерно» означает больше или меньше чем указанная величина или диапазон величин, на 10%, но предназначен для ограничения любой величины или диапазона величин только этому более широкому определению. Каждая величина или диапазон величин, которым предшествует термин «примерно», также предназначен для включения варианта осуществления указанной абсолютной величины или диапазона величин.
Используемый в настоящем описании термин «аминокислота» охватывает любую молекулу, содержащую и амино, и карбоксильную функциональные группы, где амино- и карбоксилатная группы присоединены к одному и тому же атому углерода (альфа-углероду). Возможно наличие одного или двух других органических заместителей альфа-углерода. Аминокислота может быть обозначена ее трехбуквенным кодом, однобуквенным кодом или в некоторых случаях названием ее боковой цепи. Например, неприродная аминокислота, содержащая группу циклогексана, присоединенную к альфа-углероду, называется «циклогексан» или «циклогексил». В целях настоящего описания обозначение аминокислоты без определения ее стереохимии предназначено для включения или L-, или D-формы аминокислоты или рацемической смеси. Однако в случае, когда аминокислота обозначена ее трехбуквенным кодом и включает надстрочное число (т.е. Lys-1), такое обозначение предназначено для определения нативной L-формы аминокислоты, тогда как D-форма определяется включением строчной буквы d перед трехбуквенным кодом и надстрочным числом (т.е. dLys-1).
Используемый в настоящем описании термин «гидроксильная кислота» относится к аминокислотам, которые были модифицированы для замещения аминогруппы альфа-углерода гидроксильной группой.
Используемый в настоящем описании термин «некодируемая аминокислота» охватывает любую аминокислоту, которая не является L-изомером любой из следующих 20 аминокислот: Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp, Tyr.
«Дипептид» представляет собой результат связывания альфа-аминокислоты или альфа-гидроксильной кислоты с другой аминокислотой посредством пептидной связи.
Используемый в настоящем описании термин «химическое расщепление» без какого-либо дополнительного обозначения охватывает неферментативную реакцию, которая приводит к разрушению ковалентной химической связи.
«Биоактивный пептид» относится к пептидам, которые способны оказывать биологический эффект in vitro и/или in vivo. Используемая в настоящем описании общая ссылка на пептид предназначена для охвата пептидов, которые имеют модифицированные амино- или карбоксиконцы. Например, аминокислотная последовательность, обозначающая стандартные аминокислоты, предназначена для включения стандартных аминокислот на N- и C-конце, а также соответствующей гидроксильной кислоты на N-конце и/или соответствующей C-концевой аминокислоты, модифицированной для включения амидной группы вместо концевой карбоновой кислоты.
Используемый в настоящем описании термин «ацилированная» аминокислота представляет аминокислоту, содержащую ацильную группу, которая не является нативной для естественно встречающейся аминокислоты, независимо от того, каким средством она получена. Иллюстративные способы получения ацилированных аминокислот и ацилировваных пептидов известны в данной области и включают ацилирование аминокислоты перед включением в пептид или пептидным синтезом с последующим химическим ацилированием пептида. В некоторых вариантах осуществления ацильная группа вызывает наличие у пептида одного или более из (i) длительного периода полувыведения из циркулирующей крови, (ii) отсроченного начала действия, (iii) увеличенной длительности действия, (iv) повышенной устойчивости к протеазам, таким как DPP-IV, и (v) увеличенной активности в отношении пептидного рецептора лекарственного средства.
Используемый в настоящем описании термин «алкилированная» аминокислота представляет аминокислоту, содержащую алкильную группу, которая является ненативной для естественно встречающейся аминокислоты, независимо от средства, которым она получена. Иллюстративные способы получения алкилированных аминокислот и алкилированных пептидов известны в данной области и включают алкилирование аминокислоты перед включением в пептид или пептидным синтезом с последующим химическим алкилированием пептида. Без привязанности к какой-либо определенной теории считается, что алкилирование пептидов достигает аналогичных, если не таких же, эффектов, как ацилирование пептидов, например, длительного периода полувыведения из циркулирующей крови, отсроченного начала действия, увеличенной длительности действия, повышенной устойчивости к протеазам, таким как DPP-IV, и увеличенной активности в отношении пептидного рецептора лекарственного средства.
Используемый в настоящем описании термин «пролекарство» определяется как любое соединение, которое подвергается химической модификации, перед проявлением его фармакологических эффектов.
Используемый в настоящем описании термин «лекарственное средство» относится к биоактивному веществу или веществам, которые опосредуют свой эффект через взаимодействие с рецептором, и в целях настоящего описания лекарственные средства определяются как соединения, относящиеся к одному из четырех классов:
1. ядерные гормоны и их производные;
2. неглюкагоновые и неинсулиновые гормоны и производные на основе пептидов;
3. белки в пределах класса 4-спиральных пучковых белков, включая, например, гормон роста, лептин, эритропоэтин, колониестимулирующие факторы (такие как GCSF (гранулоцитарный колониестимулирующий фактор)) и интерфероны; и
4. факторы свертывания крови, включая, например, тканевые активаторы плазминогена (TPA), фактор VII, фактор VIII и фактор IX.
Используемый в настоящем описании термин «ядерный гормон» представляет соединение, которое при связывании с его соответствующим рецептором непосредственно взаимодействует с геномной ДНК и регулирует ее экспрессию. Примеры ядерных гормонов включают тиреоидный гормон, глюкокортикоиды, эстрогены, андрогены, витамин A и витамин D.
Используемый в настоящем описании термин «рецептор» представляет молекулу, которая распознает и связывается с определенными молекулами с высоким сродством взаимодействия, оказывая некоторый эффект (или непосредственно, или косвенно) в клетке или на клетки и/или ткани организма хозяина. «Клеточный рецептор» представляет собой молекулу на клетке или внутри нее, которая распознает и связывается с определенными молекулами, оказывающими некоторый эффект (или непосредственно, или косвенно) в клетке.
Используемый в настоящем описании термин «неглюкагоновый и неинсулиновый гормон на основе пептида» представляет гормон, который содержит пептидную последовательность, но определенно исключает инсулин, производные и аналоги инсулина, которые специфически связываются с инсулиновым рецептором, инсулиноподобные факторы роста (IGF) и пептиды суперсемейства глюкагона.
Используемый в настоящем описании термин «идентичность» относится к сходству между двумя или более последовательностями. Идентичность измеряется делением числа идентичных остатков на общее число остатков и умножением произведения на 100 для получения процентной доли. Таким образом, две копии точно одинаковой последовательности имеют идентичность 100%, тогда как две последовательности, которые имеют делеции, добавления или замещения аминокислот относительно друг друга, имеют более низкую степень идентичности. Специалистам в данной области понятно, что несколько компьютерных программ, таких как программы, в которых используются алгоритмы, такие как BLAST (Инструмент исследования основного локального совмещения, Basic Local Alignment Search Tool, Altschul et al. (1993) J. Mol. Biol. 215:403-410), доступны для определения идентичности последовательностей.
Термин «связанный с глюкагоном пептид» относится к тем пептидам, которые имют биологическую активность (в качестве агонистов или антагонистов) в отношении любого одного или более глюкагоновых рецепторов GLP-1, GLP-2 и GIP, и содержат аминокислотную последовательность, разделяющую идентичность последовательности по меньшей мере 40% (например, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%) по меньшей мере с одним из нативного глюкагона (SEQ ID NO: 1), нативного оксинтомодулина (SEQ ID NO: 51), нативного эксендина-4 (SEQ ID NO: 54), нативного GLP-1 (SEQ ID NO: 50), нативного GLP-2 (SEQ ID NO: 53) или нативного GIP (SEQ ID NO: 52).
Термин «суперсемейство глюкагона» относится к группе пептидов, связанных по структуре в их N-концевых и C-концевых областях (см., например, Sherwood et al., Endocrine Reviews 21: 619-670 (2000)). Члены этой группы включают все связанные с глюкагоном пептиды, а также гормон, высвобождающий гормон роста (GHRH; SEQ ID NO: 8), вазоактивный кишечный пептид (VIP; SEQ ID NO: 55), полипептид 27, активирующий гипофизарную аденилат-циклазу (PACAP-27; SEQ ID NO: 56), пептид гистидин изолейцин (PHI), пептид гистидин метионин (PHM; SEQ ID NO: 57) и секретин (SEQ ID NO: 58), и аналоги, производные или конъюгаты с количеством аминокислотных модификаций, достигающих 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 относительно нативного пептида.
Используемый в настоящем описании термин «фармацевтически приемлемый носитель» включает любой из стандартных фармацевтических носителей, такой как солевой раствор с фосфатным буфером, вода, эмульсии, такие как эмульсия масла в воде или воды в масле, и различные типы смачивающих агентов. Термин также включает любой из агентов, утвержденных уполномоченным агентством Федерального правительства США или перечисленных в Фармакопее США для использования у животных, включая людей.
Используемый в настоящем описании термин «солевой раствор с фосфатным буфером» или «PBS» относится к водному раствору, содержащему хлорид натрия и фосфат натрия. Специалистам в данной области известны различные готовые формы PBS, но в целях настоящего изобретения фраза «стандартный PBS» относится к раствору, имеющему конечную концентрацию 137 мМ NaCl, 10 мМ фосфата, 2,7 мМ KCl и pH 7,2-7,4.
Используемый в настоящем описании термин «фармацевтически приемлемая соль» относится к солям соединений, которые сохраняют биологическую активность настоящего соединения и которые не являются нежелательными биологически или в иных аспектах. Многие из соединений, описанных в настоящей зявке, способны образовывать соли кислот и/или оснований ввиду присутствия амино- и/или карбоксильных групп или групп, подобных им.
Фармакологически приемлемые основно-аддитивные соли могут быть получены из неорганических и органических оснований. Соли, происходящие из неорганических оснований, включают только в качестве примера соли натрия, калия, лития, аммония, кальция и магния. Соли, происходящие из органических оснований, включают без ограничения соли первичных, вторичных и третичных аминов.
Фармацевтически приемлемые кислотно-аддитивные соли могут быть получены из неорганических и органических кислот. Соли, происходящие из неорганических кислот, включают хлористоводородную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и тому подобные. Соли, происходящие из органических кислот, включают уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, яблочную кислоту, малоновую кислоту, янтарную кислоту, малеиновую кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, п-толуолсульфоновую кислоту, салициловую кислоту и тому подобные.
Используемый в настоящем описании термин «лечение» включает профилактику определенного расстройства или состояния, или облегчения симптомов, связанных с определенным расстройством или состоянием, и/или предотвращение или устранение указанных симптомов.
Используемый в настоящем описании термин «эффективное» количество или «терапевтически эффективное количество» лекарственного средства относится к нетоксичному, но достаточному количеству лекарственного средства для обеспечения желательного эффекта. Количество, которое является «эффективным», варьируется от индивида к индивиду, в зависимости от возраста и общего состояния индивидуума, типа введения и тому подобного. Таким образом, не всегда возможно определение точного «эффективного количества». Однако соответствующее «эффективное» количество в любом отдельном случае может определить средний специалист в данной области, используя обычное экспериментирование.
Термин «парентеральное» означает не через пищеварительный тракт, но каким-либо другим путем, таким как подкожный, внутримышечный, интраспинальный или внутривенный.
Используемый в настоящем описании термин аминокислотная «модификация» относится к замещению, добавлению или делеции аминокислоты и включает замещение или добавление любой из 20 аминокислот, обычно обнаруживаемых в человеческих белках, а также атипичных или не встречающихся в естественных условиях аминокислот. Коммерческие источники атипичных аминокислот включают Sigma-Aldrich (Milwaukee, WI), ChemPep Inc. (Miami, FL) и Genzyme Pharmaceuticals (Cambridge, MA). Атипичные аминокислоты можно закупить у коммерческих поставщиков, синтезировать вновь или химически модифицировать или дериватизировать из естественно встречающихся аминокислот. Модификации аминокислот включают связывание аминокислоты с конъюгатной частью, такой как гидрофильный полимер, ацилирование, алкилирование и/или другую химическую дериватизацию аминокислоты.
Используемый в настоящем описании термин аминокислотное «замещение» относится к замещению одного аминокислотного остатка другим аминокислотным остатком.
Используемый в настоящем описании термин «консервативное аминокислотное замещение» определяется в настоящем описании как обмен в пределах следующих пяти групп:
I. Небольшие алифатические, неполярные или слегка полярные остатки:
Ala, Ser, Thr, Pro, Gly;
II. Полярные, отрицательно заряженные остатки и их амиды:
Asp, Asn, Glu, Gln;
III. Полярные, положительно заряженные остатки:
His, Arg, Lys; орнитин (Orn);
IV. Объемные, алифатические, неполярные остатки:
Met, Leu, Ile, Val, Cys, Норлейцин (Nle), гомоцистеин
V. Объемные, ароматические остатки:
Phe, Tyr, Trp, ацетил фенилаланин
Используемый в настоящем описании общий термин «полиэтиленгликолевая цепь» или «PEG цепь» относится к смесям конденсационных полимеров этиленоксида и воды в разветвленной или прямой цепи, представленные общей формулы H(OCH2CH2)kOH, где k равно по меньшей мере 9. При отсутствии любой другой характеристики этот термин предназначен для включения полимеров этиленгликоля со средней общей молекулярной массой, выбранной из диапазона от 500 до 60000 дальтон. «Полиэтиленгликолевая цепь» или «PEG цепь» используется в комбинации с числовым суффиксом для указания их приблизительной средней молекулярной массы. Например, PEG-5000 (5k PEG) относится к полиэтиленгликолевой цепи, имеющей общую средневзвешенную молекулярную массу примерно 5000 дальтон.
Используемый в настоящем описании термин «пэгилированный» и тому подобные термины относится к соединению, которое было модифицировано из его нативного состояния связыванием полиэтиленгликолевой цепи с соединением. «Пэгилированный полипептид» представляет собой полипептид, который имеет PEG цепь, ковалентно связанную с полипептидом.
Используемый в настоящем описании термин «линкер» представляет собой связь, молекулу или группу молекул, которая связывает два отдельных структурных элемента друг с другом. Линкеры могут обеспечить оптимальный спейсинг двух структурных элементов или может, кроме того, обеспечить лабильную связь, которая обеспечивает возможность отделения структурных элементов друг от друга. Лабильные связи включают отщепляемые светом группы, кислотно-лабильные части, основно-лабильные части и отщепляемые ферментами группы.
Используемый в настоящем описании термин «димер» представляет комплекс, содержащий две субъединицы, ковалентно связанные друг с другом через линкер. Термин «димер», используемый в отсутствие какого-либо квалифицирующего текста, включает и гомодимеры, и гетеродимеры. Гомодимер содержит две идентичные субъединицы, тогда как гетеродимер содержит две субъединицы, которые отличаются, хотя две субъединицы по-существу аналогичны друг другу.
Используемый в настоящем описании термин «C1-Cn алкил», где n может равняться от 1 до 6, представляет разветвленную или линейную алкильную группу, имеющую от одного до определенного числа атомов углерода. Типичные C1-C6 алкильные группы включают без ограничения метил, этил, н-пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил и тому подобные.
Используемый в настоящем описании термин «C1-Cn алкенил», где n может равняться от 2 до 6, представляет олефинно ненасыщенную разветвленную или линейную группу, имеющую от 2 до определенного числа атомов углерода и, по меньшей мер, одну двойную связь. Примеры таких групп включают без ограничения 1-пропенил, 2-пропенил (-CH2-CH=CH2), 1,3-бутадиенил (-CH=CHCH=CH2), 1-бутенил (-CH=CHCH2CH3), гексенил, пентенил и тому подобные.
Термин «C1-Cn алкинил», где n может равняться от 2 до 6, относится к ненасыщенной разветвленной или линейной группе, имеющей от 2 до n атомов углерода и по меньшей мере одну тройную связь. Примеры таких групп включают без ограничения 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 1-пентинил и тому подобные.
Используемый в настоящем описании термин «арил» относится к моно- или бициклической карбоциклической кольцевой системе, имеющей одно или два ароматических кольца, включая без ограничения фенил, нафтил, тетрагидронафтил, инданил, инденил и тому подобные. Размер арильного кольца и присутствие заместителей или связывающих групп указаны обозначением числа присутствующих атомов углерода. Например, термин «(C1-C3 алкил)(C6-C10 арил)» относится к 6-10-членному арилу, который присоединен к материнской части через одно-трехчленную алкильную цепь.
Используемый в настоящем описании термин «гетероарил» относится к моно- или би-циклической кольцевой системе, содержащей одно или более ароматических колец, и содержащей по меньшей мере один атом азота, кислорода или серы в ароматическом кольце. Размер гетероарильного кольца и присутствие заместителей или связывающих групп указаны обозначением числа присутствующих атомов углерода. Например, термин «(C1-Cn алкил)(C5-C6 гетероарил)» относится к 5- или 6-членному гетероарилу, который присоединен к материнской части через одно-«n»-членную алкильную цепь.
Используемый в настоящем описании термин «галоген» относится к одному или более членам группы, состоящей из фтора, хлора, брома и йода.
Используемый в настоящем описании термин «заряженная аминокислота» относится к аминокислоте, которая содержит боковую цепь, которая отрицательно заряжена (т.е. депротонирована) или положительно заряжена (т.е. протонирована) в водном растворе при физиологическом pH. Например, отрицательно заряженные аминокислоты включают аспарагиновую кислоту, глутаминовую кислоту, цистеиновую кислоту, гомоцистеиновую кислоту и гомоглутаминовую кислоту, тогда как положительно заряженные аминокислоты включают аргинин, лизин и гистидин. Заряженные аминокислоты включают заряженные аминокислоты среди 20 аминокислот, обычно обнаруживаемых в человеческих белках, а также атипичные или не встречающиеся в естественных условиях аминокислоты.
Используемый в настоящем описании термин «кислотная аминокислота» относится к аминокислоте, которая содержит вторую кислотную часть (т.е. отличную от α-карбоксильной группы, которую имеют все аминокислоты), включая, например, группу карбоновой кислоты или сульфоновой кислоты.
Используемый в настоящем описании термин «пациент» без дополнительного обозначения предназначен для включения любого теплокровного позвоночного одомашненного животного (включая, например, без ограничения, скот, лошадей, кошек, собак и других домашних животных) и людей.
Варианты осуществления изобретения
В соответствии с одним вариантом осуществления изобретение относится к способу увеличения длительности действия введенного лекарственного средства и улучшения его терапевтического индекса Способ включает связывание дипептидного элемента с лекарственным средством посредством амидной связи для получения комплекса дипептид/лекарственное средство, который секвестируется в точке его введения, или является биологически неактивным. В соответствии с одним вариантом осуществления, два или более дипептидных элементов связываются через амидную связь с лекарственным средством. В физиологических условиях дипептид отщепляется посредством механизма неферментативного разрушения, таким образом, высвобождается активное лекарственное средство для взаимодействия с его мишенью. Преимущественно, скорость расщепления зависит от структуры и стереохимии дипептидного элемента, а также от прочности присутствующего на дипептиде нуклеофила, который вызывает расщепление и образование дикетопиперазина или дикетоморфолина. В одном варианте осуществления, на основании выбранной структуры дипептида, полупериод неферментативного расщепления (t1/2) комплекса дипептид/лекарственное средство можно выбрать так, чтобы он в физиологических условиях составлял от 1 до 720 ч. Предполагается, что физиологические условия, как описано в настоящей заявке, включают температуру примерно от 35 до 40°C и pH от примерно 7,0 до примерно 7,4, и обычнее, включают pH от 7,2 до 7,4 и температуру от 36 до 38°C. Поскольку физиологический pH и температура жестко регулируются в строго определенном диапазоне, то скорость превращения из комплекса дипептид/лекарственное средство в лекарственное средство проявляет высокую воспроизводимость у одного пациента и у разных пациентов.
В соответствии с одним вариантом осуществления, дипептидный элемент ковалентно связан с лекарственным средством посредством амидной связи в активном сайте лекарственного средства для образования пролекарственного производного лекарственного средства. Обычно пролекарство проявляет не более 10% активности материнского лекарственного средства, в одном варианте осуществлениия пролекарство проявляет менее 10% активности материнского лекарственно