Новые конъюгаты аналогов сс-1065 и бифункциональные линкеры
Иллюстрации
Показать всеИзобретение относится к области органической химии, а именно к конъюгату формулы (III) или к его фармацевтически приемлемой соли, где группу V2 выбирают из антитела против CD19, антитела против CD22, антитела против CD30, антитела против CD33, антитела против CD56, антитела против CD70, антитела против CD74, антитела против CD138, антитела против CLL-1, антитела против 5Т4, антитела против CD303, антитела против Tag 72, антитела против углевода, подобного Lewis А, антитела против EphB3, антитела против HMW-MAA, антитела против CD38, антитела против Cripto, антитела против EphA2, антитела против GPNMB, антитела против интегрина, антитела против MN, антитела против Her2 и антитела против PSMA или из эпитопсвязывающего фрагмента; каждый L2 независимо представляет собой линкерную группу: ; каждый L выбирают из структур, указанных в п.1; каждый V1 выбирают из валилцитруллина, валиллизина, фенилаланиллизина, аланилфенилаланиллизина и D-аланилфенилаланиллизина; каждый Y представляет собой самоэлиминирующуюся спейсерную систему, которая состоит из 1 или нескольких самоудаляемых спейсеров и связана с V1, необязательно L и Z; p равен 1, z равен q; q составляет от 1 до 4; z равен положительному целому числу, равному или меньшему, чем общее число мест присоединения для Z; каждый Z представляет собой независимо соединение, выбранное из группы, состоящей из структур, указанных в п.1; каждый Z соединен с Y посредством ОН-группы через спейсер ω-аминоаминокарбонильной циклизации, являющийся частью Y; где спейсер Y представляет собой , и где спейсер ω-аминоаминокарбонильной циклизации А выбран из структур, указанных в п.1. Также изобретение относится к промежуточному соединению формулы (IV), применению конъюгата формулы (III). Технический результат: получен конъюгат ДНК-алкилирующего агента и системы бифункциональных линкеров, обладающий противоопухолевой активностью. 3 н. и 9 з.п. ф-лы, 7 ил., 16 пр.
,
Реферат
Область техники, к которой относится изобретение
Изобретение относится к новым аналогам ДНК-алкилирующего агента СС-1065 и к их конъюгатам. Кроме того, данное изобретение относится к промежуточным соединениям для получения указанных агентов и конъюгатов. Конъюгаты создают для высвобождения их (множественной) полезной нагрузки после одной или нескольких стадий активации и/или со скоростью и промежутком времени, регулируемыми конъюгатом, для того, чтобы селективно доставлять и/или регулируемо высвобождать один или несколько указанных ДНК-алкилирующих агентов. Агенты, конъюгаты и промежуточные соединения можно использовать для лечения заболевания, которое характеризуется нежелательной пролиферацией (клеток). Как пример, агенты и конъюгаты по данному изобретению можно использовать для лечения опухоли.
Предпосылки создания изобретения
Дуокармицины, впервые выделенные из культуральной жидкости вида Streptomyces, являются членами семейства противоопухолевых антибиотиков, которые также включают СС-1065. Такие в высшей степени сильные средства, как утверждают, получают свою биологическую активность из способности селективно в отношении последовательности алкилировать ДНК в N3 аденина в малой бороздке, что инициирует каскад событий, который обрывается в механизме гибели апоптозной клетки1.
Хотя СС-1065 показывает весьма сильную цитотоксичность, его нельзя использовать в клинике из-за тяжелой поздней гепатотоксичности2. Такое наблюдение привело к разработке синтетических аналогов СС-1065 (о производных СС-1065 см., например,
которые обычно показывают, что имеют подобную цитотоксичность, но пониженную гепатотоксичность. Однако у таких производных еще отсутствует достаточная селективность в отношении опухолевых клеток, так как селективность таких агентов - и цитотоксических агентов вообще - до некоторой степени основана на различии в скорости пролиферации опухолевых клеток и здоровых клеток, и поэтому они также воздействуют на здоровые клетки, которые показывают относительно высокую скорость пролиферации. Это обычно ведет к тяжелым побочным действиям. Концентраций лекарственных средств, которые могли бы полностью уничтожить опухоль, обычно нельзя достичь из-за ограничивающих дозу побочных действий, таких как токсичность для желудочно-кишечного тракта и костного мозга. Кроме того, у опухолей после продолжительного лечения может развиваться резистентность против противораковых средств. Поэтому при разработке современных лекарственных средств нацеливание цитотоксических средств на область опухоли может рассматриваться как одна из важнейших задач.
Одним из многообещающих подходов к получению повышенной селективности в отношении опухолевых клеток или опухолевой ткани является использование существования ассоциированных с опухолью антигенов, рецепторов и других соответствующих частиц, которые могут служить в качестве мишени. Такая мишень может, относительно других тканей, быть положительно отрегулирована или до некоторой степени специфически присутствовать в опухолевой ткани или в тесно ассоциированной ткани, такой как неоваскулярная ткань, для того, чтобы достичь эффективного нацеливания. Многие мишени идентифицированы и подтверждены, и разработаны некоторые методы идентификации и подтверждения мишеней3. Путем сочетания лиганда, например, антитела или фрагмента антитела, для такого опухоль-ассоциированного антигена, рецептора или другой соответствующей части с терапевтическим средством такое средство можно селективно нацелить на опухолевую ткань.
Другим многообещающим подходом к получению селективности в отношении опухолевых клеток или опухолевой ткани является использование существования ассоциированных с опухолью ферментов. Фермент, который локализован в основном в области опухоли, может превратить фармакологически неактивное пролекарство, которое состоит из субстрата для фермента, прямо или косвенно связанного с токсичным лекарственным средством, в соответствующее лекарственное средство вблизи или внутри опухоли. Через такую концепцию высокую концентрацию токсичного противоракового средства можно создать в области опухоли. Все опухолевые клетки могут быть уничтожены, если доза является достаточно высокой, что может снизить развитие опухолевых клеток, резистентных к лекарственному средству.
Ферменты также могут быть перенесены в непосредственную близость или в сами клетки-мишени или ткань-мишень через посредство, например, антителонаправленной ферментативной пролекарственной терапии (ADEPT)4, полимернаправленной ферментативной пролекарственной терапии (PDEPT) или макромолекулярнонаправленной ферментативной пролекарственной терапии (MDEPT)5, вируснаправленной ферментативной пролекарственной терапии (VDEPT)6 или геннаправленной ферментативной пролекарственной терапии (GDEPT)7. С помощью ADEPT, например, нетоксичное пролекарство селективно превращается в цитотоксическое соединение на поверхности клеток-мишеней конъюгатом антитело-фермент, который предварительно нацелен на поверхность таких клеток.
Еще одним многообещающим подходом к получению селективности в отношении опухолевых клеток или опухолевой ткани является использование эффекта усиленной проницаемости и удерживания (EPR). Благодаря такому эффекту EPR макромолекулы пассивно накапливаются в солидных опухолях как следствие нарушенной патологии развития сосудистой системы опухоли с ее перемежающимся эндотелием, что ведет к гиперпроницаемости для больших макромолекул и утрате эффективного лимфатического дренирования опухоли8. Путем прямого или косвенного сочетания терапевтического средства с макромолекулой указанное средство можно селективно нацелить на опухолевую ткань.
Помимо эффективного нацеливания к другим важным критериям успешного применения таргетных конъюгатов цитотоксических средств в терапии опухолей относится то, что одно или несколько средств эффективно высвобождаются из конъюгата в области опухоли и что конъюгат является нетоксичным или только очень слаботоксичным, в то время как само цитотоксическое средство проявляет весьма сильную цитотоксичность. В идеале это ведет к образованию цитотоксических молекул только в области опухоли, что приводит к существенно повышенному терапевтическому индексу относительно ненаправленного цитотоксического средства. Другим важным критерием для удачного таргетного конъюгата является то, что конъюгат должен иметь подходящие фармакологические свойства, такие как достаточная устойчивость в кровотоке, низкая склонность к агрегации и хорошая растворимость в воде. Соответствующие водорастворимость и гидрофильность лекарственного средства и/или линкера могут вносить вклад в улучшенные фармакологические свойства.
Некоторые конъюгаты СС-1065 и производные описаны (см. в отношении производных конъюгатов СС-1065, например,
В таких конъюгатах одно или несколько благоприятных свойств, описанных выше, могут быть неоптимальными.
Соответственно, еще сохраняется отчетливая потребность в конъюгатах производных СС-1065, которые показывают большое терапевтическое окно, содержат производные СС-1065, которые имеют сильную цитотоксичность и благоприятные фармакологические свойства и эффективно высвобождают производные СС-1065.
Сущность изобретения
Настоящее изобретение удовлетворяет указанной выше потребности с помощью соединения формулы (I) или (II)
или его фармацевтически приемлемой соли, гидрата или сольвата, при этом
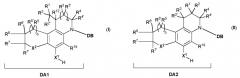
DB представляет собой ДНК-связывающую часть и выбран из группы, состоящей из
R1 представляет собой удаляемую группу;
R2, R2', R3, R3', R4, R4', R12 и R19 выбирают независимо из H, OH, SH, NH2, N3, NO2, NO, CF3, CN, C(O)NH2, C(O)H, C(O)OH, галогена, Ra, SRa, S(O)Ra, S(O)2Ra, S(O)ORa, S(O)2ORa, OS(O)Ra, OS(O)2Ra, OS(O)ORa, OS(O)2ORa, ORa, NHRa, N(Ra)Rb, +N(Ra)(Rb)Rc, P(O)(ORa)(ORb), OP(O)(ORa)(ORb), SiRaRbRc, C(O)Ra, C(O)ORa, C(O)N(Ra)Rb, OC(O)Ra, OC(O)ORa, OC(O)N(Ra)Rb, N(Ra)C(O)Rb, N(Ra)C(O)ORb и N(Ra)C(O)N(Rb)Rc, при этом
Ra, Rb и Rc выбирают независимо из Н и необязательно замещенного С1-3-алкила или С1-3-гетероалкила,
или R3+R3' и/или R4+R4' выбирают независимо из =O, =S, =NOR18, =C(R18)R18' и =NR18, причем R18 и R18' выбирают независимо из Н и необязательно замещенного С1-3-алкила, причем два или больше из R2, R2', R3, R3', R4, R4' и R12 необязательно соединяются одной или несколькими связями с образованием одного или нескольких необязательно замещенных карбоциклов и/или гетероциклов;
Х2 выбирают из О, C(R14)(R14') и NR14', при этом R14 и R14' имеют те же значения, какие установлены для R7, и выбираются независимо, или R14' и R7' отсутствуют, что приводит к двойной связи между атомами, обозначенными как присоединяющие R7' и R14';
R5, R5', R6, R6', R7 и R7' выбирают независимо из H, OH, SH, NH2, N3, NO2, NO, CF3, CN, C(O)NH2, C(O)H, C(O)OH, галогена, Re, SRe, S(O)Re, S(O)2Re, S(O)ORe, S(O)2ORe, OS(O)Re, OS(O)2Re, OS(O)ORe, OS(O)2ORe, ORe, NHRe, N(Re)Rf, +N(Re)(Rf)Rg, P(O)(ORe)(ORf), OP(O)(ORe)(ORf), SiReRfRg, C(O)Re, C(O)ORe, C(O)N(Re)Rf, OC(O)Re, OC(O)ORe, OC(O)N(Re)Rf, N(Re)C(O)Rf, N(Re)C(O)ORf, N(Re)C(O)N(Rf)Rg и водорастворимой группы, при этом
Re, Rf и Rg выбирают независимо из Н и необязательно замещенного (CH2CH2O)eeCH2CH2X13Re1, С1-15-алкила, С1-15-гетероалкила, С3-15-циклоалкила, С1-15-гетероциклоалкила, С5-15-арила или С1-15-гетероарила, при этом ее выбирают из 1-1000, Х13 выбирают из O, S и NRf1, и Rf1 и Re1 выбирают независимо из Н и С1-3-алкила, причем один или несколько необязательных заместителей в Re, Rf и/или Rg необязательно представляют собой водорастворимую группу, причем два или больше из Re, Rf и Rg необязательно соединяются одной или несколькими связями с образованием одного или нескольких необязательно замещенных карбоциклов и/или гетероциклов,
или R5+R5' и/или R6+R6' и/или R7+R7' выбирают независимо из =O, =S, =NORe3, =C(Re3)Re4 и =NRe3, причем Re3 и Re4 выбирают независимо из Н и необязательно замещенного С1-3-алкила, или R5'+R6' и/или R6'+R7' и/или R7'+R14' отсутствуют, что приводит к двойной связи между атомами, обозначенными как присоединяющие R5' и R6' и/или R6' и R7' и/или R7' и R14', соответственно, причем два или больше из R5, R5', R6, R6', R7, R7', R14 и R14' необязательно соединяются одной или несколькими связями с образованием одного или нескольких необязательно замещенных карбоциклов и/или гетероциклов;
Х1 выбирают из О, S и NR13, при этом R13 выбран из Н и необязательно замещенного С1-8-алкила или С1-8-гетероалкила и не соединен ни с каким другим заместителем;
Х3 выбирают из О, S, C(R15)R15', -C(R15)(R15')-C(R15”)(R15”')-, -N(R15)-N(R15')-, -C(R15)(R15')-N(R15”)-, -N(R15”)-C(R15)(R15')-, -C(R15)(R15')-O-, -O-C(R15)(R15')-, -C(R15)(R15')-S-, -S-C(R15)(R15')-, -C(R15)=C(R15')-, =C(R15)-C(R15')=, -N=C(R15')-, =N-C(R15')=, -C(R15)=N-, =C(R15)-N=, -N=N-, =N-N=, CR15, N и NR15, или в DB1 и DB2 -X3- представляет собой -Х3а и X3b-, при этом Х3а соединен с Х34, между Х34 и Х4 присутствует двойная связь, и X3b соединен с Х11, при этом Х3а независимо выбран из Н и необязательно замещенного (CH2CH2O)eeCH2CH2X13Re1, С1-8-алкила или С1-8-гетероалкила, и не соединен ни с каким другим заместителем;
Х4 выбирают из О, S, C(R16)R16', NR16, N и CR16;
Х5 выбирают из О, S, C(R17)R17', NOR17 и NR17, при этом R17 и R17' выбраны независимо из Н и необязательно замещенного С1-8-алкила или С1-8-гетероалкила и не соединены ни с каким другим заместителем;
Х6 выбирают из CR11, CR11(R11'), N, NR11, О и S;
Х7 выбирают из CR8, CR8(R8'), N, NR8, О и S;
Х8 выбирают из CR9, CR9(R9'), N, NR9, О и S;
Х9 выбирают из CR10, CR10(R10'), N, NR10, О и S;
Х10 выбирают из CR20, CR20(R20'), N, NR20, О и S;
Х11 выбирают из С, CR21 и N, или Х11-X3b выбирают из CR21, CR21(R21'), N, NR21, О и S;
Х12 выбирают из С, CR22 и N;
Х6*, Х7*, Х8*, Х9*, Х10* и Х11* имеют те же значения, какие установлены для Х6, Х7, Х8, Х9, Х10 и Х11, соответственно, и выбираются независимо;
Х34 выбирают из С, CR23 и N;
атом цикла В Х11* в DB6 и DB7 соединяется с циклическим атомом цикла А, так что цикл А и цикл В в DB6 и DB7 непосредственно соединяются через простую связь;
означает, что указанная связь может представлять собой простую связь или некумулированную необязательно делокализованную двойную связь;
R8, R8', R9, R9', R10, R10', R11, R11', R15, R15', R15”, R15”', R16, R16', R20, R20', R21, R21', R22 и R23 выбирают, каждый независимо, из H, OH, SH, NH2, N3, NO2, NO, CF3, CN, C(O)NH2, C(O)H, C(O)OH, галогена, Rh, SRh, S(O)Rh, S(O)2Rh, S(O)ORh, S(O)2ORh, OS(O)Rh, OS(O)2Rh, OS(O)ORh, OS(O)2ORh, ORh, NHRh, N(Rh)Ri, +N(Rh)(Ri)Rj, P(O)(ORh)(ORi), OP(O)(ORh)(ORi), SiRhRiRj, C(O)Rh, C(O)ORh, C(O)N(Rh)Ri, OC(O)Rh, OC(O)ORh, OC(O)N(Rh)Ri, N(Rh)C(O)Ri, N(Rh)C(O)ORi, N(Rh)C(O)N(Ri)Rj и водорастворимой группы, при этом
Rh, Ri и Rj выбирают независимо из Н и необязательно замещенного (CH2CH2O)eeCH2CH2X13Re1, С1-15-алкила, С1-15-гетероалкила, С3-15-циклоалкила, С1-15-гетероциклоалкила, С5-15-арила или С1-15-гетероарила, причем один или несколько необязательных заместителей в Rh, Ri и/или Rj необязательно представляют собой водорастворимую группу, причем два или больше из Rh, Ri и Rj необязательно соединяются одной или несколькими связями с образованием одного или нескольких необязательно замещенных карбоциклов и/или гетероциклов,
или R8+R8', и/или R9+R9', и/или R10+R10', и/или R11+R11', и/или R15+R15', и/или R15”+R15”', и/или R16+R16', и/или R20+R20', и/или R21+R21' выбирают независимо из =O, =S, =NORh1, =C(Rh1)Rh2 и =NRh1, причем Rh1 и Rh2 выбирают независимо из Н и необязательно замещенного С1-3-алкила, причем два или больше из R8, R8', R9, R9', R10, R10', R11, R11', R15, R15', R15”, R15”', R16, R16', R20, R20', R21, R21', R22 и R23 необязательно соединяются одной или несколькими связями с образованием одного или нескольких необязательно замещенных карбоциклов и/или гетероциклов;
R8b и R9b выбираются независимо и имеют те же значения, что и R8, за исключением того, что они не могут быть соединены с каким-либо другим заместителем;
один из R4 и R4' и один из R16 и R16' могут, необязательно, соединяться одной или несколькими связями с образованием одного или нескольких необязательно замещенных карбоциклов и/или гетероциклов;
один из R2, R2', R3 и R3' и один из R5 и R5' могут, необязательно, соединяться одной или несколькими связями с образованием одного или нескольких необязательно замещенных карбоциклов и/или гетероциклов; и
а и b выбирают независимо из 0 и 1.
В другом аспекте изобретение относится к соединению формулы (I') или (II')
,
которое образуется через перегруппировку и сопутствующее элиминирование H-R1 из соответствующих соединений формул (I) и (II), которые являются seco-соединениями (см. фигуру 1). Полагают, что указанные циклопропилсодержащие аналоги являются активными, причем, как утверждают, образуются из соединений формул (I) и (II) in vivo через указанную перегруппировку.
В более конкретном воплощении данное изобретение относится к соединению формулы (I) или (II), описанному в данном описании выше, при этом
a) группа DB не включает группу DA1, DA2, DA1' или DA2'; и
b) цикл В в DB1 представляет собой гетероцикл; и
с) если Х3 в DB1 представляет собой -Х3а и X3b-, и цикл В является ароматическим, тогда два соседних заместителя в указанном цикле В соединяются с образованием необязательно замещенного карбоцикла или гетероцикла, конденсированного с указанным циклом В; и
d) если Х3 в DB2 представляет собой -Х3а и X3b-, и цикл В является ароматическим, тогда два соседних заместителя в указанном цикле В соединяются с образованием необязательно замещенного гетероцикла, конденсированного с указанным циклом В, необязательно замещенного неароматического карбоцикла, конденсированного с указанным циклом В, или замещенного ароматического карбоцикла, который конденсирован с указанным циклом В, и к которому присоединен по меньшей мере один заместитель, который содержит гидроксигруппу, первичную аминогруппу или вторичную аминогруппу, причем первичный или вторичный амин не является ни циклическим атомом в ароматической циклической системе, ни частью амида; и
е) если цикл А в DB2 представляет собой 6-членный ароматический цикл, тогда заместители в цикле В не соединяются с образованием цикла, конденсированного с циклом В; и
f) два соседних заместителя в цикле А в DB8 соединяются с образованием необязательно замещенного карбоцикла или гетероцикла, конденсированного с указанным циклом А, с образованием бициклической группы, с которой циклы более не конденсируются; и
g) цикл А в DB9 вместе с любыми циклами, конденсированными с указанным циклом А, содержит по меньшей мере два циклических гетероатома.
В другом воплощении данное изобретение относится к соединению формулы (I) или (II), описанных выше, при этом по меньшей мере один из заместителей R1, R5, R5', R6, R6', R7, R7', R14, R14', R8, R8', R9, R9', R10, R10', R11, R11', R15, R15', R15”, R15”', R16, R16', R20, R20', R21, R21', R22 и R23 содержит группу Х14(СН2СН2О)ffCH2CH2X14, при этом ff выбирают из 1-1000, и каждый Х14 выбирают независимо из
,
который соединен с местом присоединения указанного заместителя или через прямую связь или через группу, являющуюся частью указанного заместителя, которая не включает дисульфид, гидразон, гидразид, сложный эфир, природную аминокислоту или пептид, содержащий по меньшей мере одну природную аминокислоту, и при этом если цикл В в DB1 представляет собой полностью углеродный цикл, Х3 представляет собой О или NR15, X4 представляет собой CH, Х34 представляет собой C, имеется только одна группа Х14(СН2СН2О)ffCH2CH2X14, присутствующая в указанном соединении формулы (I) или (II), и указанная группа является частью R6, R7, R8, R10 или R15, тогда b=1 и ff≥5.
Соединение формулы (I) или (II) или его конъюгат, в котором ff больше 1000, охватывается данным изобретением.
В другом воплощении изобретение относится к соединению формулы (I) или (II), описанных выше, при этом по меньшей мере один из заместителей R1, R5, R5', R6, R6', R7, R7', R14, R14', R8, R8', R9, R9', R10, R10', R11, R11', R15, R15', R15”, R15”', R16, R16', R20, R20', R21, R21', R22 и R23 содержит триазольную группу.
Следует представлять, что если -Х3- представляет собой -Х3а и X3b- в группах DB1 и DB2, такие группы фактически представлены следующими структурами:
.
В другом аспекте настоящее изобретение относится к конъюгату соединения формулы (I), (II), (I') или (II').
В еще одном аспекте данное изобретение относится к соединению формулы (III)
или его фармацевтически приемлемой соли, гидрату или сольвату, при этом
V2 или отсутствует или представляет собой функциональную группу;
каждый L2 независимо или отсутствует, или представляет собой линкерную группу, соединяющую V2 с L;
каждый L независимо или отсутствует, или представляет собой линкерную группу, соединяющую L2 с одним или несколькими V1 и/или Y;
каждый V1 независимо или отсутствует, или представляет собой условно расщепляемую или условно трансформируемую группу, которую можно расщепить или трансформировать химическим, фотохимическим, физическим, биологическим или ферментативным способом;
каждый Y независимо или отсутствует, или представляет собой самоэлиминирующуюся спейсерную систему, которая состоит из 1 или нескольких самоудаляемых спейсеров и связана с V1, необязательно L и одним или несколькими Z;
каждый р и q равны числам, представляющим собой степень разветвления, и каждый равен, независимо, положительному целому числу;
z равен положительному целому числу, равному, или схожему с, или меньшему, чем общее число мест присоединения для Z;
каждый Z представляет собой независимо соединение формулы (I), (II), (I') или (II'), определенных в данном описании выше, при этом один или несколько из Х1, R5, R5', R6, R6', R7, R7', R14, R14', R8, R8', R9, R9', R10, R10', R11, R11', R15, R15', R15”, R15”', R16, R16', R20, R20', R21, R21', R22 и R23 необязательно могут быть дополнительно замещены или представлять собой заместитель формулы (V)
,
при этом каждый V2', L2', L', V1', Y', Z', p', q' и z' имеет значения, установленные для V2, L2, L, V1, Y, Z, p, q и z, соответственно, и выбираются независимо, причем один или несколько заместителей формулы (V) независимо соединены через Y' с одним или несколькими Х1, R5, R5', R6, R6', R7, R7', R14, R14', R8, R8', R9, R9', R10, R10', R11, R11', R15, R15', R15”, R15”', R16, R16', R20, R20', R21, R21', R22, R23 и/или одним или несколькими атомами, имеющими такие заместители R;
каждый Z независимо соединяется с Y или через Х1 или атом в R5, R5', R6, R6', R7, R7', R14, R14', R8, R8', R9, R9', R10, R10', R11, R11', R15, R15', R15”, R15”', R16, R16', R20, R20', R21, R21', R22, R23 или атом, имеющий любой из таких заместителей R; и
по меньшей мере, присутствует V2 или V1.
Отмечается, что в соединении формулы (III) присутствие V2 или V1 необходимо. Однако в одной или нескольких группах формулы (V), которые необязательно присутствуют в Z, каждый V2' и V1' может быть выбран независимо как отсутствующий или как присутствующий.
В другом аспекте изобретение относится к соединению формулы (III), при этом
V2 присутствует и выбирается как нацеливающая группа, и существует по меньшей мере одна группа формулы (V), которая содержит группу V1', и или включает группу V2', L2' или L', которая содержит группу Х14(СН2СН2О)ggCH2CH2X14, при этом gg выбирают из 3-1000, и каждый Х14 выбирают независимо из
,
или указанная та же группа формулы (V) включает по меньшей мере 2 группы Х14СН2СН2ОСН2СН2Х14, в которых каждый Х14 выбирают независимо.
Отмечается, что отдельные группы Х14 в группах -СН2СН2Х14, которые могут присутствовать в соединении формулы (III), выбирают независимо.
Также отмечается, что z не представляет собой степень полимеризации; поэтому z не указывает, какое число групп Z или RM2 соединяется друг с другом.
Также отмечается, что если Y или Y' соединяются с атомом в Z или RM2, имеющих конкретный заместитель R, вместо такого самого заместителя R, это фактически означает, что такой заместитель R отсутствует, если это необходимо для соответствия правилам валентностей.
Также отмечается, что если Х14 в, например, -СН2СН2Х14 представляет собой , тогда -СН2СН2Х14 должна читаться как -СН2СНХ14.
Настоящее изобретение также относится к соединению формулы (IV)
или его фармацевтически приемлемой соли, гидрату или сольвату, при этом
RM представляет собой реакционноспособную группу, и L, V1, Y, Z, p и z имеют значения, указанные в данном описании выше, за исключением того, что L теперь связывет RM c одним или несколькими V1 и/или Y, и V1, Y и Z могут содержать защитные группы, и одна или несколько групп V2'-L2', необязательно присутствующих в Z, имеющем значения, указанные выше, могут необязательно и независимо присутствовать вместо RM', который представляет собой реакционноспособную группу, и при этом, если в (IV) имеется более 1 реакционноспособной группы, некоторые или все реакционноспособные группы являются одинаковыми или различными. Такие конъюгаты линкер-агент формулы (IV) могут или не могут считаться промежуточными соединениями для соединений формулы (III).
В другом аспекте настоящее изобретение относится к соединению формулы (IV), при этом RM представляет собой реакционноспособную группу, выбранную из карбамоилгалогенида, ацилгалогенида, активного сложного эфира, ангидрида, -галогенацетила, -галогенацетамида, малеимида, изоцианата, изотиоцианата, дисульфида, тиола, гидразина, гидразида, сульфонилхлорида, альдегида, метилкетона, винилсульфона, галогенметила и метилсульфоната, и при этом по меньшей мере одна группа формулы (V), будучи частью Z, содержит группу V1' и или включает группу V2', L2' или L', которая содержит группу Х14(СН2СН2О)ggCH2CH2X14, при этом gg выбирают из 3-1000 и каждый Х14 выбирают независимо из
,
или указанная та же группа формулы (V) включает по меньшей мере 2 группы Х14СН2СН2ОСН2СН2Х14, в которых каждый Х14 выбирают независимо. Такие конъюгаты линкер-агент формулы (IV) могут или не могут считаться промежуточными соединениями для соединений формулы (III).
В еще одном аспекте данное изобретение относится к новым бифункциональным линкерам, которые содержат место расщепления, самоудаляемую спейсерную систему и две реакционноспособные группы, одна из которых может быть введена во взаимодействие с терапевтической или диагностической частью, например, соединением формулы (I) или (II), и другая из них может быть введена во взаимодействие с функциональной группой, такой как нацеливающая группа. Такие бифункциональные линкеры могут быть использованы для получения конъюгатов формул (III) и (IV) по данному изобретению или подобных соединений с различными терапевтическими или диагностическими частями.
Конкретнее, данное изобретение относится к соединению формулы (VIII)
или его фармацевтически приемлемой соли, гидрату или сольвату, при этом
L, V1, Y, RM, p и z имеют значения, установленные для соединения формулы (IV), и RM2 представляет собой реакционноспособную группу или удаляемую группу. RM и каждый RM2 выбирают независимо. Такие бифункциональные линкеры формулы (VIII) могут или не могут считаться промежуточными соединениями для соединений формул (III) и (IV).
Данное изобретение относится к энантиомерно чистым и/или диастереомерно чистым соединениям формул (I), (II), (III), (IV) и (VIII), а также к энантиомерным и/или диастереомерным смесям соединений формул (I), (II), (III), (IV) и (VIII). Данное изобретение относится к чистым соединениям формул (I), (II), (III), (IV) и (VIII), а также к смесям изомеров соединений формул (I), (II), (III), (IV) и (VIII).
Соединения формул (I) и (II) представляют собой производные дуокармицина, которые предпочтительно содержат гетероатомы или полярные группы в выбранных положениях в ДНК-связывающей группы или в заместителях в ДНК-связывающей или ДНК-алкилирующей группы. Обнаружено, что соединения формулы (III), которые представляют собой конъюгаты соединений формул (I) и (II), по сравнению с подобными соединениями известного уровня техники являются, что не стало неожиданным, более эффективными in vivo и имеют улучшенные свойства, такие как повышенная полярность и оптимизированное высвобождение лекарственного средства.
В одном воплощении данное изобретение относится к конъюгату соединения формулы (I) или (II) согласно одному из вышеописанных воплощений и их производных. Такой конъюгат содержит одну или несколько прогрупп (promoieties). Преимущественно такой конъюгат имеет достаточную устойчивость в кровотоке, но эффективно и селективно активируется с высобождением соединения формулы (I) или (II) в области мишени, что ведет к подходящему терапевтическому окну. Доказано, что длина и характер линкера между функциональной группой и соединением формулы (I) или (II) вносят важный вклад. В одном аспекте данного изобретения линкер имеет уменьшенную длину относительно длины линкера в подобных конъюгатах известного уровня техники, что ведет к улучшенной эффективности. В другом аспекте линкер содержит самоудаляемую спейсерную систему с улучшенными свойствами, что ведет, например, к оптимизированной скорости самоудаления, оптимизированному высвобождению лекарственного средства и/или повышенной полярности. В еще одном аспекте линкер между функциональной группой и соединением формулы (I) или (II) содержит одну или несколько групп, предназначенных для улучшения фармакокинетических свойств конъюгата. Такие группы могут присутствовать в L и/или Y и/или в любой другой части в составе соединения формулы (III).
Преждевременное высвобождение в кровотоке исходного вещества, т.е. соединения формулы (I) или (II), может быть нежелательным, но в таком случае относительно быстрая дезактивация высвобожденного соединения может уменьшить токсическое побочное действие. Дезактивацию можно привести в соответствие выбором соответствующей ДНК-алкилирующей и ДНК-связывающей группы. Дезактивация может происходить по нескольким механизмам, включая ферментативное или гидролитическое отщепление ДНК-алкилирующего элемента от ДНК-связывающего элемента.
Соединения формул (I) и (II) подходят для применения в целях доставки лекарственного средства, включая применения для направления и регулируемого высвобождения лекарственного средства, с использованием соединений формул (III) и (IV).
Краткое описание чертежей
Фигура 1. Перегруппировка seco-соединения до циклопропилсодержащего соединения.
Фигура 2. Графическая иллюстрация скорости циклизации для ряда соединений спейсер циклизации-дуокармицин при 25°С и рН 7,4 (верхняя линия) и при 37°С и рН 5 (нижняя линяя).
Фигура 3. Устойчивость в человеческой плазме ряда конъюгатов линкер-агент, конъюгированных с HSA.
Фигура 4. Исследование эффективности однократной дозы с конъюгатами лекарственных средств с антителами на основе трастузумаба (ADC) на самках мышей nu/nu с ксенотрансплантатом N87.
Фигура 5. Расщепление катепсином В конъюгатов линкер-агент, заглушенных N-ацетилцистеином.
Описание изобретения
Следующее далее подробное описание приводится для того, чтобы изобретение можно было понять полнее.
Определения
Если не указано иное, все технические и научные термины, используемые в данном описании, имеют значения, которые им обычно придаются специалистами в данной области техники.
Термин «антитело», используемый в данном описании, относится к полноразмерной молекуле иммуноглобулина, иммунологически активной части полноразмерной молекулы иммуноглобулина или производному полноразмерной молекулы иммуноглобулина или ее активной части, т.е. молекуле, которая содержит антигенсвязывающий сайт, который иммуноспецифически связывает антиген мишени, представляющей интерес, или его часть, причем такие мишени включают, но не ограничиваются указанным, опухолевые клетки. Поэтому фрагмент или производное полноразмерной молекулы иммуноглобулина иммуноспецифически связывает тот же антиген, что и указанная полноразмерная молекула иммуноглобулина. Иммуноглобулин может быть любого типа (например, IgG, IgE, IgM, IgD, IgA или IgY), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 или IgA2) или подкласса. Иммуноглобулин или его производное или активная часть может происходить от любого вида, например, человека, грызуна (например, мыши, крысы или хомяка), осла, овцы, кролика, козы, морской свинки, верблюда, лошади, коровы или курицы, но предпочтительно он имеет человеческое, мышиное или кроличье происхождение, или он получен от более чем одного вида. Антитела, применимые в изобретении, включают, но не ограничиваются указанным, моноклональные, поликлональные, биспецифические, полиспецифические, человеческие, гуманизированные, химерные и созданные генной инженерией антитела, одноцепочечные антитела, Fv-фрагменты, Fd-фрагменты, Fab-фрагменты F(ab')-фрагменты, F(ab')2-фрагменты, dAb-фрагменты, фрагменты, полученные экспрессией библиотеки Fab, антиидиотипические антитела, изолированные CDR и эпитопсвязывающие фрагменты любых из вышеуказанных антител и фрагментов, которые иммуноспецифически связываются с антигеном, представляющим интерес.
Термин «удаляемая группа» относится к группе, которая может быть замещена другой группой в реакции замещения. Такие удаляемые группы хорошо известны в области техники, и примеры включают, но не ограничиваются указанным, галогенид (фторид, хлорид, бромид и иодид), азид, сульфонат (например, необязательно замещенный С1-6-алкансульфонат, такой как метансульфонат, трифторметансульфонат и трифторэтансульфонат, или необязательно замещенный бензолсульфонат, такой как п-бензолсульфонат и нозилат), имидазол, циклический имидтион, сукцинимид-N-оксид, фталимид-N-оксид, п-нитрофеноксид, о-нитрофеноксид, пентафторфеноксид, тетрафторфеноксид, 1,3,5-трихлорфеноксид, 1,3,5-трифторфеноксид, карбоксилат, аминокарбоксилат (карбамат) и алкоксикарбоксилат (карбонат). Для замещения у насыщенного углерода предпочтительными удаляемыми группами являются галогениды и сульфонаты. Для замещения у карбонильного углерода в качестве удаляемой группы могут быть использованы, например, галогенид, сукцинимид-N-оксид, п-нитрофеноксид, пентафторфеноксид, тетрафторфеноксид, карбоксилат или алкоксикарбоксилат (карбонат). Термин «