Многослойная таблетка для рассасывания в полости рта и ее изготовление
Иллюстрации
Показать всеНастоящее изобретение относится к способу изготовления двухслойной таблетки. Для изготовления двухслойной таблетки добавляют на плиту пресс-формы сначала первую порошковую смесь, затем вторую порошковую смесь. Первая порошковая смесь содержит фармацевтически активное вещество и связующее вещество. Вторая порошковая смесь содержит связующее вещество. Композиция второй порошковой смеси отличается от композиции первой порошковой смеси. Далее прессуют первую порошковую смесь и вторую порошковую смесь на плите пресс-формы с образованием таблетированной формы, которую подвергают радиочастотному излучению в течение периода времени, достаточного для активации связующего вещества и сплавления таблетированной формы в двухслойную таблетку. Плотность таблетки составляет менее приблизительно 0,8 г/см3. Время рассасывания таблетки в полости рта при помещении на язык составляет менее приблизительно 30 с. 2 н. и 16 з.п. ф-лы, 14 ил., 10 табл., 12 пр.
Реферат
Перекрестные ссылки на смежные заявки
Настоящая заявка испрашивает приоритет по предварительной заявке США № 61/245,315, поданной 24 сентября 2009 г., предварительной заявке США № 61/255,582, поданной 28 октября 2009 г., предварительной заявке США № 61/314,629, поданной 17 марта 2010 г., предварительной заявке США № 61/358,167, поданной 24 июня 2010 г., заявке на патент США № 12/887,544, поданной 22 сентября 2010 г., и заявке на патент США № 12/887,552, поданной 22 сентября 2010 г. Полное описание указанных выше заявок на патент США включено в настоящий документ путем ссылки для любых целей.
Предпосылки создания изобретения
Фармацевтические средства, предназначенные для перорального введения, как правило, имеют форму таблеток. Таблетки глотают целиком, разжевывают или рассасывают в полости рта. Мягкие таблетки, которые разжевываются или растворяются в полости рта, часто применяют при введении фармацевтических средств, при которых проглатывание таблетки целиком является нецелесообразным. В случае жевательных таблеток разжевывание способствует распаду составляющих таблетку частиц в процессе рассасывания таблетки и может увеличить скорость всасывания в пищеварительном тракте. Мягкие таблетки также являются благоприятными в тех случаях, когда необходимо обеспечить доступ к фармацевтически активному веществу при топическом введении в полость рта или горло для обеспечения местного воздействия и/или системного всасывания. Мягкие таблетки также используют для облегчения введения лекарственных средств у детей и пациентов пожилого возраста. Мягкие таблетки для рассасывания в полости рта до проглатывания особенно предпочтительны при назначении детям для улучшения соответствия требованиям к лекарственным средствам.
Мягкие таблетки по существу изготавливают путем прессования смеси порошкообразных ингредиентов, и они, как правило, содержат фармацевтически активное вещество, ароматизатор и/или связующие вещества. Порошковую смесь, как правило, подают в полость пресс-формы таблеточного пресса и формируют таблетку путем приложения давления. Твердость полученной таблетки зависит непосредственно от используемого при прессовании давления и совместимости ингредиентов в составе. Более мягкую таблетку, которую легче раскусить, можно получить путем приложения более низкого давления. Полученная таблетка является более мягкой, но также более хрупкой и ломкой, и недостатком является то, что ее производство может включать в себя сложные и дорогостоящие технологические этапы. Примеры мягких таблеток для рассасывания в полости рта без разжевывания раскрыты в патентах США №№ 5,464,632, 5,223,264, 5,178,878, 6,589,554 и 6,224,905.
Существует потребность в эстетически приятных жевательных таблетках и таблетках для рассасывания в полости рта, при изготовлении которых используют таблеточные машины на основе прессования, которые, как правило, используются для производства твердых таблеток для проглатывания с высокой плотностью. При использовании низкой сжимающей силы данные машины, как правило, производят очень хрупкие таблетки, обладающие недостаточной прочностью при упаковке, транспортировке и хранении. Настоящее изобретение относится к раскрытию способа изготовления таблеток, таких как жевательные таблетки или таблетки для рассасывания в полости рта, с использованием радиочастотного излучения (РЧ-излучения), при котором можно использовать высокоскоростные таблеточные машины.
Изложение сущности изобретения
В одном аспекте настоящее изобретение относится к способу изготовления таблетки путем прессования порошковой смеси в плите пресс-формы для образования таблетированной формы, причем порошковая смесь включает в себя фармацевтически активное вещество и плавкое связующее вещество, и приложения к таблетированной форме радиочастотного излучения в течение времени, достаточного для размягчения или расплавления связующего вещества в таблетированной форме для образования таблетки. В одном варианте осуществления полученная таблетка представляет собой таблетку для рассасывания в полости рта.
В одном аспекте настоящее изобретение относится к таблетке, содержащей первый слой и второй слой, причем: (i) первый слой включает в себя фармацевтически активное вещество, а композиция первого слоя отличается от композиции второго слоя; (ii) плотность таблетки составляет менее приблизительно 0,8 г/см3; и (iii) рассасывание таблетки в полости рта при помещении на язык занимает менее приблизительно 30 с.
В другом аспекте настоящее изобретение относится к способу изготовления таблетки, содержащей первый слой и второй слой, включающему этапы, на которых: (i) добавляют первую порошковую смесь на плиту пресс-формы, причем первая порошковая смесь включает в себя фармацевтически активное вещество и связующее вещество; (ii) добавляют вторую порошковую смесь на плиту пресс-формы, причем вторая порошковая смесь включает в себя связующее вещество, а композиция второй порошковой смеси отличается от композиции первой порошковой смеси; (iii) прессуют первую порошковую смесь и вторую порошковую смесь на плите пресс-формы для образования таблетированной формы; и (iv) прилагают к таблетированной форме излучение в течение периода времени, достаточного для активации связующих веществ внутри таблетированной формы для сплавления таблетированной формы в таблетку таким образом, чтобы плотность таблетки составляла менее приблизительно 0,8 г/см3, а таблетка рассасывалась в полости рта при помещении ее на язык в течение менее приблизительно 30 с.
Другие особенности и преимущества настоящего изобретения станут понятны из подробного описания настоящего изобретения и формулы изобретения.
Краткое описание чертежей
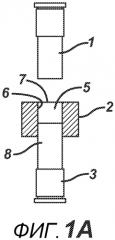
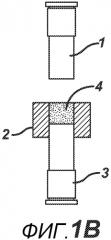
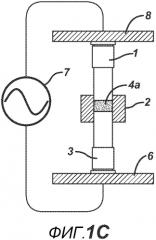
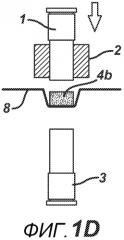
На ФИГ. 1A-F представлены виды сбоку в сечении варианта осуществления настоящего изобретения, на которых показан процесс производства таблетки 4a из порошковой смеси 4 в плите пресс-формы 2.
На ФИГ. 2A-H представлены виды сбоку в сечении варианта осуществления настоящего изобретения, на которых показан процесс производства двухслойной таблетки 12 из порошковых смесей 10 и 11 в плите пресс-формы 2.
На ФИГ. 3A-G представлены виды сбоку в сечении варианта осуществления настоящего изобретения, на которых показан процесс производства таблетки 40, содержащей предварительно образованные вставки 30 и 31, из порошковой смеси 20 в плите пресс-формы 2.
На ФИГ. 4A и 4B представлен вид в перспективе станка с делительно-поворотным столом 195.
На ФИГ. 5A и 5B представлены виды сверху станка с делительно-поворотным столом 195 в положении останова.
На ФИГ. 6A и 6B представлены виды в сечении нижнего формовочного узла 110 в положении, соответствующем началу производственного цикла.
На ФИГ. 7 представлен вид в сечении станка с делительно-поворотным столом и РЧ-блоком 195 до прессования порошковой смеси 101.
На ФИГ. 8 представлен вид в сечении станка с делительно-поворотным столом и РЧ-блоком 195, на котором показан процесс производства таблеток 101a.
На ФИГ. 9 представлен вид в сечении блока выталкивания таблеток 160 до выталкивания таблеток 101a.
На ФИГ. 10 представлен вид в сечении блока выталкивания таблеток 160 после выталкивания таблеток 101a в блистер 190.
На ФИГ. 11A-D представлены виды в сечении альтернативных вариантов осуществления формовочных устройств и плиты пресс-формы.
На ФИГ. 12 A-D представлены виды в сечении альтернативных вариантов осуществления формовочных устройств и плиты пресс-формы.
На ФИГ. 13A представлен вид в сечении формовочных устройств с волнообразной поверхностью.
На ФИГ. 13B представлен вид в перспективе формовочных устройств с волнообразной поверхностью.
На ФИГ. 14 представлен вид в сечении формовочных устройств с выступами на поверхности.
Подробное описание изобретения
Предполагается, что любой специалист в данной области может воспользоваться всеми возможностями изобретения с помощью приведенного в настоящем документе описания. Следующие специфические варианты осуществления могут рассматриваться лишь в качестве примеров, которые ни в коей мере не ограничивают раскрываемую сущность настоящего изобретения.
Если не указано другое, все технические и научные термины, используемые в настоящем документе, имеют значения, понятные специалистам в области, к которой относится настоящее изобретение. Все публикации, заявки на патенты, патенты и другие указанные в настоящем документе документы также включены в настоящий документ путем ссылки. В настоящем документе все процентные отношения приводятся по весу, если не указано другое.
Как описано выше, в одном аспекте настоящее изобретение относится к способу изготовления таблетки путем прессования порошковой смеси в плите пресс-формы для образования таблетированной формы, причем порошковая смесь включает в себя фармацевтически активное вещество и плавкое связующее вещество, а также приложения к таблетированной форме радиочастотного излучения в течение времени, достаточного для размягчения или расплавления связующего вещества в таблетированной форме для образования таблетки.
Порошковая смесь
Как описано выше, таблетку производят путем прессования порошковой смеси, содержащей фармацевтически активное вещество (описанное в настоящем документе), связующее вещество (описанное в настоящем документе) и необязательно фармацевтически приемлемый носитель. Примеры связующих веществ включают в себя без ограничений плавкие связующие вещества и связующие материалы, активируемые водой. Носитель содержит один или более применимых эксципиентов для получения таблеток. Примеры применимых эксципиентов включают в себя без ограничений наполнители, адсорбенты, разрыхлители, смазывающие вещества, скользящие вещества, подсластители, суперразрыхлители, вкусоароматические добавки, антиоксиданты, консерванты, загустители, а также их смеси. В одной частице порошковой смеси могут присутствовать один или более из описанных выше ингредиентов.
Применимые наполнители включают в себя без ограничений углеводы (как описано в настоящем документе) и нерастворимые в воде пластически деформируемые материалы (например, микрокристаллическая целлюлоза или другие производные целлюлозы), а также их смеси.
Применимые адсорбенты включают в себя без ограничений нерастворимые в воде адсорбенты, такие как дикальцийфосфат, трикальцийфосфат, силикатированная микрокристаллическая целлюлоза (например, такая как целлюлоза, доступная в продаже под маркой PROSOLV, производство PenWest Pharmaceuticals, г. Паттерсон, штат Нью-Йорк), алюмометасиликат магния (например, такой как алюмометасиликат магния, доступный в продаже под маркой NEUSILIN, производство компании Fuji Chemical Industries (USA) Inc., г. Роббинсвилль, штат Нью-Джерси), глины, кремнеземы, бентонит, цеолиты, силикаты магния, гидроталькит, вигум, а также их смеси.
Применимые разрыхлители включают в себя без ограничений натриевую соль гликолята крахмала, поперечносшитый поливинилпирролидон, поперечносшитую карбоксиметилцеллюлозу, крахмалы, микрокристаллическую целлюлозу и их смеси.
Применимые смазывающие вещества включают в себя без ограничений длинноцепочечные жирные кислоты и их соли, такие как стеарат магния и стеариновая кислота, тальк, глицеридные воски и их смеси.
Применимые скользящие вещества включают в себя без ограничений коллоидный диоксид кремния.
Примеры подсластителей включают в себя без ограничений синтетические или натуральные сахара; искусственные подсластители, такие как сахарин, сахарин натрия, аспартам, ацесульфам, тауматин, глицирризин, сукралоза, дигидрохалькон, алитам, миракулин, монеллин и стевиозид; сахарные спирты, такие как сорбит, маннит, глицерин, лактит, мальтит и ксилит; сахара, выделенные из сахарного тростника и сахарной свеклы (сахароза), декстрозу (также называемую глюкозой), фруктозу (также называемую левулозой) и лактозу (также называемую молочным сахаром); изомальт, а также их соли и смеси.
Примеры суперразрыхлителей включают в себя без ограничений кроскармеллозу натрия, натриевую соль гликолята крахмала и поперечносшитый повидон (кросповидон). В одном варианте осуществления таблетка содержит до приблизительно 5 вес.% таких суперразрыхлителей.
Примеры вкусоароматических добавок включают в себя без ограничений эфирные масла, включая дистиллированные, экстрагированные растворителями или холодным прессованием измельченные цветы, листья, очищенные или превращенные в волокнистую массу целые фрукты, содержащие смеси спиртов, эфиров, альдегидов и лактонов; эссенции, включающие либо разбавленные растворы эфирных масел, либо смеси синтетических химических соединений, смешанных для имитации естественных запахов фруктов (например, клубники, малины и черной смородины); искусственные и природные запахи пива и алкогольных напитков, например, коньяка, виски, рома, джина, хереса, портвейна и вина, табака, кофе, чая, какао и мяты; фруктовые соки, включая сок, выдавленный из промытых и очищенных фруктов, таких как лимон, апельсин и лайм, побеги мяты, перечная мята, винтергрен, корица, какао, ваниль, лакрица, ментол, эвкалипт, анисовое семя, орехи, например, арахис, кокос, лесной орех, каштан, грецкий орех и орех колы, миндаль, изюм; пудра, мука или части растительных материалов, включая части растения табака, например, рода Nicotiana, в количествах, незначительно повышающих уровень никотина, а также имбирь.
Примеры антиоксидантов включают в себя без ограничений токоферолы, аскорбиновую кислоту, пиросульфит натрия, бутилгидрокситолуен, бутилированный гидроксианизол, этилендиаминтетрауксусную кислоту и ее соли, а также их смеси.
Примеры консервантов включают в себя без ограничений лимонную кислоту, винную кислоту, молочную кислоту, оксиянтарную кислоту, уксусную кислоту, бензойную кислоту и сорбиновую кислоту, а также их смеси.
Примеры загустителей включают в себя без ограничений пектин, полиэтиленоксид и каррагинан, а также их смеси. В одном варианте осуществления уровни загустителей составляют от приблизительно 0,1% до приблизительно 10 вес.%.
В одном варианте осуществления настоящего изобретения средний размер частиц порошковой смеси составляет менее 500 мкм, как например, от приблизительно 50 мкм до приблизительно 500 мкм, как например, от приблизительно 50 мкм до 300 мкм. В частности, частицы данного размера используют при прямом прессовании.
В одном варианте осуществления порошковая смесь/таблетка по существу не содержит суперразрыхлителей. В настоящем документе «по существу не содержит» означает содержание менее 5%, как например, менее 1%, как например, менее 0,1%, как например, полное отсутствие (например, 0%). Примеры суперразрыхлителей включают в себя без ограничений гликолят крахмала, поперечносшитый поливинилпирролидон и поперечносшитую карбоксиметилцеллюлозу.
В одном варианте осуществления порошковая смесь/таблетка по существу не содержит нерастворимых в воде наполнителей прямого прессования. Нерастворимые в воде наполнители включают в себя без ограничений микрокристаллическую целлюлозу, микрокристаллическую целлюлозу прямого прессования, целлюлозы, нерастворимые в воде целлюлозы, крахмал, кукурузный крахмал и модифицированные крахмалы. Как описано в данном варианте осуществления, «по существу не содержит» означает содержание менее 2 процентов, например, менее 1 процента или ни одного.
Плавкое связующее вещество
В одном варианте осуществления порошковая смесь/таблетка, составляющая предмет настоящего изобретения, включает в себя по меньшей мере одно плавкое связующее вещество. В одном варианте осуществления температура плавления плавкого связующего вещества составляет от приблизительно 30°C до приблизительно 140°C, как например, от приблизительно 40°C до приблизительно 140°C, как например от приблизительно 55°C до приблизительно 100°C. Размягчение или расплавление плавкого(их) связующего(их) вещества (веществ) приводит к спеканию таблетированной формы благодаря связыванию размягченного или расплавленного связующего вещества с фармацевтически активным веществом и/или другими ингредиентами в прессованной порошковой смеси.
В одном варианте осуществления плавкое связующее вещество представляет собой связующее вещество, расплавляемое РЧ-излучением. Под связующим веществом, расплавляемым РЧ-излучением, понимается твердое связующее вещество, способное размягчаться или плавиться под воздействием радиочастотного (РЧ) излучения. Связующее вещество, расплавляемое РЧ-излучением, как правило, является полярным и может снова застывать или затвердевать при охлаждении.
В одном варианте осуществления связующее вещество, расплавляемое РЧ-излучением, представляет собой связующее вещество, не расплавляемое РЧ-излучением. В таком варианте осуществления порошковая смесь содержит эксципиент, который нагревается при обработке РЧ-излучением (например, полярный эксципиент) таким образом, что полученное тепло способно размягчить или расплавить плавкое связующее вещество. Примеры таких эксципиентов включают в себя без ограничений полярные жидкости, такие как вода и глицерин; порошковые металлы и соли металлов, такие как порошковое железо, хлорид натрия, гидроксид алюминия и гидроксид магния; стеариновую кислоту; мальтодекстрин и стеарат натрия.
Другие примеры плавких связующих веществ включают в себя аморфные полимеры углеводов. Под «аморфными полимерами углеводов» понимают молекулу, имеющую множество мономеров углеводов, причем такая молекула имеет уровень кристалличности менее 20%, как например, менее 10%, как например, менее 5%. Примеры аморфных полимеров углеводов включают в себя без ограничений гидрогенизированный гидролизат крахмала, полидекстрозу и олигосахариды. Примеры олигосахаридов включают в себя без ограничений фруктоолигосахарид, галактоолигосахарид, мальтоолигосахарид, инулин и изомальтоолигосахарид.
Примеры применимых плавких связующих веществ включают в себя: жиры, такие как кокосовое масло, гидрогенизированное растительное масло, такое как косточковое пальмовое масло, хлопковое масло, подсолнечное масло и соевое масло; моно-, ди- и триглицериды; фосфолипиды; цетиловый спирт; воски, такие как карнаубский воск, спермацетовый воск, пчелиный воск, канделильский воск, шеллачный воск, микрокристаллический воск и парафиновый воск; растворимые в воде полимеры, такие как полиэтиленгликоль, поликапролактон, GlycoWax-932, глицериды лауроил-макрогола-32 и глицериды стеароил-макрогола-32; полиэтиленоксиды и эфиры сахарозы.
В одном варианте осуществления плавкое связующее вещество представляет собой связующее вещество, расплавляемое РЧ-излучением, а связующее вещество, расплавляемое РЧ-излучением, представляет собой полиэтиленгликоль (ПЭГ), такой как ПЭГ-4000. Особенно предпочтительное связующее вещество, расплавляемое РЧ-излучением, представляет собой ПЭГ, содержащий по меньшей мере 95 вес.% частиц ПЭГ размером менее 100 мкм (измеряется стандартными способами, такими как рассеяние света или лазерное излучение, либо гранулометрический анализ) с молекулярной массой от 3000 до 8000 дальтон.
Связующее(ие) вещество(а) может (могут) составлять от приблизительно 0,01 процента до приблизительно 70 процентов порошковой смеси/таблетки, как например, от приблизительно 1 процента до приблизительно 50 процентов, как например, от приблизительно 10 процентов до приблизительно 30 процентов порошковой смеси/таблетки.
В одном варианте осуществления средний размер частиц связующего вещества составляет менее 250 мкм, как например, менее 100 мкм.
Водосодержащий материал
В одном варианте осуществления порошковая смесь/таблетка, составляющая предмет настоящего изобретения, включает в себя по меньшей мере один водосодержащий материал. Примеры водосодержащих материалов включают в себя без ограничений материалы, в которых вода химически связана с материалом (например, гидратированную соль), материалы, в которых вода адсорбирована или абсорбирована (например, пористый материал, такой как кремнеземы и микрогубки), а также материалы с инкапсулированной водой (например, капсулы, наполненные жидкостью). Примеры таких материалов включают в себя без ограничений пирогенные диоксиды кремния; коллоидные диоксиды кремния, такие как коллоидный диоксид кремния; силикаты, такие как силикат кальция, силикат алюминия, метасиликат магния-алюминия (такой как NEUSILIN, US-2 производства Fuji Chemical Ltd) и силикат магния; глины; цеолиты и вигум.
В одном варианте осуществления порошковая смесь/таблетка содержит по меньшей мере одну гидратированную соль. Примеры гидратированных солей включают в себя без ограничений гидрат сульфата натрия, гидрат карбоната натрия, гидрат хлорида кальция, гидрат гидрофосфата натрия, а также их смеси. В одном варианте осуществления молекулярная масса гидратированной соли составляет от приблизительно 150 до приблизительно 400 дальтон, как например, от приблизительно 200 до приблизительно 350 дальтон.
В одном варианте осуществления порошковая смесь/таблетка содержит по меньшей мере одну капсулу, наполненную жидкостью. В дополнительном варианте осуществления вода высвобождается из капсулы при ее разрыве, причем такой разрыв вызывают добавлением излучения.
Уровень(и) водосодержащего(их) материала(ов) может (могут) составлять от приблизительно 0,01 процента до приблизительно 70 процентов порошковой смеси/таблетки, как например, от приблизительно 1 процента до приблизительно 50 процентов, как например, от приблизительно 1 процента до приблизительно 30 процентов, как например, от приблизительно 2 процентов до приблизительно 10 процентов порошковой смеси/таблетки.
Связующий материал, активируемый водой
В одном варианте осуществления порошковая смесь/таблетка, составляющая предмет настоящего изобретения, содержит по меньшей мере один связующий материал, активируемый водой. Под связующим материалом, активируемым водой, понимается материал, активирующийся или гидратирующий при взаимодействии с водой (например, высвобождающейся из водосодержащего материала добавлением излучения) и способствующий соединению/сплавлению порошковой смеси в таблетку. Примеры таких материалов включают в себя без ограничений гидролизованные белки, гидратируемые полимеры и гидроколлоиды. Применимые гидролизованные белки включают в себя без ограничений гидролизованный коллаген. Применимые гидратируемые полимеры включают в себя без ограничений крахмалы, модифицированные крахмалы, метилцеллюлозу и гидроксипропилцеллюлозу. Применимые гидроколлоиды включают в себя без ограничений желатин, геллановую камедь, каррагинан и пектин.
Углевод
В одном варианте осуществления порошковая смесь содержит по меньшей мере один углевод. Углевод может влиять на растворимость и вкус таблетки, способствовать распределению плавкого связующего вещества по большей площади поверхности, а также разбавлению и ослаблению фармацевтически активного вещества. В одном варианте осуществления частицы углеводов (например, сорбита) действуют как связующее вещество и спекаются при нагревании. Примеры углеводов включают в себя без ограничений растворимые в воде сжимаемые углеводы, такие как сахара (например, декстроза, сахароза, мальтоза, изомальт и лактоза), крахмалы (например, кукурузный крахмал), сахарные спирты (например, маннит, сорбит, мальтит, эритрит, лактит и ксилит) и гидролизаты крахмала (например, декстрины и мальтодекстрины).
Уровни углевода(ов) могут составлять от приблизительно 5 процентов до приблизительно 95 процентов порошковой смеси/таблетки, как например, от приблизительно 20 процентов до приблизительно 90 процентов или от приблизительно 40 процентов до приблизительно 80 процентов порошковой смеси/таблетки. Размер частиц углевода может влиять на содержание используемого плавкого связующего вещества, причем при большем размере частиц углевода площадь поверхности меньше, и, следовательно, требуется меньше плавкого связующего вещества. В одном варианте осуществления, в котором содержание углевода(ов) составляет более 50 вес.% порошковой смеси, а средний размер частицы углевода(ов) составляет более 100 мкм, содержание плавкого связующего вещества составляет от приблизительно 10 до приблизительно 30 вес.% порошковой смеси/таблетки.
Фармацевтически активное вещество
Порошковая смесь/таблетка, составляющая предмет настоящего изобретения, включает в себя по меньшей мере одно фармацевтически активное вещество. Под «фармацевтически активным веществом» подразумевают вещество (например, соединение), которое разрешено или одобрено Управлением по контролю за качеством пищевых продуктов и лекарственных средств США, Европейским агентством лекарственных средств или любым из их правопреемников в качестве средства для перорального лечения при патологическом состоянии или заболевании. Применимые фармацевтически активные вещества включают в себя без ограничений обезболивающие, противовоспалительные вещества, жаропонижающие и антигистаминные средства, антибиотики (например, антибактериальные, противовирусные и противогрибковые средства), антидепрессанты, противодиабетические, спазмолитические средства, средства для подавления аппетита, бронходилататоры, сердечнососудистые лекарственные средства (например, статины), средства для лечения центральной нервной системы, противокашлевые и противозастойные средства, диуретики, отхаркивающие средства, средства для лечения заболеваний желудочно-кишечного тракта, анестетики, муколитические средства, мышечные релаксанты, средства для лечения остеопороза, стимулирующие средства, никотинсодержащие средства и седативные средства.
Примеры применимых средств для лечения желудочно-кишечного тракта включают в себя без ограничений антациды, такие как алюминийсодержащие фармацевтически активные вещества (например, карбонат алюминия, гидроксид алюминия, карбонат дигидроксиалюминия натрия и фосфат алюминия), бикарбонатсодержащие фармацевтически активные вещества, висмутсодержащие фармацевтически активные вещества (например, алюминат висмута, карбонат висмута, субкарбонат висмута, субгаллат висмута и субнитрат висмута), кальцийсодержащие фармацевтически активные вещества (например, карбонат кальция), глицин, магнийсодержащие фармацевтически активные вещества (например, магалдрат, алюмосиликаты магния, карбонат магния, глицинат магния, гидроксид магния, оксид магния и трисиликат магния), фосфатсодержащие фармацевтически активные вещества (например, фосфат алюминия или фосфат кальция), калийсодержащие фармацевтически активные вещества (например, бикарбонат калия), натрийсодержащие фармацевтически активные вещества (например, бикарбонат натрия) и силикаты, слабительные средства, такие как размягчающие стул слабительные средства (например, докузат) и слабительные стимулирующего действия (например, бисакодил); антагонисты H2-рецепторов, такие как фамотидин, ранитидин, циметидин и низатидин; ингибиторы протонового насоса, такие как омепразол, декслансопразол, эзомепразол, пантопразол, рабепразол и лансопразол; желудочно-кишечные цитопротекторы, такие как сукральфат и мизопростол; желудочно-кишечные прокинетики, такие как прукалоприд; антибиотики, активные в отношении H. pylori, такие как кларитромицин, амоксициллин, тетрациклин и метронидазол; противодиарейные средства, такие как субсалицилат висмута, каолин, дифеноксилат и лоперамид; гликопирролат, обезболивающие средства, такие как мезаламин; противорвотные средства, такие как ондансетрон, циклизин, дифенгидрамин, дименгидринат, меклизин, прометазин и гидроксизин; пробиотические бактерии, включающие в себя без ограничений молочнокислые бактерии, лактазу, рацекадотрил; ветрогонные средства, такие как полидиметилсилоксаны (например, диметикон и симетикон, включая описанные в патентах США №№ 4,906,478, 5,275,822 и 6,103,260); их изомеры и фармацевтически приемлемые соли и пролекарства (например, эфиры).
Примеры применимых анальгетиков, противовоспалительных и жаропонижающих средств включают в себя без ограничений нестероидные противовоспалительные лекарственные средства (НПВС), такие как производные пропионовой кислоты (например, ибупрофен, напроксен, кетопрофен, флурбипрофен, фенбуфен, фенопрофен, индопрофен, кетопрофен, флупрофен, пирпрофен, карпрофен, оксапрозин, пранопрофен и супрофен) и ингибиторы циклооксигеназы, такие как целекоксиб; ацетаминофен; ацетилсалициловую кислоту; производные уксусной кислоты, такие как индометацин, диклофенак, сулиндак и толметин; производные фенаминовой кислоты, такие как мефенаминовая кислота, меклофенаминовая кислота и флуфенаминовая кислота; производные бифенилкарбоновой кислоты, такие как дифлунизал и флуфенизал; а также оксикамы, такие как пироксикам, судоксикам, изоксикам и мелоксикам; их изомеры; а также их фармацевтически приемлемые соли и пролекарства.
Примеры антигистаминных средств и противозастойных средств включают в себя без ограничений бромфенирамин, хлорциклизин, дексбромфенирамин, бромгексан, фениндамин, фенирамин, пириламин, тонзиламин, приполидин, эфедрин, фенилэфрин, псевдоэфедрин, фенилпропаноламин, хлорфенирамин, декстрометорфан, дифенгидрамин, доксиламин, астемизол, терфенадин, фексофенадин, нафазолин, оксиметазолин, монтелукаст, пропилгексадрин, трипролидин, клемастин, акривастин, прометазин, оксомемазин, меквитазин, буклизин, бромгексин, кетотифен, терфенадин, эбастин, оксатамид, ксиломеазолин, лоратидин, дезлоратидин и цетиризин; их изомеры; а также их фармацевтически приемлемые соли и эфиры.
Примеры противокашлевых и отхаркивающих средств включают в себя без ограничений дифенгидрамин, декстрометорфан, носкапин, клофедианол, ментол, бензонатат, этилморфон, кодеин, ацетилцистеин, карбоцистеин, амброксол, алкалоиды красавки обыкновенной, собренол, гваякол и гвайфенезин; их изомеры; а также их фармацевтически приемлемые соли и пролекарства.
Примеры мышечных релаксантов включают в себя без ограничений циклобензаприн и хлорзоксазон, метаксалон, орфенадрин и метокарбамол; их изомеры; а также их фармацевтически приемлемые соли и пролекарства.
Примеры стимулирующих средств включают в себя без ограничений кофеин.
Примеры седативных средств включают в себя без ограничений снотворные средства, такие как антигистаминные средства (например, дифенгидрамин), эсзопиклон и золпидем, а также их фармацевтически приемлемые соли и пролекарства.
Примеры средств для подавления аппетита включают в себя без ограничений фенилпропаноламин, фентермин и диэтилкатинон, их фармацевтически приемлемые соли и пролекарства.
Примеры анестетиков (например, при лечении боли в горле) включают в себя без ограничений диклонин, бензокаин и пектин, их фармацевтически приемлемые соли и пролекарства.
Примеры применимых статинов включают в себя без ограничений аторвастин, розувастатин, флувастатин, ловастатин, симвастатин, аторвастатин, правастатин и их фармацевтически приемлемые соли и пролекарства.
В одном варианте осуществления фармацевтически активное вещество, добавляемое в таблетку, выбирают из фенилэфрина, декстрометорфана, псевдоэфедрина, ацетаминофена, цетиризина, аспирина, никотина, ранитидина, ибупрофена, кетопрофена, лоперамида, фамотидина, карбоната кальция, симетикона, хлорфенирамина, метокарбамола, хлорфедианола, аскорбиновой кислоты, пектина, диклонина, бензокаина и ментола, а также их фармацевтически приемлемых солей и пролекарств.
Как описано выше, фармацевтически активные вещества, составляющие предмет настоящего изобретения, могут также присутствовать в форме фармацевтически приемлемых солей, таких как кислотные/анионные или основные/катионные соли. Фармацевтически приемлемые кислотные/анионные соли включают в себя без ограничений ацетат, бензолсульфонат, бензоат, бикарбонат, битартрат, бромид, эдетат кальция, камзилат, карбонат, хлорид, цитрат, дигидрохлорид, эдетат, эдисилат, эстолат, эзилат, фумарат, глицептат, глюконат, глутамат, гликолиларсанилат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксинафтоат, иодид, изетионат, лактат, лактобионат, малат, малеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, мукат, напсилат, нитрат, памоат, пантотенат, фосфат/дифосфат, полигалактуронат, салицилат, стеарат, субацетат, сукцинат, сульфат, таннат, тартрат, теоклат, тозилат и триэтиодид. Фармацевтически приемлемые основные/катионные соли включают в себя без ограничений соли алюминия, бензатина, кальция, хлорпрокаина, холина, диэтаноламина, этилендиамина, лития, магния, меглумина, калия, прокаина, натрия и цинка.
Как описано выше, фармацевтически активные вещества, составляющие предмет настоящего изобретения, также могут присутствовать в форме пролекарств фармацевтически активных веществ. В целом такие пролекарства будут представлять собой функциональные производные фармацевтически активного вещества, которые легко преобразуются in vivo в необходимое фармацевтически активное вещество. Стандартные процедуры отбора и получения применимых производных пролекарств описаны, например, в работе Design of Prodrugs, под ред. H. Bundgaard, Elsevier, 1985 г. В дополнение к солям, настоящее изобретение предусматривает использование эфиров, амидов и других защищенных или производных форм описанных соединений.
Когда фармацевтически активные вещества в соответствии с настоящим изобретением имеют по меньшей мере один хиральный центр, следовательно, они могут существовать в виде энантиомеров. Когда фармацевтически активные вещества обладают двумя и более хиральными центрами, они могут дополнительно существовать в виде диастереомеров. Следует понимать, что все такие изомеры и их смеси входят в объем настоящего изобретения. Более того, подразумевается, что некоторые кристаллические формы фармацевтически активных веществ могут существовать в виде полиморфов, которые входят в объем настоящего изобретения. Кроме того, некоторые фармацевтически активные вещества могут образовывать сольваты с водой (например, гидраты) или обычными органическими растворителями, и подразумевается, что такие сольваты также входят в объем настоящего изобретения.
В одном варианте осуществления фармацевтически активное вещество или вещества присутствуют в таблетке в терапевтически эффективном количестве, которое представляет собой количество, которое способствует появлению необходимого терапевтического эффекта при пероральном введении и легко может быть определено специалистом в данной области. Как известно специалистам в данной области, при определении таких количеств необходимо принимать во внимание конкретное вводимое фармацевтически активное вещество, его характеристики биодоступности, режим дозирования, возраст и вес пациента, а также другие факторы.
Фармацевтически активное вещество может присутствовать в различных формах. Например, фармацевтически активное вещество может быть диспергировано на молекулярном уровне, например, быть расплавлено внутри таблетки, или может присутствовать в форме частиц, которые в свою очередь могут иметь или не иметь покрытие. Если фармацевтически активное вещество присутствует в форме частиц (с покрытием или без него), то средний размер частиц, как правило, составляет от приблизительно 1 до приблизительно 2000 мкм. В одном варианте осуществления такие частицы представляют собой кристаллы со средним размером частиц от приблизительно 1 до приблизительно 300 мкм. В другом варианте осуществления частицы представляют собой гранулы или пеллеты со средним размером частиц от приблизительно 50 до приблизительно 2000 мкм, как например, от приблизительно 50 до приблизительно 1000 мкм, как например, от приблизительно 100 до приблизительно 800 мкм.
Перед нанесением маскирующего вкус покрытия фармацевтически активное вещество может присутствовать в чисто кристаллической или гранулированной форме. Технологию гранулирования можно использовать для улучшения характеристик сыпучести или размера частиц фармацевтически активных веществ для облегчения прессования или последующего покрытия. Применимые связывающие вещества для использования в технологии гран