Лекарственные формы, соли и полиморфы транснорсертралина и их применение
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и представляет собой фармацевтическую композицию, включающую транснорсертралин или его фармацевтически приемлемую соль или сольват и маннит или ксилит, а также способ лечения, предотвращения или уменьшения рецидивов неврологического нарушения, включающий введение пациенту указанной композиции. Изобретение обеспечивает создание фармацевтической композиции на основе транснорсертралина, обладающей улучшенной химической и физической стабильностью. 2 н. и 9 з.п. ф-лы, 26 табл., 10 ил.
Реферат
Настоящая заявка испрашивает приоритет предварительной заявки на патент США 61/266864, поданной 4 декабря 2009 года, все содержание которой включено в настоящую заявку путем отсылки.
1. ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
В настоящей заявке предложены фармацевтические композиции, включающие транснорсертралин, соли и полиморфные формы транснорсертралина, способы получения композиций, а также способы их применения для лечения нарушений ЦНС, включая депрессию.
2. УРОВЕНЬ ТЕХНИКИ
2.1 Транснорсертралин
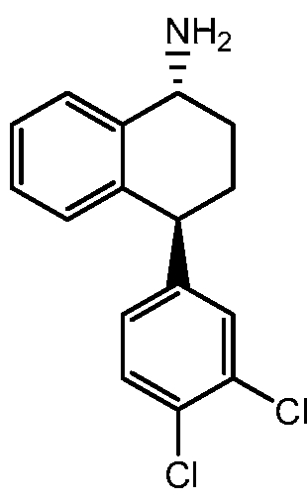
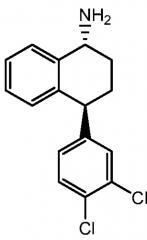
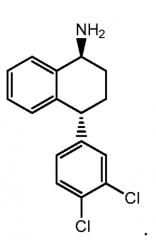
Транснорсертралин, то есть (1R,4S)-транс-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамин и (1S,4R)-транс-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамин, описаны, например, в патенте США 7087785 B2 ("патент '785"; полностью включен в настоящую заявку путем отсылки), имеет следующие химические структуры, соответственно:
и
Применения транснорсертралина в лечении, предотвращении или менеджменте аффективных расстройств и различных других нарушений ЦНС также раскрыты в патенте '785. Такие нарушения включают, помимо прочего, депрессию, расстройства настроения, тревожные расстройства, поведенческие расстройства, расстройства пищевого поведения, расстройства, связанные со злоупотреблением психоактивными веществами, а также нарушения половой функции.
2.2 Соли и полиморфные формы
Независимо от нахождения в кристаллической или аморфной форме, потенциальные твердые формы фармацевтического соединения включают однокомпонентные и многокомпонентные твердые вещества. Однокомпонентные твердые вещества состоят по существу из фармацевтического соединения при отсутствии других соединений. Разнообразие среди однокомпонентных кристаллических материалов потенциально может возникать, например, в результате явления полиморфизма, когда для определенного фармацевтического соединения существует несколько трехмерных структур (см., например, S. R. Byrn et al., Solid State Chemistry of Drugs, (1999) SSCI, West Lafayette).
Твердые формы, такие как соли, кристаллические формы, например, полиморфные формы соединения, как известно в области фармацевтики, влияют, например, на растворимость, стабильность, текучесть, хрупкость и сжимаемость соединения, а также на безопасность и эффективность лекарственных препаратов на основе данного соединения (см., например, Knapman, K. Modern Drug Discoveries, 2000:53).
Важность изучения полиморфов была подчеркнута в случае ритонавира, ингибитора протеазы ВИЧ, который был включен в мягкие желатиновые капсулы. Приблизительно через два года после начала производства препарата непредвиденное осаждение нового, менее растворимого полиморфа в лекарственной форме потребовало изъятия препарата с рынка до разработки более стабильной лекарственной формы (см. S. R. Chemburkar et al, Org. Process Res. Dev., (2000) 4:413-417). Таким образом, приготовление твердых форм имеет большое значение при создании безопасного, эффективного, устойчивого и отвечающего требованиям рынка фармацевтического соединения.
Новые соли и полиморфные формы транснорсертралина могут способствовать развитию лекарственных форм для лечения, предотвращения или терапии нарушений ЦНС.
2.3 Лечение неврологических нарушений
Серотонин, т.е. 5-HT, как известно, играет важную роль в лечении различных нарушений ЦНС. Среди прочих рецепторы 5-HT1A (серотонина 1A) обеспечивают важный механизм регуляции секреции 5-HT в мозге. Указанные рецепторы расположены пресинаптически в ядрах шва, где они функционируют как ауторецепторы, ингибирующие частоту разряда 5-HT нейронов. Рецепторы 5-HT1A также расположены постсинаптически в кортиколимбических областях, где они также уменьшают импульсную активность 5-HT нейронов. При инициировании лечения селективными ингибиторами обратного захвата серотонина (SSRI) или ингибиторами обратного захвата норэпинефрина и серотонина (SNRI), ауторецепторы 5-HT1A активизируются 5-HT, что приводит к снижению импульсной активности 5-HT нейронов. Впрочем, по мере продолжения терапии SSRI или SNRI ауторецепторы 5-HT1A теряют чувствительность, и импульсная активность восстанавливается. Такое адаптивное изменение, как предполагают, вносит вклад, по меньшей мере, частичный, в замедление эффективности SSRI и SNRI при лечении различных неврологических нарушений.
Таким образом, существует потребность в лечении, предотвращении или менеджменте различных неврологических нарушений, где может быть минимизирована десенсибилизация 5-HT рецепторов и может сохраняться увеличение импульсов 5-HT нейронов.
3. СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящей заявке предложены фармацевтические композиции, включающие транснорсертралин, соли и полиморфные формы транснорсертралина, способы получения композиций с солями и полиморфными формами, а также способы их применения для лечения нарушений ЦНС, включая депрессию.
В одном варианте осуществления предложены стабильные фармацевтические композиции и/или лекарственные формы транснорсертралина или его фармацевтически приемлемой соли или сольвата.
В другом варианте осуществления предложена соль транснорсертралина, выбранная из группы, состоящей из гидрохлорида, ацетата, L-малата, безилата, бензоата, тозилата, фумарата, гидробромида, малеата, цитрата, фосфата, сукцината, L-тартрата, D-тартрата, S-манделата и пироглутамата.
В одном варианте осуществления солью является гидрохлорид. В одном варианте осуществления гидрохлорид транснорсертралина является безводным твердым веществом. В другом варианте осуществления гидрохлорид транснорсертралина существует в виде моногидрата.
В одном варианте осуществления гидрохлорид транснорсертралина является гидрохлоридом (1R,4S)-транснорсертралина, то есть гидрохлоридом (1R,4S)-транс-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамина. В другом варианте осуществления гидрохлорид транснорсертралина является гидрохлоридом (1S,4R)-транснорсертралина, то есть гидрохлоридом (1S,4R)-транс-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамина.
Также в настоящей заявке предложены способы лечения, предотвращения или менеджмента неврологических нарушений, включающие введение субъекту (например, пациенту) лекарственной формы, соли или полиморфа транснорсертралина, раскрытых в настоящей заявке. Неврологические нарушения, которые являются объектом лечения, предотвращения или менеджмента предложенными в настоящей заявке способами, подробно описаны далее.
В некоторых вариантах осуществления лекарственная форма, соль или полиморф транснорсертралина вводят в комбинации с одним или более дополнительными терапевтическими средствами или соответствующими фармацевтически приемлемыми солями, сольватами или стереоизомерами.
4. КРАТКОЕ ОПИСАНИЕ ФИГУР
На Фиг.1A представлена кристаллическая форма безводного транснорсертралина гидрохлорида.
На Фиг.1B представлена кристаллическая форма моногидрата транснорсертралина гидрохлорида.
На Фиг.2 представлена расчетная порошковая дифракционная рентгенограмма (XRPD) безводного транснорсертралина гидрохлорида.
На Фиг.3 представлена экспериментальная рентгенограмма XRPD безводного транснорсертралина гидрохлорида.
На Фиг.4 представлена диаграмма ORTEP безводного транснорсертралина гидрохлорида.
На Фиг.5 представлена расчетная рентгенограмма XRPD моногидрата транснорсертралина гидрохлорида.
На Фиг.6 представлена экспериментальная рентгенограмма XRPD моногидрата транснорсертралина гидрохлорида.
На Фиг.7 представлена диаграмма ORTEP моногидрата транснорсертралина гидрохлорида.
Фиг.8 является типичной ВЭЖХ-хроматограммой таблеток 1 мг транснорсертралина гидрохлорида примера 6.27.
Фиг.9 представляет собой наложение ВЭЖХ-хроматограмм из исследований стабильности примера 6.31.
5. ПОДРОБНОЕ ОПИСАНИЕ
В настоящей заявке предложены фармацевтические композиции, включающие транснорсертралин, соли и полиморфные формы транснорсертралина, способы получения композиций с солями и полиморфными формами, а также способы их применения для лечения нарушений ЦНС, включая депрессию.
В одном варианте осуществления предложены стабильные фармацевтические композиции и/или лекарственные формы транснорсертралина или его фармацевтически приемлемой соли или сольвата.
В одном варианте осуществления стабильные фармацевтические композиции и/или лекарственные формы транснорсертралина включают менее чем приблизительно 3 мас.% соединения формулы (II):
В другом варианте осуществления стабильные фармацевтические композиции и/или лекарственные формы транснорсертралина включают менее чем приблизительно 1,5% или менее чем приблизительно 1 мас.% соединения формулы (II).
В другом варианте осуществления стабильные фармацевтические композиции и/или лекарственные формы транснорсертралина включают менее чем приблизительно 4 мас.% соединений формулы (III):
и
В другом варианте осуществления стабильные фармацевтические композиции и/или лекарственные формы транснорсертралина включают менее чем приблизительно 2% или менее чем приблизительно 1 мас.% соединений формулы (III).
В другом варианте осуществления стабильные фармацевтические композиции и/или лекарственные формы транснорсертралина включают менее чем приблизительно 3 мас.% соединения формулы (II) и менее чем приблизительно 4 мас.% соединений формулы (III).
В другом варианте осуществления стабильные фармацевтические композиции и/или лекарственные формы транснорсертралина включают менее чем приблизительно 1,5 мас.% соединения формулы (II) и менее чем приблизительно 2 мас.% соединений формулы (III).
В другом варианте осуществления стабильные фармацевтические композиции и/или лекарственные формы транснорсертралина включают менее чем приблизительно 1 мас.% каждого из соединений формул (II) и (III).
В некоторых вариантах осуществления, не связываясь ни с какой определенной теорией, предполагается, что соединение формулы (II) представляет собой аддукты транснорсертралина, образованные при разложении транснорсертралина в фармацевтической лекарственной форме, например, таблетке, в присутствии маннозы.
В некоторых вариантах осуществления, не связываясь ни с какой определенной теории, предполагается, что соединения формулы (III) представляют собой продукты окислительного разложения транснорсертралина, образованные при разложении транснорсертралина в фармацевтической лекарственной форме, например, таблетке, в присутствии фосфата дикальция (например, A-TAB).
В одном варианте осуществления предложенные в настоящей заявке стабильные фармацевтические композиции находятся в лекарственной форме с немедленным высвобождением.
В другом варианте осуществления предложенные в настоящей заявке стабильные фармацевтические композиции находятся в лекарственной форме с контролируемым высвобождением.
В одном варианте осуществления фармацевтическая композиция включает транснорсертралин или его фармацевтически приемлемую соль или сольват, а также маннит, ксилит или их комбинацию. В одном варианте осуществления фармацевтическая композиция включает транснорсертралин или его фармацевтически приемлемую соль или сольват и приблизительно по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% или 98 мас.% маннита или ксилита.
В другом варианте осуществления фармацевтическая композиция включает транснорсертралин или его фармацевтически приемлемую соль или сольват и маннит. В одном варианте осуществления фармацевтическая композиция включает транснорсертралин или его фармацевтически приемлемую соль или сольват и приблизительно по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% или 98 мас.% маннита.
В одном варианте осуществления предложена стабильная фармацевтическая композиция, которая включает транснорсертралин или его фармацевтически приемлемую соль или сольват и маннит, где стабильная фармацевтическая композиция содержит от менее чем приблизительно 1 мкг до приблизительно 100 мкг маннозы на 100 мг маннита. В другом варианте осуществления стабильная фармацевтическая композиция содержит от менее чем приблизительно 10 мкг до приблизительно 100 мкг маннозы на 100 мг маннита. В другом варианте осуществления стабильная фармацевтическая композиция содержит от менее чем приблизительно 1 мкг до приблизительно 50 мкг маннозы на 100 мг маннита. В другом варианте осуществления стабильная фармацевтическая композиция содержит от менее чем приблизительно 1 мкг до приблизительно 20 мкг маннозы на 100 мг маннита. В другом варианте осуществления стабильная фармацевтическая композиция содержит менее чем приблизительно 10 мкг или менее чем приблизительно 5 мкг маннозы на 100 мг маннита.
В одном варианте осуществления предложены фармацевтические композиции, которые являются стабильными в течение по меньшей мере от приблизительно 5 до приблизительно 30 недель. В другом варианте осуществления композиции стабильны при температуре от приблизительно 20°C до приблизительно 50°C в течение по меньшей мере от приблизительно 5 до приблизительно 30 недель. В другом варианте осуществления композиции стабильны при температуре от приблизительно 20°C до приблизительно 50°C в течение по меньшей мере от приблизительно 5 до приблизительно 30 недель при относительной влажности от приблизительно 35% до приблизительно 85%.
В другом варианте осуществления, когда фармацевтическая композиция включает маннит, комбинация вспомогательных веществ в композиции, без активного компонента, содержит, или образует при хранении в течение от приблизительно 5 до приблизительно 30 недель, при температуре от приблизительно 20°C до приблизительно 50°C и при относительной влажности от приблизительно 35% до приблизительно 85%, в герметичной упаковке, менее чем приблизительно 0,05% маннозы по отношению к массе маннита. В другом варианте осуществления длительность указанного хранения составляет приблизительно 24 недели. В другом варианте осуществления указанная температура составляет приблизительно 30°C. В другом варианте осуществления указанная температура составляет приблизительно 40°C. В другом варианте осуществления указанная относительная влажность составляет приблизительно 65%. В другом варианте осуществления указанная относительная влажность составляет приблизительно 75%. В другом варианте осуществления фармацевтическая композиция содержит или образует менее чем приблизительно 0,02% маннозы; или менее чем приблизительно 0,01% маннозы по отношению к весу маннита.
В одном варианте осуществления фармацевтическая композиция дополнительно включает стеарат магния, стеарат кальция, стеарат цинка или стеариновую кислоту. В одном варианте осуществления фармацевтическая композиция дополнительно включает по меньшей мере 0,1%, 0,2%, 0,5%, 0,75%, 1%, 1,5%, 2%, 3% или 5 мас.% стеарата магния, стеарата кальция, стеарата цинка или стеариновой кислоты.
В одном варианте осуществления фармацевтическая композиция дополнительно включает тальк, каолин или бентонит. В одном варианте осуществления фармацевтическая композиция дополнительно включает по меньшей мере 0,5%, 1%, 2%, 3%, 5%, 10%, 15%, 20%, 30% или 40 мас.% талька, каолина или бентонита.
В другом варианте осуществления предложена фармацевтическая композиция, включающая транснорсертралин или его фармацевтически приемлемую соль или сольват, маннит, стеарат магния, тальк и крахмалгликолят натрия.
В другом варианте осуществления предложена фармацевтическая композиция, включающая транснорсертралин или его фармацевтически приемлемую соль или сольват, 10-98 мас.% маннита, стеарата магния, талька и крахмалгликолята натрия.
В другом варианте осуществления фармацевтическая композиция включает 50-98 мас.% маннита.
В другом варианте осуществления фармацевтическая композиция включает 80-98 мас.% маннита.
В другом варианте осуществления фармацевтическая композиция включает 85-98 мас.% маннита.
В другом варианте осуществления фармацевтическая композиция включает 86-98 мас.% маннита.
В одном варианте осуществления фармацевтическая композиция представляет собой капсулу, включающую транснорсертралин или его фармацевтически приемлемую соль или сольват, маннит, тальк, крахмалгликолят натрия и стеарат магния в оболочке капсулы. Капсула может быть приготовлена с дозой транснорсертралина 0,5, 1,0 или 2,0 мг. Капсула может быть приготовлена с массой содержимого капсулы 100, 150, 200 или 300 мг.
В другом варианте осуществления фармацевтическая композиция представляет собой таблетку, включающую транснорсертралин или его фармацевтически приемлемую соль или сольват, маннит, тальк, крахмалгликолят натрия и стеарат магния. Таблетка может быть с оболочкой или без нее. Таблетка может быть приготовлена с дозой транснорсертралина 0,5, 1,0 или 2,0 мг. Таблетка может быть приготовлена в виде таблетки весом 100, 150, 200 или 300 мг.
В некоторых вариантах осуществления маннит, используемый в приготовлении предложенных в настоящей заявке композиций, представляет собой Pearlitol 160C.
В некоторых вариантах осуществления крахмалгликолят натрия, используемый в приготовлении предложенных в настоящей заявке композиций, представляет собой Primojel.
Также в настоящей заявке предложен способ определения пригодности вспомогательного вещества или комбинации вспомогательных веществ для применения в лекарственной форме транснорсертралина, предложенной в настоящей заявке. В одном варианте осуществления способ включает определение уровня маннозы в образце маннита или в содержащей маннит лекарственной форме, предложенной в настоящей заявке, где уровень маннозы в манните, меньше или равный приблизительно 0,1 мас.%, указывает на пригодность для применения в стабильной лекарственной форме транснорсертралина.
В другом варианте осуществления уровень маннозы в манните, меньше или равный приблизительно 0,05 мас.%, указывает на пригодность для применения в стабильной лекарственной форме транснорсертралина.
В другом варианте осуществления уровень маннозы в манните, меньше или равный приблизительно 0,02 мас.%, указывает на пригодность для применения в стабильной лекарственной форме транснорсертралина.
В другом варианте осуществления уровень маннозы в манните, меньше или равный приблизительно 0,01 мас.%, указывает на пригодность для применения в стабильной лекарственной форме транснорсертралина.
В одном варианте осуществления способ определения уровня маннозы в манните или в содержащей маннит лекарственной форме, предложенной в настоящей заявке, включает применение установки ВЭЖХ (высокоэффективной жидкостной хроматографии). В другом варианте осуществления установки ВЭЖХ включает детектор заряженного аэрозоля Corona®.
В другом варианте осуществления способ определения уровня маннозы в манните или в содержащей маннит лекарственной форме, предложенной в настоящей заявке, включает применение ионной хроматографии (ИХ).
Также в настоящей заявке предложена соль транснорсертралина, выбранная из группы, состоящей из гидрохлорида, ацетата, L-малата, безилата, бензоата, тозилата, фумарата, гидробромида, малеата, цитрата, фосфата, сукцината, L-тартрата, D-тартрата, S-манделата и пироглутамата.
В одном варианте осуществления соль является гидрохлоридной солью. В одном варианте осуществления гидрохлоридная соль транснорсертралина является безводным твердым веществом. В другом варианте осуществления гидрохлоридная соль транснорсертралина существует в виде моногидрата.
В одном варианте осуществления гидрохлорид транснорсертралина является гидрохлоридом (1R,4S)-транснорсертралина, т.е. гидрохлоридом (1R,4S)-транс-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамина. В другом варианте осуществления гидрохлорид транснорсертралина является гидрохлоридом (1S,4R)-транснорсертралина, т.е. гидрохлоридом (1S,4R)-транс-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-1-нафталинамина.
В одном варианте осуществления гидрохлоридная соль транснорсертралина по существу не содержит воды.
В одном варианте осуществления гидрохлоридная соль транснорсертралина является кристаллическим ангидратом.
В одном варианте осуществления гидрохлоридная соль ангидрата транснорсертралина имеет порошковую дифракционную рентгенограмму, включающую пики приблизительно при 14,9, 17,8, 19,2, 23,3, 24,6 и 25,2 градусах 2θ. В другом варианте осуществления гидрохлоридная соль ангидрата транснорсертралина имеет порошковую дифракционную рентгенограмму, дополнительно включающую пики приблизительно при 5,0 и 21,8 градусах 2θ.
В одном варианте осуществления гидрохлоридная соль ангидрата транснорсертралина имеет расчетную порошковую дифракционную рентгенограмму, включающую пики приблизительно при 5,0, 15,0, 18,0, 19,5, 22,0, 23,5, 24,8 и 25,4 градусах 2θ, на основе данных, полученных приблизительно при 173 К на монокристалле.
В одном варианте осуществления гидрохлоридная соль ангидрата транснорсертралина имеет следующие приблизительные параметры элементарной ячейки:
a=16,8 Å, b=5,2 Å, c=19,1 Å, α=90,0°, β=113,1° и γ=90,0°.
В другом варианте осуществления гидрохлоридная соль ангидрата транснорсертралина имеет следующие приблизительные параметры элементарной ячейки при измерении приблизительно при 173 К:
a=16,83 Å, b=5,23 Å, c=19,06 Å, α=90,00°, β=113,10° и γ=90,00°.
В другом варианте осуществления приблизительные параметры элементарной ячейки являются следующими:
a=16,834 Å, b=5,226 Å, c=19,059 Å, α=90,00°, β=113,10° и γ=90,00°.
В одном варианте осуществления гидрохлоридная соль ангидрата транснорсертралина имеет группу симметрии C2 (номер 5).
В одном варианте осуществления гидрохлоридная соль ангидрата транснорсертралина имеет элементарную ячейку, которая содержит четыре гидрохлорида транснорсертралина (Z=4).
В одном варианте осуществления гидрохлоридная соль ангидрата транснорсертралина имеет плотность приблизительно 1,4 г·см-3.
В одном варианте осуществления гидрохлоридная соль транснорсертралина представляет собой моногидрат.
В другом варианте осуществления гидрохлоридная соль моногидрата транснорсертралина является кристаллической.
В одном варианте осуществления гидрохлоридная соль моногидрата транснорсертралина имеет порошковую дифракционную рентгенограмму, включающую пики приблизительно при 12,1, 13,0, 16,8, 17,8, 20,4, 23,4, 24,2 и 27,1 градусах 2θ. В другом варианте осуществления гидрохлоридная соль моногидрата транснорсертралина имеет порошковую дифракционную рентгенограмму, которая дополнительно включает пики приблизительно при 20,9, 21,1 и 26,2 градусах 2θ.
В одном варианте осуществления гидрохлоридная соль моногидрата транснорсертралина имеет расчетную порошковую дифракционную рентгенограмму, включающую пики приблизительно при 12,1, 13,1, 16,9, 17,9, 20,5, 21,0, 21,3, 23,6, 24,3, 26,3 и 27,2 градусах 2θ, на основе данных, полученных приблизительно при 150 К на монокристалле.
В одном варианте осуществления гидрохлоридная соль моногидрата транснорсертралина имеет следующие приблизительные параметры элементарной ячейки:
a=7,3 Å, b=7,6 Å, c=15,3 Å, α=90,0°, β=90,1° и γ=90,0°.
В другом варианте осуществления гидрохлоридная соль моногидрата транснорсертралина имеет следующие приблизительные параметры элементарной ячейки при измерении приблизительно при 150 K:
a=7,30 Å, b=7,56 Å, c=15,29 Å, α=90,00°, β=90,09° и γ=90,00°.
В другом варианте осуществления приблизительные параметры элементарной ячейки являются следующими:
a=7,296 Å, b=7,557 Å, c=15,287 Å, α=90,00°, β=90,09° и γ=90,00°.
В одном варианте осуществления гидрохлоридная соль моногидрата транснорсертралина имеет группу симметрии P2 1 (номер 4).
В одном варианте осуществления гидрохлоридная соль моногидрата транснорсертралина имеет элементарную ячейку, которая содержит два гидрохлорида транснорсертралина (Z=2).
В одном варианте осуществления гидрохлоридная соль моногидрата транснорсертралина имеет плотность приблизительно 1,4 г·см-3.
Также в настоящей заявке предложен способ лечения, предотвращения или менеджмента неврологического нарушения, включающий введение пациенту терапевтически или профилактически эффективного количества гидрохлорида транснорсертралина или его фармацевтически приемлемого сольвата или стереоизомера.
В одном варианте осуществления предложен способ лечения, предотвращения или менеджмента неврологического нарушения, включающий введение пациенту предложенной в настоящей заявке композиции, которая включает терапевтически или профилактически эффективное количество транснорсертралина или его фармацевтически приемлемой соли, сольвата или стереоизомера.
В одном варианте осуществления неврологическим нарушением является депрессия, когнитивные расстройства, фибромиалгия, боль, нарушение сна, синдром хронической усталости, синдром дефицита внимания (ADD), синдром дефицита внимания с гиперактивностью (ADHD), синдром беспокойных ног, шизофрения, тревога, обсессивно-компульсивное расстройство, посттравматическое стрессовое расстройство, сезонное аффективное расстройство (SAD), предменструальная дисфория, постменопаузальные вазомоторные симптомы, нейродегенеративное заболевание, маниакальные состояния, дистимическое расстройство, циклотимическое расстройство, ожирение или злоупотребление или зависимость от психоактивных веществ.
В одном варианте осуществления способ включает введение пациенту терапевтически или профилактически эффективного количества композиции транснорсертралина, предложенной в настоящей заявке, в качестве дополнительной терапии.
В одном варианте осуществления способ дополнительно включает введение пациенту терапевтически или профилактически эффективного количества одного или более дополнительных активных веществ.
5.1 Определения
В настоящем описании, и если не указано иное, термины "лечить" и "лечение" относятся к устранению или уменьшению интенсивности заболевания или нарушения, или одного или более симптомов, связанных с заболеванием или нарушением. В некоторых вариантах осуществления термины относятся к уменьшению распространения или ухудшения заболевания или нарушения, достигнутому в результате введения одного или более профилактических или терапевтических средств субъекту с таким заболеванием или нарушением. В некоторых вариантах осуществления термины относятся к введению предложенного в настоящей заявке соединения, с или без другого дополнительного активного вещества, после появления симптомов конкретного заболевания.
В настоящем описании, и если не указано иное, термин "предотвращать" и "предотвращение" относятся к предотвращению появления, повтора или распространения заболевания или нарушения, или их одного или нескольких симптомов. В некоторых вариантах осуществления термины относятся к лечению с или введению предложенного в настоящей заявке соединения, с или без другого дополнительного активного соединения, до появления симптомов, в особенности пациентам с риском развития заболевания или нарушения, представленных в настоящей заявке. Термины охватывают ингибирование или уменьшение симптома конкретного заболевания. Пациенты со случаем заболевания в семейном анамнезе в особенности являются кандидатами на применение схем предотвращения в некоторых вариантах осуществления. Кроме того, пациенты, которые в анамнезе имеют рецидив симптомов, также являются потенциальными кандидатами на предотвращение. В этой связи, термин "предотвращение" может использоваться попеременно с термином "профилактическое лечение".
В настоящем описании, и если не указано иное, термин "менеджмент заболевания" относится к предотвращению или замедлению прогрессии, распространения или ухудшения заболевания или нарушения, или их одного или нескольких симптомов. Часто благоприятные воздействия, которые субъект получает от профилактического и/или терапевтического средства, не приводят к излечению заболевания или нарушения. В этой связи, термин "менеджмент заболевания" охватывает лечение пациента, страдавшего конкретным заболеванием, в попытке предотвратить или свести к минимуму рецидивы заболевания.
В настоящем описании, и если не указано иное, "терапевтически эффективное количество" соединения является количеством, достаточным для обеспечения благоприятного терапевтического эффекта при лечении или менеджменте заболевания или нарушения, или задержки или минимизации одного или нескольких симптомов, связанных с заболеванием или нарушением. Терапевтически эффективное количество соединения означает количество терапевтического средства, одного или в комбинации с другими терапиями, которое обеспечивает благоприятный терапевтический эффект при лечении или менеджменте заболевания или нарушения. Термин "терапевтически эффективное количество" может охватывать количество, которое улучшает общую терапию, уменьшает или предотвращает развитие симптомов или причин заболевания или нарушения, или увеличивает терапевтическую эффективность другого терапевтического средства.
В настоящем описании, и если не указано иное, "профилактически эффективное количество" соединения является количеством, достаточным для предотвращения заболевания или нарушения, или предотвращения его рецидива. Профилактически эффективное количество соединения означает количество терапевтического средства, одного или в комбинации с другими средствами, которое обеспечивает благоприятный профилактический эффект при предотвращении заболевания. Термин "профилактически эффективное количество" может охватывать количество, которое улучшает общую профилактику или увеличивает профилактическую эффективность другого профилактического средства.
В настоящем описании, и если не указано иное, термин "субъект", как определено в настоящей заявке, включает животных, таких как млекопитающие, включая, помимо прочего, приматов (например, людей), коров, овец, коз, лошадей, собак, кошек, кроликов, крыс, мышей и т.п. В некоторых вариантах осуществления субъектом является человек.
В настоящем описании, и если не указано иное, термин "стабильный" относится к соединению или композиции, которые не подвергаются быстрому разложению или изменению химического состава или физического состояния. Стабильная композиция или лекарственная форма, предложенная в настоящей заявке, не подвергается существенному разложению при нормальных условиях производства или хранения.
В настоящем описании, и если не указано иное, термин "фармацевтически приемлемая соль" относится к солям, полученным из фармацевтически приемлемых нетоксичных кислот, включая неорганические кислоты и органические кислоты. Подходящие нетоксичные кислоты включают неорганические и органические кислоты, такие как, помимо прочих, уксусную, альгиновую, антраниловую, бензолсульфоновую, бензойную, камфорсульфоновую, лимонную, этенсульфоновую, муравьиную, фумаровую, фуранкарбоновую, глюконовую, глутаминовую, глюкореновую, галактуроновую, глицидную, бромоводородную, хлороводородную, изэтионовую, молочную, малеиновую, яблочную (например, L-яблочную), миндальную (например, S-миндальную), метансульфоновую, муциновую, азотную, памовую, пантотеновую, фенилуксусную, пропионовую, фосфорную, пироглутаминовую, салициловую, стеариновую, янтарную, сульфаниловую, серную, винную кислоту (например, L-винную кислоту и D-винную кислоту), п-толуолсульфоновую и т.п.
В настоящем описании, и если не указано иное, термин "сольват" означает предложенное в настоящей заявке соединение или его соль, которые дополнительно включают стехиометрическое или нестехиометрическое количество растворителя, связанного нековалентными межмолекулярными силами. В том случае, если растворителем является вода, сольват является гидратом.
Термины "твердая форма", "твердые формы" и подобные термины, при использовании в настоящем описании относятся к физической форме, включающей транснорсертралин или его соль, которая не находится в жидком или газообразном состоянии. Твердые формы могут быть кристаллическими, аморфными, частично кристаллическими и/или частично аморфными.
Термин "кристаллический" и подобные термины, используемые в настоящей заявке, при использовании для описания вещества, компонента или продукта, означают, что вещество, компонент или продукт являются по существу кристаллическими, согласно определению с помощью рентгеноструктурного анализа. См., например, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA, 173 (1990); The United States Pharmacopeia, 23rd ed., 1843-1844 (1995).
Термин "кристаллические формы" и подобные термины в настоящем описании относятся к различным кристаллическим модификациям, включающим данное вещество, в том числе к однокомпонентным кристаллическим формам и многокомпонентным кристаллическим формам, и включая, помимо прочего, полиморфы, сольваты, гидраты, кокристаллы и другие молекулярные комплексы, а также соли, сольваты солей, гидраты солей, другие молекулярные комплексы солей и их полиморфы. В некоторых вариантах осуществления кристаллическая форма вещества может по существу не содержать аморфных форм и/или других кристаллических форм. В других вариантах осуществления кристаллическая форма вещества может содержать приблизительно 1%, приблизительно 2%, приблизительно 3%, приблизительно 4%, приблизительно 5%, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45% или приблизительно 50% одной или более аморфных форм и/или других кристаллических форм в весовом и/или молярном отношении.
Различные кристаллические формы могут иметь различные физические свойства, такие как, например, температура плавления, теплота плавления, растворимость, скорость растворения и/или колебательные спектры, вследствие расположения или конформации молекул или ионов в кристаллической решетке. Различия в физических свойствах, демонстрируемые кристаллическими формами, влияют на такие фармацевтические параметры, как стабильность при хранении, сжимаемость и плотность (важна в процессе приготовления лекарственной формы и производства продукта), а также скорость растворения (важный фактор в биодоступности). Различия в стабильности могут быть обусловлены изменениями химической активности (например, дифференциальное окисление, при котором лекарственная форма обесцвечивается быстрее, когда она состоит из одной кристаллической формы, чем тогда, когда она содержит другую кристаллическую форму) или механическими изменениями (например, таблетки разрушаются при хранении при превращении одной кристаллической формы в другую), или и тем, и другим (например, таблетки одной кристаллической формы в большей степени подвержены разложению при высокой влажности). В результате присутствия различий в растворимости/растворении, в крайнем случае, некоторые переходы кристаллических форм могут приводить к снижению активности или, в другом крайнем случае, появлению токсичности. Кроме того, физические свойства кристаллической формы могут быть важны при технологической обработке; например, одна кристаллическая форма более склонна к образованию сольватов или с большей сложностью подвергается фильтрованию и промывке с удалением примесей (например, форма и распределение размеров частиц у разных кристаллических форм могут быть различными).
Кристаллические формы вещества могут быть получены множеством способов, известных из уровня техники. Такие способы включают, помимо прочих, перекристаллизацию из расплава, охлаждение расплава, перекристаллизацию из раствора, перекристаллизацию в ограниченном пространстве, например, в нанопорах или капиллярах, перекристаллизацию на поверхностях или матрицах, например, на полимерах, перекристаллизацию в присутствии добавок, таких как, например, кокристаллизационные противомолекулы, десольватацию, дегидратацию, быстрое испарение, быстрое охлаждение, медленное охлаждение, диффузию паров, возгонку, измельчение, измельчение в капле растворителя, осаждение, вызванное обработкой микроволновым излучением, осаждение, вызванное обработкой ул