Способ экспресс-диагностики анаэробной хирургической инфекции
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к способу экспресс-диагностики анаэробной хирургической инфекции. Сущность способа состоит в том, что в дистиллированной воде готовят серии разведений раневого содержимого различной концентрации: 1:1, 1:2 и 1:3, через проточный электрод джоульметрического прибора пропускают ток 0,005, 001 и 0,02 мА. Определяют зависимость работы тока от времени для каждого образца, оценивают динамику вольтамперных характеристик. По показателю работы тока от 0,003 до 1 мкДж судят об отсутствии анаэробных микроорганизмов в раневом содержимом. По показателю работы тока от 100 до 820 мкДж судят о наличии анаэробных микроорганизмов в раневом содержимом. Использование заявленного способа позволяет повысить эффективность диагностики анаэробной хирургической инфекции. 4 ил., 2пр.
Реферат
Изобретение относится к медицине, преимущественно к хирургии, и может быть использовано для ранней диагностики анаэробной инфекции у больных хирургического профиля. Цель изобретения - максимальное ускорение сроков диагностики анаэробной хирургической инфекции.
Анаэробный инфекционный процесс у больных хирургического профиля может быть вызван как клостридиальной флорой, так и неклостридиальными анаэробами [1]. Кроме того, возбудители анаэробной хирургической инфекции встречаются в комбинации с другими анаэробами или аэробными микроорганизмами [2], что усиливает их патогенность и токсигенность, а также создает низкий окислительно-восстановительный потенциал, благоприятный для развития анаэробов [3]. Поэтому заболевания, вызванные клостридиальными и неклостридиальными анаэробными микроорганизмами, биологически относят к одной группе инфекционной хирургической патологии [4].
Широко известно, что быстрое прогрессирование анаэробной хирургической инфекции представляет непосредственную угрозу для жизни больных в ближайшее время (1-3 суток с момента госпитализации). Поэтому проблема ранней диагностики и сокращение сроков лабораторных исследований при анаэробном инфекционном процессе крайне важна. Вместе с этим в ранней диагностике анаэробной инфекции основным способом остается оценка клинической картины заболевания, по которой хирург вынужден принимать решение о широком адекватном рассечении тканей с радикальным иссечением пораженных зон, максимальной интраоперационной ревизией, в том числе глубоких пространств, в самое непродолжительное время для сохранения жизни больного [2, 5, 6]. Как правило, все другие виды диагностики продолжительны по времени, не выполняются лабораториями лечебных учреждений круглосуточно и их результаты становятся известны уже после хирургического вмешательства, как подтверждение правильности действий хирурга.
В настоящее время разработан и применяется на практике способ диагностики анаэробной хирургической инфекции мягких тканей [7], который заключается в том, что у хирургических больных в сыворотке крови определяют содержание миоглобина путем реакции пассивной гемагглютинации и при значении этого показателя 2048 нг/мл и выше диагностируют анаэробную инфекцию мягких тканей.
Данный способ имеет ряд недостатков:
1. поздняя диагностика по срокам, так как кровь больного после взятия из вены необходимо дефибринировать и выдержать 1-3 ч при комнатной температуре, а затем выполнять исследование, которое тоже занимает достаточное количество времени.
2. необходимость дополнительных сведений об уровне уробилиногена в моче и количестве эритроцитов в крови, исследование которых также необходимо выполнять.
3. выявление повышенного содержания миоглобина в сыворотке крови может определяться и при других патологических состояниях: при генерализованном воспалительном процессе без участия анаэробной микрофлоры, острой интоксикации в результате укуса ядовитых насекомых, ожогах и др.
Известен еще один способ диагностики анаэробной хирургической инфекции [8], целью которого является получение индикаторной питательной среды для обнаружения патогенных анаэробных неспорообразующих бактерий путем смешивания 15 мас. стимулятора роста труднокультивируемых анаэробных аспорогенных бактерий с глюкозным индикаторным питательным агаром, отличающийся тем, что берут глюкозный агар с бромкрезоловым пурпуровым индикатором в количестве 47 мас., к полученной смеси дополнительно добавляют пептон и порошковый агар-агар в количестве 28 и 10 мас. соответственно, при этом все компоненты используют в сухом виде. Этот метод также имеет свои недостатки, такие как трудоемкость, длительность, а так же необходимость наличия в арсенале лабораторий лечебных учреждений большого массива дополнительных индикаторов и питательных сред для получения искомой индикаторной питательной среды.
Так же известен способ диагностики анаэробной газовой инфекции [9], включающий изготовление гомогената ткани очага поражения, его исследование методом хроматографического анализа с определением высших жирных кислот, по обнаружению некоторых из них судят о наличии анаэробной инфекции. Однако данный способ диагностики анаэробной инфекции не лишен недостатков. Во-первых, он является эффективным только при моноинфекции при наличии газовой гангрены. Во-вторых, нуждается в специальных условиях обработки материала, а так же необходимости специального оборудования для экстракции из гомогената высших жирных кислот, что затруднительно в лабораториях лечебных учреждений. В-третьих, способ требует достаточно большой длительности по времени выполнения.
Существует устройство для диагностики состояния биологических объектов [10], позволяющее получить информационную картину за короткий промежуток времени.
Из известных способов наиболее близким прототипом к предлагаемому является способ диагностики анаэробной инфекции [11], заключающийся в микроскопическом изучении высушенной после нанесения на прозрачную поверхность капли смеси раневого отделяемого с физиологическим раствором хлорида натрия в соотношении 1:(1-2), которую перед проведением исследования выдерживают в термостате в течение 1-1,5 ч при 37-37,5°C. При наличии пузырьковых образований диагностируют анаэробную инфекцию. Однако данный способ диагностики анаэробной инфекции достаточно длителен по времени выполнения, а именно, для получения информации о наличии анаэробной инфекции согласно этому способу требуется минимум 1-1,5 ч.
Таким образом, техническим результатом, на решение которого направлено данное изобретение, является быстрое получение информации о наличии анаэробной инфекции или ее отсутствии в раневом отделяемом с помощью получения вольтамперных характеристик для расчета и составления кривых зависимости работы тока в электрохимической реакции от времени для каждого образца.
Сущность предлагаемого способа заключается в том, что определяют характер возбудителя после вскрытия гнойной полости при хирургической инфекции тканей, и согласно предлагаемому способу, с помощью устройства для диагностики состояния биологических объектов осуществляют оценку вольтамперных характеристик раневого отделяемого и составление кривых зависимости работы тока от времени. В дистиллированной воде готовят серии разведений раневого отделяемого различной концентрации: 1:1, 1:2 и 1:3, которые последовательно пропускают через проточный электрод джоульметрического прибора. Через проточный электрод джоульметрического прибора пропускают ток 0,005, 0,01 и 0,02 мА, определяют зависимость работы тока от времени для каждого образца, оценивают динамику вольтамперных характеристик.
По показателю работы тока от 0,003 до 1 мкДж судят об отсутствии анаэробных микроорганизмов в исследуемом раневом содержимом. Это подтверждается данными бактериологического исследования, при котором в данных образцах раневого содержимого были обнаружены различные аэробные микроорганизмы (Escherichia coli, Staphylococcus epidermidis, Staphylococcus aureus, Enterococcus faecium, Staphylococcus saprophyticus и некоторые другие) при отсутствии анаэробных бактерий.
По показателю работы тока от 100 до 820 мкДж судят о наличии анаэробных микроорганизмов в исследуемом раневом содержимом. Это подтверждается данными бактериологического исследования, при котором в данных образцах раневого содержимого были обнаружены различные анаэробные микроорганизмы, в том числе факультативно анаэробные (Citrobacter diversus, Bacteroides fragilis, Enterobacter cloacae, бактерии рода Peptostreptococcus, Proteus и некоторые другие) при отсутствии или сочетании с аэробными бактериями.
Такое сочетание новых признаков с уже известными позволяет достоверно оценить электро-химические свойства раневого содержимого на основании изменения джоульметрических параметров за короткий промежуток времени, определить тем самым анаэробное или аэробное происхождение инфекции тканей организма и определить дальнейшую антимикробную терапию и хирургическую тактику.
Предлагаемый способ определения анаэробной инфекции иллюстрируется чертежами.
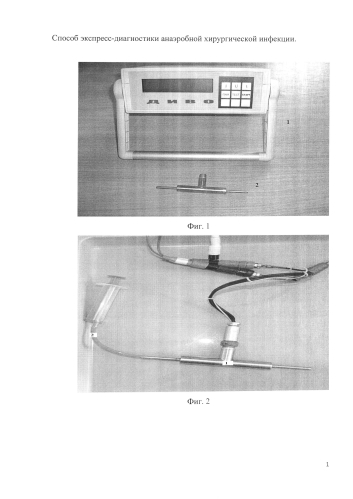
На фигуре 1 изображено устройство, реализующее способ, содержит джоульметрический прибор «Диво» (1) и проточный электрод (2).
На фигуре 2 изображен проточный электрод (1), через который пропускается разведенное раневое содержимое (2).
На фигуре 3 (больной Н., 38 года, история болезни №15590) изображены измеренные параметры в графической форме, которые свидетельствуют об отсутствии анаэробного компонента в инфекции мягких тканей.
На фигуре 4 (больной Д., 54 года, история болезни №31718) изображены измеренные параметры в графической форме, которые свидетельствуют о наличии анаэробного компонента в инфекции мягких тканей.
Способ осуществляется следующим образом. При вскрытии гнойной полости организма (например, при остром парапроктите) проводится забор раневого содержимого в количестве 2 мл. Затем в дистиллированной воде готовят серии разведений раневого содержимого различной концентрации: 1:1, 1:2 и 1:3. За время менее 6 секунд через проточный электрод джоульметрического прибора «Диво» пропускается ток 0,005, 0,01 и 0,02 мА. В программе IPC оцениваются полученные зависимости, которые представляют собой кривые со строго определенными значениями изменения потенциала во времени, кроме того, прослеживается динамика изменения вольтамперных характеристик раневого содержимого в разные периоды лечения больных. По полученным зависимостям рассчитывается работа для каждого значения тока, строятся графики, позволяющие судить об отсутствии или наличии анаэробного характера раневого содержимого.
Показатель работы тока от 0,003 до 1 мкДж свидетельствует об отсутствии анаэробных микроорганизмов в раневом содержимом; показатель работы тока в диапазоне от 100 до 820 мкДж свидетельствует о наличии анаэробных микроорганизмов в раневом содержимом.
Пример 1. Больной Н., 38 года. История болезни №15590. Поступил в Пензенскую областную клиническую больницу им. Н.Н. Бурденко 13.06.2013 г. через 3 суток с момента появления первых симптомов заболевания. Клинический диагноз: Острый ишиоректальный левосторонний парапроктит.
Больной обследован. В клиническом анализе крови лейкоцитоз 14,1×109/мл.
Пациенту проведена короткая предоперационная подготовка, после чего больной оперирован в экстренном порядке. Выполнено вскрытие, санация, дренирование острого ишиоректального левостороннего парапроктита. Полученное во время операции содержимое гнойной полости (раневое содержимое) исследовали. Данные джоульметрии: работа тока 0,003 мкДж, что свидетельствует об отсутствии анаэробного характера раневого содержимого, что было подтверждено при проведении бактериологического исследования раневого содержимого - обнаружен обильный рост аэробного микроорганизма - Escherichia coli.
Больному проведена консервативная терапия, включая эмпирическую антибактериальную терапию, направленную на подавление банальной микрофлоры (цефтриаксон, амикацин). С течением времени явления интоксикации, воспалительные явления в клиническом анализе крови нивелировались, рана очистилась. Выписан на 8 сутки в удовлетворительном состоянии.
Пример 2. Больной Д., 54 года. История болезни №31718. Поступил в Пензенскую областную клиническую больницу им. Н.Н. Бурденко 03.12.2013 г. через 3 суток с момента появления первых симптомов заболевания. Клинический диагноз: Острый гнилостно-некротический пельвиоректальный левосторонний парапроктит. Гнилостно-некротическая флегмона параректальных, паравезикальных клетчаточных пространств, промежности, передней брюшной стенки, забрюшинного пространства.
Пациент обследован. В клиническом анализе крови выраженный лейкоцитоз 17,6×109/мл.
Учитывая выраженную интоксикацию, проведена короткая предоперационная подготовка, после чего больной оперирован в экстренном порядке. Выполнено вскрытие, санация, дренирование острого пельвиоректального левостороннего парапроктита. Полученное во время операции содержимое гнойной полости (раневое содержимое) исследовали. Данные джоульметрии: работа тока 720 мкДж, что свидетельствует о присутствии в раневом содержимом анаэробных микроорганизмов. Учитывая последнее, больному назначена консервативная терапия, включая эмпирическую антибактериальную терапию, в том числе направленную на подавление анаэробной микрофлоры (метронидазол). Наличие анаэробных микроорганизмов в раневом содержимом подтверждено результатами бактериологического исследования, результат которого получен через 7 дней - обнаружена смешанная бактериальная флора: обильный рост аэробного микроорганизма Escherichia coli, и факультативного анаэроба Enterobacter cloacae.
Так же по причине установления анаэробного компонента в качестве одного из патогенов развития острого парапроктита, больной оперирован повторно в срочном порядке на следующие сутки. Выполнена ревизия послеоперационной раны, вскрытие гнилостно-некротической флегмоны промежности, параректальных, паравезикальных клетчаточных пространств, передней брюшной стенки, забрюшинного пространства.
В последующем пациент трижды перенес ревизию послеоперационных ран с целью санации, дополнительной некрэктомии, ежедневные расширенные перевязки, в том числе под наркозом. Постепенно явления интоксикации, воспалительные явления в клиническом анализе крови нивелировались. После купирования гнойно-воспалительного процесса пациенту дважды выполнено наложение вторичных швов. Выписан на 50 сутки в удовлетворительном состоянии.
Таким образом, предлагаемый способ позволяет определить наличие анаэробной микрофлоры либо ее отсутствие в раневом содержимом за чрезвычайно короткие сроки, и тем самым, позволяет выполнить коррекцию хирургической тактики, а так же обосновать выбор эмпирической антибактериальной противомикробной терапии.
Предлагаемый способ обеспечивает технический эффект и может быть осуществлен с помощью известных в технике средств.
Источники информации
1. Королюк A.M., Кочеровец В.И. Новое в диагностике анаэробной инфекции. Воен. мед. журнал, 1983, №1, с. 42-44.
2. Егоркин М.А. Современные подходы к лечению острого анаэробного парапроктита. РЖГГК, 2011, №3, с. 74-79.
3. Мельников В.Е., Мельников Н.И. Анаэробные инфекции. М.: Медицина, 1973, с. 27-30.
4. Колесов А.П. и соавт. Анаэробные инфекции в хирургии. Л.: Медицина, 1989, с. 6-7.
5. Мельник В.Н., Мельник Н.И. Анаэробные инфекции. М.: Медицина, 1973, с. 49-52.
6. Горшков С.З. Анаэробная клостридиальная раневая газовая инфекция. М.: Медицина, 2007. 127 с.
7. Патент РФ 2073245 «Способ диагностики анаэробной хирургической инфекции мягких тканей».
8. Патент РФ 2044051 «Способ получения индикаторной питательной среды для обнаружения патогенных анаэробных неспорообразующих бактерий».
9. Патент РФ 2021608 «Способ диагностики анаэробной газовой инфекции».
10. Патент РФ 2123184 «Устройство для диагностики состояния биологических объектов».
11. Патент РФ 2352937 «Способ диагностики анаэробной инфекции».
Способ экспресс-диагностики анаэробной хирургической инфекции, заключающийся в определении характера возбудителя после вскрытия гнойной полости, отличающийся тем, что в дистиллированной воде готовят серии разведений раневого содержимого различной концентрации: 1:1, 1:2 и 1:3, через проточный электрод джоульметрического прибора пропускают ток 0,005, 0,01 и 0,02 мА, определяют зависимость работы тока от времени для каждого образца, оценивают динамику вольтамперных характеристик: по показателю работы тока от 0,003 до 1 мкДж судят об отсутствии анаэробных микроорганизмов в раневом содержимом; по показателю работы тока от 100 до 820 мкДж судят о наличии анаэробных микроорганизмов в раневом содержимом.