Средство для лечения повреждений наружных тканей организма (варианты) и способ его получения
Иллюстрации
Показать всеГруппа изобретений относится к области медицины и фармакологии. Описано средство для лечения повреждений наружных тканей организма и к способу его получения. Средство выполнено в виде многослойной пленки, в которой один из слоев содержит комплекс хитозана с хотя бы одной карбоновой кислотой с длиной цепи C2-C7, а слой, прилегающий к ране, содержит гиалуроновую кислоту или ее производные, причем физиологически активные вещества содержатся в виде мицелл и размещаются исходно в слое, содержащем комплекс хитозана при травматических повреждениях либо в обоих слоях. Средство получают введением мицелл с включенными физиологически активными или вспомогательными веществами в раствор выбранного полисахарида, последовательным формированием каждого отдельного слоя из растворов полисахаридов, содержащих мицеллы и подсушиванием слоя до влажности 10-35% после чего пленки снимали с подложки. Средство обладает пролонгированным воздействием. 2 н. и 12 з.п. ф-лы, 11 табл., 36 пр.
Реферат
Изобретение относится к области медицины и фармакологии, а именно к композиционным пленочным материалам для лечения ран и иных повреждений наружных тканей организма на основе биодеградируемых полимеров, проявляющих противоопухолевые, ранозаживляющие, противовоспалительные и противомикробные свойства, и способу их получения. В частности, изобретение относится к пленочным композициям пролонгированного действия на основе биодеградируемых полисахаридов, обладающих адгезией к кожным покровам и слизистым оболочкам, а также содержащим в своем составе физиологически активные вещества.
Кожные покровы и слизистые оболочки являются барьером, предохраняющим организм от внешних воздействий и проникновения канцерогенов и патогенной микрофлоры внутрь организма. Нарушение анатомической целостности и/или функциональной активности эпителия в результате воздействия канцерогенов и развития рака кожи, травматических поражений, хронических заболеваний, инфекционных и воспалительных процессов и т.п. приводит к ослаблению защитной функции эпителия в пораженной области, способствует развитию заболеваний и его разрушению.
Физиологический процесс заживления раны направлен на восстановление эпителия, воссоздание поврежденного внеклеточного матрикса [Vowden K., Vowden Р. Wound Management Formulary and Educational Resourse Book. 2008, P. 1; Mallefet P., Dweck A.C. Biomedical Scientist. 2008, V.7, P.609-615], а при развитии рака кожи - также и на подавление злокачественных опухолевых процессов [LCA Skin Cancer Clinical Guidelines, July 2014].
Нарушение процесса заживления раны может привести к увеличению сроков и качеству заживления, вплоть до появления хронических незаживающих ран и развития необратимых патологических процессов. Поэтому препараты, применяемые в терапии заболеваний эпителия быть комплексными, то есть направленными как на уменьшение воспаления, так и на стимуляцию пролиферации и ускорение эпителизации. А при злокачественных новообразованиях комплексное лечение должно быть направлено как на подавление патологической пролиферации и роста клеток, восстановление эпителия, а также нормализации кожных покровов после лучевой и радиотерапии
Для лечения заболеваний кожных покровов и слизистых оболочек, в том числе злокачественных заболеваний, используются, как правило, лекарственные средства системного применения - таблетки, инъекционные растворы, а также наружные лекарственные средства в виде кремов, гелей, растворов. Наружное применение средств позволяет защитить пораженные участки от воздействия внешней среды, способствует быстрому достижению терапевтически эффективных доз физиологически активных веществ в пораженной области, избеганию осложнений и побочных эффектов, присущих системному применению лекарственных средств.
Учитывая разнообразие заболеваний эпителия, наружные лекарственные средства разрабатываются в форме раневых повязок, пленочных покрытий, гелей, пенок и пр.
Для защиты ран, в частности, применяются классические раневые повязки из текстильных материалов, например Sterilux® на основе нетканого полотна, например Medicomp®. Ограничение их применения связано с высокой адгезией к поверхности поврежденного участка, вызывающей травмирование раны при смене повязки, отсутствие биологической активности, способствующей ранозаживлению [Rippon M., White R., Davies P. Wounds UK. 2007. V.3. N4. P.76-86; Skórkowska-Telichowska K., Czemplik M., Kulma A., Szopa J. Journal of the American Academy of Dermatology, 2013. V.68, N4, Р.117-126].
Разрабатываются не адгезивные атравматичные повязки, такие как, гидроколлоидные и гидрогелевые повязки, повязки на основе альгината кальция или натрия, пенные повязки.
Гидроколлоидные композиции (повязки) имеют внутренний слой гелеобразующего материала на основе натриевой соли карбоксиметилцеллюлозы, желатина или пектина, зафиксированный на полупроницаемой полиуретановой основе [Fletcher J. etc. Wound. International Online Journal, 2011, V.2, N4, Р.1-6]. Композиция может содержать антимикробные вещества, например серебро [Flores A. Wounds Essentials 2007, V.2, Р.182-185]. Повязки абсорбируют экссудат, сохраняют увлажненность раны, предотвращают проникновение бактерий, способствуют ангиогенезу, но эффективны, в основном, для лечения сухих ран, покрытых фибриновым сгустком и некротической тканью [Queen D. Wounds International Online Journal 2009, V.1, N1].
Недостатком гидроколлоидных композиций является невозможность использования для лечения слизистых оболочек, инфицированных и некротических ран [Skórkowska-Telichowska K., Czemplik M., Kulma A., Szopa J. Journal of the American Academy of Dermatology 2013, V.68, N4, P.117-126]. Кроме того, возможно размягчение тканей поврежденной области при неадекватном наложении повязки [Vowden K., Vowden P. Wound Management. Formulary and Educational Resourse Book 2008, P.33-36].
Композиции на основе кальциевых солей альгиновой кислоты [Sayag J., Meaume S., Bohbot S.J. of Wound Care 1996, V.7, N8, P. 357-362] используются для лечения кровоточащих ран и могут содержать серебро или цинк, что обеспечивает их антимикробные свойства [Clark M. Wounds International Online J. 2012, V.3, N7]. Недостатками композиций является отсутствие терморегуляции, невозможность применения для сухих ран и ран, пораженных анаэробными инфекциями, ограниченность использования для глубоких ран [Skórkowska-Telichowska K., Czemplik M., Kulma A., Szopa J.J. of American Academy of Dermatology 2013, V.68, N4, P.117-126] ввиду повышенной стимуляции фибробластов [Widgerow A.D. etc. Anesthetic Plastic Surgery 2000, V.24, N3, P.227-234].
Более эффективными являются многослойные композиционные повязки. В частности, известна трехслойная повязка на основе полиуретана, в которой слой, контактирующий с раневой поверхностью, выполнен из мягкого силикона, центральный слой поддерживает увлажненность и терморегуляцию раны, а верхний, полиуретановый, защищает рану от инфицирования [Dykes P.J., Heggie R., Hill S.A. Wounds International Online Journal 2001, V.10, N2, P.7-10]. Композиции не могут использоваться для ран с низким уровнем экссудата ввиду повышенной грануляции, а также для сухих ран с черной некротической тканью или коркой [Young Т. British J. of Nursing 1995, V.4, N3, P.169-170; Skórkowska-Telichowska K., Czemplik M., Kulma A., Szopa J.J. of American Academy of Dermatology 2013, V.68, N4, P.117-126].
Применяемые в настоящее время лекарственные средства для наружного применения в полной мере не могут обеспечить условия оптимального заживления ран, не учитывают длительность применения средств в силу высокой продолжительности большинства заболеваний эпителия и потенциальную токсичность длительного применения средств.
В этой связи разработка новых композицией для местного применения при лечении поражений кожи является актуальной.
В частности, перспективным представлялось использование в таких композициях гиалуроновой кислоты и ее производных, которые широко используются в восстановительной хирургии, импланталогии, а также в косметологии [Leach J.В., Schmidt С.Е. Encyclopedia of Biomaterials and Biomedical Engineering 2004, Marcel Dekker, New York, P.779-789; Dechert T.A. et. all. Wound Repair and Regeneration 2006, V.14, Р.252-258]. Так, известна повязка для восстановления кожных покровов и слизистых оболочек после хирургических операций, содержащая эфир гиалуроновой кислоты в комбинации с волокнами коллагена, или полисахаридов, полусинтетических и синтетических полимеров и т.п. [US 5520916, 1991]. В состав повязки, как правило, включают физиологически активное вещество (ФАВ) и антибиотик - ванкомицин. Эффективность контактирующего с кожей слоя, содержащего эфир гиалуроновой кислоты, может быть повышена [US 5658582, 1993] путем введения дополнительного слоя, действующего как усилитель абсорбции жидкости. Слои соединяют с помощью химического коагулирующего агента, адгезивного агента или путем механической сшивки. В состав внутреннего слоя может дополнительно входить ФАВ, антибиотик, антисептик, антимикотик, полипептид или белок.
Недостатком такой повязки является трудоемкость процесса изготовления, а также различия в абсорбирующей и терморегулирующей способности ингредиентов, что может оказать негативное влияние на процессы ранозаживления.
Одним из перспективных компонентов в композициях для лечения эпителия является хитозан, биологическая активность которого основана на способности к гидролизу в присутствии лизоцима, образованию хитоолигосахариды, имеющих антимикробную, иммуномодулирующую активность, способствующих ранозаживлению и восстановлению тканей [Aiba S. International J. Of Biological Macromolecules 1992, V.14, N4, P.225-228; Nwe N. et all, Materials 2009, V.2, P.374-398; Ravi Kumar M.N.V. et all, Chemical Reviews 2004, V.104, N12, P.6017-6084; Lim S.-H., Hudson S.M.J. of Macromolecules Science. Part C. 2003, V.43, N2, P.223-269; Sanford P.A. Chitosan: Commercial uses and potential applications. In: Skjak G. et all, Chitin and Chitosan sources, Chemistry, Biochemistry, Physical Properties and Applica-tions, Elsevier: London, UK. 1989. Р.51-69].
Известны раневые покрытия, содержащие смесь хитозана и гиалуроновой кислоты. Так, в патенте US 7524514 предложена композиция для регенерации тканей в виде жидкой массы, полученной путем смешивания сухих частиц гиалуроновой кислоты и хитозана с последующим гидратированием. Композиция состоит из нерастворившегося хитозана, вязкоэластичного геля гиалуроновой кислоты, волокон полиэлектролитного комплекса и физиологически активного вещества (цитостатиков, факторов роста, гормонов, антибиотиков и т.п.). Аналогичная композиция (US 2009/270346) также содержит смесь хитозана, окисленного полисахарида (крахмала, целлюлозы, хитина, декстрана, гликогена или гиалуроновой кислоты) и физиологически активных веществ. Композицию наносят на ткани назальных полостей и пазух, среднего или внутреннего уха, коленный и позвоночный хрящи. После стабилизации формируется защитный слой.
Недостатками композиций является невысокая эффективность, невозможность эффективного использования на поверхности тканей, контактирующих с жидкостью, а включение в композицию ФАВ существенно ограничено.
Получение предложенной композиции является многостадийным процессом. Это связано, в частности, с тем, что получение смешанных композиций на основе полианионного (гиалуроновая кислота) и поликатионного (хитозан) полисахаридов осложнено образованием полиэлектролитного комплекса. Показано, что для предотвращения получения полиэлектролитного комплекса на основе хитозана и гиалуроната натрия, полисахариды раздельно растворяют в 50% муравьиной кислоте, растворы смешивают, формуют пленки, сушат и отмывают пленку от муравьиной кислоты [Kim S.J. et all, J. of Applied Polymer Sci. 2004, V.91, N5, P.2908-2913; Kim S.J. et all, Solid State Ionics 2003, V.164, Р.199-204].
Наряду с монопленками, известны многослойные перевязочные композиции, в котором хитозан содержится в одном из слоев в виде комплекса. Так, известно применение для лечения ран комплексов на основе смеси желатина, хитозана и формальдегида (CN 1097980, 1995); желатина и формальдегида с добавками антибиотиков (RU 2033149, 1995); целлюлозы и хитозана (JP 0376029, 1990); коллагена и хитозана (WO 8504413, 1986), которые далее наносятся на повязку из полимерного материала.
Основным недостатком данных покрытий (композиций) является невысокая ранозаживляющая активность, обусловленная их залипанием на ране.
Известно перевязочное средство (RU 2270646, 2006), которое содержит полимерную пленку с нанесенным на ее поверхность слоем гидрогеля, полученного смешением растворов хитозана с многоатомными спиртами и поливинилпирролидоном. Гидрогель наносится на водонерастворимую пленку с линейными сквозными порами, подсушивается до содержания влаги менее 30%. Перевязочное средство способствует ускоренной регенерации поврежденных тканей, способно абсорбировать до 8 г/г экссудата, препятствует инфицированию раны.
Недостатками предложенного решения является необходимость длительного времени для формирования твердого гидрогеля (более чем двое-трое суток), что препятствует промышленной применимости метода получения, возможность отекания гидрогеля с раны при обводнении (абсорбции экссудата).
Известна композиция, включающая губку, содержащую адсорбирующий материал, например, хитозан и гиалуроновую кислоту или ее производные, а также ФАВ, в частности, фактор свертываемости крови, поверхностно активные, антимикробные, антибактериальные, болеутоляющие ФАВ, витамины, белки, минералы, факторы роста, химиотерапевтические, ранозаживляющие вещества, аминокислоты, клетки, ферменты, контрастные и другие вещества [WO 2006/005340]. Хотя бы на одной из поверхностей губки, как правило, формируется дополнительный защитный слой (пластина). Композиция используется либо самостоятельно в качестве кровоостанавливающего средства, либо для доставки ФАВ в организм.
Способ изготовления композиции включает смешивание хитозана и гиалуроновой кислоты или ее производных с растворителем с последующей сушкой полученной смеси при повышенной температуре или путем пропитывания хитозансодержащей губки раствором гиалуроновой кислоты или ее производных и последующей сушки. Введение ФАВ осуществляется путем пропитывания губки их раствором.
Недостаток композиции заключается в отсутствии пролонгированного выделения ФАВ, что требует достаточно частой смены раневого покрытия.
Общим недостатком вышеприведенных композиций является отсутствие эффективности при лечении рака кожи и последствиях воздействия на кожу химо- и рентгенотерапии.
К раку кожи обычно относят следующие виды злокачественных опухолей кожи: базалиому, карциному, меланому. Рак кожи является одним из наиболее распространенных опухолей, заболеваемость которыми в последние годы возрастает. Стандартизированные показатели заболеваемости для рака кожи составляют среди мужчин 26, а среди женщин - 21 на 100 тысяч населения [http://www.lood.ru/skin-and-smooth/skincancer.html].
При раке кожи применяют лучевое, хирургическое, криогенное, лазерное и медикоментозное лечение, а также их комбинации. Выбор метода лечения зависит от локализации, формы роста, стадии и гистологического строения опухоли, а также от состояния окружающей кожи. Чаще всего применяется хирургическое вмешательство - иссечение опухоли, криодеструкция (удаление при воздействии низкой температуры) или электрокоагуляция (удаление при воздействии тока) опухоли. Опухоль иссекают на расстоянии 1-2 см от видимого края. Криогенное воздействие осуществляется с помощью жидкого азота. Вызываемый охлаждением некроз тканей приводит к разрушению новообразования с последующим заживлением без грубых рубцов. Метод может быть применен при неглубокой инфильтрации кожи.
Лечение лучами лазера также достаточно эффективно. Для некроза опухоли, как правило, достаточно одного сеанса. Заживление участка некроза происходит с образованием тонкого эластичного рубца. Лучевая терапия применяется главным образом при опухолях небольших размеров и в случаях, когда невозможно удалить опухоль хирургическим иссечением из-за ее расположения [RU 2189261, 2002]. Недостатками метода являются лучевые повреждения здоровых тканей (перихондриты, лучевые язвы), а также большая (более 1 месяца) продолжительность лечения [http://www.euroonco.ru/khirurgiya-kozhi/rak-kozhi].
Медикаментозное лечение используется, как правило, только как компонент комбинированного лечения., которое, кроме того, включает операцию и пред- или послеоперационную лучевую терапию. В качестве медикаментов использовались 0,5% колхаминовая мазь, 25% мазь с подофиллином, жидкость Гордеева N 2, жидкость Карчаули. В частности, для лечения базалиом, применяются 30% и 50% мазь проспидиновая, а для лечения рака кожи I и II стадии - 0,5%. мазь колхаминовая, которая кроме колхамина, содержит антисептические средства тимол и этиловый спирт; а также антибиотик - синтомицин. (Машковский М.Д. Лекарственные средства, М., "Медицина", 1993 г.).
Недостатком этих композиций является недостаточная избирательность действия и высокая токсичность. Так, колхаминовая мазь оказывает кожно-резорбтивное действие, которое проявляется лейкопенией и другими побочными эффектами, при использовании проспидиновой мази возможны гиперемия, отечность, фибринозные налеты окружающей здоровой ткани.
Наиболее близкой по достигаемому эффекту для лечения рака кожи является мазь Глицифон, содержащая 5-50% диглицидилового эфира метилфосфоновой кислоты и вспомогательные вещества - ланолин, вазелин, эмульсионные воски [RU 2146927, 1998] Мазь наносится на пораженную зону и эффективна при воздействии на бластоматозные клетки. Она характеризуется антимикробной активностью и безвредностью для окружающих нормальных тканей, а также отсутствием побочного кожно-резорбтивного действия.
Недостатками мази является ограниченность применения (только бластоматозные клетки), а также недостаточная эффективность при воздействии на раковые клетки и иные повреждения кожи.
Наиболее близкой по технической сущности к заявляемому изобретению в отношении воздействия на повреждения кожного покрова является композиция в виде пены или пленки для доставки ФАВ в системный кровоток через поверхность эпителия слизистых оболочек [US 2004/0151774]. Композиция может содержать, в частности, хитозан и его производные, гиалуроновую или полиакриловую кислоты, полиолы и другие соединения, солюбилизаторы, консерванты, наполнители, пластификаторы или антиоксиданты, а также ФАВ-антиостеопоротические, нестероидные противовоспалительные вещества, антагонисты кальциевых и калиевых каналов, анестетики противогрибковые, противовирусные, антимикробные соединения, и другие вещества. Композиция может быть изготовлена в виде пены, или однослойной пленки с различной толщиной и размером.
Способ изготовления данной композиции в виде пленок заключается в растворении полимера в водном или неводном растворителе, например, в метаноле, этаноле, глицерине, или в очищенной воде, смешивании полученного раствора с раствором ФАВ в очищенной воде, распылении полученной смеси на стеклянную пластину с последующей сушкой при комнатной температуре, или лиофильной сушкой. Композиция может использоваться как самостоятельно, например, закладываться за щеку, в носовой ход или влагалище, накладываться на ткань мошонки, так и в качестве покрытия для пластины, канюли, тампона, подушечки, полоски, шарика, таблетки, кольца или гранулы для местной доставки физиологически активного вещества. Терапевтически эффективная доза ФАВ, доставляемого в системный кровоток, составляет от 0,01 до 2000 мг.
Недостатком композиции и способа ее получения является отсутствие пролонгированного действия, что особенно важно для лечения длительных ран, ран у больных с пониженным иммунитетом, невозможность применения для лечения эпителия ротовой полости без дополнительной защиты поверхности композиции пленкой из гидрофобного водонерастворимого полимера, в частности - из полиэтилентерефталата, полиэтилена, нейлона, невысокая эффективность при лечении повреждений кожных покровов, а также невысокая эффективность при лечении рака кожи и результатов воздействия на кожный покров химотерапии и рентгенотерапии.
Технической задачей, решаемой авторами, являлось расширение спектра композиций, нормализующих травмированного состояния наружных тканей организма с целью создания более эффективных средств, в частности, обладающих перспективных для лечения рака кожи и обладающих пролонгированным воздействием.
Указанная задача решалась при использовании одного из следующих вариантов.
По первому варианту раневое покрытие наиболее эффективное для лечения рака кожи и негативного воздействия на кожу радио- и химотерапии создается на основе хитозана и гиалуроновой кислоты (или их производных), а также содержащих ФАВ и вспомогательные вещества выполнено в виде многослойной пленки, в которой один из слоев содержит комплекс хитозана с хотя бы одной органической кислотой с длиной цепи C2-C7, а слой, прилегающий к ране, содержит гиалуроновую кислоту или ее производные, причем в качестве ФАВ, оно содержит цитостатики, которые находятся в виде мицелл
В качестве цитостатиков покрытие содержит блеомицин, фторурацин, метронидазол или иные препараты с аналогичным воздействием
По второму варианту, более эффективному для лечения травматического повреждения кожи технический результат достигался тем, что раневое покрытие для лечения поражений слизистых оболочек и кожных покровов, содержащее хитозан и гиалуроновую кислоту или их производные, а также ФАВ и вспомогательные вещества, выполнено в виде многослойной пленки, в которой один из слоев содержит комплекс хитозана с хотя бы одной органической кислотой с длиной цепи C2-C7, а слой, прилегающий к ране, содержитгиалуроновую кислоту или ее производные, причем ФАВ содержатся в виде мицелл и размещаются в слое, содержащем комплекс хитозана.
Раневое покрытие в качестве ФАВ содержит хотя бы одно вещество из групп, в которые входят цитостатики, антибиотики, антисептики, анальгетики, анестетики, витамины, фунгициды, иммуномодуляторы, противовоспалительные средства, аминокислоты, а в качестве вспомогательных веществ - декстран, альгиновую кислоту или альгинат натрия, пластификаторы, эмульгаторы, регуляторы вкуса, красители, консерванты, влагоудерживающие агенты.
Физиологически активные вещества в обоих вариантах содержатся в покрытии в форме мицелл, выполненных из карбоновых кислот с длиной цепи C8-C26 и/или их триглицеридов и/или фосфолипидов.
Как правило, покрытие выполняется из двух слоев, наружный из которых содержит комплекс хитозана, однако возможно дополнение пленочного покрытия адгезионно связанной с ним подложкой, выполненной из полимерной пленки, нетканого или углеродного полотна.
Особенность заявляемого покрытия по второму варианту состоит в том, что сетчатая структура, образующаяся при создании комплекса хитозана с органическими кислотами с длиной цепи C2-C7, удерживает мицеллы с ФАВ, регулируя скорость их миграции в рану из хитозанового слоя, в слой, содержащий гиалуроновую кислоту или ее соли, одновременно «откачивая» из него экссудат, поступающий из раны. При этом гиалуроновая кислота обеспечивает оптимальную адгезию покрытия к ране и оптимальное отделение экссудата. Для первого варианта пролонгированный эффект менее важен по сравнению с лечебным воздействием, поэтому ФАВ распределены по всем слоям.
Технический результат в отношении способа получения покрытия достигался введением мицелл с включенными физиологически активными или вспомогательными веществами в раствор выбранного полисахарида, последовательным формированием каждого отдельного слоя из растворов полисахаридов, содержащих мицеллы и подсушиванием слоя до влажности 10-35% после чего пленки снимали с подложки.
Мицеллы с включенными физиологически активными веществами и вспомогательные вещества можно вводить в растворитель до растворения полисахаридов или в полученный раствор полисахарида.
При влажности образцов 10÷35%, пленки эластичны и могут быть легко сняты с подложки. При более низкой влажности пленок, 5÷8%, они теряют эластичность, крошатся при попытке снятия с подложки, а при нанесении поверх таких пленок формовочных растворов, содержащих другой полисахарид, происходит дефект первого слоя. При более высокой влажности прочность слоя существенно уменьшается.
Если в состав раневого покрытия дополнительно входит адгезионно связанная с ним подложка, выполненная из полимерной пленки, нетканого или углеродного полотна, то ее наносят на хитозановый слой, после чего композицию высушивают до влажности 10-35%.
Раствор гиалуроновой кислоты или ее соли получали ее растворением в водном растворе, содержащем физиологически активные и вспомогательные вещества.
Раствор комплекса хитозана готовили обработкой хитозана раствором одно- или многоосновной органической кислоты, или смесью кислот, после чего проводили дополнительную фильтрацию раствора для удаления нерастворимых частиц и образовавшихся коллоидных микрочастиц.
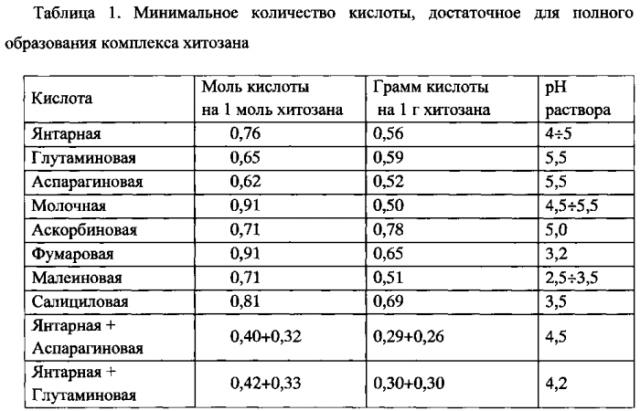
Лучшие результаты достигались, если хитозан растворяли в водном растворе органической кислоты, содержащей в количестве на 1 г хитозана: янтарной - 0,56 г, глутаминовой - 0,59 г, аспарагиновой - 0,52 г, молочной - 0,50 г, аскорбиновой - 0,78 г, фумаровой - 0,65 г, малеиновой - 0,51 г, салициловой - 0,69 г.
Формирование слоев проводят, как правило, на уравновешенной гладкой стеклянной, металлической или полимерной подложке методами полива или экструзией через фильеру.
В последнем случае готовят растворы полисахаридов с вязкостью 1000-100000 сП. При более низкой вязкости формовочного раствора (менее ~1000 сП) происходит его самопроизвольное вытекание через фильеру или растекание по поверхности подложки в процессе сушки, при высоких значениях вязкости (более ~1000000 сП) растворы не могут быть обработаны, т.к. не обладают текучестью.
Толщина каждого слоя пленочных лекарственных композиций варьируется, как правило, в пределах 20-100 мкм и определяется необходимой толщиной как многослойной пленки в целом, так и отдельных составляющих слоев на основе хитозана и на основе гиалуроновой кислоты.
Исследования полученных композиций проводили следующим образом.
Определение гидродинамического радиуса частиц в растворе (Rh) проводили методом динамического рассеяния света на длине волны 632.8 нм при температуре 20°C на установке PhotoCor. Перед измерением эмульсии разбавляли водой в 20-50 раз для получения растворов с содержанием мицеллообразователя (эмульгатора) 0,05 вес.%.
Определение содержания воды в пленках проводилось по методу Карла Фишера на автоматическом титраторе Mettler Tolledo V30 с использованием реагентов HYDRANAL®-Solvent и HYDRANAL®-Titrant 5. Измерения проводились в соответствии с протоколом V20 (предварительная экстракция), согласно которому определялось содержание влаги в метанольном экстракте из пленок и в метаноле (холостой опыт). Расчеты производились в предположении 100% экстракции воды из пленок.
Исследования трансдермальной диффузии физиологически активных веществ проводилось на установке для растворения USP Apparatus#2 производства компании Varian с использованием сэндвича для мембран и пленок, расположенного на дне термостатируемого стакана в соответствии со спецификацией USP Apparatus #5. В качестве рабочей среды (искусственная слюна) использовался фосфатный буфер pH=6.8 в количестве 300 мл. Температура буфера составляла 37±0.5°C. Перемешивание осуществлялось со скоростью 50 об/мин.
Сэндвич для трансдермальной диффузии готовили следующим образом. На глянцевую поверхность мембраны Strat-M (Merck-Millipore) Ø47 мм наносили 3÷4 капли фосфатного буферного раствора для обеспечения адгезии полимерных композиций (пленок). Полимерную композиции прикладывали к капле буферного раствора слоем на основе гиауроната, обеспечивающим адгезию, и разглаживали к краям мембраны, выдавливая раствор, после высушивали 1 час. Мембрану с нанесенной пленкой плотно фиксировали между подложкой и крышкой диализной ячейки Quix Sep 5000 µl Ø44 мм. Сэндвича помещали на дно стакана с буферным раствором, через определенные промежутки времени производили отбор проб для определения количества ФАВ, перешедшего в буферный раствор. Определение метронидазола проводили методом УФ спектроскопии на длине волны 320 нм с использованием спектрофотометра Varian Cary 50 и кювет с длиной оптического пути 10 мм. Определение преднизолона натрия фосфата проводили методом ВЭЖХ на приборе Alliance (Waters) по методике, приведенной в USP 31 изд.
Динамическую вязкость растворов полисахаридов определяли на ротационном вискозиметр eBrookfield RVDV-II с использованием дисковых шпинделей №1÷7 при скорости вращения от 0.01 до 200 об/мин и по скорости падающего заранее откалиброванного шарика на вискозиметре Гепплера.
Исследование набухания пленочных лекарственных композиций при 98% влажности проводили следующим образом. Для обеспечения влажной атмосферы насыщенный раствор медного купороса помещали в эксикатор и выдерживали в течение 3 ч при комнатной температуре. Точные навески пленочных лекарственных композиций с помощью крючков подвешивали в эксикаторе, через определенные промежутки времени вынимали, взвешивали и вновь помещали в эксикатор. Рассчитывали прирост массы пленочной композиции, в % по отношению к начальной массе.
Изучение проницаемости паров влаги через пленочные композиции проводили по модифицированной методике Bhuvaneshwari S. et all [International J. of Engineering Research and Application. 2011 V 1, N 2, Р. 292-299]. Для поддержания относительной влажности 90±5% насыщенный раствор хлорида натрия выливали на чашку Петри, чашку помещали на дно эксикатора. В стеклянные флаконы (Schuette Biotec) диаметром 27 мм и высотой 50 мм помещали 0,73 г безводного кальция хлорида. Пленку (площадь контактной поверхности - 3.1 см2) закрепляли на горлышках флаконов с помощью завинчивающихся крышек с отверстием и уплотняющим силиконовым кольцом. Для оценки пропускания паров воды каждым из слоев двухслойной пленки, пленка закреплялось указанным слоем в направлении паров воды. Далее флаконы помещали в эксикатор с насыщенным раствором хлорида натрия. Проницаемость паров влаги через пленку оценивали по приросту массы флакона и количественно выражали как количество воды, проникающей через единицу площади (Кп, мг/мм2).
Сущность и преимущества настоящего изобретения иллюстрируются следующими примерами.
Пример 1 (вариант 1). Пленочная лекарственная композиция, содержащая цитостатик-блеомицин в мицеллах фосфолипида
Раствор блеомицина. 20 мг блеомицина сульфата растворяют в 50 мл 0,03% эмульсии соевого лецитина в воде при перемешивании в течение 0,5 ч. Значение Rh мицелл в растворе составляет 110-150 нм.
Раствор консервантов. 20 мг нипагина и 10 мг нипазола растворяли в 2 мл пропиленгликоля, раствор смешивают с 0,03% эмульсии соевого лецитина в воде.
К 3,0 г хитозана (ММ=240 кДа, Ennagram, Франция) и 0,6 г глицерина (влагоудерживающее вещество) добавляют к 125 мл 0,03% эмульсии соевого лецитина в воде, перемешивают 1 ч для набухания хитозана, прибавляют 5 мл раствора консервантов, раствор смеси 0,9 г янтарной кислоты и 0,9 г глютаминовой кислоты в 50 мл воды, перемешивают на механической мешалке 7 ч до растворения компонентов, прибавляют 20 мл раствора блеомицина, перемешивают в течение 1 ч. Раствор фильтруют в пресс-фильтре под давлением.
На обезжиренную спиртом стеклянную подложку, расположенную на горизонтальной поверхности, через фильеру шириной 110 мм с зазором 1,4 мм наносят раствор хитозана. Пленку высушивают при комнатной температуре в течение 10 ч до влажности 15%. Толщина пленки 45 мкм.
0,6 г гиалуроната натрия (ММ=1.9 МДа, Ennagram, Франция) и 0,1 г декстрана (ММ=110 кДа, Pharmacia Fine Chemicals АВ Uppsala, Швеция) и 0,15 г альгината натрия (ISP, Германия) растворяют в 50 мл 0,03% эмульсии соевого лецитина в воде при перемешивании в течение 5 ч, прибавляют 5 мл раствора консервантов, 10 мл раствора блеомицина, перемешивают еще 2 ч.
На поверхность пленки на основе хитозана наносят раствор гиалуроновой кислоты, содержащий мицеллы ФАВ, через фильеру с зазором 2,0 мм. Пленку высушивают при комнатной температуре в течение 3 ч. Получают пленку с влажностью 35%. На пленку накладывают медицинскую пленку из политетрафторэтилена (Экофлон, Россия). Композицию герметично упаковывают в комбинированный пакет для предотвращения высыхания.
Пример 2 (вариант 1). Пленочная лекарственная композиция, содержащая цитостатик-фторурацил в мицеллах фосфолипида
Раствор фторурацила. 85 мг фторурацила, 20 мг нипагина и 10 мг нипазола растворяют в 5 мл глицерина, раствор смешивают с 20 мл 0,05% эмульсии соевого лецитина в воде, перемешивают в течение 1 час. Значение Rh, мицелл в растворе составляет 130-190 нм.
К 4,0 г хитозана (ММ=240 кДа, Ennagram, Франция), 0,1 г аргинина гидрохлорида, 0,2 г лизина гидрохлорида добавляют 190 мл 0,8% раствора янтарной кислоты в 0,05% эмульсии соевого лецитина в воде, перемешивают на механической мешалке 5 час до растворения хитозана, прибавляют 10 мл раствора фторурацила, перемешивают 2 ч. Раствор фильтруют в пресс-фильтре под давлением для удаления не растворившихся частиц хитозана.
На обезжиренную спиртом стеклянную подложку, расположенную на горизонтальной поверхности, через фильеру шириной 110 мм с зазором 1,2 мм наносят раствор хитозана. Пленку высушивают при комнатной температуре в течение 10 ч до влажности 15%. Толщина пленки 40 мкм.
0,6 г гиалуроната натрия (ММ=1,9 МДа, Ennagram, Франция), 0,2 г декстрана (ММ=110 кДа, PharmaciaFineChemicals АВ Uppsala, Швеция) и 0,05 г альгината натрия (ISP, Германия) растворяют в 45 мл 0,05% эмульсии соевого лецитина в воде при перемешивании в течение 2 ч, прибавляют 10 мл раствора фторурацила, перемешивают еще 2 ч.
На поверхность пленки на основе хитозана наносят раствор гиалуроновой кислоты, содержащий мицеллы ФАВ, через фильеру с зазором 2,0 мм. Пленку высушивают при комнатной температуре и атмосферном давлении в течение 3 ч. Получают пленку с влажностью 32%. На пленку накладывают медицинскую пленку из политетрафторэтилена (Экофлон, Россия). Композицию герметично упаковывают в комбинированный пакет для предотвращения высыхания.
Пример 3 (вариант 1). Пленочная лекарственная композиция, содержащая метронидазол в мицеллах фосфатидилхолина
Раствор метронидазола. 1 г метронидазола и растворяют в 25 мл 0,05% эмульсии фосфатидилхолинав воде, перемешивают в течение 1 ч. Значение Rh мицелл в растворе составляет 140-205 нм.
Раствор консервантов. 20 мг нипагина и 10 мг нипазола растворяли в 2 мл пропиленгликоля, раствор смешивают с 20 мл 0,05% эмульсиифосфатидилхолина в воде.
К 4,0 г хитозана (ММ=240 кДа, Ennagram, Франция) добавляют 190 мл 0,8% раствора янтарной кислоты в 0,05% эмульсии фосфатидилхолина в воде, перемешивают 6 ч до растворения хитозана, прибавляют 10 мл раствора метронидазола, перемешивают на механической мешалке 2 ч. Раствор фильтруют в пресс-фильтре под давлением.
На обезжиренную спиртом стеклянную подложку, расположенную на горизонтальной поверхности, через фильеру шириной 110 мм с зазором 1,2 мм наносят раствор хитозана. Пленку высушивают при комнатной температуре в течение 8 ч до влажности 15%. Толщина пленки 45 мкм.
0,6 г гиалуроната натрия (ММ=1.9 МДа, Ennagram, Франция), 0,01 г лизина гидрохлорида 0,2 г декстрана (ММ=110 кДа, PharmaciaFineChemicals АВ Uppsala, Швеция) и 0,15 г альгината натрия (ISP, Германия) растворяют в 50 мл 0,05% эмульсии фосфатидилхолинав водепри перемешивании в течение 4 ч, прибавляют 10 мл раствора метронидазола, 1 мл глицерина, 10 мл раствора консервантов, перемешивают еще 2 ч.
На поверхность пленки на основе хитозана наносят раствор гиалуроновой кислоты, содержащий мицеллы ФАВ, через фильеру с зазором 2,2 мм. Пленку высушивают при комнатной температуре и атмосферном давлении в течение 3 ч. Получают пленку с влажностью 28%. На пленку накладывают медицинскую пленку из политетрафторэтилена (Экофлон, Россия). Композицию герметично упаковывают в комбинированный пакет для предотвращения высыхания.
Пример 4 (вариант 2). Получение пленочной лекарственной композиции, содержащей антибиотик ципрофлоксацин в мицеллах лецитина
Раствор 3,5 г гиалуроната натрия (ММ=1.6 МДа, CPN, Чехия) в 150 мл воды наносят на обезжиренную спиртом стеклянную подложку, расположенную на горизонтальной поверхности, через фильеру шириной 110 мм с зазором 1,8 мм. Пленку высушивают при комнатной температуре в течение 15 ч. Толщина пленки 35 мкм. Влажность 18%.
Раствор ципрофлоксацина. 0,1 г соевого лецитина растворяют при интенсивном перемешивании в 100 мл дистиллированной воды в течение 30 мин. 2,5 г ципрофлоксацина гидрохлорида прибавляют к полученному раствору, ФАВ растворяют при перемешивании в течение 20 мин. Образуется устойчивая эмульсия, содержащая ципрофлоксацин в мицеллах. Значение Rh мицелл в растворе составляет 130-210 нм.
3,5 г хитозана (ММ=240 кДа, Ennagram, Франция) и 2.08 г глутаминовой кислоты растворяют в 100 мл воды при интенсивном перемешивании. Раствор смешивают 50 мл раствора ципрофлоксацина гидрохлорида. Полученный раствор наносят на слой, содержащий гиалуроновую кислоту, через фильеру с зазором 1,5 мм. Пленку высушивают при комнатной температуре в течение 15 ч. Толщина двухслойной пленки 120 мкм, влажность 16%. Длительность воздействия покрытия составила 15 ч.
Пример 5 (вариант 2). Получение пленочной лекарственной композиции, содержащей антибиотик ципрофлоксацин в мицеллах олеиновой кислоты.
Раствор 3,5 г гиалуроновой кислоты (ММ=1.6 МДа) и 0,075 г гидроксида калия в 150 г воды наносят на обезжиренную спиртом стеклянную подложку, расположенную на горизонтальной поверхности, через фильеру шириной 110 мм с зазором 3,3 мм. Пленку высушивают при комнатной температуре в течение 15 ч. Толщина пленки 60 мкм. Влажность 10,0%.
Раствор ципрофлоксацина. К 400 мкл олеиновой кислоты при интенсивном перемешивании прикапывают 200 мл дистиллированной воды. Смесь помещают в ультразвуковую баню и выдерживают в течение 30 мин. Образуется устойчивая эмульсия. В 75 г эмул