Трансдермальное введение мемантина
Иллюстрации
Показать всеГруппа изобретений относится к медицине. Описаны трансдермальные терапевтические системы (ТТС), которые в качестве биологически активного вещества содержат антагонист NMDA-рецепторов мемантин или его физиологически совместимую соль. Трансдермальные терапевтические системы могут изготавливаться и использоваться для лечения заболеваний центральной нервной системы и могут вводить мемантин на более длительный промежуток времени, например, по меньшей мере на 24 ч, и в течение этого промежутка времени могут поддерживаться фармакологически эффективные концентрации мемантина в плазме. 2 н. и 13 з.п. ф-лы, 4 табл., 3 ил., 3 пр.
Реферат
Изобретение касается трансдермальных терапевтических систем (ТТС), которые в качестве биологически активного вещества содержат антагонист NMDA-рецепторов (N-метил-D-аспартат-рецепторов) мемантин или его физиологически совместимую соль. Эти трансдермальные терапевтические системы могут получаться и использоваться для лечения заболеваний центральной нервной системы.
Согласно уровню техники заболевания центральной нервной системы, особенно заболевания, связанные со слабоумием, типа болезни Альцгеймера в ее формах от легких до средней тяжести, лечатся при помощи ингибиторов ацетилхолинэстеразы (например, донепезила). Для лечения болезни Альцгеймера в формах от средней до тяжелой используются антагонисты NMDA-рецепторов.
Возникновение болезни Альцгеймера основано на нейродегенеративных процессах с усыханием клеток в коре головного мозга или соответственно отделах мозга. При этом холинергетические нервные волокна, включая их области проекции, затрагиваются в большей степени. На ранней стадии заболевания повреждается глутаматергическая система. Вследствие избыточного поступления кальция в нейроны со временем может дойти до нейродегенерации. При этом NMDA комплекс играет центральную роль в качестве важнейшего глутаматергического синапса. Его подавление с помощью селективного антагониста может предохранить нейрональную область от нервных повреждений.
Симптомами болезни Альцгеймера являются сильно расширенные желудочки, микроскопически различимые атеросклеротические бляшки и нейрофибриллярные узелки. Клиническая картина по большей части выражается потерей памяти, а также постепенной деградацией личности и интеллекта. В этом отношении целью лечения болезни Альцгеймера является смягчить личные страдания и, таким образом, препятствовать социальной изоляции. Лечебная терапия на сегодняшний день является недоступной. Пока желательно соответственно отсрочить развитие слабоумия, которое в большинстве случаев протекает прогрессивно. Облегчающая терапия при этом имеет следующие цели: улучшение когнитивной дееспособности, минимизация бросающихся в глаза неврологических моделей поведения, отсрочивание прогресса заболевания и предотвращение приступов.
Согласно уровню техники известно, что антагонисты NMDA-рецепторов подходят в качестве нейропротекторов, путем того, что они предотвращают вредное воздействие глутамата на NMDA-рецепторы. К группе антагонистов NMDA-рецепторов относятся, например, такие вещества, как МК 801, декстрометорфан, кетамин, мемантин, амантадин, декстрофан, фелбамат, акампросат, MRZ 2/579, фенциклидин, аптиганель, причем эти вещества рассматриваются и как индивидуальные вещества, и как смеси или соответственно как их физиологически совместимые соли, например, гидрохлориды, цитраты, малеаты и т.д.
Известно, что применение антагонистов NMDA-рецепторов, особенно вследствие психомиметических побочных эффектов, ограничено, в этом отношении их широкое применение до сих пор не осуществляется. При этом особенное значение при лечении пациентов с болезнью Альцгеймера придается антагонисту NMDA-рецепторов мемантину (3,5-диметил-9-аминоадамантану) или соответственно его гидрохлориду. Мемантин назначается для лечения болезни Альцгеймера в формах от средней до тяжелой. Это медицинский препарат доступен в Германии под названием Axura®. Это лекарственное средство имеется в распоряжении в пероральной форме как капли для приема или в виде таблеток, покрытых оболочкой. Прием этого медицинского препарата может осуществляться только под контролем ухаживающего персонала, причем дозировка биологически активного вещества на протяжении промежутка времени в несколько недель должна повышаться постепенно, чтобы минимизировать побочные эффекты, описанные особенно в случае лечения болезни Альцгеймера в формах от средней до тяжелой, такие как, среди прочего, галлюцинации, спутанность сознания, головокружение, головные боли и усталость. После начальной фазы этот препарат также следует принимать соответственно строго один раз утром и один раз после обеда (капли) или соответственно при использовании таблеток, покрытых оболочкой, ежедневно в одно и то же время.
По причине этой строгой схемы лечения и связанной с ней обязанностью по надзору получается неблагоприятная ситуация с очень высокими затратами или соответственно высокой стоимостью лечения при уходе за этими пациентами.
На основании этих указанных недостатков проистекает потребность в новых терапевтических системах, которые преодолевают эти недостатки, особенно таких системах, в случае которых могут снижаться затраты на уход.
Из уровня техники известно, что антагонисты NMDA-рецепторов при необходимости в комбинации с анальгетиками могут применяться для лечения местных болей в лекарственных формах для наружного применения (международные заявки WO 00/03716; WO 03/015 699; патенты США US 2002/0016319, US 6,194,000). Также в патентах США US 2004/0102525, US 2003/0139698 и международной заявке WO 04/009062 предлагается введение антагонистов NMDA-рецепторов. Международная заявка WO 04/106275 предлагает определенные соли антагонистов NMDA-рецепторов.
Однако лекарственные формы из уровня техники не подходят или лишь условно подходят для того, чтобы после наружного применения создавать системные концентрации в плазме антагонистов NMDA-рецепторов, которые вызывают достаточный фармакологический эффект в течение периода достаточной продолжительности. В отношении чрескожной проницаемости в уровне техники не предлагается экспериментальных данных.
Однако при профилактике и лечении заболеваний центральной нервной системы особенно желательными были бы именно лекарственные формы, которые могут поддерживать фармакологически эффективные концентрации в плазме в течение сравнительно длинного промежутка времени (например, 12 ч, 24 ч или дольше), не в последнюю очередь, поскольку в таких случаях могли бы снизиться затраты пациентов на уход обслуживающим персоналом.
Следовательно, в основе изобретения лежит задача предоставить лекарственную форму для лечения или профилактики заболеваний центральной нервной системы, особенно заболеваний, связанных со слабоумием, предпочтительно болезни Альцгеймера (Morbus Alzheimer), которая обладает преимуществами по сравнению с лекарственными формами из уровня техники.
При этом преимущества могут проявляться в отношении применимости, дозировки и/или переносимости. По возможности эта лекарственная форма при однократном применении должна бы обеспечивать фармакологически эффективную концентрацию биологически активного вещества в плазме на протяжении более длительного периода времени, например, по меньшей мере в течение 12 ч, предпочтительно по меньшей мере в течение 24 ч или даже в течение нескольких дней, так что повторное использование, а, таким образом, и повторный контроль обслуживающим персоналом требуется менее часто (например, только один раз в день).
Эта задача решается с помощью предмета данной заявки на патент.
Неожиданно было обнаружено, что может быть получена трансдермальная терапевтическая система, которая подходит для того, чтобы вводить мемантин трансдермально, причем применение может осуществляться на срок, например, по меньшей мере 12 ч, или, к примеру, на более длительный промежуток времени, например, по меньшей мере на 24 ч, и в течение этого промежутка времени могут поддерживаться фармакологически эффективные концентрации мемантина в плазме.
Изобретение касается трансдермальной терапевтической системы (ТТС) для введения биологически активного вещества мемантина в форме свободного основания или физиологически совместимой соли, или пролекарства, причем эта ТТС имеет
- непроницаемый для биологически активного вещества слой носителя;
- по меньшей мере один слой, содержащий биологически активное вещество, который содержит удерживающий материал, в который помещено это биологически активное вещество;
- при необходимости защитную пленку;
- tmax по меньшей мере 24 ч;
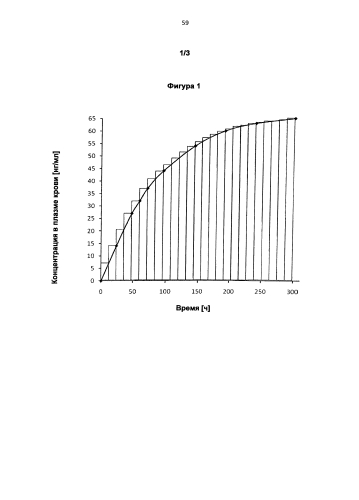
и причем при следующих друг за другом или смещенных во времени, предпочтительно повторяющихся применениях соответственно одной или нескольких трансдермальных терапевтических систем для интервалов между применениями, составляющих соответственно независимо друг от друга по меньшей мере 12 ч, предпочтительно на протяжении всего промежутка времени, составляющего по меньшей мере 300 ч, у нуждающегося в лечении индивида в его плазме крови соответственно от начала первого применения достигаются следующие концентрации биологически активного вещества:
спустя 24 ч по меньшей мере 14 нг/мл, предпочтительно по меньшей мере 16,2 нг/мл,
спустя 48 ч по меньшей мере 27 нг/мл, предпочтительно по меньшей мере 29,2 нг/мл,
спустя 60 ч по меньшей мере 32 нг/мл, предпочтительно по меньшей мере 34,5 нг/мл,
спустя 72 ч по меньшей мере 37 нг/мл, предпочтительно по меньшей мере 39,1 нг/мл,
спустя 96 ч по меньшей мере 44 нг/мл, предпочтительно по меньшей мере 46,6 нг/мл,
спустя 144 ч по меньшей мере 54 нг/мл, предпочтительно по меньшей мере 56,5 нг/мл,
спустя 192 ч по меньшей мере 60 нг/мл, предпочтительно по меньшей мере 62,3 нг/мл,
спустя 240 ч по меньшей мере 63 нг/мл, предпочтительно по меньшей мере 65,5 нг/мл, и
спустя 300 ч по меньшей мере 65 нг/мл, предпочтительно по меньшей мере 67,8 нг/мл.
Предпочтительно максимальная интенсивность высвобождения биологически активного вещества составляет не более 100 мкг/см3.
ТТС согласно изобретению содержит биологически активное вещество мемантин (3,5-диметиладамантан-1-амин) в форме свободного основания или физиологически совместимой соли, или пролекарства. Для целей описания термин «биологически активное вещество» включает мемантин и его физиологически совместимые сольваты. При этом мемантин может присутствовать в форме свободного основания, в форме физиологически совместимой соли и/или в форме сольвата, особенно гидрата или на выбор - в форме любых смесей вышеупомянутых соединений.
В одном предпочтительном варианте исполнения ТТС согласно изобретению содержит мемантин в виде свободного основания. Принципиальное получение свободного основания из гидрохлорида известно специалисту. Это может производиться, например, с применением ионообменных смол. Другим методом является экстракция из щелочной водной среды с использованием органических растворителей, которые обычно не смешиваются или незначительно смешиваются с водой. В результате удаления органического растворителя получается свободное основание (3,5-диметиладамантан-1-амин).
В другом предпочтительном варианте исполнения ТТС согласно изобретению содержит мемантин в форме физиологически совместимой соли. Предпочтительными физиологически совместимыми солями мемантина являются, например, его гидрохлорид, гидробромид, сульфат, гидросульфат, фосфат, гидрофосфат, дигидрофосфат, ацетат, пропионат, лактат, цитрат, аскорбат, формиат, фумарат, малеат, себацинат, мезилат и безилат. Особенно предпочтительным является гидрохлорид мемантина.
ТТС согласно изобретению может содержать пролекарство мемантина. В качестве пролекарства в этой связи обозначается неактивное или мало активное фармакологическое вещество, которое только при помощи метаболизирования в организме переводится в действующее биологически активное вещество (метаболит). Примерами пролекарств мемантина или его фармакологически совместимых солей являются производные, полученные по аминной функциональной группе, например, амидированные с помощью физиологически совместимых карбоновых кислот. В таком случае эти амиды расщепляются в физиологических условиях, при необходимости при ферментативном катализе. Другим примером пролекарства мемантина является его N-оксид.
ТТС согласно изобретению в качестве биологически активного вещества, помимо мемантина или соответственно его физиологически совместимых солей, или пролекарств, может содержать другие фармакологически активные вещества. Однако предпочтительно помимо мемантина или соответственно его физиологически совместимых солей не содержится других биологически активных веществ.
Предпочтительно ТТС согласно изобретению представляет собой пластырь, содержащий биологически активное вещество.
Обычно такая ТТС включает в себя по меньшей мере
a) непроницаемый для биологически активного вещества слой носителя (защитный слой, backing layer), предпочтительным является слой носителя, который непроницаем для воды в жидком виде и/или водяного пара;
b) по меньшей мере один слой, содержащий биологически активное вещество, который по меньшей мере частично покрывает слой носителя и предпочтительно сам имеет возможность приклеивания. При необходимости может быть нанесен дополнительный клеящий слой, чтобы обеспечить достаточную адгезию на коже;
с) при необходимости защитную пленку, которая покрывает слой, содержащий биологически активное вещество, и может сниматься с него (удаляемую подложку, release liner). Предпочтительной является защитная пленка, которая непроницаема для воды в жидком виде и/или водяного пара.
Обычно перед применением ТТС имеющаяся при необходимости защитная пленка удаляется, чтобы раскрыть способный приклеиваться слой. Эта защитная пленка может состоять, например, из полиэтилена, сложного полиэфира, полиэтилентерефталата, полипропилена, полисилоксана, поливинилхлорида или полиуретана, а при необходимости из обработанных бумажных волокон, таких как, например, целлофан, и при необходимости иметь силиконовое, фторсиликоновое или фторуглеродное покрытие.
ТТС согласно изобретению имеет непроницаемый для биологически активного вещества слой носителя и один слой, содержащий биологически активное вещество, или несколько слоев, содержащих биологически активное вещество, причем, разумеется, не все слои помимо слоя носителя должны содержать биологически активное вещество.
В одном предпочтительном варианте исполнения ТТС согласно изобретению в общей сложности имеет не более 3, 4, 5, 6, 7, 8 или 9 различных слоев. В другом предпочтительном варианте исполнения ТТС согласно изобретению имеет в общей сложности по меньшей мере 3, 4, 5, 6, 7, 8 или 9 различных слоев.
Слой носителя, непроницаемый для биологически активного вещества, (задний или соответственно наружный слой) ТТС согласно изобретению предпочтительно для веществ, содержащихся в слое, содержащем биологически активное вещество, и в клеящем слое, особенно для содержащегося при необходимости биологически активного вещества, является непроницаемым и инертным и может быть образован из полимеров, таких как сложные полиэфиры, например, полиэтилентерефталата, полиолефинов, таких как полиэтилены, полипропилены или полибутилены, поликарбонатов, полиэтиленоксидов, политерефталатов, таких как полиэтилентерефталаты, полиуретанов, полистиролов, полиамидов, полиимидов, поливинилацетатов, поливинилхлоридов и/или поливинилиденхлоридов, сополимеров, таких как сополимеры акрилонитрил/бутадиен/стирол, содержащих бумажные волокна, текстильные волокна, и/или их смесей, которые при необходимости могут быть металлизированы или пигментированы. Слой носителя также может быть образован из комбинации металлической пленки и полимерного слоя. Приведенные полимеры могут использоваться в виде пленки, ткани, валяного материала или пеноматериала.
Слой, непроницаемый для биологически активного вещества, предпочтительно имеет толщину слоя в диапазоне от 15 до 2000 мкм.
ТТС согласно изобретению имеет слой, содержащий биологически активное вещество, который содержит удерживающий материал, в который помещено биологически активное вещество. Этот слой, содержащий биологически активное вещество, одновременно может быть клеящимся слоем, в котором биологически активное вещество присутствует в растворенном виде и/или диспергированным в матрице вместе с клеящим веществом (drug in adhesive). Однако в случае ТТС согласно изобретению слой, содержащий биологически активное вещество, и клеящийся слой также могут присутствовать отдельно друг от друга.
Слой, содержащий биологически активное вещество, предпочтительно имеет толщину слоя в интервале от 10 до 9000 мкм.
ТТС согласно изобретению может быть оформлена, например, как мембранно-контролируемая система (ТТС резервуарного типа), или как диффузионно-контролируемая система (ТТС матричного типа) (сравните с К.Н. Bauer, с соавт., Pharmazeutische Technologie; R.H. Müller, с соавт., Pharmazeutische Technologie: ModerneArzneiformen).
ТТС резервуарного типа обычно включает самоприклеивающийся на кожу плоский пакет, который содержит биологически активное вещество в растворенном виде. Со стороны, обращенной к коже, пакет снабжен проницаемой для биологически активного вещества мембраной, которая регулирует высвобождение биологически активного вещества. Клеящийся слой и слой, содержащий биологически активное вещество (резервуар), обычно представляют собой отделенные друг от друга в пространстве субсоставляющие.
В случае ТТС матричного типа биологически активное вещество внедрено в матрицу, причем оно может присутствовать в диспергированном жидком, полутвердом или твердом состоянии или в растворенной форме. Если матрица одновременно обладает клеящимися свойствами, то клеящийся слой одновременно представляет собой также слой, содержащий биологически активное вещество (drug in adhesive). Но также возможно, чтобы клеящийся слой и слой, содержащий биологически активное вещество, так же как и в случае ТТС резервуарного типа, были отделены друг от друга. В этом случае клеящийся слой может быть нанесен на слой, содержащий биологически активное вещество, или соответственно мембрану резервуара по всей поверхности, частично или в форме кольца.
С помощью состава и структурирования матрицы и/или мембраны высвобождение биологически активного вещества может регулироваться. В отношении дополнительных подробностей можно сослаться, например, на Т.К. Gosh, Transdermal and Topical Drug Delivery Systems Es Into Practice, CRC Press, 1997; R.O. Potts с соавт., Mechanisms of Transdermal Drug Delivery (Drugs and the Pharmaceutical Sciences), Marcel Dekker, 1997; и R. Gurny с соавт., Dermal and Transdermal Drug Delivery. New Insights and Perspectives, Wissenschaftliche VG., Stuttgart, 1998.
В качестве клеящих веществ для изготовления клеящего слоя ТТС согласно изобретению могут использоваться клеящие вещества, чувствительные к давлению (самоклеящиеся материалы, pressure-sensitive adhesives, PSA). Клеящий слой может быть образован, например, как клейкая область или клейкая поверхность, которая ограничивает слой, содержащий биологически активное вещество, по бокам. Для изготовления клеящего слоя подходят, например, полимеры, такие как полиакрилаты, простые поливиниловые эфиры, полиизобутилены (ПИБ), сополимеры стирол/изопрен или бутадиен/стирол или полиизопреновые каучуки. Кроме того, подходят силиконовые клеящие вещества, такие как, например, при необходимости полимерно сшитые полидиметилсилоксаны. Помимо этого, подходящими являются смолы, такие как, например, сложные эфиры глицина, глицерина или пентаэритритола, или углеводородные смолы, такие как политерпены. Клеящие вещества на акрилатной основе получаются в результате полимеризации акрилатов, метакрилатов, алкилакрилатов и/или алкилметакрилатов, при необходимости с другими ненасыщенными мономерами, такими как акриламид, диметилакриламид, диметиламиноэтилакрилат, гидроксиэтилакрилат, гидроксипропилакрилат, метоксиэтилакрилат, метоксиэтилметакрилат, акрилонитрил и/или винилацетат. Примерами подходящих полимеров являются коммерчески доступные под наименованием Durotak®, например, продукты 2516, 2287, 900А или 9301. Другими подходящими коммерчески доступными полимерами являются полиизобутилены, полиакрилаты, такие как, например, GMS 3083, Plastoid В и Eudragit® E 100.
Клеящий слой может дополнительно содержать вспомогательные вещества, такие как пластификаторы, например, фталаты, такие как дибутилфталат, минеральные масла, сложные эфиры лимонной кислоты или сложные эфиры глицерина, средства, усиливающие проницаемость кожи, например, диметилсульфоксид, активатор склеивания (вещество, придающее клейкость, tackifier), наполнители (такие как оксид цинка или диоксид кремния), сшивающий агент, консервант и/или растворитель. Вспомогательные вещества такого типа известны специалисту. В отношении них можно сослаться, например, на публикации R. Niedner с соавт., Dermatika: therapeutischer Einsatz, Pharmakologie und Pharmazie, Wiss. Verl.-Ges. 1992; H.P. Fiedler, Lexikon der Hilfsstoffe für Pharmazie, Kosmetik und angrenzende Gebiete, Editio Cantor Aulendorff, 2002.
Биологически активное вещество в слое, содержащем это биологически активное вещество, присутствует в растворенной или твердой форме. Предпочтительно биологически активное вещество присутствует в полностью растворенном виде, то есть, предпочтительно практически нельзя обнаружить кристаллическую часть биологически активного вещества. В одном предпочтительном варианте исполнения концентрация биологически активного вещества в слое, содержащем биологически активное вещество, согласно изобретению составляет по меньшей мере 25%, более предпочтительно по меньшей мере 50%, еще более предпочтительно по меньшей мере 66%, наиболее предпочтительно по меньшей мере 75%, но и в особенности по меньшей мере 80% от его концентрации насыщения. Определение концентрации насыщения является известным специалисту. Например, концентрация насыщения еще не достигнута, если кристалл чистого биологически активного вещества приводится в контакт со слоем, содержащим это биологически активное вещество, и в течение 5 минут поглощается этим слоем, то есть, растворяется. Если биологически активное вещество присутствует по крайней мере частично в твердой форме, то речь предпочтительно идет о микродисперсии.
Слой, содержащий биологически активное вещество, ТТС согласно изобретению содержит удерживающий материал, в который помещено это биологически активное вещество.
В одном предпочтительном варианте исполнения этот удерживающий материал расположен между непроницаемым для биологически активного вещества слоем носителя и проницаемым для биологически активного вещества слоем мембранного материала, так что ТТС согласно изобретению предпочтительно представляет собой ТТС резервуарного типа.
В другом предпочтительном варианте исполнения удерживающий материал служит в качестве матрицы, так что ТТС согласно изобретению предпочтительно представляет собой ТТС матричного типа.
Подходящими удерживающими материалами являются природные или (полу)синтетические полимеры, образующие матрицу. В качестве полимеров, образующих матрицу, могут быть названы, например, полиэтилены, хлорированные полиэтилены, полипропилены, полиуретаны, поликарбонаты, сложные эфиры полиакриловой кислоты, полиакрилаты, полиметакрилаты, поливиниловые спирты, поливинилхлориды, поливинилиденхлориды, поливинилпирролидоны, полиэитлентерефталаты, политетрафторэтилены, сополимеры этилен/пропилен, сополимеры этилен/этилакрилат, сополимеры этилен/винилацетат, сополимеры этилен/виниловый спирт, сополимеры этилен/винилоксиэтанол, сополимеры винилхлорид/винилацетат, сополимеры винилпирролидон/этилен/винилацетат, каучуки, резиноподобные синтетические гомо-, со- или блоксополимеры, силиконы, производные силикона, такие как сополимеры полисилоксан/полиметакрилат, производные целлюлозы, такие как простые эфиры целлюлозы, особенно метилцеллюлоза, этилцеллюлоза, пропил целлюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза и/или их смеси. Особенно предпочтительными являются полиакрилаты или полисиликоны.
Удерживающий материал может включать в себя указанные выше полимеры, которые подходят для изготовления клеевого слоя (drug in adhesive).
Содержание удерживающего материала составляет предпочтительно от 10 до 99,9% масс. в пересчете на общую массу слоя, содержащего биологически активное вещество, более предпочтительно от 50 до 95% масс.
Что касается количественных соотношений удерживающий материал/содержание биологически активного вещества, предпочтительно выбираются соотношения от 99:1 до 50:50 (масса удерживающего материала : масса биологически активного вещества), предпочтительно от 95:5 до 60:40. В предпочтительных вариантах исполнения выбирают от 99,5:0,5 до 80:20 (масса матрицы : масса биологически активного вещества), предпочтительно от 99:1 до 85:15. Относительно высокая доля биологически активного вещества обосновывается пропорционально высокой потребностью в веществе для лечения болезни Альцгеймера в формах от средней тяжести до тяжелой.
Предпочтительно удерживающий материал включает в себя:
- жидкую или гелеобразную композицию, в которой частично или полностью растворено биологически активное вещество; и/или
- матрицу на основе полимерного материала, в которой биологически активное вещество присутствует в растворенном виде или распределенным как микродисперсия; и/или
- полимерный материал на основе полиакрилата или полисиликона; и/или
- липогель, который предпочтительно содержит от 10 до 50% масс. биологически активного вещества.
В одном предпочтительном варианте исполнения слой, содержащий биологически активное вещество, включает гидрогель или липогель. В рамках этого описания гидрогели представляют собой гели, которые содержат воду и/или другие гидрофильные или полностью или частично смешивающиеся с водой вещества, которые придают этому гелю гидрофильные свойства. В рамках этого описания липогели представляют собой гели, которые в основном содержат вещества, не смешивающиеся с водой, которые придают этому гелю липофильные свойства.
В одном предпочтительном варианте исполнения биологически активное вещество в слое, содержащем это биологически активное вещество, присутствует в виде физиологически совместимой соли, особенно как гидрохлорид мемантина. Предпочтительно слой, содержащий биологически активное вещество, дополнительно содержит по меньшей мере один основный материал, основность которого достаточна, чтобы вступать в реакцию с физиологически совместимой солью биологически активного вещества с высвобождением свободного основания биологически активного вещества. Подходящие основные материалы известны специалисту, а их пригодность может оцениваться на основании величины pKa основания мемантина. Предпочтительно основный материал выбирается из группы, состоящей из полимеров с основными боковыми группами, органических оснований и неорганических оснований. В одном предпочтительном варианте исполнения основный материал отбирается из группы, состоящей из полимеров на акрилатной основе, которые имеют аминоалкильные боковые группы; неорганических оксидов или гидроксидов, особенно оксидов щелочных или щелочноземельных металлов; органических аминов или их солей; алкоголятов или карбоксилатов щелочных или щелочноземельных металлов.
Предпочтительными примерами подходящих основных материалов являются оксид кальция (CaO), этилат натрия и основные сополимеры метакрилата, такие как, например, Eudragit® E100.
В одном предпочтительном варианте исполнения слой, содержащий биологически активное вещество, содержит от 20 до 90% масс. удерживающего материала, от 10 до 50% масс. биологически активного вещества, а также при необходимости от 5 до 40% масс. основного материала, в пересчете на общую массу слоя, содержащего биологически активное вещество.
Слой, содержащий биологически активное вещество, ТТС согласно изобретению, помимо биологически активного вещества и присутствующего при необходимости клеящего вещества, также может содержать усилитель клейкости, пластификатор, вещества, усилители проникающей способности, вещества, повышающие вязкость, усилители растворимости, сшивающие агенты, консерванты, эмульгаторы, загустители и/или другие обычные вспомогательные вещества. Добавки такого типа являются известными специалисту.
Примерами усилителей растворимости и/или усилителей проникающей способности являются ацетилацетон, ацетилтрибутилцитрат, ацетилтриэтилцитрат, бензиловый спирт, бутилстеарат, цетиллактат, цетилпальмитат, цетилстеарат, цетилстеариловый спирт/цетиловый спирт, хлорбутанол, цинеол, децилметилсульфоксид, децилолеат, дибутилфталат, простой моноэтиловый эфир диэтиленгликоля, диэтилфталат, диэтилсебацинат, диизопропиладипат, диметилфталат, диоктиладипат, дипропиленгликоль, глицерилмоноолеат, глицерилмоностеарат, стеариловый спирт, арахисовое масло, этиллактат, этиллинолеат, этил-(9,12,15)-линолеат, эвгенол, фарнезол, глицерин, сложный глицерилацетиловый эфир, глицерилстеарат, гликольдистеарат, глиоксаль, гексадеканол, гексиленгликоль, изобутилстеарат, изоцетилстеарат, изодецилолеат, изопропилланолат, изопропилмиристат/изопропилпальмитат, изопропилстеарат, изостеарилнеопентаноат, диэтаноламид лауриновой кислоты, лимонен, линоленовая кислота, диэтаноламид линоленовой кислоты, ментол, миристиллактат, миристилмиристат, миристилстеарат, м-толилацетат, октилдодеканол, октилпальмитат, октилстеарат, диэтаноламид олеиновой кислоты, олеиловый спирт, олеилолеат, фенилэтиловый спирт, пропиленгликоль, пропиленкарбонат, изостеариновая кислота, октановая кислота, гидрированное касторовое масло, 1,3-бутиленгликоль, сафлоровое масло, сквалан, сквален, триацетин, глицерилтриацетат, триэтилцитрат, ундециленовая кислота, (+)-фенхон, простой лаурилэфирсульфат аммония, холестерин, лецитин, глицерингидроксистеарат, моно- и диглицериды жирных кислот, каприлат натрия, простой лаурилэфирсульфат натрия, натриевые/калиевые соли жирных кислот, лаурилсульфат натрия, ПЭГ-(2)-сеарат, сульфосукцинат натрия, сложные полиглицериловые эфиры жирных кислот, простые полиоксиэтиленалкиловые эфиры, цетомакрогол, сложные эфиры сорбита и полиоксиэтиленовых жирных кислот, пропиленгликольстеарат, сложные эфиры сорбита и жирных кислот, диэтаноламид стеариновой кислоты, триглицериды со средней длиной цепи (предпочтительно 12-14 атомами углерода) (согласно Европейской фармакопее, Ph. Eur.).
В качестве веществ, способствующих растворению, могут применяться N-метил-2-пирролидон, лаурилпирролидон, триэтаноламин, триацетин, простой моноэтиловый эфир диэтиленгликоля, производные жирных кислот или жирных спиртов и/или низкомолекулярных многоатомных спиртов, таких как, например, пропиленгликоль или глицерин.
В случае веществ, повышающих вязкость, в рамках этого описания речь идет предпочтительно о гелеобразователе, то есть, о веществе, которое, с одной стороны, повышает вязкость композиции, а с другой стороны, способствует образованию геля. Примерами таких повышающих вязкость веществ являются желатины (например, Gelatin), камедь плодов рожкового дерева (например, Cesagum® LA-200, Cesagum® LID/150, Cesagum® LN-1), пектины, такие как цитрусовый пектин (например, Cesapectin® HM Medium Rapid Set), яблочный пектин, пектин из кожуры лимона, крахмал восковидной кукурузы (C*Gel® 04201), альгинат натрия (например, Frimulsion® ALG (E401)), гуаровая камедь (например, Frimulsion® ВМ, Polygum® 26/1-75), йота-каррагинан (например, Frimulsion® D021), камедь карайи, геллановая камедь (например, Kelcogel® F, Kelcogel® LT100), галактоманнан (например, Meyprogat® 150), камедь тары (например, Polygum® 43/1), пропиленгликольальгинат (например, Protanal®-Ester SD-LB), гиалуронат натрия, трагант, камедь тары (например, Vidogum® SP 200), ферментированная полисахаридная велановая камедь (например, К1А96), ксантановая камедь (например, Xantural® 180).
Если ТТС согласно изобретению образована по системе с резервуаром, мембрана резервуара может состоять из инертных полимеров, таких как, например, полиэтилены, полипропилены, поливинилацетаты, полиамиды, сополимеры этилен/винилацетат и/или силиконы. С помощью мембраны резервуара может достигаться контролируемое высвобождение биологически активного вещества из этого резервуара.
Матрица, содержащая биологически активное вещество, или соответственно резервуар, содержащий биологически активное вещество, также может содержать растворитель, такой как, например, вода, этанол, 1-пропанол, изопропанол, низкомолекулярный многоатомный спирт, например, пропиленгликоль или глицерин, или сложный эфир, такой как изопропилмиристат, или их смеси. Однако в предпочтительном варианте исполнения матрица, содержащая биологически активное вещество, или соответственно резервуар, содержащий биологически активное вещество, в основном не содержат этанола и/или изопропанола.
В качестве консервантов для слоя, содержащего биологически активное вещество, могут применяться антиокислители, такие как витамин Е, бутилгидрокситолуол, бутилгидроксианизол, парабены, аскорбиновая кислота, аскорбилпальмитат, и/или вещества, образующие хелаты, такие как динатриевая соль этилендиаминтетрауксусной кислоты, цитрат калия или натрия. Кроме того, в качестве консервантов подходят сложные эфиры полигидроксибутирата (ПГБ), такие как сложный метиловый эфир ПГБ и сложный пропиловый эфир ПГБ, хлорид бензалкония, хлоргексидин, сорбиновая кислота, бензойная кислота, пропионовая кислота, салициловая кислота и ее соли, формальдегид и параформальдегид, гексахлорофен, о-фенилфенол, цинкпиритион, неорганические сульфиты, йодат натрия, хлорбутол, дегидроуксусная кислота, муравьиная кислота, дибромгексамид, мертиолат, фенилртутные соли (соединения фенилртути), ундециленовая кислота, гексетидин, бронидокс, бронопол, 2,4-дихлорбензиловый спирт, триклокарбан, парахлорметакрезол, триклозан, парахлорметаксиленол, производные имидазолидинилмочевины, хлоргидрат полигексаметиленбигуанида, феноксиэтанол, метенамин, Dowicil 200, 1-имидазолил-(4-хлорфенокси)-3,3'-диметилбутан-2-он, диметилгидантоин, бензиловый спирт, 1-гидрокси-4-метил-6-(2,4,4-триметилпентил)-2-пиридон, 1,2-дибром-2,4-дицианобутан, 3,3'-дибром-5,5'-дихлор-2,2-дигидроксидифенилметан, изопропилметакрезол и катон.
ТТС согласно изобретению может в одном слое или в нескольких слоях содержать также по меньшей мере один пластификатор, выбираемый из группы, включающей длинноцепные спирты, такие как додеканол, ундеканол, октанол, сложные эфиры карбоновых кислот с полиэтоксилированными спиртами, сложные диэфиры алифатических дикарбоновых кислот, таких как адипиновая кислота, и триглицериды каприловой кислоты и/или каприновой кислоты со средней длиной цепи, кокосовое масло, многоатомные спирты, такие как 1,2-пропандиол, сложные эфиры многоатомных спиртов, таких как глицерин, с левулиновой кислотой или каприловой кислотой и превращенные в простые эфиры многоатомные спирты.
Получение ТТС согласно изобретению может осуществляться согласно известным способам получения, особенно для пластырей, содержащих активные вещества, с помощью таких стадий процесса, как ламинирование, перфорирование, расслаивание, раскатывание, нарезка, перематывание, сборка или дозирование (сравните с публикацией Verpackungs-Rundschau 4/2002, 83-84).
Высвобождение биологически активного вещества из ТТС согласно изобретению предпочтительно осуществляется контролируемо. При этом ТТС согласно изобретению предпочтительно имеет максимальную скорость высвобождения биологически активного вещества не более 100 мкг/см2 ч, предпочтительно не более 95 мкг/см2 ч, не более 90 мкг/см2 ч или не более 85 мкг/см2 ч; более предпочтительно не более 80 мкг/см2 ч, не более 75 мкг/см2 ч или не более 70 мкг/см2 ч; еще более предпочтительно не более 65 мкг/см2 h, не более 60 мкг/см2 ч или не более 55 мкг/см2 ч; наиболее предпочтительно не более 50 мкг/см2 ч, не более 45 мкг/см2 ч или не более 40 мкг/см2 ч; и в особенности не более 35 мкг/см2 ч или не более 32 мкг/см2 ч.
В одном предпочтительном варианте исполнения максимальная скорость высвобождения биологически активного вещества находится в диапазоне 20±15 мкг/см2 ч, более предпочтительно 20±12,5 мкг/см2 ч, еще более предпочтительно 20±10 мкг/см2 ч, наиболее предпочтительно 20±7,5 мкг/см2 ч и в особенности 20±5 мкг/см2 ч. В другом предпочтительном варианте исполнения максимальная скорость высвобождения биологически активного вещества находится в диапазоне 25±10 мкг/см2 ч, еще более предпочтительно 25±7,5 мкг/см2 ч, наиболее предпочтительно 25±5 мкг/см2 ч и в особенности 25±