Способ получения амидов креатина
Иллюстрации
Показать всеИзобретение относится к области фармацевтической химии, конкретно к способу получения амидов креатина указанной ниже общей формулы, которые проявляют антиишемическую активность. В формуле R означает аминокислотный остаток аминокислоты; Y означает OR1, NR2R3, где R1 представляет собой Н, CH2Ph, алкил С1-С3, R2, R3 - Н, алкил С1-С4; X - низкомолекулярная С1-С4 органическая кислота или минеральная кислота, или вода. Способ заключается в обработке креатина пара-толуолсульфоновой кислотой в диметилформамиде с последующим взаимодействием полученного комплекса с производными аминокислот в присутствии конденсирующего агента и основания. В качестве конденсирующего агента используют хлорангидрид моноэфира муравьиной кислоты, причем конденсирующий агент и основание вводят одновременно. Затем к полученной смеси прибавляют ацетат щелочных металлов, отгоняют не менее 80% диметилформамида, экстрагируют активное начало полярным апротонным растворителем, содержащим не менее одного ингредиента из группы, в которую входят ацетон, тетрагидрофуран, метилэтилкетон и ацетонитрил. После этого растворитель отгоняют, остаток растворяют в полярном протонном растворителе, содержащем не менее одного ингредиента из группы, в которую входят вода, этиловый и изопропиловый спирт, муравьиная и уксусная кислоты, пара-толуолсульфоновую кислоту удаляют путем хроматографирования на анионообменном сорбенте. Растворитель отгоняют в присутствии низкомолекулярной С1-С4 органической кислоты или минеральной кислоты и спирта при pH не более 4,5, затем обрабатывают растворителем, содержащим не менее одного ингредиента из группы, в которую входят ацетон, тетрагидрофуран, метилэтилкетон, ацетонитрил и этилацетат. Активное начало экстрагируют растворителем, содержащим не менее одного ингредиента из группы, в которую входят этиловый и метиловый спирты, отгоняют не менее 70% растворителя и обрабатывают растворителем, содержащим не менее одного ингредиента из группы, в которую входят ацетон, тетрагидрофуран, метилэтилкетон, ацетонитрил и этилацетат. Предлагаемый способ позволяет повысить выход и чистоту целевого продукта. 21 з.п. ф-лы, 1 табл., 25 пр.
Реферат
Изобретение относится к области фармацевтической химии, а именно к способам получения биологически активных веществ, в частности, проявляющих антиишемическую активность амидов креатина общей формулы NH=C(NH2)-N(CH3)-CH2-CO-RY*X, где R - аминокислотный остаток аминокислоты; Y - OR1, NR2R3, где R1 - Н, CH2Ph, алкил C1-C3, R2, R3=Н, алкил С1-С4; X - низкомолекулярная С1-С4 органическая кислота, или минеральная кислота или вода.
Ишемическое поражение головного мозга и миокарда приводит к развитию патофизиологических изменений в тканях, сопровождающихся нарушением метаболических процессов, нарушением энергетического тканевого метаболизма [Reichelt K.L. Acta Anesthesiol. Scand. 1978], развитием ацидоза, разрушением астроцитов [Hertz L.J. Cereb. Blood Flow Metab. 2004; 24:1241-8], компрессии капилляров головного мозга [Ames A.I. et al. 1968; 52:437-53].
Известна многочисленная группа лекарственных препаратов - тромболитики, антиагреганты, ноотропы и т.п., повышающих устойчивость тканей, в частности, головного мозга, к ишемии (Goodman Е. Gilman's. The Pharmacological Basis of Therapeutics, 11 ed, McGraw-Hill, Medical Publ. Division, New York 2006; RU 1746886, 1991; WO 96/08527, 1996).
Недостатками большинства известных препаратов является узкий спектр действия, значительное количество побочных эффектов и противопоказаний, невысокая нейропротективная активность, ограниченность применения при острой и хронической ишемии головного мозга и остром инфаркте миокарда [The Cochrane Library, Issue 4, 2002. Oxford].
Поэтому разработка лекарственных препаратов для лечения и профилактики ишемии является важной проблемой.
Перспективным направлением профилактики и лечения ишемии является использование амидов креатина и их производных (RU 2354645, 2009; US 8,350,077 В2).
Амиды креатина проявляют нейропротективную активность при ишемии головного мозга [Burov S.V et all. J. Pept. Sci. 2011. V. 17. N.9. P. 620-626], а также антитромботическую и антиагрегантную активность, способствующую восстановлению кровотока [Веселкина О.С. и др. Вестник службы крови России, №3, с. 31-37, 2010], однако технология их получения не позволяет получать целевой продукт с высоким выходом. К тому же спектр получаемых амидов ограничен и нуждается в расширении. В этой связи остается важной задачей разработка более эффективных способов синтеза амидов креатина.
Известен способ получения амидов креатина и алифатических, ароматических или гетероароматических аминокислот или их производных, заключающийся в первоначальном получении полупродуктов, а именно амидов саркозина и алифатических, ароматических или гетероароматических аминокислот или их производных, дальнейшем гуанидилировании полупродуктов в полярных органических растворителях при температуре не более 50°С и получении амидов креатина [RU 2354645, 2009].
Недостатками указанного способа являются низкий выход целевого продукта, необходимость использовать при синтезе дорогостоящие гуанидилирующие агенты - бензотриазол-1-карбоксамидина тозилат, N,N′-дибензилоксикарбонил-1-Н-бензотриазол-1-карбоксимидин, что в целом обуславливает высокую себестоимость амидов креатина.
Наиболее близким к заявляемому изобретению, является способ получения амидов креатина и аминокислот или их производных [RU 2428414, 2011] в виде солей, заключающийся в обработке креатина или креатина моногидрата пара-толуолсульфокислотой в органическом растворителе, последующей обработкой реакционной смеси сложноэфирными или амидными производными аминокислот, в присутствии последовательно вводимых конденсирующего агента и основания.
Недостатком указанного способа является низкий выход амидов креатина, не превышающий 32% и ограниченный спектр получаемых препаратов. Кроме того, указанный способ, используя в процессе синтеза пара-толуолсульфокислоту (п-ТСК) или толуолсульфонаты, не обеспечивают полноту их удаления в процессе выделения и очистки целевого продукта. Вместе с тем, п-ТСК не является фармакологически приемлемой кислотой, и при попадании в организм может образовывать продукты, обладающие токсичностью.
Технической задачей, решаемой авторами, являлось создание способа синтеза амидов креатина общей формулы NH=C(NH2)-N(CH3)-CH2-CO-RY*X, где R - аминокислотный остаток аминокислоты; Y - OR1, NR2R3, где R1 - Н, CH2Ph, алкил С1-С3; R2, R3=Н, алкил С1-С4; X - низкомолекулярная С1-С4 органическая кислота или минеральная кислота или вода, обеспечивающего более высокий выход целевого продукта и его чистоту в соответствии с современными фармакопейными требованиями к новым фармацевтическим субстанциям.
Технический результат достигался путем обработки креатина пара-толуолсульфоновой кислотой в диметилформамиде с последующим взаимодействием полученного комплекса с производными аминокислот, в присутствии конденсирующего агента и основания, причем в качестве конденсирующего агента используют хлорангидрид моноэфира муравьиной кислоты, а в качестве основания N-метилморфолин или триэтиламин. При этом конденсирующий агент и основание вводят в реакционную смесь, одновременно в отличие от аналога, где вначале вводят конденсирующий агент, а затем, после него, вводят основание. Далее к реакционной смеси прибавляют ацетат щелочных металлов, отгоняют не менее 80% диметилформамида, активное начало экстрагируют полярным апротонным растворителем, содержащим не менее одного ингредиента из группы, в которую входят ацетон, тетрагидрофуран, метилэтилкетон и ацетонитрил, и отгоняют не менее 80% растворителя. Активное начало экстрагируют из остатка полярным апротонным растворителем, содержащим не менее одного ингредиента из группы, в которую входят ацетон, тетрагидрофуран, метилэтилкетон и ацетонитрил, растворитель отгоняют, остаток растворяют в полярном протонном растворителе, содержащем не менее одного ингредиента из группы, в которую входят вода, этиловый и изопропиловый спирт, муравьиная и уксусная кислоты. Пара-толуолсульфоновую кислоту удаляют путем хроматографирования на анионообменном сорбенте, растворитель отгоняют в присутствии низкомолекулярной С1-С4 органической кислоты или минеральной кислоты и спирта при pH не более 4,5. Остаток обрабатывают растворителем, содержащим не менее одного ингредиента из группы, в которую входят ацетон, тетрагидрофуран, метилэтилкетон, ацетонитрил и этилацетат, активное начало экстрагируют растворителем, содержащим не менее одного ингредиента из группы, в которую входят этиловый и метиловый спирты, далее отгоняют не менее 70% растворителя. Остаток после отгонки обрабатывают растворителем, содержащим не менее одного ингредиента из группы, в которую входят ацетон, тетрагидрофуран, метилэтилкетон, ацетонитрил и этилацетат.
Было установлено, что одновременное введение конденсирующего агента, такого как хлорангидрид моноэфира муравьиной кислоты, и основания, такого как N-метилморфолин, триэтиламин, позволяет существенно увеличить выход амидов креатина на стадии синтеза, а прибавление к маточному раствору, получаемому после стадии синтеза, ацетата щелочных металлов, позволяет добиться более полного удаления хлорид-ионов, образующихся в реакции конденсации комплекса креамида с п-ТСК с производными аминокислот, что приводит к оптимизации процесса хроматографирования на анионообменном сорбенте и обеспечивает высокий выход и необходимую чистоту целевого продукта - содержание основного вещества в синтезированных амидах креатина по данным ОФ ВЭЖХ было не менее 98%, содержание хлорид-ионов - следовое (на уровне погрешности измерения), а содержание п-ТСК не превышало нескольких р.р.м.
В ходе синтеза, для предотвращения способности молекул аминокислот (и креатина) вступать в реакцию друг с другом, одну из одну из функциональных групп защищают, чтобы сделать инертной [S. Chandrudu, Р. Simerska,* and I.Т. Chemical Methods for Peptide and Protein Production. Molecules 2013, 18, 4373-4388; doi:10.3390]. Получают комплекс креатина с пара-толуолсульфокислотой, что позволяет защитить гуанидиновую группу креатина, и производными аминокислот, содержащими заместители по карбоксильной группе молекулы. В качестве таких производных аминокислот используют эфирные, амидные или нитро производные протеиногенных α-аминокислот, эфирные или амидные производные β-аланина. Термин «протеиногенные α-аминокислоты» понимается в соответствии с международной номенклатурой (NOMENCLATURE AND SYMBOLISM FOR AMINO ACIDS AND PEPTIDES. Pure & Appi. Chem., Vol. 56, No. 5, pp. 595-624, 1984). В частности, в качестве протеиногенных α-аминокислот могут быть использованы ациклические или ароматические α-аминокислоты, О-этилтирозин, О-изопропилтирозин, пролин или гистидин и т.п.
В качестве креатина при синтезе может быть использован безводный креатин или креатина моногидрат.
В качестве хлорангидрида моноэфира муравьиной кислоты могут быть использованы изобутилхлорформиат или этилхлорформиат и их аналоги, в качестве основания - N-метилморфолин, триэтиламин и т.п. В качестве ацетатов щелочных металлов могут быть использованы безводный ацетат натрия или калия, гидраты ацетатов натрия или калия.
В качестве анионообменного сорбента оптимально использовать смолы на основе сополимеров стирола или на основе акриловых сополимеров содержащие третичные или четвертичные аммонийные группы, например Dowex 1x8, Amberlite IRA-67. Как правило, в качестве элюента применяют водный раствор муравьиной или уксусной кислот или водно-спиртовый растворитель.
В качестве низкомолекулярной С1-С4 органической кислоты могут быть использованы метансульфоновая, уксусная, фумаровая или янтарная кислота и т.п., а в качестве минеральной кислоты могут быть использованы такие кислоты, как ортофосфорная, соляная и т.п.
Контроль за ходом реакции, а также оценка выхода и чистоты амидов креатина осуществлены с использованием метода ОФ ВЭЖХ на хроматографе Alliance (Waters), колонка Zorbax Eclipse С18, 3,5 мкм, 3*100 мм (Agilent Technologies), элюирование в режиме линейного градиента от 100% фазы А (смесь буферного раствора, содержащего 0.01 М натрия октансульфоната и 0,02 М натрия дигидрофосфата (рН=3,0) с ацетонитрилом в соотношении 95:5) до 100% фазы Б за 30 мин (смесь буферного раствора, содержащего 0.01 М натрия октансульфоната и 0,02 М натрия дигидрофосфата (рН=3,0) с ацетонитрилом в соотношении 70:30), или в режиме линейного градиента от 100% фазы А (0,05 М ортофосфорная кислота в смеси вода : ацетонитрил в соотношении 95:5) до 100% фазы Б 0,05 М ортофосфорная кислота в смеси вода : ацетонитрил в соотношении 50:50) за 30 мин; детектирование - при 210 нм. Содержание п-ТСК в амидах креатина определено методом ОФ ВЭЖХ на хроматографе Alliance (Waters), колонка Symmetry С18, (Waters, США), подвижная фаза - 0,1% раствор трифторуксусной кислоты в смеси вода : ацетонитрил (97:3), детектирование при 220 нм. Сульфатную золу в амидах креатина пределяли по ЕР 8.2, содержание хлорид-ионов - методом аргентометрического титрования.
Структура полученных соединений подтверждена данными ЯМР спектроскопии 1Н и 13С.
Сущность и преимущества заявляемого способа иллюстрируются следующими примерами.
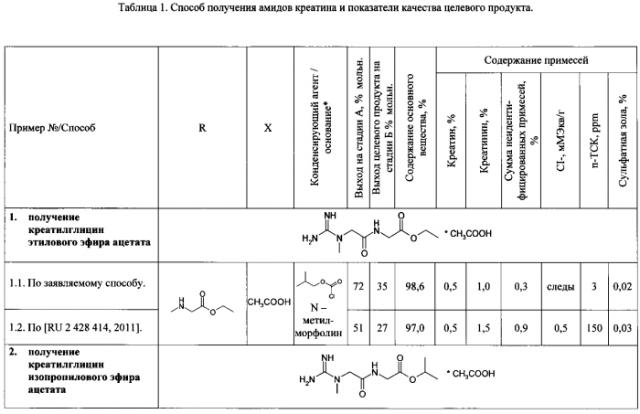
Пример 1. Получение креатилглицин этилового эфира ацетата
1.1. Получение креатилглицин этилового эфира ацетата по заявляемому способу.
Стадия А. Получение креатилглицин этилового эфира тозилата.
В трехгорлую колбу на 100 мл, снабженную термометром, двумя капельными воронками, воздушным холодильником с хлоркальциевой трубкой, установленную на магнитной мешалке, помещают креатина моногидрат (5,69 г, 38 ммоль), п-ТСК (15,23 г, 80 ммоль) и ДМФА (30 мл), перемешивают в течение 10 мин, прибавляют раствор глицин этилового эфира гидрохлорида (5,32 г, 38 ммоль) в 15 мл ДМФА. Реакционную смесь перемешивают при комнатной температуре в течение 5 мин, охлаждают (смесь лед-соль) до температуры (-)15°С, прибавляют одновременно, в течение 30 мин, изобутилхлорформиат (6,25 г, 45,8 ммоль) и N-метилморфолин (8,48 г, 83,9 ммоль), перемешивают при температуре (-)10°С в течение 1,5 ч. Осадок солей N-метилморфолина отфильтровывают от охлажденной реакционной смеси, промывают на фильтре охлажденным до температуры 0°С ДМФА (2×5 мл). Промывные жидкости и маточный раствор объединяют. В объединенном растворе определяют выход креатинглицин этилового эфира тозилата и содержание хлорид-ионов. Выход креатилглицин этилового эфира тозилата составляет 72% мольн., суммарное количество хлорид-ионов 29,3 мМЭкв. К раствору прибавляют натрия ацетат тригидрат (3,99 г, 29,3 ммоль), перемешивают в течение 1 ч, отгоняют 50 мл (91%) ДМФА при пониженном давлении и температуре 45°С. К остатку, охлажденному до комнатной температуры, прибавляют 40 мл ацетона, суспензию перемешивают в течение 20 мин, прибавляют 4 г целита, перемешивают в течение 20 мин. На фильтр помещают 10 г целита, промывают 40 мл ацетона, промывную жидкость утилизируют. Суспензию фильтруют через целит, осадок на фильтре промывают 25 мл ацетона. Промывные жидкости и маточный раствор объединяют. Количество хлорид-ионов в растворе снижается до 5,6 мМЭкв. Из раствора отгоняют растворитель при пониженном давлении и температуре 45°С до окончания погона. Остаток растворяют в 20 мл воды, получают раствор креатилглицин этилового эфира тозилата.
Стадия Б. Получение креатилглицин этилового эфира ацетата.
Удаление п-ТСК и ее замену на фармацевтически приемлемую кислоту осуществляют методом ионообменной хроматографии (хроматографическая система Buchi «Sepacore», колонка размером 49×210 мм (General Electric, США), заполненная сорбентом Dowex 1x8 в ацетатной форме). Раствор креатилглицин этилового эфира тозилата наносят на колонку, элюируют 0,05 М раствором уксусной кислоты со скоростью 0,3 см/мин. Детектирование осуществляют при длине волны 220 нм. Отбирают фракции, анализируют методом ВЭЖХ, объединяют на основании результатов анализа для получения креатилглицин этилового эфира ацетата с суммарным содержанием неидентифицированных примесей не более 1%, креатинина - не более 1%, креатина - не более 1%. К объединенным фракциям прибавляют уксусную кислоту до рН 4,3, отгоняют растворитель при пониженном давлении и температуре 40°С до окончания погона. К остатку прибавляют 100 мл изопропилового спирта, растворитель отгоняют при пониженном давлении и температуре 40°С до окончания погона, прибавляют 50 мл ацетона, перемешивают 3 ч. Осадок отделяют фильтрацией, промывают ацетоном (3×25 мл), высушивают в вакууме при температуре 40°С, растворяют в 125 мл абсолютного этанола при перемешивании в течение 20 мин, не растворившийся остаток отделяют фильтрованием, промывают на фильтре абсолютным этанолом (2×20 мл), промывные жидкости объединяют с маточным раствором. Из объединенного раствора отгоняют 130 мл (78%) этанола при пониженном давлении и температуре 40°С, прибавляют 50 мл этилацетата, смесь выдерживают 2 ч при комнатной температуре, осадок отделяют фильтрованием, промывают этилацетатом (2×50 мл), высушивают в вакууме при температуре 40°С.
Выход креатилглицин этилового эфира ацетата C8H16N4O3*C2H4O2 составляет 3,67 г (35%). Содержание основного вещества 98,6%, посторонние примеси: креатинин - 1,0%, креатин - 0,5%, максимальная единичная неидентифицированная примесь - 0,1%, сумма неидентифицированных примесей - 0,3%; сульфатная зола - 0,02%, хлорид-ионы - следы, п-ТСК - 3 ppm. Спектр ЯМР 1Н (D2O), δ, м.д. (J, Гц): 1,26 (3Н, т, 7,17 Гц, СН2СН3), 1,90 (3Н, с, СН3СООН), 3,07 (3Н, с, NCH3), 4,06 (2Н, с, N(CH3)CH2CO), 4,20-4,25 (4Н, м, NHCH2CO и СН2СН3). Спектр ЯМР 13С (D2O), δ, м.д.: 15,96, 25,98, 39,72, 44,09, 55,30, 65,34, 160,55, 172,69, 174,24, 184,09.
1.2. Получение креатилглицин этилового эфира ацетата по способу, приведенному в прототипе [RU 2428414, 2011].
Стадия А. Получение креатилглицин этилового эфира тозилата.
В трехгорлую колбу на 100 мл, снабженную термометром, двумя капельными воронками, воздушным холодильником с хлоркальциевой трубкой, установленную на магнитной мешалке, помещают креатина моногидрат (5,69 г, 38 ммоль), п-ТСК (15,23 г, 80 ммоль) и ДМФА (30 мл), перемешивают в течение 10 мин, прибавляют раствор глицин этилового эфира гидрохлорида (5,32 г, 38 ммоль) в 15 мл ДМФА. Реакционную смесь перемешивают при комнатной температуре в течение 5 мин, охлаждают баней (смесь лед-соль) до температуры (-)15°С, последовательно прибавляют изобутилхлорформиат (6,25 г, 45,8 ммоль), затем, в течение 30 мин, по каплям, прибавляют N-метилморфолин (8,48 г, 83,9 ммоль), перемешивают при температуре (-)10°С в течение 1 ч, доводят температуру до комнатной. Осадок отфильтровывают от реакционной смеси. В маточном растворе определяют содержание креатинглицин этилового эфира тозилата, хлорид-ионов. Выход креатилглицин этилового эфира тозилата 51% мольн., суммарное количество хлорид-ионов 35,1 мМЭкв. Из раствора отгоняют растворитель при пониженном давлении и температуре 50°С до окончания погона. Остаток растворяют в 160 мл хлороформа, оставляют на 10 ч при температуре (-)10°С. Раствор отфильтровывают и экстрагируют водой 3 раза по 100 мл. Водные экстракты объединяют, 2 раза экстрагируют хлороформом, из объединенного водного экстракта отгоняют растворитель до объема 50 мл при пониженном давлении и температуре 40°С. Получают раствор креатилглицин этилового эфира тозилата. Стадия Б. Получение креатилглицин этилового эфира ацетата.
Удаление п-ТСК и ее замену на фармацевтически приемлемую кислоту осуществляют методом ионообменной хроматографии (хроматографическая система Buchi «Sepacore», колонка размером 49×210 мм (General Electric, США), заполненная сорбентом Dowex 1x8 в ацетатной форме). Раствор креатилглицин этилового эфира тозилата наносят на колонку, элюируют водой со скоростью 0,3 см/мин, контролируя рН элюата. Фракции с рН=7 (рН воды 5) собирают, анализируют методом ВЭЖХ, объединяют, прибавляют уксусную кислоту, из полученного раствора отгоняют растворитель при пониженном давлении и температуре 40°С до окончания погона. Остаток кристаллизуют из 20 мл ацетонитрила при температуре (-)10°С в течение 20 ч. Осадок ацетата этилового эфира креатилглицина отфильтровывают, промывают холодным ацетонитрилом, диэтиловым эфиром и высушивают.
Выход креатилглицин этилового эфира ацетата C8H16N4O3*C2H4O2 составляет 2,83 г (27%). Содержание основного вещества 97%, посторонние примеси: креатинин - 1,5%, креатин - 0,5%; максимальная единичная неидентифицированная примесь - 0,5%, сумма неидентифицированных примесей - 0,9%, сульфатная зола - 0,03%, хлорид-ионы - 0,5 мМЭкв/г, п-ТСК - 150 ppm. Спектр ЯМР 1Н (D2O), δ, м.д. (J, Гц): 1,26 (3Н, т, 7,17 Гц, СН2СН3), 1,91 (3Н, с, СН3СООН), 3,07 (3Н, с, NCH3), 4,06 (2Н, с, N(CH3)CH2CO), 4,20-4,25 (4Н, м, NHCH2CO и СН2СН3). Спектр ЯМР 13С (D2O), δ, м.д.: 15,95, 25,99, 39,72, 44,11, 55,30, 65,34, 160,55, 172,71, 174,24, 184,09.
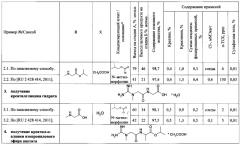
Пример 2. Получение креатилглицин изопропилового эфира ацетата
2.1 Получение креатилглицин изопропилового эфира ацетата по заявляемому способу.
Стадия А. Получение креатилглицин изопропилового эфира тозилата.
В трехгорлую колбу на 100 мл, снабженную термометром, двумя капельными воронками, воздушным холодильником с хлоркальциевой трубкой, установленную на магнитной мешалке, помещают безводный креатин (5 г, 38 ммоль), п-ТСК (15,23 г, 80 ммоль) и ДМФА (30 мл), перемешивают в течение 10 мин, прибавляют раствор глицина изопропилового эфира гидрохлорида (5,84 г, 38 ммоль) в 15 мл ДМФА. Смесь перемешивают при комнатной температуре в течение 5 мин, охлаждают баней (смесь лед-соль) до температуры (-)15°С, прибавляют одновременно в течение 30 мин изобутилхлорформиат (6,25 г, 45,8 ммоль) и N-метилморфолин (8,48 г, 83,9 ммоль), перемешивают при температуре (-)10°С в течение 1,5 ч. Осадок отфильтровывают от охлажденной реакционной смеси, промывают на фильтре охлажденным до температуры 0°С ДМФА (2×5 мл). Промывные жидкости и маточный раствор объединяют. В растворе определяют выход креатинглицин изопропилового эфира тозилата и содержание хлорид-ионов. Выход креатилглицин изопропилового эфира тозилата 79% мольн., суммарное количество хлорид-ионов 29,0 мМЭкв. К раствору прибавляют натрия ацетат тригидрат (3,95 г, 29,0 ммоль), перемешивают в течение 1 ч, отгоняют 50 мл (91%) ДМФА при пониженном давлении и температуре 45°С. К остатку при комнатной температуре прибавляют 40 мл ацетона, суспензию перемешивают в течение 20 мин, прибавляют 4 г целита, перемешивают в течение 20 мин. На фильтр помещают 5 г целита, промывают 40 мл ацетона, промывную жидкость утилизируют. Суспензию фильтруют через целит, осадок промывают 25 мл ацетона. Промывные жидкости и маточный раствор объединяют. Содержание хлорид-ионов в растворе 5,7 мМЭкв. Из объединенного раствора отгоняют растворитель при пониженном давлении и температуре 45°С до окончания погона. Остаток растворяют в 20 мл 0,05 М раствора уксусной кислоты, получают раствор креатилглицин изопропилового эфира тозилата.
Стадия Б. Получение креатилглицин изопропилового эфира ацетата.
Удаление п-ТСК и ее замену на фармацевтически приемлемую кислоту осуществляют методом ионообменной хроматографии (хроматографическая система Buchi «Sepacore», колонка размером 49×210 мм (General Electric, США), заполненная сорбентом Dowex 1x8 в ацетатной форме). Раствор креатилглицин изопропилового эфира тозилата наносят на колонку, элюируют 0,05 М раствором уксусной кислоты со скоростью 0,3 см/мин. Детектирование осуществляют при длине волны 220 нм. Отбирают фракции, анализируют методом ВЭЖХ, объединяют на основании результатов анализа для получения креатилглицин изопропилового эфира ацетата с суммарным содержанием неидентифицированных примесей не более 1%, креатинина - не более 1%, креатина - не более 1%, прибавляют уксусную кислоту до рН 4,5. Из объединенных фракций отгоняют растворитель при пониженном давлении и температуре 40°С до окончания погона. К остатку прибавляют 100 мл изопропилового спирта, отгоняют растворитель при пониженном давлении и температуре 40°С до окончания погона, прибавляют 50 мл ацетона, перемешивают 3 ч, осадок отделяют фильтрацией, промывают ацетоном (3×25 мл), высушивают в вакууме при температуре 40°С. Осадок растворяют в 125 мл абсолютного этанола при перемешивании в течение 20 мин, нерастворившийся остаток отделяют фильтрованием, промывают на фильтре абсолютным этанолом (2×20 мл), промывные жидкости объединяют с маточным раствором. Из раствора отгоняют 130 мл (78%) этанола при пониженном давлении и температуре 40°С, прибавляют 50 мл этилацетата, смесь выдерживают 2 ч при комнатной температуре. Осадок отделяют фильтрованием, промывают этилацетатом (2×50 мл), высушивают в вакууме при температуре 40°С.
Выход креатилглицин изопропилового эфира ацетата C9H18N4O3*C2H4O2 составляет 5,08 г (46%). Содержание основного вещества 98,7%, сульфатная зола - 0,01%, хлорид-ионы - следы, п-ТСК - 4 ppm, посторонние примеси: креатинин - 1,0%, креатин - 0,4%, максимальная единичная неидентифицированная примесь - 0,1%, сумма неидентифицированных примесей - 0,3%,. Спектр ЯМР 1Н (D2O), δ, м.д. (J, Гц): 1,26 (6Н, д, 6,22 Гц, СН(СН3)2), 1,90 с (3Н, с, СН3СООН), 3,07 с (3Н, с, NCH3), 4,02 (2Н, с, N(CH3)CH2CO), 4,23 (2Н, с, NHCH2CO), 5,05 (1H, м, СН(СН3)2). Спектр ЯМР 13С (D2O), δ, м.д.: 23,49, 25,96, 39,72, 44,36, 55,29, 73,65, 160,54, 172,63, 173,69, 184,06.
2.2 Получение креатилглицин изопропилового эфира ацетата по способу, приведенному в прототипе [RU 2428414, 2011].
Стадия А. Получение креатилглицин изопропилового эфира тозилата.
В трехгорлую колбу на 100 мл, снабженную термометром, двумя капельными воронками, воздушным холодильником с хлоркальциевой трубкой, установленную на магнитной мешалке, помещают креатина моногидрат (5,69 г, 38 ммоль), п-ТСК (15,23 г, 80 ммоль) и ДМФА (30 мл), перемешивают в течение 10 мин, прибавляют раствор глицин изопропилового эфира гидрохлорида (5,84 г, 38 ммоль) в 15 мл ДМФА. Реакционную смесь перемешивают при комнатной температуре в течение 10 мин, охлаждают баней (смесь лед-соль) до температуры (-)15°С, последовательно прибавляют изобутилхлорформиат (6,25 г, 45,8 ммоль), затем, в течение 30 мин, по каплям, прибавляют N-метилморфолин (8,48 г, 83,9 ммоль). Реакционную смесь перемешивают при температуре (-)10°С в течение 1 ч, доводят температуру до комнатной. Осадок отфильтровывают. В маточном растворе определяют содержание креатинглицин изопропилового эфира тозилата, хлорид-ионов. Выход креатилглицин изопропилового эфира тозилата 41% мольн., суммарное количество хлорид-ионов 36,3 мМЭкв. Из раствора отгоняют растворитель при пониженном давлении и температуре 50°С до окончания погона. Остаток растворяют в 160 мл хлороформа, оставляют на 10 ч при температуре (-)10°С. Раствор отфильтровывают, экстрагируют водой 3 раза по 100 мл. Водные экстракты объединяют, 2 раза экстрагируют хлороформом, из объединенного водного экстракта отгоняют растворитель при пониженном давлении и температуре 40°С до объема 50 мл. Получают раствор креатилглицин изопропилового эфира тозилата.
Стадия Б. Получение креатилглицин изопропилового эфира ацетата.
Удаление п-ТСК и ее замену на фармацевтически приемлемую кислоту осуществляют методом ионообменной хроматографии (хроматографическая систему Buchi «Sepacore», колонка размером 30×250 мм, заполненная сорбентом Dowex 1x8 в ацетатной форме). Раствор креатилглицин изопропилового эфира тозилата наносят на колонку, элюируют водой со скоростью 0,3 см/мин, контролируя pH элюата. Фракции с pH=7 (pH воды 5) собирают, анализируют методом ВЭЖХ, объединяют, прибавляют уксусную кислоту, отгоняют растворитель при пониженном давлении и температуре 40°С до окончания погона. Остаток кристаллизуют из 35 мл ацетонитрила при температуре (-) 10°С в течение 20 ч. Осадок ацетата изопропилового эфира креатилглицина отфильтровывают, промывают холодным ацетонитрилом, диэтиловым эфиром и высушивают.
Выход креатилглицин изопропилового эфира ацетата C9H18N4O3*C2H4O2 составляет 2,33 г (21%). Содержание основного вещества - 97,4%, посторонние примеси: креатинин - 1,5%, креатин - 0,4%, максимальная единичная неидентифицированнаяй примесь - 0,5%, сумма неидентифицированных примесей - 0,7%; сульфатная зола - 0,03%, хлорид-ионы - 0,4 мМЭкв /г, п-ТСК - 150 ppm. Спектр ЯМР 1Н (D2O), δ, м.д. (J, Гц): 1,25 (6Н, д, 6,22 Гц, СН(СН3)2), 1,90 с (3Н, с, СН3СООН), 3,07 с (3Н, с, NCH3), 4,00 (2H, с, N(CH3)CH2CO), 4,23 (2Н, с, NHCH2CO), 5,05 (1Н, м, СН(СН3)2). Спектр ЯМР 13С (D2O), δ, м.д.: 23,49, 25,96, 39,72, 44,38, 55,29, 73,63, 160,55, 172,63, 173,69, 184,06.
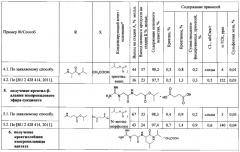
Пример 3. Получение креатилглицин бензилового эфира ацетата и креатилглицина гидрата
3.1 Получение креатилглицин бензилового эфира ацетата и креатилглицин гидрата по заявляемому способу.
Стадия А. Получение креатилглицин бензилового эфира тозилата.
В трехгорлую колбу на 100 мл, снабженную термометром, двумя капельными воронками, воздушным холодильником с хлоркальциевой трубкой, установленную на магнитной мешалке, помещают безводный креатин (5 г, 38 ммоль), п-ТСК (15,23 г, 80 ммоль) и ДМФА (30 мл), раствор глицин бензилового эфира тозилата (12,82 г, 38 ммоль) в 15 мл ДМФА. Смесь перемешивают в течение 5 мин, охлаждают баней (смесь лед-соль) до температуры (-)15°С, прибавляют одновременно, в течение 30 мин изобутилхлорформиат (6,25 г, 45,8 ммоль) и N-метилморфолин (8,48 г, 83,9 ммоль), перемешивают при температуре (-)10°С в течение 1,5 ч. Осадок отфильтровывают от охлажденной реакционной смеси, промывают на фильтре охлажденным до температуры 0°С ДМФА (2×5 мл). Промывные жидкости и маточный раствор объединяют. В объединенном растворе определяют содержание креатинглицин бензилового эфира тозилата. Выход креатилглицин бензилового эфира тозилата 60% мольн. К раствору прибавляют натрия ацетат тригидрат (2,10 г, 15,5 ммоль), перемешивают в течение 1 ч, отгоняют 50 мл (91%) ДМФА при пониженном давлении и температуре 45°С. К остатку прибавляют 40 мл тетрагидрофурана при комнатной температуре, перемешивают в течение 20 мин, прибавляют 4 г целита, перемешивают в течение 20 мин. На фильтр помещают 10 г целита, промывают 40 мл тетрагидрофурана, промывную жидкость утилизируют. Суспензию фильтруют через целит, осадок промывают 25 мл тетрагидрофурана. Промывные жидкости и маточный раствор объединяют. Количество хлорид-ионов в растворе 2,6 мМЭкв. Из объединенного раствора отгоняют растворитель при пониженном давлении и температуре 45°С до окончания погона. К остатку прибавляют 75 мл бидистиллированной воды, экстрагируют 3×100 мл хлористого метилена. Органические экстракты объединяют, отгоняют растворитель при пониженном давлении и температуре 40°С до окончания погона, растворяют остаток в 20 мл смеси 0,05 М уксусной кислота: изопропиловый спирт (50:50). Получают раствор креатинглицин бензилового эфира тозилата.
Стадия Б. Получение креатилглицина бензилового эфира ацетата.
Удаление п-ТСК и ее замену на фармацевтически приемлемую кислоту осуществляют методом ионообменной хроматографии (хроматографическая система Buchi «Sepacore», колонка размером 49×230 мм, заполненная сорбентом Dowex 1x8 в ацетатной форме). Раствор креатинглицин бензилового эфира тозилата наносят на колонку, элюируют смесью 0,05 М уксусная кислота : изопропиловый спирт (75:25) со скоростью 0,3 см/мин. Детектирование осуществляют при длине волны 220 нм. Отбирают фракции, анализируют методом ВЭЖХ, объединяют на основании результатов анализа для получения креатинглицин бензилового эфира ацетата с суммарным содержанием неидентифицированных примесей не более 1%, креатинина - не более 1%, креатина - не более 1%, прибавляют уксусную кислоту до pH 4,4. Из объединенных фракций отгоняют растворитель при пониженном давлении и температуре 40°С до окончания погона.
К остатку прибавляют 100 мл изопропилового спирта, отгоняют растворитель при пониженном давлении и температуре 40°С до окончания погона, прибавляют 50 мл ацетона, перемешивают 3 ч, осадок отделяют фильтрацией, промывают ацетоном (3×25 мл), высушивают в вакууме при температуре 40°С, растворяют в 125 мл абсолютного этанола при перемешивании в течение 20 мин, нерастворившийся остаток отделяют фильтрованием, промывают на фильтре абсолютным этанолом (2×20 мл), промывные жидкости объединяют с маточным раствором. Из раствора отгоняют 125 мл (75%) этанола при пониженном давлении и температуре 40°С, прибавляют 50 мл этилацетата, смесь выдерживают 2 ч при комнатной температуре. Осадок отделяют фильтрованием, промывают этилацетатом (2×50 мл), высушивают в вакууме при температуре 40°С.
Выход креатилглицина бензилового эфира ацетата C13H18N4O3*C2H4O2 5,40 г (42%). Содержание основного вещества 97,9%, сульфатная зола - 0,01%, хлорид-ионы - следы, п-ТСК - 3 ppm, посторонние примеси: креатинин - 1,0%, креатин - 0,3%, максимальная единичная неидентифицированная примесь - 0,1%, сумма неидентифицированных примесей - 0,3%. Спектр ЯМР 1Н (D2O), δ, м.д. (J, Гц): 1,92 (3Н, с, СН3СООН), 2,99 (3Н, с, NCH3), 4,10 (2Н, с, N(CH3)CH2CO), 4,19 (2Н, с, NHCH2CO), 5,22 (2Н, с, CH2Ph), 7,45 (5Н, м, CH2Ph). Спектр ЯМР 13С (D2O), δ, м.д.: 25,97, 39,62, 44,11, 55,26, 70,44, 131,08, 131,53, 137,80, 160,48, 172,63, 173,86, 184,09.
Стадия С. Получение креатилглицин гидрата.
5,40 г креатилглицин бензилового эфира ацетата, полученного на стадии Б, растворяют в 100 мл метанола и гидрируют над палладием на углероде - Pd/C в течение 3 ч. Полноту удаления бензильной группы контролируют с помощью ТСХ в системе ацетонитрил : вода : уксусная кислота 6:1:1. Катализатор отфильтровывают и промывают 10 мл смеси вода : метанол 10:90. Маточный раствор и промывные жидкости объединяют, из объединенного раствора отгоняют растворитель при пониженном давлении и температуре 40°С. Получают продукт в виде белого порошка. Выход креатилглицин гидрата C6H12N4O3*H2O 2,67 г (37%). Содержание основного вещества 98,2%, посторонние примеси: креатинин - 0,8%, креатин - 0,3%, максимальная единичная неидентифицированная примесь - 0,1%, сумма неидентифицированных примесей - 0,2%; сульфатная зола - 0,01%, хлорид-ионы - следы, п-ТСК - 2 ppm. Спектр ЯМР 1Н (D2O), δ, м.д. (J, Гц): 3,06 (3Н, с, NCH3), 3,81 (2Н, с, N(CH3)CH2CO), 4,20 (2Н, с, NHCH2CO). Спектр ЯМР 13С (D2O), δ, м.д.: 39,75, 45,94, 55,47, 160,60, 171,94, 179,22.
3.2 Получение креатинглицин бензилового эфира ацетата и креатилглицин гидрата по способу, приведенному в прототипе [RU 2428414, 2011].
Стадия А. Получение креатилглицин бензилового эфира тозилата.
В трехгорлую колбу на 100 мл, снабженную термометром, двумя капельными воронками, воздушным холодильником с хлоркальциевой трубкой, установленную на магнитной мешалке, помещают безводный креатин (5 г, 38 ммоль), п-ТСК (15,23 г, 80 ммоль) и ДМФА (30 мл), перемешивают в течение 10 мин, прибавляют раствор глицин бензилового эфира тозилата (12,82 г, 38 ммоль) в 15 мл ДМФА. Смесь перемешивают при комнатной температуре в течение 5 мин, охлаждают баней (смесь лед-соль) до температуры (-)15°С, последовательно прибавляют изобутилхлорформиат (6,25 г, 45,8 ммоль), затем, в течение 30 мин, по каплям, прибавляют N-метилморфолин (8,48 г, 83,9 ммоль), перемешивают при температуре (-)10°С в течение 1 ч, доводят температуру до комнатной. Осадок отфильтровывают. В маточном растворе определяют содержание креатинглицин бензилового эфира тозилата и хлорид-ионов. Выход креатинглицин бензилового эфира тозилата 42% мольн., суммарное количество хлорид-ионов 18,0 мМЭкв. Из раствора отгоняют растворитель при пониженном давлении и температуре 50°С до окончания погона. Остаток растворяют в 300 мл н-бутилового спирта, 4 раза промывают 5% раствором NaHCO3, 2 раза - водой. Из органической фазы отгоняют растворитель при пониженном давлении и температуре 40°С, к остатку прибавляют 60 мл смеси вода : изопропиловый спирт (50:50), перемешивают, получают раствор креатинглицин бензилового эфира тозилата.
Стадия Б. Получение креатилглицина бензилового эфира ацетата.
Удаление п-ТСК и ее замену на фармацевтически приемлемую кислоту осуществляют методом ОФ хроматографии (хроматографическая система Buchi «Sepacore», колонка размером 22,5×150 мм, заполненная сорбентом YMC*Gel ODS). Раствор креатинглицин бензилового эфира тозилата наносят на колонку, элюируют в режиме линейного градиента от 0,05 М уксусной кислоты до 20% изопропилового спирта в 0,05 М уксусной кислоте со скоростью 0,3 см/мин. Фракции собирают, анализируют методом ВЭЖХ, объединяют на основании результатов анализа, отгоняют растворитель при пониженном давлении и температуре 40°С до окончания погона. Остаток кристаллизуют из 35 мл ацетонитрила, отделяют фильтрованием и высушивают.
Выход креатилглицин бензилового эфира ацетата C13H18N4O3*C2H4O2 2,83 г (22%). Содержание основного вещества 97,5%, посторонние примеси: креатинин - 1,3%, креатин - 0,5%, максимальная единичная неидентифицированная примесь - 0,2%, сумма неидентифицированных примесей - 0,5%; сульфатная зола - 0,01%, хлорид-ионы - 0,1 мМЭкв/г, п-ТСК - 5 ppm. Спектр ЯМР 1Н (D2O), δ, м.д. (J, Гц): 1,92 (3Н, с, СН3СООН), 2,99 (3Н, с, NCH3), 4,11 (2Н, с, N(CH3)CH2CO), 4,19 (2Н, с, NHCH2CO), 5,22 (2Н, с, CH2Ph), 7,43 (5Н, м, CH2Ph). Спектр ЯМР 13С (D2O), δ, м.д.: 25,95, 39,62, 44,11, 55,26, 70,44, 131,10, 131,53, 137,80, 160,48, 172,62, 173,86, 184,09.
Стадия С. Получение креатилглицин гидрата.
2,83 г креатилглицин бензилового эфира ацетата, полученного на стадии Б, растворяют в 70 мл метанола и гидрируют над Pd/C в течение 3 ч. Полноту удаления бензильной группы контролируют с помощью ТСХ в системе ацетонитрил : вода : уксусная кислота 6:1:1. Катализатор отфильтровывают и промывают 10 мл смеси вода : метанола 10:90. Маточный раствор и промывные жидкости объединяют, из раствора отгоняют растворитель при пониженном давлении и температуре 40°С до окончания погона. Получают продукт в виде белого порошка.
Выход креатилглицин гидрата C6H12N4O3*H2O 1,61 г (22%). Содержание основного вещества 97,5%, посторонние примеси: креатинин - 1,3%, креатин - 0,5%, максимальная единичная неидентифицированная примесь - 0,2%, сумма неидентифицированных примесей - 0,5%; сульфатная зола - 0,01%, хлорид-ионы - 0,1 мМЭкв /г, п-ТСК - 5 ppm. Спектр ЯМР 1H (D2O), δ, м.д. (J, Гц): 3,07 (3Н, с, NCH3), 3,81 (2Н, с, N(CH3)CH2CO), 4,21 (2Н, с, NHCH2CO). Спектр ЯМР 13С (D2O), δ, м.д.: 39,75, 45,94, 55,49, 160,60, 171,93, 179,22.
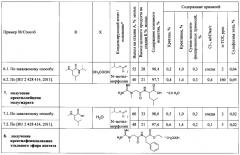
Пример 4. Получение креатил-α-аланин изопропилового эфира ацетата
4.1 Получение креатил-α-аланин изопропилового эфира ацетата по заявляемому способу.
Стадия А. Получение креатил-α-аланин изопропилового эфира тозилата.
В трехгорлую колбу на 100 мл, снабженную термометром, двумя капельными воронками, воздушным холодильником с хлоркальциевой трубкой, установленную на магнитной