Моногидрат производного азаадамантана
Иллюстрации
Показать всеИзобретение относится к фармацевтической композиции, модулирующей активность α7 и/или α4β2 никотиновых ацетилхолиновых рецепторов, содержащей в качестве активного ингредиента кристаллический моногидрат (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата. Технический результат - использование фармацевтической композиции, содержащей кристаллический моногидрат (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата, обладающего повышенной стабильностью и негигроскопичностью. 2 з.п. ф-лы, 9 ил., 6 пр.
Реферат
Перекрестная ссылка на родственные заявки
Эта заявка испрашивает приоритет предварительной заявки на патент США № 61/385674, поданной 23 сентября 2010 года, содержание которой приводится в описании настоящего изобретения путем ссылки на нее.
Заявление о финансируемых из государственного бюджета исследованиях и разработках
Не финансировались.
УРОВЕНЬ ТЕХНИКИ
Область техники, к которой относится изобретение
Изобретение относится к производным азаадамантана и, более конкретно, к кристаллическим моногидратным формам производных азаадамантана, композициям, включающим эти соединения, способам предупреждения или лечения состояний и расстройств с использованием таких соединений и композиций, и к способам получения этих соединений.
Описание родственной технологии
Никотиновые ацетилхолиновые рецепторы (nAChRs) широко распространены в центральной (ЦНС) и периферической (ПНС) нервной системе. Такие рецепторы играют важную роль в регулировании функции ЦНС, в частности, путем модуляции высвобождения широкого ряда нейротрансмиттеров, включая, но этим не ограничиваясь, ацетилхолин, норэпинефрин, допамин, серотонин и гамма-аминомасляную кислоту (GABA). Следовательно, никотиновые рецепторы опосредуют весьма широкий ряд физиологических эффектов, и их целенаправленно применяют для терапевтического лечения наряду с прочими состояниями, расстройств, связанных с когнитивной функцией, запоминанием и памятью, нейродегенеративных расстройств, боли, воспаления, психоза, сенсорных расстройств, расстройств настроения и эмоциональных расстройств.
В ЦНС и на периферии существует большое количество подтипов nAChR. Каждый подтип по-разному воздействует на регулирование общей физиологической функции. Обычно nAChRs представляют собой ионные каналы, которые образованы из пентамерного ансамбля белковых субъединиц. По меньшей мере, в нервной ткани были идентифицированы 12 белковых субъединиц - α2-α10 и β2-β42. Эти субъединицы обеспечивают большое разнообразие гомомерных и гетеромерных комбинаций, которые дают разные подтипы рецепторов. Например, доминирующий рецептор, который является ответственным за высокоаффинное связывание никотина в ткани головного мозга, имеет композицию (α4)2(β2)3 (подтип α4β2), в то время как другая основная популяция рецепторов состоит из гомомерных (α7)5 (подтип α7) рецепторов.
Некоторые соединения, такие как никотин растительных алкалоидов, взаимодействуют со всеми подтипами nAChR, что объясняет сильные физиологические эффекты этого соединения. Несмотря на то, что было показано, что никотин обладает многими положительными свойствами, тем не менее не все эффекты, опосредуемые никотином, являются желательными. Например, никотин оказывает побочное действие на желудочно-кишечный тракт и сердечнососудистую систему, которое проявляется при терапевтических дозах, и хорошо известна его способность вызывать привыкание к нему и его высокая токсичность. Лиганды, которые селективно взаимодействуют только с конкретными подтипами nAChR, дают возможность достигать положительных терапевтических эффектов при обеспечении большей степени безопасности.
Было показано, что α7 и α4β2 nAChRs играют важную роль в улучшении познавательной функции, включая аспекты запоминания, памяти и внимания (Levin, E.D., J. Neurobiol. 53: 633-640, 2002). Например, α7 nAChRs связывают с такими состояниями и расстройствами, как синдром нарушения внимания, синдром дефицита внимания с гиперактивностью (ADHD), шизофрения, болезнь Альцгеймера (AD), умеренные когнитивные нарушения, сенильная деменция, деменция, связанная с тельцами Леви, деменция, связанная с синдромом Дауна, деменция, связанная со СПИДом, и болезнь Пика, а также воспаление. Подтип α4β2 рецептора вовлечен в процессы, связанные с вниманием, познавательной способностью, эпилепсией и контролем боли (Paterson and Norberg, Progress in Neurobiology 61 75-111, 2000), а также с прекращением курения или абстинентным синдромом отмены приема никотина.
Активность обоих подтипов α7 и α4β2 nAChRs может быть модифицирована или контролируема путем введения лигандов, селективных в отношении данного подтипа nAChR. Лиганды могут проявлять свойства антагониста, агониста или частичного агониста. Известны также соединения, которые действуют как аллостерические модуляторы.
Несмотря на то, что известны соединения, которые проявляют неселективную активность в отношении ряда подтипов никотинового рецептора, включая α4β2 и α7 nAChRs, тем не менее желательно создать соединения, которые бы селективно взаимодействовали с α7-содержащими нейронными nAChRs, α4β2 nAChRs или с обоими, и с α7, и с α4β2 nAChRs, по сравнению с другими подтипами.
В связи с этой возникшей в рамках известного уровня техники необходимостью авторы изобретения проводили поиск других соединений и разработали новые производные азаадамантана, раскрытые в одновременно заявленных патентных документах. А именно, заявка на патент США № 2008/0167336 (далее в описании изобретения называемая "публикацией '336") относилась к производным азаадамантана и солевым формам соединения. В публикации '336 указано, что раскрытые в ней конкретные соединения могут существовать в виде солей соединения изобретения. Соли такого соединения включают, но этим не ограничиваясь, негидратированный L-битартрат, гидратированный L-битартрат, негидратированный дигидрофосфат, гидратированный дигидрофосфат, негидратированный бисукцинат, гидратированный бисукцинат, четверной гидрат гидрохлорида, полуторагидрат гидрохлорида, дигидроцитрат и моногидроцитрат. Эти соединения считают важными вследствие их селективного взаимодействия с α7-содержащими нейрональными nAChRs, α4β2 nAChRs, или с обоими, и с α7, и с α4β2 nAChRs, по сравнению с другими соединениями известного уровня техники.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
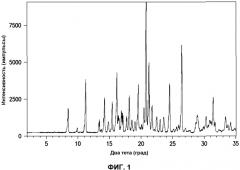
На фиг.1 приведена порошковая рентгенограмма кристаллического моногидрата соли (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата.
На фиг.2 приведена термограмма кристаллического моногидрата соли (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата.
На фиг.3 приведена изотерма сорбции влаги для кристаллического моногидрата соли (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата, полученная с помощью весов для исследования динамической сорбции влаги, используемых для определения гигроскопичности соединения.
На фиг.4(a) приведена порошковая рентгенограмма для состава, содержащего практически чистый кристаллический моногидрат (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата (Соединение A).
На фиг.4(b) приведена порошковая рентгенограмма для твердого (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата (Соединения A), выделенного из суспензии, имеющей активность воды 0,20.
На фиг.4(c) приведена порошковая рентгенограмма для твердого (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата (Соединения A), выделенного из суспензии, имеющей активность воды 0,15.
На фиг.4(d) приведена порошковая рентгенограмма для твердого (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата (Соединения A), выделенного из суспензии, имеющей активность воды 0,10.
На фиг.4(e) приведена порошковая рентгенограмма для твердого (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата (Соединения A), выделенного из суспензии, имеющей активность воды 0,05.
На фиг.4(f) приведена порошковая рентгенограмма для состава, содержащего практически чистый кристаллический безводный (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрат (Соединение A).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Для выявления представляющих интерес исходных соединений был проведен тщательный скрининг солей соединений публикации '336. В процессе испытания композиций солей негидратированная дигидроцитратная соль (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана была выявлена в качестве соединения, представляющего особый интерес, вследствие благоприятных свойств в твердом состоянии, фармацевтических свойств и свойств, позволяющих осуществить его промышленное производство. В связи с этими благоприятными характеристиками дигидроцитрат (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана был выбран для дополнительного анализа, включающего скрининг полиморфов и анализ полиморфов. Соответственно, настоящее изобретение относится к кристаллической моногидратной соли (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата и относящимся к ней способам и процессам.
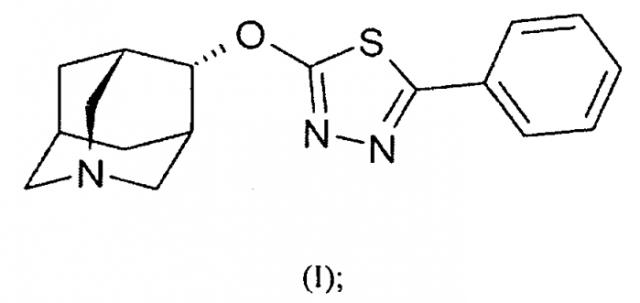
Один вариант осуществления изобретения относится к кристаллической соли (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана, имеющей формулу (I)
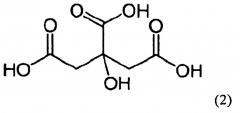
где соль включает дигидроцитрат, имеющий формулу (II)
В дополнительном варианте осуществления кристаллическая моногидратная соль (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата имеет чистоту, которая характеризуется содержанием, по меньшей мере, 90% моногидратной формы и не более чем 10% немоногидратной формы. В еще одном дополнительном варианте осуществления кристаллическая моногидратная соль (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата имеет чистоту, которая характеризуется содержанием, по меньшей мере, 95% моногидратной формы и не более чем 5% немоногидратной формы. В еще одном дополнительном варианте осуществления кристаллическая моногидратная соль (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло-[3.3.1.13,7]декана дигидроцитрата имеет чистоту, которая характеризуется содержанием, по меньшей мере, 97% моногидратной формы и не более чем 3% немоногидратной формы.
В дополнительном варианте осуществления кристаллический моногидрат (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата характеризуется, по меньшей мере, одним характеристическим пиком на порошковой рентгенограмме при значениях в градусах два тета 8,4±0,20, 11,3±0,20, 14,2±0,20, 15,5±0,20, 16,4±0,20, 16,6±0,20, 17,2±0,20, 19,7±0,20, 20,7±0,20, 21,0±0,20, 21,2±0,20, 21,6±0,20, 24,8±0,20 и 26,9±0,20.
В еще одном варианте осуществления кристаллический моногидрат (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата по пункту 1 имеет параметры элементарной ячейки, где a составляет приблизительно 6,52 Å, b составляет приблизительно 20,99 Å, c составляет приблизительно 16,83 Å, α составляет приблизительно 90,0°, β составляет приблизительно 93,75°, γ составляет приблизительно 90,0°, объем составляет приблизительно 2297,52 Å3, и Z составляет приблизительно 4.
В другом варианте осуществления кристаллический моногидрат (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло-[3.3.1.13,7]декана дигидроцитрата характеризуется негигроскопическими свойствами, определяемыми с помощью метода гравиметрии сорбции влаги в динамическом режиме, при этом потери массы составляют меньше, чем приблизительно 0,2% при относительной влажности от 0% до 90%.
Другой вариант осуществления изобретения относится к фармацевтическим композициям, включающим соединения изобретения. Такие композиции могут быть введены в соответствии со способами изобретения обычно в качестве части терапевтической схемы для лечения или предотвращения состояний и расстройств, связанных с nAChR активностью, и, более конкретно, с α7 nAChR активностью, α4β2 nAChR активностью, или и с α7 nAChR активностью, и с α4β2 nAChR активностью.
Еще один вариант осуществления изобретения относится к способу модулирования как α7, так и α4β2 nAChR активности. Способ применяют для лечения, предотвращения, или и для лечения, и для предотвращения состояний и расстройств, связанных как с α7, так и с α4β2 nAChR активностью, в частности, у млекопитающих.
Другой вариант осуществления относится к способу селективного модулирования nAChR активности, например, α7 nAChR активности. Способ применяют для лечения, предотвращения или как для лечения, так и для предотвращения состояний и расстройств, связанных с α7 nAChR активностью у млекопитающих. Способ также предусматривает и селективное модулирование α4β2 nAChR активности.
Такие способы, наряду с другими системными и нейроиммуномодулирующими методами, применяют при состояниях и расстройствах, относящихся к синдрому нарушения внимания, синдрому дефицита внимания с гиперактивностью (ADHD), болезни Альцгеймера (AD), шизофрении, умеренному когнитивному нарушению, возрастному нарушению памяти (AAMI), сенильной деменции, деменции при СПИДе, болезни Пика, деменции, связанной с тельцами Леви, деменции, связанной с синдромом Дауна, шизофрении, прекращению курения, абстинентному синдрому отмены приема никотина, боковому амиотрофическому склерозу, болезни Хантингтона, дефицитарной функции ЦНС, связанной с травматическим повреждением мозга, острой боли, послеоперационной боли, хронической боли, воспалительной боли, невропатической боли, бесплодию, недостаточности кровообращения, необходимости в росте новых кровеносных сосудов, связанной с заживлением раны, более конкретно, кровообращении вокруг окклюзии сосуда, необходимости в росте новых кровеносных сосудов, связанной с васкулиризацией кожных трансплантатов, ишемии, воспалению, сепсису, заживлению раны, и другим осложнениям, связанным с диабетом.
Дополнительный вариант осуществления изобретения относится к способу получения кристаллической моногидратной соли настоящего изобретения, используя негидратированную дигидроцитратную соль в качестве исходного материала. А именно, способ получения кристаллической моногидратной соли (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата, где способ включает стадии: (a) растворения (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана, по меньшей мере, в одном растворителе при температуре в интервале от приблизительно 65°C до приблизительно 85°C; (b) доведения температуры раствора до температуры в интервале от приблизительно 55°C до приблизительно 75°C в течение периода времени, по меньшей мере, тридцати минут; (c) добавления, по меньшей мере, одного дополнительного растворителя к раствору и перемешивания в течение периода времени, по меньшей мере, тридцати минут; (d) доведения температуры растворов до температуры в интервале от приблизительно 30°C до приблизительно 50°C в течение периода времени больше, чем два часа; (e) добавления, по меньшей мере, одного дополнительного растворителя к раствору в течение периода времени не меньше, чем три часа; (f) выдерживания суспензии при температуре в интервале от приблизительно 30°C до приблизительно 50°C в течение периода времени, по меньшей мере, одного часа; (g) доведения температуры суспензии до температуры в интервале от приблизительно -5°C до приблизительно 15°C; (h) перемешивания суспензии, по меньшей мере, в течение одного часа; и (i) выделения кристаллической моногидратной соли (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата.
Растворитель стадии (a) может включать органический растворитель, воду и их комбинации. В дополнительном варианте осуществления растворитель стадии (a) выбирают из группы, состоящей из метанола, этанола, 2-пропанола, бутанола, ацетонитрила, ацетона, формамида, диметилформамида, толуола, бензола, анизола, этилацетата, изопропилацетата, тетрагидрофурана, 1,4-диоксана, метилтретбутилового эфира, дихлорметана, хлороформа, гексанов, н-гептана, 2-бутанона, диметилсульфоксида, нитрометана, 1-метил-2-пирролидона, триэтиламина, трибутиламина, трифтортолуола, воды и их смесей. В предпочтительном варианте осуществления растворитель стадии (a) включает смесь 2-пропанола и воды. Смесь 2-пропанола и воды может включать отношение 2-пропанола к воде в интервале от приблизительно 1:10 до приблизительно 10:1. В более предпочтительном варианте осуществления смесь 2-пропанола и воды может включать отношение 2-пропанола к вода в интервале от приблизительно 3:1 до приблизительно 5:1. Кроме того, температура стадии (a) может находиться в интервале от приблизительно 70°C до приблизительно 80°C и, в более предпочтительном варианте осуществления температура стадии (a) может находиться в интервале от приблизительно 74°C до приблизительно 76°C.
Стадия (b) может включать доведение температуры раствора до температуры от приблизительно 60°C до приблизительно 70°C в течение периода времени, по меньшей мере, тридцати минут. При предпочтительной итерации стадия (b) может включать доведение температуры раствора до температуры от приблизительно 64°C до приблизительно 66°C в течение периода времени, по меньшей мере, тридцати минут.
Растворитель стадии (c) может включать органический растворитель, воду и их комбинации. В предпочтительном варианте осуществления растворитель стадии (c) может быть выбран из группы, состоящей из метанола, этанола, 2-пропанола, бутанола, ацетонитрила, ацетона, формамида, диметилформамида, толуола, бензола, анизола, этилацетата, изопропилацетата, тетрагидрофурана, 1,4-диоксана, метилтретбутилового эфира, дихлорметана, хлороформа, гексанов, н-гептана, 2-бутанона, диметилсульфоксида, нитрометана, 1-метил-2-пирролидона, триэтиламина, трибутиламина, трифтортолуола, воды и их смесей. В более предпочтительном варианте осуществления растворитель стадии (c) может включать 2-пропанол. Кроме того, количество 2-пропанола, используемого на стадии (c), может включать от приблизительно 2 объемов до приблизительно 10 объемов относительно количества растворителя, вводимого на стадии (a). В предпочтительном варианте осуществления количество 2-пропанола, используемого на стадии (c), может включать от приблизительно 5 объемов до приблизительно 7 объемов по сравнению с количеством растворителя, используемого на стадии (a).
Стадия (d) может включать доведение температуры в интервале от приблизительно 35°C до приблизительно 45°C в течение периода времени больше, чем два часа. При предпочтительной итерации способа стадия (d) может включать доведение температуры в интервале от приблизительно 39°C до приблизительно 41°C в течение периода времени в интервале от приблизительно 30 минут до приблизительно восьми часов. Однако для специалиста в этой области является очевидным, что время может быть увеличено без отклонения от объема изобретения.
Растворитель стадии (e) может включать органический растворитель, воду и их комбинации. В предпочтительном варианте осуществления растворитель стадии (e) может быть выбран из группы, состоящей из метанола, этанола, 2-пропанола, бутанола, ацетонитрила, ацетона, формамида, диметилформамида, толуола, бензола, анизола, этилацетата, изопропилацетата, тетрагидрофурана, 1,4-диоксана, метилтретбутилового эфира, дихлорметана, хлороформа, гексанов, н-гептана, 2-бутанона, диметилсульфоксида, нитрометана, 1-метил-2-пирролидона, триэтиламина, трибутиламина, трифтортолуола, воды и их смесей. В более предпочтительном варианте осуществления растворитель стадии (e) может включать 2-пропанол. Кроме того, количество 2-пропанола, используемого на стадии (e), может включать от приблизительно 1 объема до приблизительно 10 объемов относительно количества растворителя, вводимого на стадии (a). В предпочтительном варианте осуществления количество 2-пропанола, используемого на стадии (e), может включать от приблизительно 4 объемов до приблизительно 6 объемов по сравнению с количеством растворителя, используемого на стадии (a).
Стадия (f) может включать доведение температуры реакции в интервале от приблизительно 35°C до приблизительно 45°C в течение периода времени, по меньшей мере, одного часа. В предпочтительном варианте осуществления стадия (f) может включать доведение температуры в интервале от приблизительно 39°C до приблизительно 41°C в течение периода времени, по меньшей мере, одного часа.
Стадия (g) может включать доведение температуры суспензии до температуры в интервале от приблизительно 0°C до приблизительно 10°C. В более предпочтительном варианте осуществления стадия (g) может включать доведение температуры суспензии до температуры в интервале от приблизительно 4°C до приблизительно 6°C.
Кроме того, стадия (i) может включать выделение кристаллической моногидратной соли (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата с помощью фильтрации.
В другом варианте осуществления настоящее изобретение включает способ получения кристаллической моногидратной соли (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло-[3.3.1.13,7]декана дигидроцитрата, где способ включает стадии: (a) растворения (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана в приблизительно 4 объемах 2-пропанола и в приблизительно 1 объеме воды при температуре приблизительно 75°C; (b) доведения температуры раствора до температуры в интервале от приблизительно 65°C в течение периода времени, по меньшей мере, тридцати минут; (c) добавления приблизительно 6 объемов 2-пропанола к раствору и перемешивания в течение периода времени, по меньшей мере, тридцати минут; (d) доведения температуры до приблизительно 40°C в течение периода времени больше, чем два часа; (e) добавления к раствору приблизительно 5 объемов 2-пропанола в течение периода времени не меньше, чем три часа; (f) выдерживания суспензии при температуре приблизительно 40°C в течение периода времени, по меньшей мере, одного часа; (g) доведения температуры суспензии до температуры приблизительно 5°C; (h) перемешивания суспензии в течение, по меньшей мере, одного часа; и (i) выделения кристаллической моногидратной соли (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана.
В альтернативном варианте осуществления настоящее изобретение также включает способ получения кристаллической моногидратной соли (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата, где способ включает стадии: (a) контактирования безводного (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата с растворителем в реакционном сосуде; (b) герметизации реакционного сосуда и защиты суспензии от воздействия света при условиях окружающей среды; и (c) выделения кристаллической моногидратной соли (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана.
Согласно этому способу, растворитель стадии (a) может включать воду. Кроме того, количество безводного (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата может составлять приблизительно от 100 мг до приблизительно 300 мг, а количество воды может составлять приблизительно от 0,1 мл до приблизительно 2,0 мл. В дополнительном предпочтительном варианте осуществления количество безводного (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата составляет приблизительно от 150 мг до приблизительно 250 мг, и при этом количество воды составляет от приблизительно 0,8 мл до приблизительно 1,2 мл. Для специалиста в этой области является также очевидным, что растворитель стадии (a) может включать смесь органического растворителя и воды. Кроме того, органический растворитель может включать метанол, этанол, 2-пропанол, бутанол, бутанол ацетонитрил, ацетон, формамид, диметилформамид, толуол, бензол, анизол, этилацетат, изопропилацетат, тетрагидрофуран, 1,4-диоксан, метилтретбутиловый эфир, дихлорметан, хлороформ, гексаны, н-гептан, 2-бутанон, диметилсульфоксид, нитрометан, 1-метил-2-пирролидон, триэтиламин, трибутиламин, трифтортолуол и их смеси.
В еще одном альтернативном варианте осуществления настоящее изобретение включает фармацевтическую композицию, содержащую кристаллическую моногидратную соль (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата в качестве активного ингредиента и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. В предпочтительном варианте осуществления фармацевтической композиции кристаллический моногидрат (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата присутствует в количестве в интервале от приблизительно 0,1% до приблизительно 99,9% по массе от суммарной массы композиции. В этом варианте осуществления фармацевтическая композиция, включающая кристаллический моногидрат (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрат, характеризуется, по меньшей мере, одним характеристическим пиком на порошковой рентгенограмме при значениях в градусах два тета 8,4±0,20, 11,3±0,20, 14,2±0,20, 15,5±0,20, 16,4±0,20, 16,6±0,20, 17,2±0,20, 19,7±0,20, 20,7±0,20, 21,0±0,20, 21,2±0,20, 21,6±0,20, 24,8±0,20 и 26,9±0,20.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Известно, что (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декан существует в разнообразных солевых формах, о которых сообщается в находящемся в процессе одновременного рассмотрения документе "публикация '336". Одна из солевых форм - дигидроцитратная соль, была выявлена в качестве самого перспективного соединения, вследствие нескольких обнаруженных преимуществ, относящихся к этому соединению. А именно, негидратированный дигидроцитрат обладает предпочтительными свойствами в твердом состоянии, включающими высокую кристалличность, приемлемую температуру плавления, негигроскопичность и отсутствие склонности к проявлению комплексных полиморфизмов. Кроме того, дигидроцитратная негидратированная соль проявляла предпочтительные фармацевтические свойства, включающие стабильность в твердом состоянии при 40°C и 75% относительной влажности в течение 12 недель, стабильность при воздействии источника излучения УФ/видимого света, определяемая в соответствии со стандартом ICH Type I, и стабильность при воздействии паров пероксида при 40°C в течение 8 дней. Негидратированный дигидроцитрат также характеризуется растворимостью 28 мг/мл в воде. Кроме того, негидратированный дигидроцитрат также имеет предпочтительные свойства, позволяющие осуществить его промышленное производство, в результате которых может быть получено соединение с приемлемой чистотой и выходом, а размер частиц может контролироваться путем размола.
Вследствие этих предпочтительных характеристик, (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрат был выбран для дополнительного анализа, включающего скрининг полиморфов и анализ полиморфов. Было отмечено, что (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрат, когда его получают в соответствии со способами публикации '336, выделяется в негидратированной форме. В связи с этим авторы настоящего изобретения провели для негидратированного дигидроцитрата скрининг полиморфов и термодинамический анализ с целью выявления возможности получения других форм соединения. А именно, дигидроцитрат суспендировали в различных растворителях с целью выявления возможности получения других кристаллических форм.
Новый моногидрат настоящего изобретения обладает более предпочтительными свойствами по сравнению с соединениями, раскрытыми в публикации '336. А именно, моногидрат настоящего изобретения представляет собой термодинамически стабильную форму соли при условиях более высокой активности воды, более высокой относительной влажности или более высокой активности воды и более высокой относительной влажности, в силу чего моногидрат обладает более высокой химической и физической стабильностью при воздействии окружающей среды с более высокой влажностью и более высокой активностью воды по сравнению с негидратированной формой. Такие типы условий могут часто иметь место в определенных типах фармацевтических композиций, таких как растворы, суспензии или любые парентеральные лекарственные формы. Форма моногидрата дигидроцитрата настоящего изобретения также обладает преимуществами с точки зрения технологии получения лекарственных препаратов. Для получения фармацевтически активных ингредиентов широко применяется метод влажной грануляции. В процессе влажной грануляции использование моногидратной формы позволяет предотвращать любое превращение безводной формы в моногидрат, что в результате приводит к повышению стабильности. Соответственно, моногидрат дигидроцитрата обеспечивает свойства физической и химической стабильности, которые раньше были недостижимы.
Моногидратные дигидроцитратные соединения настоящего изобретения обычно включают одну молекулу (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана, имеющего химическую формулу (I), и одну молекулу соли лимонной кислоты (то есть дигидроцитрата), имеющей химическую формулу (II). Несмотря на то, что настоящее изобретение направлено главным образом на (4s)-диастереомер соединения азаадамантана, тем не менее соединения по настоящему изобретению могут существовать и в формах, представленных формулой (Ia) и (Ib):
Азаадамантановая часть изомера (Ia) и изомера (Ib) не является хиральной, однако C-4 углерод, к которому присоединен L1, считается псевдоасимметричным. Соединения, представленные формулой (Ia) и (Ib), являются диастереомерами. Конфигурацию структур формулы (Ia) относят к конфигурации 4r в соответствии с публикацией Synthesis, 1992, 1080, Becker, D.P.; Flynn, D.L. и определениями в монографии Stereochemistry of Organic Compounds, E.L. Eliel, S.H Wilen; John Wiley and Sons, Inc. 1994. Кроме того, применяя аналогичные подходы, конфигурацию структур формулы (Ib) относят к конфигурации 4s.
Изомеры (Ia) и (Ib) могут быть синтезированы раздельно, используя индивидуальные стереоизомеры, в соответствии с описанными в изобретении схемами и примерами. В качестве варианта изомеры (Ia) и (Ib) могут быть синтезированы вместе, когда в синтезе используют смеси стереизомеров, после чего из смеси обоих изомеров могут быть выделены индивидуальные изомеры с помощью хроматографических методов. Смеси изомеров могут быть также разделены с помощью фракционной кристаллизации солей аминов, содержащихся в соединениях формулы (I), которые получают путем взаимодействия с энантиомерно чистыми карбоновыми кислотами.
Настоящее изобретение относится к кристаллическому твердому моногидрату (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло-[3.3.1.13,7]декана дигидроцитрата, который может быть идентифицирован характеристическими пиками на его порошковой рентгенограмме, показанной на фиг.1. Любой специалист в области аналитической химии может легко идентифицировать твердый моногидрат (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата, как минимум, по одному характеристическому пику на его порошковой рентгенограмме. Положения угла два тета характеристических пиков на порошковой рентгенограмме (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата составляют 8,4±0,20, 11,3±0,20, 14,2±0,20, 15,5±0,20, 16,4±0,20, 16,6±0,20, 17,2±0,20, 19,7±0,20, 20,7±0,20, 21,0±0,20, 21,2±0,20, 21,6±0,20, 24,8±0,20, и 26,9±0,20. Таким образом, кристаллический моногидрат (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата настоящего изобретения характеризуется, по меньшей мере, одним характеристическим пиком на порошковой рентгенограмме при значениях в градусах два тета 8,4±0,20, 11,3±0,20, 14,2±0,20, 15,5±0,20, 16,4±0,20, 16,6±0,20, 17,2±0,20, 19,7±0,20, 20,7±0,20, 21,0±0,20, 21,2±0,20, 21,6±0,20, 24,8±0,20 и 26,9±0,20. Кроме того, настоящее изобретение дополнительно предполагает, что кристаллический моногидрат (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло-[3.3.1.13,7]декана дигидроцитрата характеризуется, по меньшей мере, двумя, по меньшей мере, тремя, по меньшей мере, четырьмя, по меньшей мере, пятью, по меньшей мере, шестью, по меньшей мере, семью, по меньшей мере, восемью, по меньшей мере, девятью, по меньшей мере, десятью, по меньшей мере, одиннадцатью, по меньшей мере, двенадцатью или, по меньшей мере, тринадцатью характеристическими пиками на порошковой рентгенограмме при значениях в градусах два тета 8,4±0,20, 11,3±0,20, 14,2±0,20, 15,5±0,20, 16,4±0,20, 16,6±0,20, 17,2±0,20, 19,7±0,20, 20,7±0,20, 21,0±0,20, 21,2±0,20, 21,6±0,20, 24,8±0,20 и 26,9±0,20. Кроме того, настоящее изобретение дополнительно предполагает, что кристаллический моногидрат (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]-декана дигидроцитрата характеризуется следующими четырнадцатью характеристическими пиками на порошковой рентгенограмме при значениях в градусах два тета 8,4±0,20, 11,3±0,20, 14,2±0,20, 15,5±0,20, 16,4±0,20, 16,6±0,20, 17,2±0,20, 19,7±0,20, 20,7±0,20, 21,0±0,20, 21,2±0,20, 21,6±0,20, 24,8±0,20 и 26,9±0,20.
Кроме того, на фиг.2 приведен термогравиметрический анализ (TGA) моногидрата (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата. Термогравиметрический анализ показывает, что с ростом температуры происходит дегидратация моногидрата (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата. А именно, моногидратная соль характеризуется потерей массы от приблизительно 2,5% до приблизительно 3,5%, с началом потери массы при температуре от приблизительно 60°C до приблизительно 70°C. В предпочтительном варианте осуществления моногидратная соль характеризуется потерей массы (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата приблизительно на 2,9%, с началом потери массы при температуре приблизительно 65°C.
Были также определены кристаллографические параметры элементарной ячейки моногидрата (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата, которые составляли следующие значения: a равняется 6,519 Å, b равняется 20,982 Å, c равняется 16,833 Å, α составляет приблизительно 90,0°, β составляет приблизительно 93,75° и γ составляет приблизительно 90,0° с объемом ячейки приблизительно 2297,52 Å3, где a, b и c - каждый представляют собой длину вектора кристаллической решетки, а α, β и γ - все представляют собой углы элементарной ячейки. Соль кристаллизуется в моноклинной сингонии P21/n.
Кроме того, кристаллическую моногидратную соль (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата обычно считают негигроскопичной, при этом изменение ее массы, измеряемое с помощью весов для исследования динамики сорбции влаги, составляет от 0,05% до 0,4% при относительной влажности в интервале от 0% до 90%,. В предпочтительном варианте осуществления изменение массы при относительной влажности от 0% до 90% составляет приблизительно 0,2%. Изотерма сорбции влаги моногидратом (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата показана на фиг.3. А именно, на фиг.3 приведена изотерма сорбции влаги для моногидратной соли при относительной влажности в интервале от 10% до 90%.
Кроме того, кристаллический моногидрат настоящего изобретения является термодинамически стабильной формой соли в условиях высокой активности воды, высокой относительной влажности, или высокой активности воды и высокой относительной влажности. А именно, обычно считают, что кристаллическая моногидратная соль (4s)-4-(5-фенил-1,3,4-тиадиазол-2-илокси)-1-азатрицикло[3.3.1.13,7]декана дигидроцитрата имеет критическое значение для активности воды в интервале от 0,05 до 0,20. В предпочтительном варианте осуществления моногидрат дигидроцитратной соли имеет критическое значение для активности воды от 0,10 до 0,15. В связи с этим, когда кристаллический моногидрат настоящего изобретения подвергается воздействию относительной влажности с уровнями менее чем 0,15, или других растворителей при активности воды 0,15, соль может превращаться из моногидратной формы в безводную форму. Если кристаллический моногидрат подвергается воздействию относительной влажности с уровнем 0,15 или выше, или растворителей с активностью воды более чем 0,15, кристаллическая моногидратная соль настоящего изобретения будет оставаться термодинамически стабильной и не будет превращаться в безводную форму соединения. Соответственно, при относительной влажности или активности воды 0,10 или менее, твердые вещества настоящего изобретения превращаются в негидратированную форму соли, в то время как при относительной влажности или активности воды 0,15 и выше твердые вещества превращаются в моногидратную форму соли. Поэтому кристаллическая моногидратная форма соли настоящей композиции