Аптамер к химазе и его применение
Иллюстрации
Показать всеГруппа изобретений относится к обоасти биохимии и биотехнологии. Представлены аптамер, связывающийся с химазой и ингибирующий активность химазы, содержащий нуклеотидную последовательность, представленную как X1GAUAGAN1N2UAAX2, где X1 и X2 идентичны или не идентичны друг другу и каждый означает A или G, а N1 и N2 идентичны или не идентичны друг другу и каждый означает A, G, C, U или T; комплекс, включающий аптамер и функциональное вещество, например вещество, обладающее сродством, вещество для мечения, фермент, средство доставки лекарственного средства, лекарственное средство; лекарственное средство или реагент, содержащее аптамер или комплекс; способы детекции и очистки химазы с использованием аптамера или комплекса. 9 н. и 7 з.п. ф-лы, 8 ил., 9 табл., 9 пр.
Реферат
Область техники
Настоящее изобретение относится к аптамеру к химазе, способу использования его и ему подобных.
Уровень техники
Химаза человека (EC.3.4.21.39), химотрипсин-подобная сериновая протеаза, аккумулируется в секреторных гранулах тучных клеток. В ответ на внешний стимул тучные клетки претерпевают дегрануляцию, которая приводит к высвобождению химазы человека вне клеток, наряду с множеством медиаторов воспаления. Высвобожденная химаза человека специфически распознает ароматические аминокислоты, такие как фенилаланин и тирозин, в составе субстратов - белков и пептидов - и расщепляет пептидную связь рядом с этими аминокислотами. Типичным субстратом химазы человека является ангиотензин I (AngI). В результате расщепления AngI химазой человека получается ангиотензин II (AngII), который является фактором вазоконстрикции.
Химазы млекопитающих по филогенетическим признакам относят к двум семействам: α и β. У приматов, включая человека, экспрессируется только один вид химазы, принадлежащей к семейству α. В то же время у грызунов экспрессируются химазы, принадлежащие как к семейству α, так и к семейству β. У мышей экспрессируются различные виды химаз, из которых протеаза 4 тучных клеток мыши (mMCP-4), принадлежащая к семейству β, считается наиболее близкородственной химазе человека, исходя из ее субстратной специфичности и экспрессии в тканях. У хомяков химазе человека соответствует химаза хомяков 1, также принадлежащая к семейству β. В то же время mMCP-5 и химаза хомяков 2, принадлежащие, как и химаза человека, к семейству α, обладают эластазоподобной активностью и отличаются от химазы человека по субстратной специфичности.
Химаза тесно ассоциирована с активацией трансформирующего фактора роста β (TGF-β). TGF-β присутствует в латентной форме (латентный TGF-β) во внеклеточных матриксах вокруг эпителиальных и эндотелиальных клеток и удерживается во внеклеточных матриксе посредством большого белка, связывающего латентный TGF-β (large latent TGF-β binding protein, LTBP). По мере необходимости TGF-β высвобождается из внеклеточных матриксов и активируется, а активированный TGF-β - цитокин, имеющий огромное значение для живых организмов, участвующий, как было показано, в пролиферации и дифференцировке клеток, заживлении тканей и регенерации тканей после повреждения. Прекращение сигнала TGF-β приводит к возникновению и развитию различного рода заболеваний. Считается, что в этом процессе химаза задействована на этапе высвобождения латентного TGF-β из внеклеточных матриксов и превращения латентного TGF-β в активный TGF-β.
Известно, что химаза ассоциирована с широким спектром заболеваний, включая фиброз, сердечно-сосудистые заболевания, воспаление, аллергические заболевания и адгезию органов. Фиброз представляет собой заболевание, характеризующееся аномальным метаболизмом внеклеточных субстратов в легких, сердце, печени, почках, коже и т.д., что приводит к избыточному отложению соединительнотканных белков. Например, при легочном фиброзе белки соединительной ткани, такие как коллаген, в избытке откладывается в легких, что приводит к сильному сжатию легочных альвеол, что, в свою очередь, является причиной дыхательной недостаточности. Было показано, что причиной легочного фиброза может являться пневмокониоз, возникающий из-за воздействия большой концентрации пыли, лекарственная пневмония, возникающая из-за воздействия лекарств, таких как противоопухолевые агенты, аллергическая пневмония, туберкулез легких, аутоиммунные заболевания, такие как коллагеновые болезни и т.д. Однако в немалом количестве случаев причина фиброза легких остается невыясненной.
Механизм возникновения фиброза на молекулярном уровне изучен недостаточно. Обычно в норме, пролиферация и функционирование фибробластов находятся под жестким контролем. Однако в случае сильного или персистирующего воспаления или травмы механизм заживления тканей работает с избыточной интенсивностью, что приводит к ненормальной пролиферации фибробластов и избыточной продукции белков соединительной ткани. Известно, что фактор TGF-β является причиной этих явлений. В качестве фактов, свидетельствующих о роли TGF-β, на модели фиброза у экспериментальных животных было показано, что введение нейтрализующих антител к TGF-β снижало экспрессию коллагена и значительно ослабляло фиброз. У пациентов с идиопатическим легочным фиброзом наблюдаются повышенный уровень TGF-β и повышенное количество химаза-положительных тучных клеток.
В то же время ассоциация химазы с фиброзом была показана в экспериментах с использованием экспериментальных животных. На модели легочного фиброза хомяков, индуцированного блеомицином, ингибиторы химаз ослабляли повышенную активность химаз, повышенную экспрессию мРНК коллагена III, фиброз тканей и другие явления. На модели легочного фиброза мышей, индуцированного блеомицином, наблюдались те же эффекты; введение ингибиторов химаз подавляло активность химаз и снижало содержание гидроксипролина.
Учитывая эти свойства, ингибиторы химаз можно использовать как профилактические или терапевтические лекарственные средства против заболеваний, относящихся к химазам, таких как фиброз. Ранее разработанные ингибиторы химаз включают низкомолекулярные соединения, такие как TPC-806, SUN-13834, SUN-C8257, SUN-C8077 и JNJ-10311795 (патентный документ 1)
В последнее время привлекает внимание применение РНК-аптамеров в качестве терапевтических лекарственных средств, диагностических реагентов и реагентов для тестирования; некоторые РНК-аптамеры уже находятся на стадии клинического исследования или применяются на практике. В декабре 2004 г. первое в мире лекарственное средство на основе РНК-аптамеров, Macugen, было одобрено в качестве терапевтического лекарственного средства для лечения возрастной дегенерации желтого пятна в США. РНК-аптамером называется РНК, специфически связывающаяся с молекулой-мишенью, такой как белок, и которую можно получить с использованием способа SELEX (Systematic Evolution of Ligands by Exponential Enrichment) (патентные документы 2-4). В способе SELEX РНК, специфически связывающуюся с молекулой-мишенью, выбирают из пула РНК, включающего примерно 1014 различных нуклеотидных последовательностей. Используемая РНК имеет случайную последовательность длиной примерно 40 нуклеотидов, фланкированную последовательностями праймеров. Этот пул РНК смешивают с молекулой-мишенью, и РНК, связавшуюся с молекулой-мишенью, отделяют с использованием фильтра или подобного способа. Отделенную РНК амплифицируют с помощью RT-PCR и используют в качестве матрицы для следующего раунда. Путем повторения этой операции примерно 10 раз можно получить РНК-аптамер, специфически связывающийся с молекулой-мишенью.
Аптамерные лекарственные средства, как и лекарственные средства, основанные на антителах, могут быть специфичными к внеклеточным белкам. Судя по данным, опубликованным в большом количестве научных публикаций и других справочных материалов, находящихся в свободном доступе, в некоторых отношениях аптамерные лекарственные средства могут превзойти лекарственные средства, основанные на антителах. Например, аптамеры часто имеют более высокие сродство и специфичность к молекулам-мишеням, чем антитела. Маловероятно, что иммунная система будет элиминировать аптамеры, и значит, маловероятно, что использование аптамеров приведет к побочным реакциям, характерным для антител, таким как антитело-зависимая клеточная цитотоксичность (ADCC) и комплемент-зависимая цитотоксичность (CDC). С точки зрения доставки лекарственных средств, малая молекулярная масса аптамеров (одна десятая молекулярного веса антител) способствует их проникновению в ткани и облегчает доставку лекарственных средств к сайтам-мишеням. Химический синтез, с помощью которого получают аптамеры, позволяет применять сайт-селективные химические модификации, а также снизить затраты с помощью массового производства. Другие преимущества аптамеров включают стабильность при длительном хранении, устойчивость к нагреванию и растворителям. В то же время, время полужизни аптамеров в крови обычно короче, чем у антител; однако иногда это может оказаться преимуществом ввиду токсичности. Эти факты позволяют сделать вывод, что даже при одной и той же молекуле-мишени, аптамерные лекарственные средства могут превзойти лекарственные средства, основанные на антителах.
Патентный документ 1 USB6500835
Патентный документ 2 WO91/19813
Патентный документ 3 WO94/08050
Патентный документ 4 WO95/07364
Сущность изобретения
Задачи, решаемые изобретением
Настоящее изобретение направлено на получение аптамера к химазе и способа использования его и ему подобных.
Способы решения задач
Авторы настоящего изобретения провели всесторонние исследования, направленные на решение вышеописанной проблемы, и им удалось получить аптамер к химазе хорошего качества, что и привело к завершению настоящего изобретения.
Соответственно, в настоящем изобретении представлено следующее:
[1] аптамер, связывающийся с химазой и ингибирующий активность химазы.
[2] аптамер по п. [1], содержащий нуклеотидную последовательность, представляемую в виде X1GAUAGAN1N2UAAX2 (SEQ ID NO: 21; каждый из X1 и X2, идентичных или не идентичных, обозначает A или G, а каждый из N1 и N2, идентичных или не идентичных, обозначает A, G, C, U или T).
[3] аптамер по п. [2], где N1N2 обозначает GA, GU, GC, UU, GT или CU.
[4] аптамер по п. [2], где X1 и Х2 оба обозначают А или оба обозначают G.
[5] аптамер по пп. [3] или [4], где по меньшей мере один пиримидиновый нуклеотид был изменен или модифицирован.
[6] аптамер по п. [1], включающий любую из нуклеотидных последовательностей (a), (b) и (c), приведенных ниже:
(а) аптамер, содержащий нуклеотидную последовательность, выбираемую из SEQ ID NO: 4-34, 38-57, 59-65 и 69-72 (при условии, что урацил может представлять собой тимин);
(b) аптамер, содержащий нуклеотидную последовательность, выбираемую из SEQ ID NO: 4-34, 38-57, 59-65 и 69-72 (при условии, что урацил может представлять собой тимин), в которой могут быть заменены, делетированы, вставлены или добавлены от 1 до 5 нуклеотидов; и
(с) нуклеотидная последовательность, идентичная на 70% или более нуклеотидной последовательности, выбираемой из SEQ ID NO: 4-34, 38-57, 59-65 и 69-72 (при условии, что урацил может представлять собой тимин).
[7] аптамер по п. [6], где по меньшей мере один нуклеотид, содержащийся в аптамере, был изменен или модифицирован.
[8] аптамер по п. [1], включающий любую из нуклеотидных последовательностей (a'), (b') и (c'), приведенных ниже:
(а') нуклеотидная последовательность, выбираемая из SEQ ID NO: 56(1)-56(7), 56(9), 56(11), 56(12), 56(15)-56(52), 61(1), 69(1), 69(2) и 72(1)-72(8) (при условии, что урацил может представлять собой тимин);
(b') нуклеотидная последовательность, выбираемая из SEQ ID NO: 56(1)-56(7), 56(9), 56(11), 56(12), 56(15)-56(52), 61(1), 69(1), 69(2) и 72(1)-72(8) (при условии, что урацил может представлять собой тимин), в которой могут быть заменены, делетированы, вставлены или добавлены от 1 до 5 нуклеотидов; и
(с') нуклеотидная последовательность, идентичная на 70% или более нуклеотидной последовательности, выбираемой из SEQ ID NO: 56(1)-56(7), 56(9), 56(11), 56(12), 56(15)-56(52), 61(1), 69(1), 69(2) и 72(1)-72(8) (при условии, что урацил может представлять собой тимин).
[9] аптамер по п. [1], где все гидроксильные группы в 2'-положениях соответствующих пиримидиновых нуклеотидов, содержащихся в аптамере, идентичных или не идентичных, могут заменяться на атом или группу, выбираемые из группы, состоящей из атома водорода, атома фтора и метоксигруппы.
[10] аптамер по п. [1], где все гидроксильные группы во 2'-положениях соответствующих пуриновых нуклеотидов, содержащихся в аптамере, идентичных или не идентичных, могут заменяться на атом или группу, выбираемые из группы, состоящей из атома водорода, атома фтора и метоксигруппы.
[11] Комплекс, включающий любой из аптамеров [1]-[10] и функциональное вещество.
[12] Комплекс по п. [11], где функциональное вещество представляет собой вещество, обладающее сродством, вещество для мечения, фермент, средство доставки лекарственного средства или лекарственное средство.
[13] Лекарственное средство, включающее любой из аптамеров [1]-[10] или комплекс [11] или [12].
[14] Лекарственное средство по п. [13], использующееся для профилактики или лечения сердечно-сосудистого заболевания или фиброза.
[15] Диагностический реагент, включающий любой из аптамеров [1]-[10] или комплекс [11] или [12].
[16] Зонд для детекции химазы, включающий любой из аптамеров [1]-[10] или комплекс [11] или [12].
[17] Твердофазный носитель для очистки химазы, включающий любой из аптамеров [1]-[10] или комплекс [11] или [12].
[18] Способ детекции химазы, включающий использование любого из аптамеров [1]-[10] или комплекса [11] или [12].
[19] Способ очистки химазы, включающий использование любого из аптамеров [1]-[10] или комплекса [11] или [12].
Эффект изобретения
Аптамер или комплекс согласно настоящему изобретению может использоваться в качестве лекарственного средства или реагента, такого как диагностический реагент для различных заболеваний, вызываемых химазой, таких как фиброз и сердечно-сосудистые заболевания. Аптамер или комплекс согласно настоящему изобретению также может использоваться для очистки и концентрации химазы, а также для детекции и количественного анализа химазы.
На фиг.1 приведена вторичная структура аптамера, представленного SEQ ID NO:4, 5, 12-14, 18, предсказанная программой MFOLD, где часть, обведенная кружком, означает общую последовательность, представленную SEQ ID NO:21.
На фиг.2 приведена вторичная структура аптамера, представленного SEQ ID NO: 22-27, предсказанная программой MFOLD, где часть, обведенная кружком, означает общую последовательность, представленную SEQ ID NO:21.
На фиг.3 приведена вторичная структура аптамера, представленного SEQ ID NO: 28-34, предсказанная программой MFOLD, где часть, обведенная кружком, означает общую последовательность, представленную SEQ ID NO:21.
На фиг.4 показано, как аптамеры, представленные SEQ ID NO:12 и 13, связываются с химазой, где 40N означает пул РНК, содержащий случайную последовательность длиной 40 нуклеотидов. Для использования в качестве молекулы захвата каждый аптамер или отрицательный контроль иммобилизовали; химазу человека инъецировали в качестве анализируемого вещества. Измерения проводили с помощью Biacore T100 (производство GE Helthcare).
На фиг.5 приведена вторичная структура аптамера, представленного SEQ ID NO:38-40, 43, 48, предсказанная программой MFOLD, где часть, обведенная кружком, означает общую последовательность, представленную SEQ ID NO:21.
На фиг. 6 приведена вторичная структура аптамера, представленного SEQ ID NO:49, 51, 55-57, предсказанная программой MFOLD, где часть, обведенная кружком, означает общую последовательность, представленную SEQ ID NO:21.
На фиг. 7 показано, как аптамеры, представленные SEQ ID NO:13, 55 и 56, связываются с химазой, где 40N означает пул РНК, содержащий случайную последовательность длиной 40 нуклеотидов. Химазу иммобилизовали на поверхности чипа; инъецировали каждый аптамер или отрицательный контроль в качестве анализируемых веществ. Измерения проводили с помощью Biacore T100 (производство GE Helthcare).
На фиг. 8 приведены результаты Вестерн-блоттинга, показывающие деградацию LTBP-1 химазой и ингибирование деградации LTBP-1 аптамерами, приведенными в таблице 9. Полосы 1, 8, 9, 23 и 31 содержат маркеры; полосы 6, 21 и 29 содержат отрицательный контроль (без ингибитора); полосы 7, 22 и 30 содержат контроли без химазы.
Предпочтительный способ осуществления изобретения
В настоящем изобретении представлен аптамер, обладающий способностью связываться с химазой. Аптамеры согласно настоящему изобретению способны ингибировать активности химазы.
Аптамер означает молекулу нуклеиновой кислоты, обладающую сродством связывания к определенной молекуле-мишени. Аптамер также может ингибировать активность определенной молекулы-мишени путем связывания с определенной молекулой-мишенью. Аптамер согласно настоящему изобретению обладает сродством связывания к химазе и способен ингибировать активность химазы. Аптамер согласно настоящему изобретению может представлять собой РНК, ДНК, модифицированную нуклеиновую кислоту или их смесь. Аптамер согласно настоящему изобретению также может иметь линейную или круговую форму.
Химаза, известная сериновая протеаза, запасается в секреторных гранулах тучных клеток. Химаза тесно ассоциирована с множеством различных биологических реакций, опосредуемых тучными клетками, включая, например, продукцию и деградацию биореактивных пептидов, перестройку внеклеточного матрикса, сигналы цитокинов и иммунитет. Аптамер согласно настоящему изобретению может проявлять ингибиторную активность по отношению к химазе, полученной из любого млекопитающего. Такие млекопитающие включают приматов (например, человека, обезьян), грызунов (например, мышей, крыс, морских свинок, хомяков) и животных-компаньонов, домашних животных и рабочих животных (например, собак, кошек, лошадей, коров, коз, овец, свиней); предпочтительным млекопитающим является человек. Аминокислотная последовательность химазы человека имеет номер доступа AAB26828, и может представлять собой последовательность, содержащую один или несколько мутированных остатков, ее домен или пептид. Химаза человека может находиться не только в мономерной форме, но также в димерной и полимерной.
Аптамер согласно настоящему изобретению связывается с химазой в физиологических буферных растворах. Ограничений на выбор буферного раствора нет, однако предпочтительно, если pH буферного раствора находится в пределах от 5,0 до 10,0. Такие буферные растворы включают, например, раствор А и раствор С, описанные ниже (см. Примеры 1 и 2). Силу связывания аптамера согласно настоящему изобретению с химазой можно измерить с помощью любого из тестов, описанных ниже.
Силу связывания измеряют с помощью Biacore T100 (производство GE Healthcare). В способе измерения вначале аптамер иммобилизуют на сенсорном чипе, причем количество иммобилизованного аптамера составляет примерно 1000 RU. Для анализа инъецируют 20 мкл раствора химазы с концентрацией 0,2 мкМ и детектируют связывание химазы с аптамером. Отрицательным контролем служит РНК, включающая случайную последовательность нуклеотидов длиной от 30 до 40 нуклеотидов. Если химаза связывается с аптамером эквивалентно или со значительно большей силой, чем с контрольной РНК, считается, что аптамер обладает способностью связываться с химазой.
В другом способе вначале химазу иммобилизуют на сенсорном чипе, причем количество иммобилизованной химазы составляет примерно 4000 RU. Для анализа инъецируют 20 мкл раствора аптамера с концентрацией 0,01 мкг/мкл, и детектируют связывание химазы с аптамером. Отрицательным контролем служит РНК, содержащая случайную последовательность нуклеотидов длиной от 30 до 40 нуклеотидов. Если химаза связывается с аптамером эквивалентно или со значительно большей силой, чем с контрольной РНК, считается, что аптамер обладает способностью связываться с химазой.
Ингибиторная активность по отношению к химазе означает ингибиторный потенциал по отношению к любой активности химазы. Например, ингибируется способность фермента гидролизовать и расщеплять пептидные цепи, что является одной из функций химазы. Приемлемые субстраты для ферментативной активности не ограничиваются белками и биоактивными пептидами, присутствующими в живых организмах (например, AngI, латентный TGF-β и т.п.), но включают пептиды, содержащие частичные аминокислотные последовательности вышеуказанных пептидов, конъюгированные с хромогенным веществом или флуоресцентным веществом. Хромогенные вещества и флуоресцентные вещества известны специалистам в области техники. Явления, имеющие место при расщеплении белков или биоактивных пептидов, включают повышенную экспрессию коллагена I/III, повышенное содержание гидроксипролина, повышенную экспрессию IgE и т.п.; подавление этих явлений также включается в понятие ингибиторной активности в отношении химазы. Кроме того, ингибиторная активность по отношению к миграции нейтрофилов, моноцитов и эозинофилов к химазе также включается в понятие ингибиторной активности по отношению к химазе. Далее, эффекты подавления вызываемых химазой высвобождения гистамина, повышения количества тучных клеток, повышения проницаемости сосудов, фиброза тканей, воспаления, ангиогенеза, утолщения сосудистой интимы и т.п. также включаются в понятие ингибиторной активности в отношении химазы.
Субстрат химазы означает пептид, белок или подобное вещество, которое подвергается гидролитическому расщеплению химазой. Известные субстраты для химазы, содержащиеся в живых организмах, включают пептиды и белки такие как AngI, латентный TGF-β, фактор стволовых клеток (SCF), проколлаген, проколлагеназа, фибронектин, проматриксная металлопротеаза-1 (pro-MMP-1), pro-MMP-9, тканевой ингибитор матриксной металлопротеазы-1 (TIMP-1), аполипопротеин A-I (apoA-I), apoE, белок переноса фосфолипидов, предшественник IL-1β, большой эндотелин-1 (big-ET-1), big-ET-2, пептид, активирующий соединительную ткань III, предшественник IL-18, вещество P, вазоактивный кишечный пептид (VIP), каллидин, брадикинин и С3а. В настоящем документе субстраты химазы не ограничиваются вышеперечисленными, но включают искусственно сконструированные модельные пептиды, содержащие аминокислотные остатки, специфически узнаваемые химазой, такие как Phe и Tyr, а также такие пептиды, конъюгированные с хромогенным веществом или флуоресцентным веществом.
Происходит ли ингибирование ферментативной активности химазы аптамером, можно определить, например, с помощью трех способов анализа, описанных ниже.
В первом способе используется синтетический субстрат. Пригодным субстратом для химазы является Suc-Ala-Ala-Pro-Phe-MCA (4-метилкумарин-7-амидная группа) (производство Peptide Institute, Inc.), включающий пептид из 4 аминокислот «Ala-Ala-Pro-Phe» - стандартный субстрат для химотрипсин-подобных протеаз.
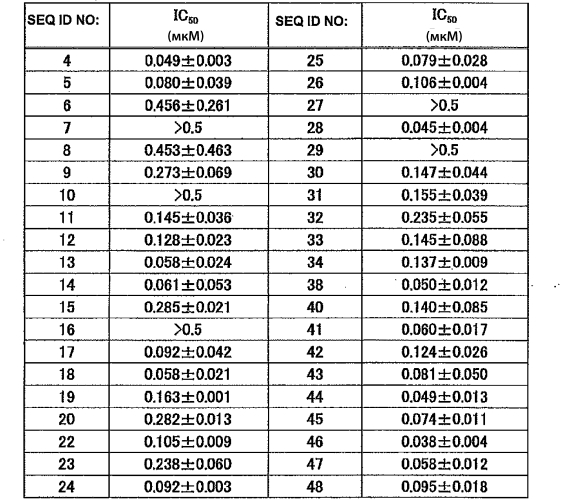
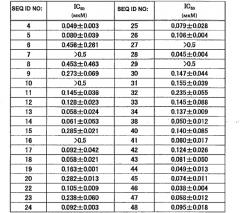
Тест проводится с использованием 96-луночного планшета (F16 Black Maxisorp Fluoronunc, производство Nunc), в объеме реакционной смеси 100 мкл, в буферном растворе (раствор С; см. Пример 2 ниже). Вначале готовят по 50 мкл растворов всех нуклеиновых кислот в растворе С. Далее добавляют по 10 мкл 1мМ раствора субстрата в растворе С и помещают планшет в считыватель микропланшетов SpectraMax190 (производство Molecular Devices Corporation) и инкубируют при 37°С в течение 5 минут. В отдельной пробирке 0,05 мкг химазы (рекомбинантный белок производства Sigma) разводят в растворе С, и 40 мкл этого разведения инкубируют при 37°С в течение 5 минут. Раствор химазы добавляют к смеси нуклеиновой кислоты и субстрата для начала ферментативной реакции. Планшет с реакционной смесью помещают в считыватель микропланшетов SpectraMax190 (производство Molecular Devices Corporation) и анализируют изменения флуоресценции в зависимости от времени при 37°С в течение 5 минут (возбуждение при длине волны 380 нм, детекция при длине волны 460 нм). Строят линейную аппроксимацию усиления флуоресценции AMC (7-амино-4-метилкумарина), высвобождаемого из субстрата активностью химазы, и ее наклон принимают за начальную скорость реакции. Для контроля образцы обрабатывают и анализируют одинаковым способом в двух случаях: использование пула нуклеиновых кислот, содержащего случайную последовательность длиной в 30-40 нуклеотидов (отрицательный контроль), и использование химостатина, известного ингибитора химотрипсин-подобных сериновых протеаз (положительный контроль). Начальную скорость реакции без нуклеиновой кислоты и ингибитора принимают за 100% активности фермента, рассчитывают степень ингибирования для каждого анализируемого вещества и определяют концентрацию ингибитора, необходимую для 50% ингибирования ферментативной активности (IC50). Считается, что аптамер, имеющий IC50 ниже, чем известный ингибитор химостатин, обладает прекрасной ингибиторной активностью.
Во втором способе оценки используется нативный субстрат. Пригодным нативным субстратом для химазы является ангиотензин I. В этом случае, пептидный фрагмент His-Leu, высвобождающийся при расщеплении ангиотензина I, флуоресцентно дериватизуют и измеряют активность его флуоресценции.
В ходе теста проводится ферментативная реакция в 50 мкл раствора С. Вначале 0,3-0,75 нг химазы (рекомбинантный белок, производство Sigma; или нативный белок, производства Calbiochem) разводят в 5 мкл раствора С. Каждую нуклеиновую кислоту растворяют в 25 мкл раствора С. Смешивают 5 мкл каждого разведения химазы и 25 мкл раствора каждой нуклеиновой кислоты и далее смесь инкубируют при 37°С в течение 5 минут. В отдельной пробирке готовят 20 мкл раствора ангиотензина I (производство Peptide Institute, Inc.) с концентрацией 125 мкМ в растворе С и инкубируют при 37°С в течение 5 минут. Раствор ангиотензина I добавляют к смеси химазы и нуклеиновой кислоты, и начинается ферментативная реакция. Реакцию проводят в течение 90 минут при 37°С, после чего добавляют 25 мкл ледяной 30% трихлоруксусной кислоты для остановки реакции. Смесь центрифугируют при 4°С и 14000 об/мин в течение 10 минут и 30 мкл полученного супернатанта используют для следующей реакции флуоресцентной дериватизации.
После добавления 30 мкл супернатанта в 96-луночный планшет (Black, производства Costar), в каждую лунку добавляют 15 мкл 2% раствора о-фталальдегида (производство Sigma) в метаноле и 170 мкл 0,3М раствора NaOH, и планшет оставляют на 10 минут при комнатной температуре. Далее добавляют 25 мкл 3М раствора HCl для остановки реакции. Планшет помещают в ридер микропланшетов SpectraMax190 (производство Molecular Devices Corporation) и определяют интенсивность флуоресценции при длине волны возбуждения 355 нм и длине волны флуоресценции 460 нм.
Для контроля образцы обрабатывают и анализируют аналогичным образом в двух случаях: использование SEQ ID NO:58 (отрицательный контроль) и использование химостатина, известного ингибитора химотрипсин-подобных сериновых протеаз (положительный контроль). В обоих случаях, интенсивность флуоресценции, полученная в момент времени реакции 0 минут, используется в качестве контрольного определения. За 100% в ферментативной реакции химазы принимают интенсивность флуоресценции, детектируемую при добавлении равного объема раствора С вместо каждой нуклеиновой кислоты, рассчитывают степень ингибирования для каждого анализируемого вещества и определяют концентрацию ингибитора, необходимую для 50% ингибирования ферментативной активности (IC50). Считается, что аптамер, имеющий IC50 ниже, чем известный ингибитор химостатин, обладает прекрасной ингибиторной активностью.
В третьем способе оценки используется нативный субстрат, содержащийся в супернатанте клеточной культуры. В этом случае расщепление субстрата химазы LTBP-1 определяют с помощью Вестерн-блоттинга. Замороженные клетки NHLF (производство Cambrex Bio Science) быстро размораживают в водяной бане при 37°С и суспендируют в среде (10% FBS/F-12). После центрифугирования при 1200 об/мин в течение 5 минут удаляют супернатант, а клетки ресуспендируют в среде. К отцентрифугированным клеткам добавляют среду до общего объема 10 мл и полученную суспензию переносят в культуральную чашку и культивируют при 37°С в присутствии 5% С02. За морфологией и пролиферативным статусом клеток наблюдают в микроскоп. При достижении клетками конфлюентности среду заменяют на бессывороточную среду (0,2% BSA/F-12). Через два дня после смены среды культуральный супернатант собирают, разливают и хранят в морозильнике при -30°С.
40 мкл культурального супернатанта NHLF, свежеразмороженного перед употреблением, добавляют в пробирку и добавляют 5 мкл раствора нуклеиновой кислоты, разведенной раствором С. Для положительного контроля химостатин разводят раствором С и это разведение добавляют тем же способом. Для отрицательного контроля добавляют только раствор С. Далее добавляют 5 мкл разведения химазы в растворе Е с концентрацией 100 нг/мл (раствор С + 0,1% BSA, 0,05% азида натрия). Для контроля готовят пробирку, не содержащую химазу. Образец перемешивают и инкубируют при 37°С в течение 1 часа и смешивают с равным объемом лизисного буфера для электрофореза для остановки реакции. LTBP-1 в образце определяют с помощью Вестерн-блоттинга, описанного ниже.
Образец, смешанный с лизисным буфером, кипятят в течение 3 минут и 10 мкл образца подвергают электрофорезу в 5-20% акриламидном геле. После завершения электрофореза образец переносят на нитроцеллюлозный фильтр, после чего фильтр забивают 5% обезжиренного молока, 50 мМ Tris-HCl (pH 8,0) и 0,05% азида натрия. К фильтру добавляют раствор моноклонального антитела к LTBP-1 с концентрацией 2 мкг/мл в 2% BSA, PBS и 0,05% азида натрия и инкубируют при комнатной температуре в течение ночи. Фильтр промывают три раза и инкубируют с раствором вторых антител (антитела к мышиным IgG, помеченные HRP, разведенные в 10000 раз в 0,1%BSA/PBS) при комнатной температуре в течение 2 часов. Фильтр промывают пять раз, и проявляют с использованием хемилюминесцентного субстрата.
По плотности и положению (молекулярному весу) полосы LTBP-1 очевидно, что полоса, соответствующая образцу без химазы, может служить хорошим положительным контролем (+), а полоса, соответствующая отрицательному контролю, может служить хорошим отрицательным контролем (-). Ингибиторная активность каждого анализируемого вещества оценивается с помощью визуального контроля.
На аптамер согласно настоящему изобретению не накладывается никаких ограничений, при условии, что он может связываться с любой частью химазы и ингибировать ее активность.
Длина аптамера согласно настоящему изобретению не ограничена, и обычно может составлять от примерно 10 до примерно 200 нуклеотидов, и может составлять, например, не более 100 нуклеотидов, предпочтительно не более 50 нуклеотидов, более предпочтительно не более 40 нуклеотидов, наиболее предпочтительно не более 30 нуклеотидов. При меньшем общем числе нуклеотидов облегчается химический синтез и массовое производство, и также обеспечивается выигрыш в стоимости. Также считается, что меньшее общее число нуклеотидов обеспечивает легкость химической модификации, высокую стабильность в теле и низкую токсичность.
Каждый нуклеотид, содержащийся в аптамере согласно настоящему изобретению, идентичный или не идентичный, может представлять собой нуклеотид, содержащий гидроксильную группу во 2' положении рибозы (например, рибозы пиримидинового нуклеотида, рибозы пуринового нуклеотида) (т.е. незамещенный нуклеотид) или нуклеотид, содержащий замещающий атом или группу во 2' положении рибозы. Примерами таких атомов или групп могут служить нуклеотид, замещенный атомом водорода, атомом фтора или -О-алкильной группой (например, группой -O-Me), -О-ацильной группой (например, группой -O-COMe) или аминогруппой (например, группой -NH2).
Аптамер согласно настоящему изобретению имеет последовательность, обозначаемую X1GAUAGAN1N2UAAX2 (SEQ ID NO: 21; где каждый из X1 и X2, идентичных или не идентичных, представляет собой A или G, а каждый из N1 и N2, идентичных или не идентичных, представляет собой A, G, C, U или T; при условии, что урацил может представлять собой тимин). Аптамер, имеющий такую последовательность, прочно связывается с химазой и ингибирует активность химазы.
В вышеприведенной формуле предпочтительно, если Х1 и Х2 оба представляют собой А или оба представляют собой G; предпочтительно, если N1N2 представляет собой GA, GU, GC, GT или CU (при условии, что урацил может представлять собой тимин).
Аптамер согласно настоящему изобретению также может представлять собой нуклеотид, где по меньшей мере один тип нуклеотидов (например, 1, 2, 3 или 4 типа) содержит гидроксильную группу или любой вышеописанный атом или группу, например, по меньшей мере два типа групп (например, 2, 3 или 4 типа), выбранных из группы состоящей из атома водорода, атома фтора, гидроксильной группы и метоксигруппы, во 2'-положении рибозы.
В аптамере согласно настоящему изобретению все пиримидиновые нуклеотиды могут представлять собой нуклеотиды, замещенные атомом фтора, или нуклеотиды, замещенные любым вышеупомянутым атомом или группой, предпочтительно, атомом или группой, выбираемыми из атома или группы, состоящих из атома водорода, гидроксильной группы и метоксигруппы, идентичных или не идентичных, во 2'-положении рибозы.
В аптамерах согласно настоящему изобретению все пуриновые нуклеотиды могут представлять собой нуклеотиды, содержащие гидроксильную группу, или нуклеотид, замещенный любым вышеупомянутым атомом или группой, предпочтительно, атомом или группой, выбираемыми из группы, состоящей из атома водорода, метоксигруппы и атома фтора, идентичных или не идентичных, во 2'-положении рибозы.
В аптамере согласно настоящему изобретению также все нуклеотиды могут идентичным образом содержать гидроксильную группу или любой вышеупомянутый атом или группу, например, идентичную группу, выбираемую из группы, состоящей из атома водорода, атома фтора, гидроксильной группы и метоксигруппы, во 2'-положении рибозы.
В настоящем документе, в описании модификаций сахарных групп в составе нуклеотидов подразумевается, что нуклеотиды, составляющие аптамер, представляют собой РНК (т.е., подразумевается, что сахарные группы представляют собой рибозу). Однако, это не означает, что ДНК исключается из нуклеотидов, составляющих аптамер, и где это возможно, модификация РНК означает также модификацию ДНК. Например, если нуклеотид, составляющий аптамер, представляет собой ДНК, замещение гидроксильной группы во 2'-положении рибозы на Х означает замещение одного из водородных атомов во 2'-положении дезоксирибозы на Х.
Аптамер согласно настоящему изобретению также может представлять собой:
(а) аптамер, содержащий нуклеотидную последовательность, выбираемую из SEQ ID NO: 4-34, 38-57, 59-65 и 69-72 (при условии, что урацил может представлять собой тимин);
(b) аптамер, содержащий нуклеотидную последовательность, выбираемую из SEQ ID NO: 4-34, 38-57, 59-65 и 69-72 (при условии, что урацил может представлять собой тимин), в которой могут быть заменены, делетированы, вставлены или добавлены от 1 до 5 нуклеотидов; и
(с) аптамер, содержащий нуклеотидную последовательность, идентичную на 70% или более (предпочтительно на 80% или более, более предпочтительно на 90% или более, наиболее предпочтительно на 95% или более) нуклеотидной последовательности, выбираемой из SEQ ID NO: 4-34, 38-57, 59-65 и 69-72 (при условии, что урацил может представлять собой тимин). Аптамер согласно настоящему изобретению также включает:
(d) конъюгат, выбираемый из группы, состоящей из конъюгата множества аптамеров (а), описанных выше, конъюгата множества аптамеров (b), описанных выше, конъюгата множества аптамеров (c), описанных выше, и конъюгата множества аптамеров (а), (b) и (с), описанных выше.
Способностью связываться с химазой и/или ингибировать активность химазы (ферментативную активность химазы и т.п.) обладает не только аптамер (а), описанный выше, но и аптамеры (b)-(d).
Аптамер согласно настоящему изобретению может также представлять собой: (a') аптамер, содержащий нуклеотидную последовательность, выбираемую из SEQ ID NO: 56(1)-56(7), 56(9), 56(11), 56(12), 56(15)-56(52), 61(1), 69(1), 69(2) и 72(1)-72(8) (при условии, что урацил может представлять собой тимин);
(b') аптамер, содержащий нуклеотидную последовательность, выбираемую из SEQ ID NO: 56(1)-56(7), 56(9), 56(11), 56(12), 56(15)-56(52), 61(1), 69(1), 69(2) и 72(1)-72(8) (при условии, что урацил может представлять собой тимин), в которой заменены, делетированы, вставлены или добавлены от 1 до 5 нуклеотидов; или
(с') аптамер, содержащий нуклеотидную последовательность, идентичную на 70% или более нуклеотидной последовательности, выбираемой из SEQ ID NO: 56(1)-56(7), 56(9), 56(11), 56(12), 56(15)-56(52), 61(1), 69(1), 69(2) и 72(1)-72(8) (при условии, что урацил может представлять собой тимин). Аптамер согласно настоящему изобретению также включает:
(d') конъюгат, выбираемый из группы, состоящей из конъюгата множества аптамеров (а'), описанных выше, конъюгата множества аптамеров (b'), описанных выше, конъюгата множества аптамеров (c'), описанных выше, и конъюгата множества аптамеров (а'), (b') и (с'), описанных выше. Кроме того, аптамер согласно настоящему изобретению также включает:
(е) конъюгат, состоящий из одного или более аптамеров, выбираемых из группы, состоящей из (a), (b) и (с), описанных выше, и одного или более аптамеров, выбираемых из группы, состоящей из (a'), (b') и (c').
Вышеописанные аптамеры (a')-(d') и (e) такж