Содержащие фактор фон виллебранда (vwf) препараты и способы, наборы и применения, связанные с ними
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к рекомбинантному получению модифицированного vWF, и может быть использовано в медицине для лечения гемофилии. Получают укороченные варианты vWF, связанные с Fc-частью иммуноглобулина, способные связывать FVIII. Изобретение позволяет облегчить получение и очистку FVIII, а также способствует пролонгированию полужизни FVIII в крови. 10 н. и 2 з.п. ф-лы, 11 ил., 1 табл., 3 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает приоритет на основе Заявки США № 61/261145, поданной 13 ноября 2009 года, которая включена здесь посредством ссылки в ее полном объеме.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Обеспечены способы, композиции и наборы для vWF-содержащих препаратов, в том числе способы, наборы и применение таких препаратов для получения Фактора VIII (FVIII). Предоставляются также полипептиды vWF и молекулы нуклеиновых кислот, кодирующие их.
УРОВЕНЬ ТЕХНИКИ
FVIII, экспрессируемый клетками млекопитающих, является часто специфически или неспецифически абсорбируемым на клеточных поверхностях взаимодействием с компонентами поверхности (например, протеогликанами) или рецептор-опосредованными событиями (например, взаимодействием с LRP-рецептором). Возможно также, что экспрессируемый FVIII ферментативно расщепляется и/или деградируется в средах культивируемых клеток. На протяжении культивирования концентрация экспрессированного FVIII уменьшается в среде, если этот секретируемый материал не удаляется быстро после экспрессии (например, перфузионными способами).
При обычных обстоятельствах, комплекс FVIII-vWF может быть удален из среды общепринятыми хроматографическими способами, включающими в себя абсорбцию на заряженных матриксах, или псевдоаффинной хроматографией. Затем FVIII очищают из комплекса FVIII:vWF селективными стадиями промывания с получением обогащенной молекулами FVIII популяции, минимально загрязненной vWF.
vWF образуется в васкулярных эндотелиальных клетках, которые являются основным источником этого белка плазмы, конститутивным или стимулируемым высвобождением, но он также синтезируется в меньших количествах мегакариоцитами. Считается, что первичный продукт трансляции состоит из 2813 аминокислот. После отщепления сигнального пептида (22 аминокислот) имеет место димеризация. Дальнейший процессинг выполняется в аппарате Гольджи, где эти димеры полимеризуются после отщепления и удаления пропептида (741 аминокислот). Этот пропептид играет важную роль в последующем связывании этих димеров, где он катализирует образование дисульфидных мостиков на амино-концевой стороне. Таким образом, могут образовываться олигомеры разного размера в диапазоне размеров от димера 500000 дальтон до больших мультимеров до 20 миллионов дальтон. Кроме протеолитических процедур, vWF подвергается другим посттрансляционным модификациям, в том числе гликозилированию и сульфатированию.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте, данное изобретение обеспечивает полипептид, содержащий первую аминокислотную последовательность, присутствующую в полипептиде vWF, и другую аминокислотную последовательность, гетерологичную относительно первой, где этот полипептид способен связывать FVIII.
В другом аспекте, данное изобретение обеспечивает композицию, содержащую полипептид, содержащий эту первую и вторую аминокислотную последовательность.
В некоторых аспектах, данное изобретение обеспечивает белковый комплекс, содержащий этот полипептид и FVIII.
В других аспектах, данное изобретение обеспечивает композицию, содержащую этот белковый комплекс.
В других дополнительных аспектах, данное изобретение обеспечивает нуклеотидную последовательность, кодирующую полипептид, содержащий первую и вторую аминокислотную последовательность.
В одном аспекте, данное изобретение обеспечивает экспрессирующий вектор, содержащий эту нуклеотидную последовательность.
В другом аспекте, данное изобретение обеспечивает клетку, экспрессирующую полипептид, содержащий эту первую и вторую аминокислотную последовательность.
В некоторых аспектах, данное изобретение обеспечивает клетку, экспрессирующую белковый комплекс, содержащий этот полипептид и FVIII.
В других аспектах, данное изобретение обеспечивает способ получения этого белкового комплекса, предусматривающий контактирование этого полипептида с FVIII.
В одном аспекте, данное изобретение обеспечивает способ получения FVIII, предусматривающий: контактирование FVIII с полипептидом, содержащим первую и вторую аминокислотную последовательность, с образованием белкового комплекса, содержащего этот полипептид и FVIII.
В другом аспекте, данное изобретение обеспечивает способ усиления фармакокинетического свойства FVIII в плазме, предусматривающий введение субъекту композиции, содержащей этот белковый комплекс, включающий в себя этот полипептид и FVIII.
В некоторых аспектах, данное изобретение обеспечивает композицию, содержащую этот белковый комплекс и фармацевтически приемлемый носитель.
В других аспектах, данное изобретение обеспечивает способ лечения связанного с кровью состояния, предусматривающий введение композиции, содержащей белковый комплекс, содержащий этот полипептид и FVIII, где этот полипептид содержит первую и вторую аминокислотную последовательность.
В дополнительных аспектах обеспечен набор.
КРАТКОЕ ОПИСАНИЕ ФИГУР
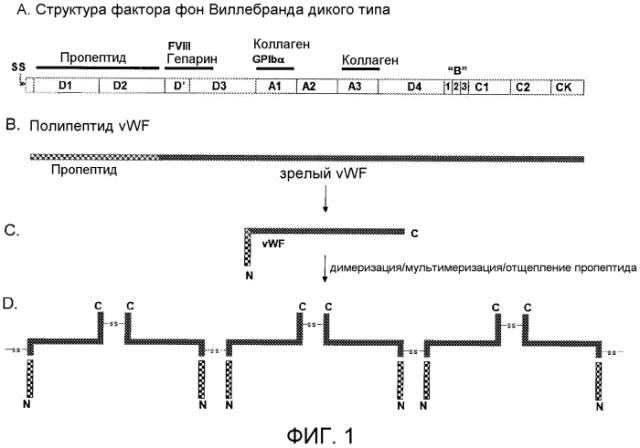
Фигура 1 показывает схематическое представление структуры, процессинга и созревания белка фактора фон Виллебранда. (A) Структура доменов первичного полипептида фактора фон Виллебранда: SS = сигнальный пептид; D1 и D2 = последовательность пропептида; D'-D3 = включает в себя номинальный район связывания фактора FVIII; A1 и A3 = домены связывания коллагена (и других взаимодействий); (B) Во время секреции и процессинга сигнальный пептид удаляется и пропептид позднее отщепляется от полипептида vWF фурин-подобной стадией процессинга с образованием зрелого полипептида vWF, который начинается обычно в месте присоединения D'-домена; (C) Пропептид, ассоциированный со зрелым полипептидом vWF, стимулирует увеличенное связывание и мультимеризацию FVIII; и (D) Остатки цистеина, обеспечиваемые комплексом пропептид-зрелый vWF, обеспечивают ковалентные мостики, которые позволяют интра- и интермолекулярное образование мультимера.
Фигура 2 показывает схематическое представление укорочений доменов фактора фон Виллебранда с ковалентным слиянием с Fc IgG1. (А) Структура доменов первичного полипептида фактора фон Виллебранда: SS = сигнальный пептид; D1 и D2 = последовательность пропептида; D'-D3 = включает в себя номинальный район связывания фактора FVIII; A1 и A3 = домены связывания коллагена (и других взаимодействий); (B) Эти первичные укороченные полипептиды vWF с Fc представлены в виде диаграммы, показывающей ожидаемую структуру доменов отщепления сигнального пептида. Последовательности включают в себя пропептид, за которым следует либо D'-D3-, либо D'-A1-, либо D'-A3-домен, каждый из которых, в свою очередь, слит ковалентно в шарнирной области константного района IgG1; и (C) Пропептид, ассоциированный со слияниями укороченный полипептид vWF-Fc (т.е., D'-D3-Fc, D'-A1-Fc или D'A3-Fc), стимулирует увеличенное связывание FVIII и мультимеризацию, точно так, как это происходит в процессинге зрелого vWF.
Фигура 3 показывает схематическое представление процессинга, созревания и мультимеризации слияния укороченный vWF-домен-Fc первичного продукта трансляции. (A) Представление пропептида и слияния укороченный vWF-домен-Fc после отщепления сигнального пептида. В этом представлении, эти полипептиды получены из единственного первичного продукта трансляции, изображенного, например, на фигуре 1; (B) Представление, показывающее пропептид и мономер слияния vWF-домен-Fc после процессинга первичного продукта трансляции и ассоциации пропептида с полипептидом укороченный vWF-домен-Fc для стимуляции правильной укладки (фолдинга), и (C) Остатки цистеина, содержащиеся в шарнирной области Fc IgG1, обеспечивают внутримолекулярное образование мостика для содействия созданию функционального димера vWF-Fc, который также связывает FVIII, способом, сходным со способом, обнаруживаемым в полученным из плазмы vWF; пропептиды vWF, в свою очередь, стимулируют мультимеризацию этих слитых полипептидов.
Фигура 4 показывает схематическое представление процессинга, созревания и мультимеризации vWF-Fc двух первичных продуктов трансляции из независимых кодирующих районов. (А) Представление отдельных и независимых первичных продуктов трансляции пропептида и слитых полипептидов укороченный vWF-домен-Fc после отщепления сигнального пептида; не требуется фурин-подобный процессинг, как в нормальном процессинге vWF. В этом представлении, полипептиды получают из двух независимых промоторных кассет, транскрибируемых либо из одного экспрессирующего вектора, либо из двух экспрессирующих векторов, коэкспрессируемых в одной и той же клетке, первый способ экспрессии изображен, например, на фигуре 6; (B) Представление, показывающее слитый мономер vWF-домен-Fc после процессинга первичного продукта трансляции и ассоциации коэкспрессируемого пропептида с полипептидом укороченный vWF-домен-Fc для стимуляции правильной укладки; и (C) Остатки цистеина, содержащиеся в шарнирной области Fc IgG1, обеспечивают внутримолекулярное образование мостика для содействия созданию функционального димера vWF-Fc, который также связывает FVIII, способом, сходным со способом, обнаруживаемым в полученном из плазмы vWF; пропептиды vWF, в свою очередь, стимулируют мультимеризацию этих слитых полипептидов.
Фигура 5 является схематической иллюстрацией, в некоторых вариантах осуществления, трансфекции плазмидных экспрессирующих векторов в клетки млекопитающих, которые экспрессируют полипептиды зрелого vWF или слитые полипептиды укороченный vWF-домен-Fc. (A) Экспрессирующая плазмида с кодирующей последовательностью для vWF или слитых белков укороченный vWF-домен-Fc, каждый из которых содержит домены последовательностей сигнального пептида и пропептида в виде части первичного продукта трансляции. (B) Представление плазмид, трансфицированных и поглощенных в клетки млекопитающих при отборе для создания стабильно экспрессирующей клеточной линии; (C) Экспрессирующая плазмида с кодирующей кассетой для Фактора VIII, использующая другой селектируемый маркер (неомицин), чем в (А); и (D) Представление плазмид FVIII (C) и vWF или vWF-Fc (D), ко-трансфицированных и поглощенных в клетки млекопитающих при отборе для создания стабильно экспрессирующей клеточной линии, которая экспрессирует FVIII и vWF-Fc (или vWF).
Фигура 6 является схематической иллюстрацией, в других вариантах осуществления, трансфекции плазмидных экспрессирующих векторов в клетки млекопитающих, которые экспрессируют полипептиды зрелого vWF или слитых полипептидов укороченный vWF-домен-Fc от независимых промоторов либо на одних и тех же, либо на различных плазмидных векторах. (A) Экспрессирующая плазмида с кодирующими последовательностями для vWF или слитых белков укороченный vWF-домен-Fc, которые не экспрессируют домен пропептида в виде части их первичного продукта трансляции, и экспрессирующая плазмида для домена пропептида vWF (каждая с соответствующими последовательностями сигнального пептида) от независимых промоторов; (B) Представление плазмид полипептидов пропептид-минус vWF или слитых полипептидов vWF-Fc и плазмид полипептида пропептида, трансфицированных и поглощенных в клетки млекопитающих при отборе для создания стабильной клеточной линии, которая коэкспрессирует как vWF, так и белки vWF-Fc, а также полипептид пропептида; (С) Экспрессирующая плазмида с кодирующей кассетой для Фактора VIII, использующая другой селектируемый маркер (неомицин), чем в (А); и (D) Представление плазмид FVIII (C) и vWF или vWF-Fc (D), ко-трансфицированных и поглощенных в клетки млекопитающих при отборе для создания стабильно экспрессирующей клеточной линии, которая экспрессирует FVIII, и либо vWF-Fc, либо vWF, и, независимо, пропептид vWF.
Фигура 7 показывает окрашенные Кумасси белки экспрессированных белков, подвергнутых электрофорезу на 4-12% Бис-Трис-ПААГ гелях при восстанавливающих и денатурирующих условиях, либо непосредственно из культуральных супернатантов (А), либо из Белок G-иммунопреципитаций (В) этих белков, присутствующих в культуральных супернатантах из (А). Клетки PER.C6, трансфицированные плазмидами, содержащими конструкт укороченный vWF-Fc, отбирали на стабильные культуры в виде пула с использованием отбора с применением антибиотиков. Для непосредственных проб супернатантов, 20 микролитров наносили на гель. Для иммунопреципитации, 20 микролитров гранул Белка G добавляли либо к 1 мл среды с D'-D3-Fc, либо к 0,2 мл среды с D'-Al-Fc или D'-A3-Fc. Дорожки на обоих гелях представляют: Дорожка 1: Стандарт молекулярных масс; Дорожка 2: D'-D3-Fc; Дорожка 3: pro-D'-D3-Fc; Дорожка 4: D'-A1-Fc; Дорожка 5: pro-D'-Al-Fc; Дорожка 6: D'-A3-Fc; Дорожка 7: pro-D'-A3-Fc; и Дорожка 8: кондиционированная среда нетрансфицированных PER.C6 в качестве контроля. Полосы более высоких молекулярных масс в дорожках 3, 5 и 8 представляют непроцессированный пропептид, все еще присоединенный к соответствующим доменам vWF.
Фигура 8 является диаграммой в виде столбцов, показывающей извлеченную активность FVIII с использованием слитых белков vWF-Fc или полученный из плазмы белок vWF. Заштрихованный столбец показывает увеличенное извлечение выше контроля (т.e., BDD-FVIII без добавленных белков vWF). Супернатанты клеток, содержащие экспрессируемые, слитые белки укороченный vWF-Fc или полноразмерный vWF смешивали с клетками BDD-078, экспрессирующими рекомбинантный FVIII. После двух дней, пробы анализировали на экспрессию FVIII с использованием хромогенного анализа FVIII.
На Фигуре 9 показан гель, показывающий мультимеризацию слитых белков pro-vWF-Fc в сравнении с нормальными полученными из плазмы мультимерами vWF. Полученный из плазмы фактор VIII (Koate-DVI®) подвергался электрофорезу в качестве стандарта для мультимеризации на денатурирующих, а не на восстанавливающих, 1,6% (дорожка 1) и 2% HGT(P) (дорожка 2) агарозных гелях, тогда как пробы белков pro-D'-D3-Fc (дорожка 3), pro-D'-Al-Fc (дорожка 4) и pro-D'-A3-Fc (дорожка 5) подвергались электрофорезу на 1,6% гелях для визуализации различий в размерах “лэддера”. Скобки идентифицируют положение триплетов vWF-димеров в дорожке 1 и соответствующее положение в дорожке 2. Как и ожидалось, увеличивающийся размер полипептидной цепи pro-vWF-Fc приводит к созданию мультимерных полос увеличивающейся молекулярной массы, в порядке: pro-D'-D3-Fc < pro-D'-A1-Fc < pro-D'-A3-Fc.
Фигура 10 показывает очистку FVIII из супернатантов, содержащих комплексы pro-D'A3-Fc/FVIII: (A) Хроматографическое отслеживание пиков, элюированных во время различных буферных условий; и (B) Кумасси-окрашенный 7,5% гель электрофореза в ПААГ с пробами, взятыми из колоночного отслеживания, представленного в (А), показывает специфическую элюцию FVIII из комплексов pro-D'A3-Fc/FVIII в дорожке 4. Дорожки 1-9 представляют, соответственно, (1) исходный материал, (2) проходящий поток, (3) 0,1 M CaCl2-элюат, (4) 0,3M CaCl2-элюат, (5) pH 5,5 цитрат-элюат, (6) концентрированный препарат BDD-FVIII, (7) маркеры молекулярных масс (размеры на правой стороне), (8) клеточный супернатант из экспрессирующих pro-D'-A3-Fc клеток PER.C6, (9) коммерческий BDD-FVIII (Xyntha®), причем звездочки показывают три полосы приблизительно 170, 90 и 80 кД, соответствующие полноразмерному BDD-FVIII, тяжелой цепи и легкой цепи, соответственно.
Фигура 11 показывает очистку FVIII из супернатантов, содержащих коммерческий рекомбинантный FVIII с делетированным В-доменом (Xyntha), с супернатантом, содержащим белок pro-D'D3-Fc. После элюции из гелей различными буферными композициями эти фракции анализировали электрофорезом на 7%-ных восстанавливающих/денатурирующих полиакриламидных гелях (NuPAGE) и окрашивали Кумасси бриллиантовым синим. Дорожка 7 показывает по существу чистый FVIII, извлеченный после элюции из комплексов pro-D'-D3-Fc/FVIII, связанный с Белком А. Дорожки 1-9 представляют, соответственно, (1) маркеры молекулярных масс полипептидов с молекулярными массами, перечисленными слева, (2) клеточный супернатант pro-D'-D3-Fc, (3) коммерческий FVIII с делетированным B-доменом (Xyntha®), (4) Xyntha®, смешанный с супернатантом pro-D'-D3, (5) супернатант (pro-D'D3-Fc + Xyntha®), загруженный на колонку белок А, (6) проходящий через колонку промывочный поток с 20 мМ Tris-HCl, pH 7,0, (7) 0,3 M CaCl2-элюат и (8) промывку глицином с pH 3,9, которая разделяет эту колонку на дополнительные Белок А-связывающие белки. Три звездочки в дорожке 3 соответствуют полосам белков приблизительно 170, 90 и 80 кД, соответствующим полноразмерному BDD-FVIII, тяжелой цепи и легкой цепи, соответственно.
ПОДРОБНОЕ ОПИСАНИЕ
В одном аспекте данное изобретение обеспечивает полипептид, содержащий первую аминокислотную последовательность, присутствующую в полипептиде vWF, и вторую аминокислотную последовательность, гетерологичную относительно первой, где этот полипептид способен к связыванию FVIII.
В данном контексте термин "способный к связыванию" подразумевает варианты, в которых эта способность полипептида связываться с FVIII осуществляется сборкой белка высокого порядка и/или одной или несколькими посттрансляционными модификациями, такими как, например, отщепление сигнального пептида, отщеплением пропептида, ассоциацией пропептида, фосфорилированием, гликозилированием и т.п. Например, В некоторых вариантах осуществления, этот полипептид является "способным к связыванию" с FVIII в виде димерного, тримерного, четырехмерного или более высокого порядка мультимерного комплекса, который образуется после мультимеризации этого полипептида. Или, например, в других вариантах осуществления, этот полипептид "способен к связыванию" FVIII после мультимеризации этого полипептида после ассоциации пропептида с этим полипептидом. "Мультимеризация" и "олигомеризация" используются здесь взаимозаменяемо и относятся к ассоциации двух или более молекул белков, опосредуемой ковалентными (например, межмолекулярными дисульфидными связями) и/или нековалентными взаимодействиями. Таким образом, термины "мультимер (мультимеры)" и "олигомер (олигомеры)" также используются здесь взаимозаменяемо.
Данное изобретение рассматривает полипептиды vWF и FVIII человека и не человека (происходящие, например, из приматов, собак, кошек, лошадей, свиней, мышей, крыс, морских свинок, кроликов, коров, других позвоночных), включающие в себя природные, синтетические и рекомбинантные белки. В объеме данного изобретения находятся также полипептиды vWF и FVIII, соответствующие белкам дикого типа, или их мутанты, варианты и/или их укороченные (процессированные) формы. Например, в некоторых вариантах осуществления, первая аминокислотная последовательность соответствует фрагменту полипептида vWF из человека, причем гетерологичная вторая аминокислотная последовательность содержит последовательность или состоит из последовательности, не присутствующей в каком-либо белке vWF, человека, или наоборот. FVIII и/или vWF включают в себя природные белки, а также их производные, например, белки, мутированные делецией, заменой или инсерцией, или химическое производное или его фрагмент.
I. Первая аминокислотная последовательность
В одном варианте осуществления, первая аминокислотная последовательность определяет структуру или домен, которые взаимодействуют с моноклональным анти-vWF-антителом, способным специфически связываться с районом полипептида VWF, содержащим домен связывания FVIII. В одном варианте осуществления, этим моноклональным антителом является моноклональное антитело С3, описанное, например, в статьях Foster et al, JBC, 262:8443 (1987) и Fulcher et al, J. Clin. Invest, 76:117 (1985), каждая из которых включена здесь посредством ссылки на их описания моноклонального антитела С3 и способа получения моноклональных антител, в частности, моноклонального антитела С3.
Не ограничивающие примеры аминокислотных последовательностей vWF и последовательностей нуклеиновых кислот, кодирующих vWF или его часть, описаны например, под номерами доступа GenBank: NP_000543, NM_000552, AAE20723, AAB59512, P04275, EAW88815, ACP57027, EAW88816 и AAD04919; U.S Patent No. 5,260,274; Titani et al, Biochemistry, 25:3171-84 (1986); и Sadler et al, PNAS, 82:6391-6398 (1985), каждые из которых включены здесь посредством ссылки на их описания аминокислотных последовательностей и последовательностей нуклеиновых кислот, соответствующих vWF.
Специалистам с обычной квалификацией в данной области известно, что прототипическим preprop-vWF является полипептид из 2813 аминокислот с сигнальным пептидом из 22 аминокислот и повторяющимися функциональными доменами, A, B, C, D и CK, которые распределены от амино-конца в порядке "D1", "D2", "D'", "D3", "A1", "A2", "A3", "D4", "B1", "B2", "B3” (последние три вместе считаются "B"), "C1", "C2" и "CK". Субъединица "зрелого" vWF состоит, от N-конца к C-концу в этом порядке, из доменов: D'-D3-A1-A2-A3-D4-B1-B2-B3-C1-C2-CK.
Аминокислотная последовательность примерного полноразмерного vWF человека показана посредством SEQ ID NO:29, которая кодируется нуклеотидами 251-8689 SEQ ID NO:30. Со ссылкой на SEQ ID NO:29, часть "сигнального пептида" простирается от положения 1 аминокислот по Cys-22, включительно, часть "пропептида" (D1-D2) простирается от положения 23 аминокислот по Arg-763, включительно, и "зрелый" белок vWF простирается от положения 764 по 2813, включительно. Индивидуальные домены были также приближенно картированы, как D': 764-865; D3: 866-1242; A1: 1260-1479; A2: 1480-1672; A3: 1673-1874; D4: 1947-2298; B: 2296-2399; C1: 2400-2516; C2: 2544-2663 и CK: 2720-2813. Одна альтернативная система картирования и обозначения доменов vWF была использована конвенцией Базы данных белков EXPASY (worldwideweb.uniprot.org/uniprot/P04275) в виде D1: 34-240; D2: 387-598; D': 776-827; D3: 866-1074; A1: 1277-1453; A2: 1498-1665; A3: 1691-1871; D4: 1949-2153; B: 2255-2328 (который называемый C1 в EXPASY); C1: 2429-2495 (называемый C2 в EXPASY); C2: 2580-2645 (называемый C3 в EXPASY); и CK: 2724-2812.
Не ограничивающие примеры аминокислотной последовательности и последовательности нуклеиновых кислот FVIII описаны, например, номерами доступа GenBank 1012296A AAA52420.1, CAA25619.1, AAA52484.1, 1012298A, EAW72647.1, EAW72646.1, XP_001498954.1, ACK44290.1, AC095359.1, NP_001138980.1, ABZ10503.1, NP_032003.2, Патент США с номером 6,307,032, и Wood et al, Nature, 312:330-7 (1984), каждые из которых включены здесь посредством ссылки на их описания последовательностей FVIII. Варианты, производные, модификации и комплексы FVIII также известны в данной области и охватываются данным изобретением. Например, варианты Фактора FVIII, описанные в Патенте США № 5668108, описывают варианты FVIII, посредством которых аспарагиновая кислота в положении 1241 заменена глутаминовой кислотой с сопутствующими изменениями также нуклеиновых кислот; Патент США № 5149637 описывает варианты FVIII, содержащие С-концевую часть, либо гликозилированную, либо негликозилированную; и Патент США 5661008 описывает вариант FVIII, содержащий аминокислоты 1-740, связанные с аминокислотами 1649-2332 по меньшей мере 3 аминокислотными остатками, которые включены здесь посредством ссылки на описания каждой из этих вариантных последовательностей FVIII.
В одном варианте осуществления, FVIII является происходящим из плазмы или сыворотки FVIII. В другом варианте осуществления, этот FVIII является рекомбинантным FVIII, например, активным FVIII человека, экспрессируемым в культивируемых клетках млекопитающих из рекомбинантных ДНК-клонов. Экспрессионные системы для получения Фактора FVIII известны в данной области и включают в себя прокариотические и эукариотические клетки, как описано Патентами США с номерами 5633150, 5804420 и 5422250, каждый из которых включен здесь посредством ссылки на описание получения FVIII.
Специалисту с обычной квалификацией в данной области известно, что способность полипептида связывать FVIII может быть определена различными способами. В частности, полипептид данного изобретения может анализироваться на его способность связывать FVIII с использованием способов, описанных здесь, и/или адаптацией способов, известных в данной области. Например, для анализа/определения связывания могут быть использованы иммуноанализы, включающие в себя, но не ограничивающиеся ими, конкурентные и неконкурентные системы анализа, использующие такие способы, как вестерн-блоты, радиоиммуноанализы, ELISA (твердофазный иммуноферментный анализ), "сэндвич"-иммуноанализы, анализы иммунопреципитации, преципитиновые реакции, гель-диффузионные преципитиновые реакции, иммунодиффузионные анализы, анализы агглютинации, анализы фиксации комплемента, иммунорадиометрические анализы, флуоресцентные иммуноанализы и т.д. (см., например, руководство Ausubel et al, eds, 1994, Current Protocols in Molecular Biology, Vol. 1, John Wiley & Sons, Inc., New York, которое включено здесь посредством ссылки в его полном объеме).
Например, полипептид, содержащий первую и вторую аминокислотные последовательности, может быть контактирован с FVIII в подходящем буфере, таком как TBS, в присутствии моноклонального антитела, связанного с Сефарозой. Это антитело может быть направлено против района этого полипептида, так что связывание этого антитела с полипептидом не мешает связыванию этого полипептида с FVIII (например, это антитело может быть направлено против второй аминокислотной последовательности или против повторяющегося района "A1" или "A2" или "A3" vWF, где такой район также присутствует на этом полипептиде. После контакта, FVIII, связанный с этим полипептидом/антителом, и несвязанный FVIII могут быть разделены, например, центрифугированием, и FVIII может быть измерен, например, с использованием анализа с хромогенным субстратом (Factor VIII Coatest; Chromogenix, Molndal, Sweden).
В предпочтительных вариантах осуществления, первой аминокислотной последовательностью является укороченный полипептид vWF. Например, укороченные формы vWF, в некоторых вариантах осуществления, включают в себя (i) укороченные полипептиды vWF, которые лишены последовательности "пропептида"; и (ii) укороченные полипептиды vWF, которые лишены "A1", "A2", "A3", "D4", "B" (также известные как "B1", "B2" и "B3"), "C1", "C2" и/или "CK" домена зрелой последовательности. Встречаются также и другие укороченные или иным образом модифицированные формы vWF.
В одном варианте осуществления, первая аминокислотная последовательность является такой как последовательность, представленная в SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:33, SEQ ID NO:34 или SEQ ID NO:35.
II. Вторая аминокислотная последовательность
В других вариантах осуществления, вторая аминокислотная последовательность этого полипептида обеспечивает структуру или домен, имеющие аффинность в отношении партнера связывания.
Эта вторая аминокислотная последовательность является гетерологичной относительно первой. В одном варианте осуществления, эта гетерологичная вторая аминокислотная последовательность содержит последовательность или состоит из последовательности, которая не присутствует ни в каком белке vWF. В одном варианте осуществления, по меньшей мере часть (например, смежная часть) гетерологичной второй аминокислотной последовательности соответствует последовательности, не присутствующей ни в каком полипептиде vWF.
Предпочтительно, в некоторых вариантах осуществления, эта вторая аминокислотная последовательность соответствует Fc-полипептиду антитела, такому как, например, Fc-район IgG1 человека. Например, вторая аминокислотная последовательность может соответствовать аминокислотным остаткам, которые простираются от N-концевой шарнирной области до природного С-конца, т.е. является по существу Fc-районом полноразмерного антитела. Могут быть также использованы фрагменты Fc-районов, например, Fc-районов, которые были усечены на С-концевой стороне. В некоторых вариантах осуществления, эти фрагменты предпочтительно содержат один или несколько остатков цистеина (по меньшей мере остатки цистеина в шарнирной области) для получения возможности образования межцепочечных дисульфидных связей между частями Fc-полипептидов двух отдельных полипептидов данного изобретения, с образованием димеров.
Другие Fc-районы антитела могут заменять Fc-район IgG1 человека. Например, другими подходящими Fc-районами являются Fc-районы, которые могут связываться с аффинностью с белком А или белком G или другими подобными Fc-связывающими матриксами и включают в себя Fc-районы мышиных IgG, IgA, IgE, IgD, IgM или фрагменты Fc-района IgG, IgA, IgE, IgD, IgM человека, например, фрагменты, содержащие по меньшей мере шарнирную область, так что будут образовываться межцепочечные дисульфидные связи.
Fc-район IgG1 описан, например, номером доступа Х70421 GenBank, который включен здесь посредством ссылки в его полном объеме.
В одном варианте осуществления эта вторая аминокислотная последовательность содержит последовательность, представленную в SEQ ID NO:16.
В некоторых вариантах осуществления вторая аминокислотная последовательность предпочтительно является С-концом для первой аминокислотной последовательности. Получение слитых полипептидов, содержащих гетерологичную аминокислотную последовательность, слитую с различными частями другой аминокислотной последовательности, описано, например, в статьях Ashkenazi et al, PNAS, 88:10535 (1991) и Byrn et al, Nature 344:677 (1990), каждая из которых включена здесь посредством ссылки в ее полном объеме. Например, слияние генов, кодирующее полипептид, содержащий первую и вторую аминокислотные последовательности, может быть инсертировано в подходящий экспрессирующий вектор. Экспрессированные слитые белки могут быть собраны, посредством чего межцепочечные дисульфидные связи могут образовываться между этими полипептидами с образованием димеров. В других вариантах осуществления, эти слитые полимеры данного изобретения могут быть экспрессированы со спейсерными связывающими аминокислоты группами или без спейсерных связывающих аминокислоты групп. Например, в некоторых вариантах осуществления, полипептиды данного изобретения могут дополнительно содержать линкер между первой и второй аминокислотными последовательностями, причем этот линкер содержит один или несколько аминокислотных остатков, разделяющих первую и вторую последовательности.
В другом варианте осуществления полипептид данного изобретения содержит аминокислотную последовательность, представленную в SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:36, SEQ ID NO:38 или SEQ ID NO:39.
В одном варианте осуществления этот полипептид кодируется молекулой нуклеиновой кислоты, имеющей нуклеотидную последовательность, представленную в SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:37, SEQ ID NO:42 или SEQ ID NO:43.
Варианты описанных здесь последовательностей также находятся в объеме данного изобретения. Вариантом полипептида может называться аминокислотная последовательность, которая изменена одной или несколькими аминокислотами. Этот вариант может иметь "консервативные" изменения, в которых замененная аминокислота имеет сходные структурные или химические свойства, например, замену лейцина изолейцином. Альтернативно, вариант может иметь "не-консервативные" изменения, например, замену глицина триптофаном. Аналогичная минорная вариация может также включать в себя делецию или инсерцию аминокислоты или и то, и другое. Конкретной формой "вариантного" полипептида является "функционально эквивалентный" полипептид, т.е. полипептид, который проявляет по существу сходную активность in vivo или in vitro и/или сходное связывание, что и полипептид этого изобретения. Руководство в определении, какие аминокислотные остатки могут быть заменены, инсертированы или делетированы без элиминации биологической или иммунологической активности, может быть найдено с использованием компьютерных программ, хорошо известных в данной области, например, в программе DNASTAR (DNASTAR, Inc., Madison, WI). Дополнительно, конкретное руководство обеспечено ниже, в том числе руководство, обеспеченное в цитируемых ссылках, которые включены здесь посредством ссылки.
В других вариантах осуществления конкретные положения названных остатков могут несколько варьироваться, все еще при присутствии их в полипептиде в структурно и функционально аналогичных положениях (см. Chang, Y., et al, Biochemistry 57:3258-3271 (1998).
Кроме того, конкретные варианты этого изобретения могут характеризоваться функционально в отношении полипептида vWF, или его фрагмента, по FVIII-связывающей способности. В некоторых вариантах осуществления, полипептид этого изобретения проявляет способность связывания в отношении FVIII, которая является меньшей, приблизительно равной или большей, чем способность связывания ссылочного белка vWF (например, эндогенного vWF дикого типа) или его фрагмента, который способен связываться с белком FVIII (например, эндогенным FVIII дикого типа).
Таким образом, это изобретение включает в себя такие вариации полипептидов, описанных здесь. Такие варианты включают в себя делеции, инсерции, инверсии, повторы и замены. Дополнительное руководство в отношении того, какие аминокислотные изменения являются, вероятно, молчащими, может быть найдено в Bowie, J. U., et al, "Deciphering the Message in Protein Sequences: Tolerance to Amino Acid Substitutions", Science 247:1306-1310 (1990).
Таким образом, фрагменты, производные или аналоги полипептидов данного изобретения включают в себя фрагменты, производные или аналоги, имеющие последовательности, которые имеют, в сравнении с полипептидами данного изобретения, (i) один или несколько из аминокислотных остатков (например, 1, 3, 5, 8, 10, 15 или 20 остатков), замененных консервативным или неконсервативным аминокислотным остатком (предпочтительно консервативным аминокислотным остатком). Такие замененные аминокислотные остатки могут быть кодированы или могут не быть кодированы генетическим кодом; или (ii) один или несколько из аминокислотных остатков (например, 1, 3, 5, 8, 10, 15 или 20 остатков) включают в себя группу-заместитель. В других вариантах осуществления фрагменты, производные или аналоги полипептида данного изобретения включают в себя полипептид данного изобретения, который связан с другим соединением, таким как соединение для увеличения времени полужизни этого полипептида (например, полиэтиленгликоль), или таким соединением, в котором дополнительные аминокислоты слиты с этим полипептидом. Предполагается, что такие фрагменты, производные и аналоги находятся в рамках квалификации специалистов в данной области на основе описанного здесь.
Как указано, изменения предпочтительно являются незначительными, например, включают в себя консервативные аминокислотные замены, которые не влияют значимо на укладку или способность связывания FVIII. Конечно, количество аминокислотных замен, которое может производить специалист в данной области, зависит от многих факторов, в том числе описанных выше факторов. В некоторых вариантах осуществления количество замен для любого конкретного полипептида будет не более чем 50, 40, 30, 25, 20, 15, 10, 5, 3, 2 или 1.
Аминокислотные остатки (полипептидов данного изобретения), которые являются существенными для связывания с FVIII, могут быть идентифицированы способами, известными в данной области, такими как сайт-направленный мутагенез или аланин-сканирующий мутагенез (Cunningham and Wells, Science 244:1081-1085 (1989)). Последняя процедура вводит одиночные аланиновые мутации при каждом остатке в молекуле. Затем полученные мутантные молекулы тестируют на связывание с FVIII, например, как описано здесь. Сайты, которые являются критическими для связывания с FVIII, могут быть также определены структурным анализом, таким как кристаллизация, ядерный магнитный резонанс или фотоаффинное мечение (Smith, et al., J. Mol. Biol. 224:399-904 (1992) и de Vos, et al. Science 255:306-312 (1992)).
В одном варианте осуществления этот рекомбинантный полипептид имеет аминокислотные последовательности, которые являются по меньшей мере на 70%, 80%, 90%, 95%, 98% или более идентичными любой из аминокислотных последовательностей, представленных здесь.
В другом варианте осуществления первая аминокислотная последовательность присутствует в полипептиде vWF, содержащем аминокислотную последовательность, представленную в SEQ ID NO:29, или ее вариант или фрагмент.
В других вариантах осуществления первая аминокислотная последовательность присутствует в полипептиде vWF, кодируемом последовательностью нуклеиновой кислоты, представленной в SEQ ID NO:30 или ее варианте или фрагменте.
В других аспектах данное изобретение обеспечивает рекомбинантный слитый белок vWF-Fc, в котором vWF-часть этого слитого белка является укороченным vWF, который лишен по меньшей мере одного домена зрелого полноразмерного полипептида vWF, причем этот слитый белок способен образовывать мультимеры, которые способны связывать белок FVIII. В одном варианте осуществления, этот укороченный vWF имеет домены D' и D3, при условии, что этот укороченный vWF лишен домена A1, A2, A3, D4, B1, B2, B3, C1, C2, CK или их комбинации. В другом варианте осуществления, этот укороченный vWF имеет домены D', D3 и A1, при условии, что этот укороченный vWF лишен доменов A2, A3, D4, B1, B2, B3, C1, C2 и CK. В некоторых вариантах осуществления, этот укороченный vWF имеет домены D', D3 и A1 и A2, при условии, что этот укороченный vWF лишен доменов A3, D4, B1, B2, B3, C1, C2 и CK. В других вариантах осуществления, этот ук