Тест-система для обнаружения экспрессии генов nat2 у человека
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, а именно к тест-системе для обнаружения экспрессии гена NAT2 у человека. Данная тест-система включает смесь праймеров, комплементарных концам разных цепей требуемого фрагмента ДНК-матрицы для ПЦР, эндонуклеазу рестрикции с буфером и технологическую смесь для ПЦР с Taq-полимеразой. В качестве смеси праймеров она содержит пару дезоксиолигонуклеотидов, обладающих активностью прямого и обратного праймеров в реакции обратной транскрипции и полимеразной цепной реакции со следующей структурой: Nat2(F) MR1ACCWAAYCAGCCAGR1AAGC и Nat2(R) AGMCCSACCAWACAGYAMACC, где F и R - прямой и обратный праймеры соответственно и A, G, С, R1, W, М, S и Y - кодовые обозначения нуклеотидов. Предложенное изобретение позволяет с высокой достоверностью обнаруживать экспрессию гена NAT2 у человека. 6 ил., 3 табл., 2 пр.
Реферат
Изобретение относится к области биотехнологии и генной инженерии, а точнее к фармакогенетике, в частности к технике определения экспрессии специфических генов, в данном случае гена, кодирующего изофермент N-ацетилтрансферазу II (NAT2), и может быть использовано для изучения и описания ацеляторного полиморфизма человека.
В настоящее время внимание исследователей направлено на изучение системы генов NAT, кодирующих целый комплекс ферментов II фазы детоксикации - ацетилирование ароматических и гетероциклических аминов фармакологической или токсической природы (ксенобиотиков, в том числе лекарств - сульфаниламидов, изониазида, кофеина и др.). Наиболее важными из указанного комплекса являются два основных изофермента - N-ацетилтрансфераза 1 (NAT1) и N-ацетилтрансфераза 2 (NAT2). NAT1 ацетилирует небольшое количество ариламинов и не обладает широким генетическим полиморфизмом, a NAT2 является основным ферментом ацетилирования многих лекарственных средств и генетически полиморфен. Поскольку абсолютное количество субстратов NAT является ксенобиотиками, многие из которых используются в качестве лекарственных средств, естественен интерес исследователей к изучению полиморфизма генов NAT2 и связи этого полиморфизма с функцией ацетилирования у биологических объектов (в данном случае человека), в том числе и к изучению механизмов сегрегации индивидуумов в медленные, средние или быстрые ацетиляторные генотипы.
Известны тест-системы для определения экспрессии генов, включающие смеси праймеров для ПЦР, эндонуклеазу рестрикции с буфером и технологические смеси для ПЦР с Taq-полимеразой [2-5].
Одним из основных недостатков вышеуказанных тест-систем является низкий уровень контроля за процессом обнаружения экспрессии или его отсутствие. Кроме того, обычно в данных технических решениях используют либо двухшаговую ПЦР, либо ассиметричную мультипраймерную ПЦР, которая достаточно затратна и, что основное, используют праймеры, необязательно оптимальные по структуре и последовательности нуклеотидов.
Наиболее близким к заявляемому техническому решению по своей сущности и достигаемому результату является тест-система обнаружения экспрессии гена NAT2, включающая смесь праймеров для ПЦР, эндонуклеазу рестрикции с буфером и технологическую смесь для ПЦР с Taq-полимеразой [6].
Основными недостатками указанной тест-системы являются невысокая степень аппроксимирования последовательностей в воспроизводимых праймерах, что сказывается на эффективности обнаружения экспрессии, а также недостаточная оптимизация условий проведения реакции, не позволяющая добиться эффективной ПЦР.
Техническая результатом, на создание которого направлено заявляемое техническое решение, является создание тест-системы для определения экспрессии гена NAT2, обеспечивающей существенное повышение уровня достоверности и воспроизводимости получаемых результатов за счет использования воспроизведенных праймеров - максимально приближенных к структуре и с высокой степенью достоверности дублирующих последовательность олигонуклеотидов искомого участка гена, кодирующих экспрессию кофермента NAT2 при одновременном снижении затратности скрининга наличия и интенсивности экспрессии исследуемого гена.
Поставленный технический результат достигается тем, что тест-система для обнаружения экспрессии гена NAT2 у человека, включающая смесь праймеров, комплементарных концам разных цепей требуемого фрагмента ДНК-матрицы для ПЦР, эндонуклеазу рестрикции с буфером и технологическую смесь для ПЦР с Taq-полимеразой, в качестве праймеров содержит пару дезоксиолигонуклеотидов, обладающих активностью прямого и обратного праймеров в реакции обратной транскрипции и полимеразной цепной реакции со следующей структурой: и , с размером 277 пар нуклеотидов, где F и R - прямой и обратный праймеры соответственно и A, G, С, R1, W, М, S и Y - кодовые обозначения нуклеотидов.
Попутной задачей заявляемого технического решения является создание праймеров, максимально идентифицирующих экспрессию гена NAT2 во всей совокупности аллельного полиморфизма указанного гена. При этом следует понимать, что тест-система на основе синтезированной пары праймеров требует или, точнее, вовлекает «свои» параметры как по составу вспомогательных компонентов, так и по технологическим параметрам проведения ПЦР (время, температура отжига и т.д.), продиктованные составом, последовательностью и молекулярной массой праймера.
Решение задачи воспроизведения праймеров, отвечающих поставленной задаче, проиллюстрировано на Фиг. 1, где 1 - выбранная область гена, «отвечающая» за производство NAT2, а 2, 3, 4 … и «n» - выбранные для воспроизведения праймеров участки гена, при этом молекулярная масса праймеров соответствует длине выбранных участков.
При воспроизведении праймеров последовательности могут быть идентифицированы, например, с использованием программы Oligo-TM Primer Analysis (National Biosciences, Hamel, Mn.), при этом следует иметь в виду, что в случае неверного выбора длины и нуклеотидного состава праймера (или температуры отжига) возможно образование частично комплементарных комплексов с другими участками матричной ДНК, что может привести к появлению неспецифических продуктов.
Праймеры могут быть синтезированы, например, с использованием ДНК-синтезатора Applied Biosystems Model 391 PCR-Mate.
Амплификация может быть проведена, например, с помощью амплификатора «Терцик» («ДНК-технология», Россия).
Количественное определение экспрессии может быть осуществлено анализом real time, например, с помощью прибора Real-Time CFX-96 (США, Bio-rad).
В качестве компонентов реакционных смесей при проведении амплификации могут быть использованы соответствующие химические соединения, в частности Трис-HCl, (NH4)2SO4, MgCl2, dNTPs (смесь нуклеозидтрифосфатов), и Taq-полимераза, и при этом процесс амплификации должен проводиться в условиях (при параметрах), обеспечивающих оптимальное протекание с максимальным выходом.
Принятые сокращения: РНК - рибонуклеиновая кислота, ДНК - дезоксирибонуклеиновая кислота, ОТ-ПЦР - ПЦР с использованием обратной транскрипции - синтез кДНК на матрице РНК; осуществляется ферментом РНК-зависимой ДНК-полимеразой (обратной транскриптазой, ревертазой), мРНК - матричная рибонуклеиновая кислота, Taq-полимераза - термостабильная ДНК-зависимая-ДНК-полимераза.
Техника реализации заявляемого технического решения включает и содержит следующие аналитические и технологические приемы:
Первоначально отбирают и анализируют последовательности праймеров для мишеней. Исследование будущей структуры олигонуклеотидных праймеров для ПЦР проводят на отсутствие внутренней вторичной структуры - само- и взаимнокомплиментарности, комплиментарности между 3′-концами (праймер-димеров, шпилек).
Для подбора и исследования оптимальных концентраций компонентов тест-системы, учитывая их стоковые концентрации и параметры синтезированных олигонуклеотидных праймеров, проводят компоновку вариантов реакционных смесей ПЦР с термостабильной Taq-полимеразой. Исследование концентраций реакционных смесей позволяет установить оптимальный вариант - в нашем случае концентрация фермента составляет 1,5 ед. на пробу. Такая концентрация лежит в диапазоне 0,5-5,0 ед., что не приводит к уменьшению специфичности реакции; концентрация праймеров составляет от 10 до 15 пМ, что уменьшает вероятность возникновения неспецифического отжига праймеров и накопления неспецифического продукта. Далее определяют рабочую концентрацию свободных ионов Mg2+ и устанавливают ее на уровне 2,5 mM, поскольку при данной концентрации не происходит значительного ингибирования фермента полимеразы (на 40-50%) и не наблюдается неспецифических продуктов амплификации, концентрацию каждого dNTP устанавливают в пределах 80 µМ. Уменьшение концентрации dNTP до такого предела допустимо, т.к. при этом сохраняются свободные ионы Mg2+, поддерживающие активность фермента полимеразы на должном уровне, что, в свою очередь, не приводит к снижению отжига олигонуклеотидных праймеров и, как следствие, уменьшению выхода специфического продукта.
Температуры отжига олигонуклеотидных праймеров и зондов и продолжительность этапов денатурации отжига и элонгации рассчитывают согласно соотношению оснований G/C и А/Т их нуклеотидной последовательности, а также размера амплифицируемых фрагментов.
Для молекулярно-генетического исследования экспрессии гена NAT2 на уровне мРНК выделяют тотальную РНК из образцов материала человека. Полученную тотальную РНК подвергают реакции обратной транскрипции для получения кДНК, применяемой в дальнейшей реакции ПЦР со специфическими праймерами.
Специфичность ПЦР оценивают по соответствию размера продуктов амплификации с размером, определенным паре праймеров гена NAT2 конкретного объекта исследования.
Материалом исследования служит плазма периферической крови.
Стадию амплификации предваряют (с учетом стоковых концентраций компонентов и параметров синтезированных олигонуклеотидных праймеров) разработкой оптимальных вариантов состава реакционных смесей ПЦР и параметров осуществления ПЦР - продолжительности этапов денатурации, отжига и элонгации и, наконец, определяют эффективность праймеров и всей тест-системы в целом.
Изобретение может быть осуществлено следующим образом.
Первоначально с привлечением данных биоинформационного анализа в электронной базе данных NCBI Gen Bank отбирают наиболее перспективные последовательности праймеров для мишеней и далее с привлечением комплекса компьютерных программ, в частности Vector NTI Advance 9.0 (PC) (http://www.invitrogen.com/site/us/en/home.html), DNASTAR, BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cgi/), конструируют специфичные праймеры к гену NAT2. Затем синтезируют сконструированные праймеры амидофосфитным методом, например на автоматическом синтезаторе ДНК ASM-800 [1]. «Экспрессивные» характеристики праймеров определяют методом горизонтального электрофореза и анализа "in real time".
Пример 1 осуществления изобретения
А. Воспроизведение праймеров.
В электронной базе данных NCBI Gen Bank отбирают последовательности праймеров для мишеней. Исследование будущей структуры олигонуклеотидных праймеров для ПЦР проводят на отсутствие внутренней вторичной структуры (отсутствие само- и взаимнокомплиментарности), отсутствие комплиментарности между 3′-концами (праймер-димеров, шпилек). Далее с привлечением комплекса компьютерных программ Vector NTI Advance 9.0 (PC) (http://www.invitrogen.com/site/us/en/home.html). DNASTAR, BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cgi/) конструируют специфичные праймеры к гену NAT2 у человека. Затем синтезируют сконструированные праймеры амидофосфитным методом на автоматическом синтезаторе ДНК ASM-800.
Структура и последовательность нуклеотидов синтезированных праймеров представлены в Таблице 1.
Где F и R - прямой и обратный праймеры и A, G, С, М, R1, W, S и Y - нуклеотиды (в виде буквенных кодов).
Б. Контрольная амплификация с участием синтезированных праймеров.
Синтезированные праймеры, обозначенные F-R парой, подвергают молекулярно-генетическому исследованию экспрессии гена NAT2 на уровне мРНК, для чего выделяют тотальную РНК из образцов периферийной крови добровольцев. Далее из тотальной РНК получают кДНК путем реакции обратной транскрипции. Указанную кДНК применяют в дальнейшей реакции ПЦР со специфическими праймерами. По истечении амплификации 10 мкл ампликонов смешивают с 6 кратным буфером для загрузки и вносят в 2% агарозный гель (0,5 мкг/мл ЭБР). Размер амплифицируемого продукта определяют с помощью маркера длин фрагментов 1000-50 п.н. в концентрации 0,5 мкг/мкл в буфере для нанесения на гель. Специфичность ПЦР оценивают по соответствию размера продуктов амплификации с размером, определенным паре праймеров гена NAT2 конкретного объекта исследования.
У пациентов-добровольцев (5 чел. разного пола и возраста) забирают периферийную кровь (в количестве 0,5 мл) и экстрагируют РНК из плазмы крови. Экстракцию проводят с помощью комплекта реагентов для экстракции РНК/ДНК из клинического материала «АмплиПрайм РИБО-сорб». Для амплификации готовят соответствующую систему-раствор. Стадию амплификации проводят в 25 мкл смеси: ПЦР Буфер (×10): 700 mM Трис-HCl, pH 8,6 / 25°C, 166 mM (NH4)2SO4, 25 mM MgCl2, 0,2 mM dNTPs, Taq-полимераза, на амплификаторе «Терцик» (ДНК-технология, Россия). Для реакции обратной транскрипции используют комплект реагентов для получения кДНК на матрице РНК "PEBEPTA-L". Концентрацию фермента устанавливают в 1,5 ед. на пробу, праймеров от 10 до 15 пМ, концентрацию свободных ионов Mg2+ 2,5 mM в реакции, (при данной концентрации не происходит ингибирования фермента полимеразы по меньшей мере на 40-50% и не наблюдается неспецифических продуктов амплификации), концентрация каждого dNTP в пределах 80 µМ. Среднюю температуру отжига (согласно соотношению оснований G/C и А/Т их нуклеотидной последовательности для ПЦР) устанавливают в пределах 52°C. Продолжительность этапов денатурации, отжига и элонгации устанавливают в пределах 30 сек, 30 сек и 30 сек соответственно. Параметры амплификации фрагментов гена NAT2 представлены в Таблице 2.
Примечание: последующее хранение при +4°C (в течение не более 3-х час) и далее хранение при -20°C.
По окончании реакции амплификации 10 мкл ампликонов смешивают с 6-кратным буфером для загрузки и вносят в 2% агарозный гель (0,5 мкг/мл ЭБР). Размер амплифицируемого продукта определяют с помощью маркера длин фрагментов 1000-50 п.н. в концентрации 0,5 мкг/мкл в буфере для нанесения на гель. Электрофорез проводят при 50 А, 100 В на 1 см2 в течение 30 минут. Продукты амплификации визуализируют при помощи системы ChemiDoc MP (Bio-Rad, США). Одновременно образцы анализируют в системе "real time" CFX-96 (Bio-Rad, США).
Электрофоретические спектры продуктов амплификации представлены на Фиг. 2, где 1 - маркер; 2 - показатель молекулярной массы амплификата; 3 - маркировка исследуемых образцов, а 4 - индикация «наличия» экспрессии гена соответственно. Электрофоретические спектры продуктов амплификации в сравнении с прототипом (поз. 7 - nat2) представлены на Фиг. 3, (см. стр. 13 описания), где 5 - маркер; 6 - показатель молекулярной массы амплификата; 7 - маркировка исследуемых образцов, а 8 - индикация «наличия» экспрессии гена.
Для упрощения в Таблице 3 представлены объединенные результаты электрофоретического анализа исследованных образцов крови, а также образца по прототипу.
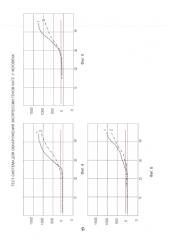
На Фиг. 4-6 представлены спектры анализа экспрессии генов «in real time» для NAT2 образцов крови 2, 3 и 4 с использованием праймеров: 1 - Nat2(R,F) и 2 - по прототипу (по нумерации кривых).
Следует отметить, что, если электрофоретический спектр является качественным показателем - наличие или отсутствие экспрессии, то анализ «in real time» представляет количественные показатели, т.е. эффективность праймеров.
Сопоставление спектров электрофоретического анализа и результатов "real time" показало высокую активность синтезированной пары праймеров по сравнению с прототипом.
Специфичность ПЦР оценивают по соответствию размера продуктов амплификации с размером, определенным паре праймеров генов и NAT2 конкретного добровольца.
В результате проведенных ПЦР неспецифических продуктов реакции не наблюдается, амплификация проходит только с наработкой специфических фрагментов, соответствующих заявленным размерам, что подтверждает высокую видовую специфичность воспроизведенных праймеров к генам NAT2 исследуемых добровольцев.
У каждого добровольца было выявлено наличие специфичных участков гена NAT2.
Пример сравнительный (по прототипу)
Препараты (комплекс реактивов и праймер для обнаружения экспрессии гена NAT2), полученные от разработчика [6], используют как в Примере 1Б. Процесс проводят при параметрах, указанных в инструкции производителя.
Результаты анализа интерпретированы выше (см. Таблицу 3 и Фиг. 4, 5 и 6 - кривая 2).
Из описания, приведенных примеров конкретного осуществления способа и контрольной амплификации с участием разработанной пары праймеров и сравнительного примера по прототипу, видно, что заявляемая тест-система для обнаружения экспрессии гена NAT2 у человека на основе указанных праймеров обладает несомненными преимуществами по сравнению с известными решениями.
Источники информации
1. Патент RU 2354700 С2, МПК C12N 15/11, 2009;
2. Патент RU 2338788 С2, МПК C12N 15/11, 2008;
3. Патент RU 2458141 С1, МПК C12N 15/11, 2012;
4. Патент RU 2509804 С2, МПК C12N 15/11, 2014;
5. Патент RU 2385934 С2, МПК C12N 15/11, 2006;
6. Взято из интернета http://gen.exp.ru/ - прототип.
Тест-система для обнаружения экспрессии гена NAT2 у человека, включающая смесь праймеров, комплементарных концам разных цепей требуемого фрагмента ДНК-матрицы для ПЦР, эндонуклеазу рестрикции с буфером и технологическую смесь для ПЦР с Taq-полимеразой, отличающаяся тем, что в качестве смеси праймеров она содержит пару дезоксиолигонуклеотидов, обладающих активностью прямого и обратного праймеров в реакции обратной транскрипции и полимеразной цепной реакции со следующей структурой: Nat2(F) MR1ACCWAAYCAGCCAGR1AAGC и Nat2(R) AGMCCSACCAWACAGYAMACC с размером продукта 277 пар нуклеотидов, где F и R - прямой и обратный праймеры соответственно и A, G, С, R1, W, М, S и Y - кодовые обозначения нуклеотидов.