Штаммы spnk
Иллюстрации
Показать всеИзобретения относятся к области молекулярной генетики и касаются способов преобразования продуцирующего спиносад штамма Saccharopolyspora spinosa в штамм, продуцирующий предшественника спинеторама (варианты), и генетически модифицированной клетки-хозяина Saccharopolyspora spinosa. Охарактеризованные способы включают внесение модификации в ген spnK или выключение гена spnK при сохранении продуцирования спинозина J и L для устранения активности 3′-O-метилтрансферазы с получением генетически модифицированной клетки-хозяина Saccharopolyspora spinosa, продуцирующей предшественник спинеторама. Причем указанная модификация является точковой мутацией, находящейся в положении пары оснований, выбранном из группы, состоящей из положений 528, 589, 602, 668, 721, 794, 862, 895, 908, 937 и 1131. Изобретения позволяют продуцировать спинозин с большей эффективностью. 3 н. и 2 з.п.ф-лы, 6 ил., 6 табл., 6 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
По данной патентной заявке испрашивается приоритет по временной патентной заявке № 61/333540, поданной 11 мая 2010 года, которая включена в настоящее описание в качестве ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к технической области молекулярной генетики, связанной с нарушением экспрессии генов. Более конкретно, было открыто, что мутация в гене spnK преобразует продуцирующий спиносад штамм в штамм, продуцирующий предшественник спинеторама.
УРОВЕНЬ ТЕХНИКИ
Как описано в патенте США № 5362634, продукт ферментации A83543 представляет собой семейство родственных соединений, продуцируемых Saccharopolyspora spinosa. Известные представители этого семейства называют факторами или компонентами, и каждому из них присвоено идентификационное буквенное обозначение. Эти соединения далее в настоящем описании называют спинозином A, B и т.д. Соединения спинозина пригодны для борьбы с паукообразными, круглыми червями и насекомыми, в частности видами Lepidoptera и Diptera, и они являются довольно благоприятными для окружающей среды и обладают привлекательным токсикологическим профилем.
Продуцируемые в природе соединения спинозина состоят из 5,6,5-трициклической кольцевой системы, конденсированной с 12-членным макроциклическим лактоном, нейтрального сахара (рамноза) и аминосахара (форозамин) (см. Kirst et al. (1991). Если аминосахар не присутствует, соединения называют псевдоагликоном A, D и т.д., и, если нейтральный сахар не присутствует, тогда соединения называют обратным псевдоагликоном A, D и т.д. Более предпочтительной номенклатурой является называние псевдоагликонов спинозином A 17-Psa, спинозином D 17-Psa и т.д. и называние обратных псевдоагликонов - спинозином A 9-Psa, спинозином D 9-Psa и т.д.
Природные соединения спинозинов можно получать ферментацией культур NRRL 18395, 18537, 18538, 18539, 18719, 18720, 18743 и 18823. Эти культуры были депонированы и являются частью коллекции исходных культур Midwest Area Northern Regional Research Center, Agricultural Research Service, United States Department of Agriculture, 1815 North University Street, Peoria, Ill., 61604.
Патент США № 5362634 и соответствующая патентная заявка Европы № 375316 A1 относятся к спинозинам A, B, C, D, E, F, G, H и J. Описано, что эти соединения получают культивированием штамма нового микроорганизма Saccharopolyspora spinosa, выбранного из NRRL 18395, NRRL 18537, NRRL 18538 и NRRL 18539.
WO 93/09126 относится к спинозинам L, M, N, Q, R, S и T. Также в ней обсуждаются штаммы, продуцирующие спинозин J: NRRL 18719 и NRRL 18720, и штамм, который продуцирует спинозины Q, R, S и T: NRRL 18823.
WO 94/20518 и патент США № 56704486 относятся к спинозинам K, O, P, U, V, W и Y и их производным. Также обсуждается продуцирующий спинозин K штамм NRRL 18743.
Проблема при продуцировании соединений спинозина возникает из того факта, что требуется очень большой объем ферментации для получения очень небольшого количества спинозинов. Высоко желательным является увеличение эффективности продуцирования спинозина и, тем самым, увеличение доступности спинозинов при одновременном снижении их стоимости.
Было бы преимущественным предоставление клонированных генов биосинтеза, которые обеспечивают способ продуцирования новых производных спинозинов, которые могут обладать отличающимся спектром инсектицидной активности. Новые производные являются желательными, поскольку, хотя известные спинозины ингибируют широкий спектр насекомых, они не осуществляют борьбу со всеми вредителями. Различные профили контроля могут быть предоставлены с помощью промежуточных соединений биосинтеза спинозинов или с помощью их производных, продуцированных in vivo, или с помощью производных, полученных их химической модификацией in vitro.
Также было бы преимущественным предоставление новых промежуточных соединений, синтезируемых мутантными штаммами S. spinosa, в которых части определенных генов, кодирующих ферменты для биосинтеза спинозина, заменены частями тех же генов, которые были подвергнуты определенным мутациям in vitro, или соответствующими частями генов из других организмов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
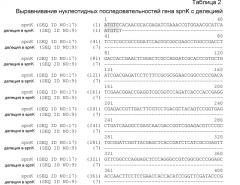
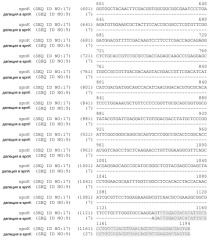
Настоящее изобретение относится к способам преобразования штамма, продуцирующего спиносад, такой как спинозин A и D, в штамм, продуцирующий спинеторам, такой как спинозин J и L. Такой способ может включать обеспечение модификации в гене spnK для устранения активности 3'-O-метилтрансферазы. Модификацию можно проводить с помощью делеций в рамке считывания, мутаций, замен, делеций, инсерций и т.п. Делеции в рамке считывания можно проводить по всему гену, включая делеции на 5'-конце, 3'-конце или в кодирующей области spnK. Одна такая делеция в рамке считывания может включать SEQ ID NO:9. Точковые мутации могут включать, но не ограничиваться ими, мутации в положениях пар оснований 528, 589, 602, 668, 721, 794, 862, 895, 908, 937 и 1131. Эти мутации могут приводить к изменению трансляции гена spnK. Такие изменения могут представлять собой изменения аминокислот, замены или создание стоп-кодонов. Такие модификации приводят к продуцированию соединения спинозина J и L относительно спинозина A и D.
Конкретные способы по настоящему изобретению включают преобразование продуцирующего спиносад штамма в штамм, продуцирующий предшественник спинеторама, путем выключения гена spnK при одновременном сохранении продуцирования спинозина J и L. Выключение или нарушение нормальной активности белка spnK может происходить с помощью делеций в рамке считывания, мутаций, замен, делеций, инсерций и т.п. Также оно может быть вызвано манипуляциями с последовательностями промотора или участка связывания рибосом.
Кроме того, изобретение относится к генетически модифицированной клетке-хозяину, которая продуцирует предшественник спинеторама. Этого генетически модифицированного хозяина можно получать путем модификации гена spnK для устранения активности 3'-O-метилтрансферазы. Модификация может быть осуществлена с помощью делеций в рамке считывания, мутаций, замен, делеций, инсерций и т.п. Делеции в рамке считывания могут включать делеции на 5'-конце, 3'-конце или в кодирующей области spnK.
Также изобретение относится к способам преобразования продуцирующих спиносад штаммов в штаммы, продуцирующие предшественник спинеторама, путем модификации гена spnK для устранения активности 3'-O-метилтрансферазы. Этот процесс может включать делеции в рамке считывания, точковые мутации, делеции и инсерции. Такие делеции в рамке считывания могут включать делеции в рамке считывания на 5'-конце, делеции в рамке считывания на 3'-конце и делеции в рамке считывания в кодирующей области spnK. Делеции могут включать делеции одного или нескольких нуклеотидных оснований, которые нарушают нормальную рамку считывания гена spnK. Инсерции могут включать инсерции одного или нескольких нуклеотидных оснований, которые нарушают нормальную рамку считывания гена spnK. Точковые мутации могут находиться в положениях пар оснований 528, 589, 602, 668, 721, 794, 862, 895, 908, 937 и 1131. Эти точковые мутации могут приводить к аминокислотным заменам в активном центре или участке связывания субстрата гена spnK.
Также изобретение включает генетически модифицированные клетки-хозяева, которые продуцируют предшественник спинеторама вследствие обеспечения модификации в гене spnK для устранения активности 3'-O-метилтрансферазы, где генетически модифицированная клетка-хозяин представляет собой прокариотическую клетку-хозяина, которая в норме не продуцирует значительные количества предшественника спинеторама. Другие варианты осуществления включают способы преобразования продуцирующего спиносад штамма в штамм, продуцирующий предшественник спинеторама, путем выключения гена spnK при одновременном сохранении продуцирования спинозина J и L. Такие способы могут включать делеции в рамке считывания, точковые мутации, делеции и инсерции. Такие делеции в рамке считывания могут включать делеции в рамке считывания на 5'-конце, делеции в рамке считывания на 3'-конце и делеции в рамке считывания в кодирующей области spnK. Делеции могут включать делеции одного или нескольких нуклеотидных оснований, которые нарушают нормальную рамку считывания гена spnK. Инсерции могут включать инсерции одного или нескольких нуклеотидных оснований, которые нарушают нормальную рамку считывания гена spnK. Точковые мутации могут находиться в положениях пар оснований 528, 589, 602, 668, 721, 794, 862, 895, 908, 937 и 1131. Эти точковые мутации могут приводить к заменам аминокислот в активном центре или участке связывания субстрата гена spnK. Другие способы выключения spnK могут осуществляться путем манипулирования с участком связывания рибосом или путем манипулирования с промотором гена spnK.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 представлено расположение точковых мутаций spnK. Мутации выделены в последовательности spnK дикого типа (SEQ ID NO:17).
На фиг.2 представлена физическая карта spnJ, spnK, spnL и spnM. Продукты ПЦР, которые были получены, указаны линиями ниже карты хромосомы.
На фиг.3 представлено встраивание конструкции с делецией spnK в рамке считывания в область spnLM с помощью гомологичной рекомбинации с одним кроссинговером согласно варианту осуществления настоящего изобретения. (Звездочка указывает на неполную кодирующую последовательность spnJ и spnM).
На фиг.4 представлены мутанты с двойным кроссинговером, которые приводили к делеции гена spnK согласно одному варианту осуществления настоящего изобретения. Размер и последовательность ДНК фрагмента ПЦР указывает на делецию гена spnK в рамке считывания.
На фиг.5 представлена диаграмма встраивания кассеты, содержащей кассету гена устойчивости к апрамицину (aac(3)IV) в рамке считывания, в spnK в соответствии с одним вариантом осуществления настоящего изобретения.
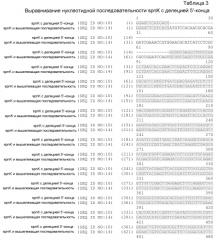
На фиг.6 представлен участок связывания рибосом (обозначенный как последовательность Шайна-Дальгарно), который расположен выше кодирующей последовательности spnK согласно одному варианту осуществления настоящего изобретения (SEQ ID NO:16). Эта последовательность выделена на фиг.6.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Существует множество применений для клонированной ДНК Saccharopolyspora spinosa. Клонированные гены можно использовать для увеличения выхода спинозинов и получения новых спинозинов. Увеличения выхода можно достигать путем встраивания в геном конкретного штамма удвоенной копии гена для фермента, который является скоростьограничивающим в этом штамме. В случаях, где биосинтетический каскад блокирован в конкретном мутантном штамме вследствие нехватки требуемого фермента, продуцирование желаемых спинозинов может быть восстановлено путем встраивания копии требуемого гена. Когда нарушен биосинтетический путь, можно создавать другой штамм-предшественник. Более конкретно, нарушение гена spnK может приводить к продуцированию спинозина J и L относительно продуцирования спинозина A и D.
Новые спинозины можно получать, используя фрагменты клонированной ДНК для нарушения стадий в биосинтезе спинозинов. Такое нарушение может приводить к накоплению предшественников или “шунтовых” продуктов (природным образом процессируемые производные предшественников). Фрагменты, пригодные для осуществления нарушения, являются внутренними фрагментами гена с отсутствующими основаниями на 5'- и 3'-концах гена, а также по всему гену. События гомологичной рекомбинации, в которых используются такие фрагменты, приводят к двум неполным копиям гена: в одной из них отсутствуют основания на 5'-конце и в другой из них отсутствуют основания на 3'-конце. Количество оснований, пропущенных на каждом конце фрагмента, должно быть достаточным, чтобы ни одна из неполных копий гена не сохраняла активность.
Следующие определения используют в настоящем описании, и на них следует ссылаться для интерпретации формулы изобретения и описания. Если нет иных указаний, все патенты США и патентные заявки США, упоминаемые в настоящем описании, включены в качестве ссылок в полном объеме.
Как используют в рамках изобретения, подразумевают, что форма единственного числа у элемента или компонента по изобретению является неограничивающей в отношении количества случаев (т.е. встречаемости) элемента или компонента. Таким образом, форму единственного числа следует истолковывать как включающую один или по меньшей мере один, и словоформа элемента или компонента в единственном числе также включает множественное число, если явно не предполагается, что число является единственным.
Как используют в рамках изобретения, термины “содержащий” и “включающий” означают присутствие указываемых признаков, чисел, стадий или компонентов, упоминаемых в формуле изобретения, но они не исключают присутствия или добавления одного или нескольких других признаков, чисел, стадий, компонентов или их групп. Это означает, что композиция, смесь, процесс, способ, изделие или устройство, которые “содержат” или “включают” перечень элементов, не ограничиваются только этими элементами, а могут включать другие, явно не перечисленные или не присущие ему. Как используют в рамках изобретения, “или” относится к включающему и исключающему “или”. Например, условие A или B удовлетворяется одним из следующих: A справедливо (или присутствует) и B ошибочно (или отсутствует), A ошибочно (или отсутствует) и B справедливо (или присутствует), и как A, так и B являются справедливыми (или присутствуют).
Как используют в рамках изобретения, термин “приблизительно” относится к модификации количества ингредиента или реагента по изобретению или используемого ингредиента или реагента и относится к варьированию числового количества, которое может возникать, например, при типических процессах измерения или обработки жидкостей, используемых для получения концентратов или растворов для применения: в реальном мире; вследствие неизбежных ошибок в этих процессах; вследствие различий в производстве, источнике и чистоте ингредиентов, используемых для получения композиций или осуществления способов и т.п. Термин “приблизительно” также охватывает количества, которые отличаются благодаря различным равновесным условиям для композиции, получаемой из конкретной первоначальной смеси. Независимо от модификации термином “приблизительно” формула изобретения включает эквиваленты количествам.
Как используют в рамках изобретения, термин “изобретение” или “настоящее изобретение” является неограничивающим термином, и подразумевают, что он охватывает все возможные варианты, как описано в описании и перечислено в формуле изобретения.
Как используют в рамках изобретения, термины “полипептид” и “пептид” используют взаимозаменяемо для обозначения полимера из двух или более аминокислот, связанных друг с другом пептидной связью. В одном аспекте этот термин также включает модификации после экспрессии полипептида, например гликозилирование, ацетилирование, фосфорилирование и т.п. В это определение включены, например, пептиды, содержащие один или несколько аналогов аминокислот или меченые аминокислоты и пептидомиметики. Пептиды могут содержать L-аминокислоты.
Как используют в рамках изобретения, термины “представляющий интерес пептид”, “POI”, “продукт гена”, “целевой продукт гена” и “целевой генный продукт кодирующей области” относятся к желаемому гетерологичному пептидному/белковому продукту, кодируемому рекомбинантно экспрессируемым чужеродным геном. Представляющий интерес пептид может включать любой пептидный/белковый продукт, включающий, но не ограничивающийся ими, белки, слитые белки, ферменты, пептиды, полипептиды и олигопептиды. Размер представляющего интерес пептида находится в диапазоне от 2 до 398 аминокислоты в длину.
Как используют в рамках изобретения, термин “генетическая конструкция” относится к серии последовательно расположенных нуклеиновых кислот, пригодных для модулирования генотипа или фенотипа организма. Неограничивающие примеры генетических конструкций включают, но не ограничиваются ими, молекулу нуклеиновой кислоты и открытую рамку считывания, ген, экспрессирующую кассету, вектор, плазмиду и т.п.
Как используют в рамках изобретения, термин “эндогенный ген” относится к нативному гену в его природном положении в геноме организма.
Как используют в рамках изобретения, “чужеродный ген” относится к гену, который в норме не встречается в организме-хозяине, но введен в организм-хозяин путем переноса генов. Чужеродные гены могут включать нативные гены, встроенные в ненативный организм, или химерные гены.
Как используют в рамках изобретения, термин “гетерологичный” в отношении последовательности в конкретном организме/геноме указывает на то, что последовательность происходит из чужеродных видов, или, если она из того же вида, существенно модифицирована относительно ее нативной формы с точки зрения состава и/или геномного локуса путем преднамеренного вмешательства человека. Таким образом, например, экспрессия гетерологичного гена относится к процессу экспрессии гена из одного организма/генома путем помещения его в геном другого организма/генома.
Как используют в рамках изобретения, термин “рекомбинантный” относится к искусственному комбинированию двух в ином случае разделенных сегментов последовательности, например, путем химического синтеза или путем манипулирования с выделенными сегментами нуклеиновых кислот способами генетической инженерии. “Рекомбинантный” также включает указание на клетку или вектор, которые были модифицированы путем встраивания гетерологичной нуклеиновой кислоты, или клетку, происходящую из клетки, модифицированной таким путем, но не охватывает изменение клетки или вектора вследствие природных событий (например, спонтанная мутация, природная трансформация, природная трансдукция, природная транспозиция), таких как события, происходящие без преднамеренного вмешательства человека.
Термин “полученный способами генетической инженерии” или “генетически измененный” означает научное изменение структуры генетического материала в живом организме. Он вовлекает получение и применение рекомбинантной ДНК. Более конкретно, его используют для отграничения полученного способами генетической инженерии или модифицированного организма от встречающегося в природе организма. Получение способами генетической инженерии можно проводить с помощью ряда способов, известных в данной области, например таких как замена генов, амплификация генов, нарушение генов, трансфекция, трансформация с использованием плазмид, вирусов или других векторов. Генетически модифицированный организм, например генетически модифицированный микроорганизм, часто называют рекомбинантным организмом, например рекомбинантным микроорганизмом.
Как используют в рамках изобретения, термин “нарушенный” или “нарушение” относится к гену, подвергнутому манипулированию или модифицированному способами генетической инженерии или вследствие природных причин, которые изменяют активность гена. Такая активность гена может быть увеличенной или сниженной. Кроме того, такое нарушение может устранять функцию белка. Для способствования такому снижению можно снижать число копий гена, например, путем недостаточной экспрессии или нарушения гена. Ген называют геном с “недостаточной экспрессией”, если уровень транскрипции указанного гена снижен по сравнению с геном дикого типа. Это можно измерять, например, с помощью нозерн-блот-анализа, количественно определяющего количество мРНК в качестве признака экспрессии гена. Как используют в рамках изобретения, экспрессия гена является недостаточной, если количество образовавшейся мРНК снижено по меньшей мере на 1%, 2%, 5% 10%, 25%, 50%, 75%, 100%, 200% или даже более чем на 500% по сравнению с количеством мРНК, образовавшейся из гена дикого типа. Альтернативно, для регуляции экспрессии полинуклеотида можно использовать слабый промотор. В другом варианте осуществления для достижения сниженной экспрессии можно изменять промотор, регуляторную область и/или участок связывания рибосом выше гена. Экспрессию также можно снижать путем снижения относительного времени полужизни матричной РНК. В другом варианте осуществления можно снижать активность самого полипептида с использованием одной или нескольких мутаций в аминокислотной последовательности полипептида, которые снижают активность. Например, к сниженной активности может приводить изменение аффинности полипептида в отношении его соответствующего субстрата. Аналогично, может быть снижено относительное время полужизни полипептида. В любом сценарии, где снижают экспрессию гена или снижают активность, снижения можно достигать путем изменения состава клеточной культуральной среды и/или способов, используемых для культивирования. “Сниженная экспрессия” или “сниженная активность”, как используют в рамках изобретения, означает снижение по меньшей мере на 5%, 10%, 25%, 50%, 75%, 100%, 200% или даже более чем на 500% по сравнению с белком, полинуклеотидом, геном дикого типа; или активностью и/или концентрацией белка, присутствующего до снижения содержания полинуклеотидов или полипептидов. Активность белка SpnK также можно снижать путем контактирования белка со специфическим или общим ингибитором его активности. Термины “сниженная активность”, “сниженная или устраненная активность” используют в настоящем описании взаимозаменяемо.
Выражение “последовательности контроля” относится в совокупности к промоторным последовательностям, участкам связывания рибосом, последовательностям терминации транскрипции, вышерасположенным регуляторным доменам, энхансерам и т.п., которые в совокупности обеспечивают транскрипцию и трансляцию кодирующей последовательности в клетке-хозяине. Не все из этих последовательностей контроля всегда должны присутствовать в рекомбинантном векторе при условии, что желаемый ген способен быть транскрибированным и транслированным.
“Рекомбинация” относится к перераспределению фрагментов последовательностей ДНК или РНК между двумя молекулами ДНК или РНК. “Гомологичная рекомбинация” происходит между двумя молекулами ДНК, которые гибридизуются благодаря гомологичным или комплементарным нуклеотидным последовательностям, присутствующим в каждой молекуле ДНК.
Термины “жесткие условия” или “гибридизация в жестких условиях” относятся к условиям, в которых зонд гибридизуется предпочтительно с его подпоследовательностью-мишенью и в меньшей степени гибридизуется или вообще не гибридизуется с другими последовательностями. “Жесткая гибридизация” и “жесткие условия промывания при гибридизации” в контексте экспериментов по гибридизации нуклеиновых кислот, таких как саузерн-гибридизация и нозерн-гибридизация, являются зависимыми от последовательности и различаются при различных параметрах окружающей среды. Обширное руководство по гибридизации нуклеиновых кислот представлено в Tijssen (1993) Laboratory Techniques in Biochemistry and Molecular Biology-Hybrydisation with Nucleic Acid Probes part I chapter 2 Overview of principles of hybridization and the strategy of Nucleic acid probe assays, Elsevier, New York. Как правило, в высокой степени жесткие условия гибридизации и промывания выбирают так, чтобы температура была приблизительно на 5°C ниже, чем температура плавления (Tm) для конкретной последовательности при заданной ионной силе и pH. Tm представляет собой температуру (при определенной ионной силе и pH), при которой 50% последовательности-мишени гибридизуется с абсолютно совпадающим зондом. В высокой степени жесткие условия выбирают так, чтобы температура была равна Tm для конкретного зонда.
Примером жестких условий гибридизации для гибридизации комплементарных нуклеиновых кислот, которые имеют более 100 комплементарных остатков, на фильтре при саузерн-блоттинге или нозерн-блоттинге, является 50% формамид с 1 мг гепарина при 42°C, причем гибридизацию проводят в течение ночи. Примером в высокой степени жестких условий промывания является 0,15M NaCl при 72°C в течение приблизительно 15 минут. Примером жестких условий промывания является промывание 0,2×SSC при 65°C в течение 15 минут (см., Sambrook et al. (1989) Molecular Cloning-A Laboratory Manual (2nd ed.) Vol. 1-3, Cold Spring Harbor Laboratory, Cold Spring Harbor Press, NY, для описания буфера SSC). Часто промыванию высокой жесткости предшествует промывание низкой жесткости для устранения фонового сигнала зонда. Примером промывания средней жесткости для дуплекса, например, более чем из 100 нуклеотидов является 1×SSC при 45°C в течение 15 минут. Примером промывания низкой жесткости для дуплекса, например, более чем из 100 нуклеотидов является 4-6xSSC при 40°C в течение 15 минут. Как правило, отношение сигнала к шуму 2× (или более) относительно того, что наблюдают для неродственного зонда в конкретном анализе гибридизации, указывает на детекцию специфической гибридизации. Нуклеиновые кислоты, которые не гибридизуются друг с другом в жестких условиях, все еще являются идентичными, если полипептиды, которые они кодируют, являются по существу идентичными. Это происходит, например, когда создают копию нуклеиновой кислоты с использованием максимальной вырожденности кодонов, допускаемой генетическим кодом.
Также изобретение относится к выделенному полинуклеотиду, гибридизующемуся в жестких условиях, предпочтительно в высокой степени жестких условиях, с полинуклеотидом по настоящему изобретению.
Как используют в рамках изобретения, термин “гибридизующийся” предназначен для описания условий гибридизации и промывания, в которых нуклеотидные последовательности, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 70%, более предпочтительно по меньшей мере приблизительно на 80%, еще более предпочтительно по меньшей мере приблизительно на 85%-90%, наиболее предпочтительно по меньшей мере на 95% гомологичные друг другу, как правило, остаются гибридизованными друг с другом.
В одном варианте осуществления нуклеиновая кислота по изобретению по меньшей мере на 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более гомологична последовательности нуклеиновой кислоты, представленной в данной заявке, или комплементарной ей последовательности.
Другим неограничивающим примером жестких условий гибридизации является гибридизация в 6x хлориде натрия/цитрате натрия (SSC) при приблизительно 45°C, с последующим одним или несколькими промываниями в 1×SSC, 0,1% SDS при 50°C, предпочтительно при 55°C, более предпочтительно при 60°C и еще более предпочтительно при 65°C.
В высокой степени жесткие условия могут включать инкубацию при 42°C в течение нескольких суток, например 2-4 суток, с использованием меченого ДНК-зонда, такого как меченный дигоксигенином (DIG) ДНК-зонд, с последующими одним или несколькими промываниями в 2×SSC, 0,1% SDS при комнатной температуре и одним или несколькими промываниями в 0,5×SSC, 0,1% SDS или 0,1×SSC, 0,1% SDS при 65-68°C. В частности, в высокой степени жесткие условия включают, например, инкубацию в течение от 2 ч до 4 суток при 42°C с использованием меченого DIG ДНК-зонда (полученного, например, с использованием системы для мечения DIG; Roche Diagnostics GmbH, 68298 Mannheim, Германия) в растворе, таком как раствор DigEasyHyb (Roche Diagnostics GmbH) с 100 мкг/мл ДНК спермы лосося или без нее, или в растворе, содержащем 50% формамид, 5xSSC (150 мМ NaCl, 15 мМ трицитрат натрия), 0,02% додецилсульфат натрия, 0,1% N-лауроилсаркозин и 2% блокирующий реагент (Roche Diagnostics GmbH), с последующим промыванием фильтров два раза в течение от 5 до 15 минут в 2×SSC и 0,1% SDS при комнатной температуре, а затем промыванием два раза в течение 15-30 минут в 0,5xSSC и 0,1% SDS или 0,1×SSC и 0,1% SDS при 65-68°C.
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты по изобретению, которая гибридизуется в высокой степени жестких условиях с нуклеотидной последовательностью по изобретению, может соответствовать встречающейся в природе молекуле нуклеиновой кислоты. Как используют в рамках изобретения, “встречающаяся в природе” молекула нуклеиновой кислоты относится к молекуле РНК или ДНК, имеющей нуклеотидную последовательность, которая встречается в природе (например, кодирует природный белок).
Квалифицированному специалисту известно, какие условия применять для жестких или в высокой степени жестких условий гибридизации. Дополнительное руководство по таким условиям легко доступно в данной области, например в Sambrook et al., 1989, Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Press, N.Y.; и Ausubel et al. (eds.), 1995, Current Protocols in Molecular Biology (John Wiley & Sons, N.Y.).
Клонированный фрагмент ДНК, содержащий гены ферментов биосинтеза спинозина, может обеспечить дупликацию генов, кодирующих скоростьограничивающие ферменты при продуцировании спинозинов. Это можно использовать для увеличения выхода в любых обстоятельствах, когда одно из кодируемых активных веществ ограничивает синтез желаемого спинозина. Увеличение выхода этого типа достигали при ферментации Streptomyces fradiae путем удвоения гена, кодирующего скоростьограничивающую метилтрансферазу, которая конвертирует макроцин в тилозин (Baltz et al., 1997).
Конкретные промежуточные соединения (или их природные производные) могут синтезироваться мутантными штаммами S. spinosa, в которых нарушены определенные гены, кодирующие ферменты для биосинтеза спинозина. Такие штаммы можно получать встраиванием путем гомологичной рекомбинации мутагенной плазмиды, содержащей внутренний фрагмент гена-мишени. При встраивании плазмиды образуются две неполных копии гена биосинтеза, тем самым устраняя ферментативную функцию, которую он кодирует. При ферментации мутантного штамма должен накапливаться субстрат для этого фермента или его природное производное. Такую стратегию эффективно использовали для получения штамма Saccharopolyspora erythraea, продуцирующего новые производные 6-дезоксиэритромицина (Weber & McAlpine, 1992).
Такие штаммы можно получать путем замены заданной области посредством гомологичной рекомбинации с двойным кроссинговером на мутагенную плазмиду, содержащую новый фрагмент между немутантными последовательностями, которые фланкируют заданную область. Гибридный ген будет продуцировать белок с измененными функциями либо лишенный активности, либо выполняющий новое ферментативное преобразование. При ферментации такого мутантного штамма будет накапливаться новое производное. Такую стратегию использовали для получения штамма Saccharopolyspora erythraea, продуцирующего новое производное ангидроэритромицина (Donadio et al., 1993).
Гены биосинтеза спинозина и родственные ORF были клонированы, и была определена последовательность ДНК каждого из них. Клонированные гены и ORF обозначаются далее как spnA, spnB, spnC, spnD, spnE, spnF, spnG, spnH, spnI, spnJ, spnK, spnL, spnM, spnN, spnO, spnP, spnQ, spnR, spnS, ORFL15, ORFL16, ORFR1, ORFR2, S. spinosa gtt, S. spinosa gdh, S. spinosa epi и S. spinosa kre.
Saccharapolyspora spinosa продуцируют смесь из девяти близкородственных соединений в совокупности называемых “спинозинами”. В смеси спинозин A и D, известные как спиносад, являются основными компонентами и обладают наиболее высокой активностью против ключевых насекомых-мишеней. Спинозин J и L, два из второстепенных компонентов в смеси спинозина, являются предшественниками спинеторама, инсектицида на основе спинозина второго поколения. Варианты осуществления изобретения касаются прямого преобразования продуцирующего спиносад штамма в штамм, продуцирующий предшественник спинеторама, с помощью манипуляций с spnK, который кодирует 3'-O-метилтрансферазу.
Спиносад представляет собой инсектицид, производимый Dow AgroSciences (Indianapolis, Ind.), который содержит, главным образом, приблизительно 85% спинозина A и приблизительно 15% спинозина D. Спинозин A и D являются природными продуктами, продуцируемыми ферментацией Saccharopolyspora spinosa, как описано в патенте США № 5362634. Спиносад является активным ингредиентом нескольких инсектицидных составов, коммерчески доступных от Dow AgroSciences, включая продукты для борьбы с насекомыми TRACERTM, SUCCESSTM, SPINTORTM и CONSERVETM. Например, продукт TRACER содержит от приблизительно 44% до приблизительно 48% спиносада (масс./об.), или приблизительно 4 фунтов спиносада на галлон (0,5 кг на 1 л). Соединения спинозина в гранулярных и жидких составах имеют общепризнанную применимость для борьбы с паукообразными, круглыми червями и насекомыми, в частности видами Lepidoptera, Thysanoptera и Diptera. Спинозин A и D также называют в настоящем описании спинозином A/D.
Спинеторам представляет собой смесь 5,6-дигидро-3'-этоксиспинозина J (основной компонент) и 3'-этоксиспинозина L, производимую Dow AgroSciences. Смесь можно получать путем этоксилирования смеси спинозина J и спинозина L с последующей гидрогенизацией. 5,6-двойная связь спинозина J и его 3'-этоксипроизводного гидрогенизируется значительно более легко, чем у спинозина L и его 3'-этоксипроизводного вследствие пространственного препятствия в виде метильной группы на C-5 в спинозине L и его 3'-этоксипроизводном. См. патент США № 6001981. Спинозин J и L также называют в настоящем описании спинозином J/L.
Недавно было продемонстрировано, что spnK кодирует 3'-O-метилтрансферазу. См., Kim et al., JACS, 132(9): 2901-3 (2010). Заявители открыли, что spnK может быть удален из кластера генов биосинтеза спинозина путем гомологичной рекомбинации с двойным кроссинговером в рамке считывания без полярного эффекта на транскрипцию нижележащих генов spnL и spnM. Это позволяет получение способами инженерии продуцирующего спиносад штамма для получения штамма, продуцирующего предшественник спинеторама. Это также указывает на то, что штамм с нокаутом spnK утратил активность 3'-O-метилтрансферазы.
Варианты осуществления настоящего изобретения могут включать манипуляции в гене spnK, которые приводят к делеции в рамке считывания гена spnK путем удаления одного или нескольких кодонов в продуцирующем спиносад штамме. Делеция гена spnK в рамке считывания может включать любое укорочение любой части гена spnK. Делеции в рамке считывания в соответствии с настоящим изобретением включают делеции, которые удаляют сегмент кодирующей белок последовательности, но сохраняют надлежащую рамку считывания после делеции. Некоторые варианты осуществления настоящего изобретения могут включать делеции, которые представляют собой “чистые делеции”, т.е. они не содержат экзогенных последовательностей ДНК, встроенных в ген. Делеция гена spnK в рамке считывания может включать удаления из любого положения от 1 до 397 аминокислот. Она может включать удаление инициирующего кодона. Кроме того, она может включать удаление любого консервативного домена или любой области инициации транскрипции.
Для описания полинуклеотидных последовательностей в настоящем описании используются общепринятые обозначения: левый конец одноцепочечной полинуклеотидной последовательности представляет собой 5'-конец; направление двухцепочечной полинуклеотидной последовательности влево называют 5'-направлением. Направление добавления нуклеотидов от 5'- к 3'- к образующимся РНК-транскриптам называют направлением транскрипции. Цепь ДНК, имеющая ту же последовательность, что и мРНК, называют “кодирующей цепью”; последовательности на ДНК-цепи, имеющие ту же последовательность, что и мРНК, транскрибированная с этой ДНК и расположенные с 5'-стороны от 5'-конца РНК-транскрипта, называют “вышележащими последовательностями”; последовательности на цепи ДНК, имеющие ту же последовательность, что и РНК, и располагающиеся с 3'-сторны от 3'-конца кодирующего РНК-транскрипта называют “нижележащими последовательностями”.
Варианты осуществления настоящего изобретения могут включать манипуляции в гене spnK, которые приводят к делеции в рамке считывания 5'-конца гена spnK путем удаления одного или нескольких кодонов в продуцирующем спиносад штамме. Эти кодоны могут включать первый, второй или третий встречающийся кодон ATG.
Дополнительные варианты осуществления настоящего изобретения могут включать манипуляции в гене spnK, которые приводят к делеции в рамке считывания 3'-конца гена spnK путем удаления одного или нескольких кодонов в продуцирующем спиносад штамме.
Другие варианты осуществления настоящего изобретения могут включать манипуляции в гене spnK с делецией в рамке считывания в кодирующей области spnK либо одного кодона, либо нескольких кодонов, при сохранении как 5'-конца, так и 3'-конца гена, неизмененными.
Дополнительные варианты осуществления настоящего изобретения могут включать манипуляции в гене spnK, которые включают единичные или множественные точковые мутации, которые приводит к преждевременной терминации транскрипции или замене(ам) аминокислот во множеств