Плазмидный вектор pet-his8-trxl-acip1, штамм бактерии escherichia coli bl21(de3)/pet-his8-trxl-acip1 для экспрессии антимикробного пептида аципенсина-1 и способ получения указанного пептида
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к рекомбинантной продукции белков, и может быть использовано для получения антимикробного пептида аципенсина-1 русского осетра Acipenser gueldenstaedtii. Конструируют плазмидный вектор pET-His8-TrxL-Acip1 для экспрессии аципенсина-1 в клетках Escherichia coli в составе гибридного белка His8-TrxL-Acip1. Трансформируют данным вектором родительский штамм Escherichia coli BL21(DE3) и получают штамм-продуцент гибридного белка His8-TrxL-Acip1. Далее проводят культивирование клеток штамма-продуцента, осуществляют лизис клеток, аффинную очистку гибридного белка His8-TrxL-Acip1 на металлохелатном носителе, расщепление гибридного белка His8-TrxL-Acip1 бромцианом по остатку метионина, введенному между последовательностями аципенсина-1 и тиоредоксина, повторную металлохелатную очистку и финальную очистку целевого пептида методом обращенно-фазовой ВЭЖХ. Изобретение позволяет получить биологически активный аципенсин-1 по упрощенной технологии. 3 н.п. ф-лы, 4 ил., 4 пр.
Реферат
Изобретение относится к области биотехнологии, а именно к получению аципенсина-1 - антимикробного пептида русского осетра Acipenser gueldenstaedtii, который может найти применение в медицинской и ветеринарной практике в качестве антибиотика широкого спектра действия.
Антимикробные пептиды (АМП) системы врожденного иммунитета играют важную роль в противоинфекционной защите человека и животных [Кокряков В.Н. Очерки о врожденном иммунитете. СПб.: Наука, 2006. 261 с.]. Особое место эти молекулярные факторы врожденного иммунитета занимают в обеспечении защитных функций у низших позвоночных (рыб, амфибий), так как система адаптивного иммунитета у пойкилотермных животных не может обеспечить формирование достаточно быстрого и эффективного ответа (антителообразование) на инфекцию при низкой температуре окружающей среды. Аципенсин-1 (SEQ ID No: 1) - один из фрагментов N-концевой части гистона Н2А, выделенных из лейкоцитов русского осетра Acipenser gueldenstaedtii [Shamova O.V., Orlov D.S., Balandin S.V., Shramova E.I., Tsvetkova E.V., Panteleev P.V., Leonova Yu.F., Tagaev A.A., Kokryakov V.N., Ovchinnikova T.V. Acipensins - Novel Antimicrobial Peptides from Leukocytes of the Russian Sturgeon Acipenser gueldenstaedtii // Acta Naturae. - 2014. - Vol. 6. - 4(23). - Р. 99-109]. По своей первичной структуре он близок антимикробным пептидам хиппосину и буфорину I. Аципенсин-1 обладает широким спектром бактерицидного и фунгицидного действия, которое частично сохраняется в растворах с высокой концентрацией солей. Основной мишенью действия пептида в концентрациях, близких к МИК, являются не бактериальные мембраны, а внутриклеточные компоненты. Активность в отношении метициллин-резистентного штамма Staphylococcus aureus АТСС 33591 создает предпосылки для использования препаратов на основе аципенсина-1 в хирургии и трансплантологии. Как и другие природные АМП - производные гистона Н2А, аципенсин-1 не проявляет существенной цитотоксической активности в отношении культивируемых клеток человека. Наличие подобных свойств открывает перспективы практического применения пептида в противоопухолевой терапии, в качестве векторов для доставки лекарственных препаратов в малигнизированные клетки.
Единственный известный способ получения аципенсина-1 включает стадии получения лейкоцитарной массы из крови русского осетра Acipenser gueldenstaedtii, кислотной экстракции белков и пептидов, ультрафильтрации, препаративного электрофореза в полиакриламидном геле и обращенно-фазовой высокоэффективной жидкостной хроматографии [Шамова О.В., Орлов Д.С., Овчинникова Т.В., Сал Х.Г., Тверьянович И.А., Попова В.А., Дюбин В.А., Кокряков В.Н. // Фундаментальные исследования. 2006. №1. С. 10-13]. К недостатку способа можно отнести необходимость переработки больших объемов крови осетра для получения пептида в количествах, необходимых для его применения в медицинской и ветеринарной практике.
Изобретение решает задачу расширения ассортимента биологически активных пептидов и получения антимикробного пептида аципенсина-1.
Поставленная задача решается за счет конструирования экспрессирующего плазмидного вектора pET-His8-TrxL-Acip1, состоящего из двух фрагментов ДНК:
- BglII/XhoI-фрагмента с нуклеотидной последовательностью SEQ ID No. 2, который содержит промотор транскрипции Т7 РНК-полимеразы, lac-оператор, участок связывания рибосомы и участок, кодирующий аффинную метку, модифицированный белок-носитель тиоредоксин A Escherichia coli (TrxL) и антимикробный пептид аципенсин-1;
- BglII/XhoI-фрагмента плазмиды pET31b(+), который содержит терминатор транскрипции Т7 РНК-полимеразы, сайт инициации репликации, ген β-лактамазы и ген lac-penpeccopa (lacI);
за счет штамма-продуцента гибридного белка His8-TrxL-Acip1 путем трансформации штамма Escherichia coli BL21(DE3) указанным вектором pET-His8-TrxL-Acip1;
а также за счет способа получения антимикробного пептида аципенсина-1, включающего культивирование штамма-продуцента Escherichia coli BL21(DE3)/pET-His8-TrxL-Acip1, разрушение клеток, аффинную очистку гибридного белка His8-TrxL-Acip1 на металлохелатном носителе, расщепление гибридного белка His8-TrxL-Acip1 бромцианом по остатку метионина, введенному между последовательностями аципенсина-1 и тиоредоксина, повторную очистку на металлохелатном носителе и очистку целевого пептида методом обращенно-фазовой ВЭЖХ.
С целью предотвращения преждевременной гибели микроорганизма-продуцента вследствие экспрессии в его клетках антимикробных пептидов и связанной с этим потери продуктивности требуется временно нейтрализовать токсичность синтезируемого продукта. Заявленный плазмидный вектор pET-His8-TrxL-Acip1 обеспечивает высокий уровень экспрессии аципенсина-1 в клетках Escherichia coli за счет включения его аминокислотной последовательности в состав гибридного белка His8-TrxL-Acip1 (SEQ ID No. 3), несущего последовательность тиоредоксина А. Тиоредоксин способен накапливаться в высокой концентрации (до 40%) в цитоплазме E.coli в растворимой форме и применяется для сверхэкспрессии биологически активных полипептидов [LaVallie E.R. et al. (1993) Nature BioTechnology. 11: 187-193]. Необходимость использования белка-носителя обусловлена не только токсичностью зрелого аципенсина-1 для бактериальной клетки, но и возможностью его деградации в гетерологичной системе. Для высвобождения целевого пептида из молекулы гибридного белка His8-TrxL-Acip1 между последовательностями аципенсина-1 и тиоредоксина вводят остаток метионина, позволяющий проводить избирательное расщепление гибридного полипептида бромцианом.
При расщеплении гибридного белка TrxL-Acip1 бромцианом целесообразным является использование в качестве партнера для гетерологичной экспрессии модифицированного тиоредоксина A Escherichia coli, содержащего замену внутреннего остатка метионина на остаток другой аминокислоты, например, на лейцин (M37L). Известно, что подобное незначительное изменение первичной структуры не оказывает влияния на пространственную структуру и свойства тиоредоксина [Rudresh et al. (2002) Protein Eng. 15(8): 627-33]. Отсутствие внутренних остатков метионина в последовательности белка-носителя уменьшает число индивидуальных полипептидных фрагментов, образующихся в результате реакции с бромцианом. В предпочтительном случае расщепление гибридного белка дает всего один побочный продукт, значительно отличающийся по физико-химическим свойствам от целевого пептида, что облегчает процесс очистки последнего.
Очистку целевого пептида упрощают за счет включения в состав гибридного белка His8-TrxL-Acip1 аффинной метки - аминокислотной последовательности, позволяющей проводить очистку гибридного полипептида методом аффинной хроматографии на сорбентах с иммобилизованными (хелатированными) ионами металлов, т.е. металлохелатную очистку. В качестве такой последовательности обычно используют последовательность из 4-10 остатков гистидина, чаще всего - последовательность из шести остатков гистидина, которая вводится в N-концевую или С-концевую область гибридного белка либо в область, разделяющую белок-носитель и целевой белок [Terpe K. (2003) Appl Microbiol Biotechnol. 60(5): 523-33]. В качестве аффинной метки для металлохелатной очистки также используют фрагменты HAT и 6xHN [U.S. Pat. No. 7,176,298].
В состав заявленного вектора pET-His8-TrxL-Acip1 включают регуляторные элементы, контролирующие экспрессию гибридного белка: промотор и терминатор для РНК-полимеразы бактериофага Т7, lac-оператор, консенсусный сайт связывания бактериальной рибосомы, стартовый и стоп-кодоны. Для подавления базальной экспрессии гена гибридного белка в состав вектора pET-His8-TrxL-Acip1 включают ген lac-penpeccopa (lacI). В состав заявленного вектора входят сайт инициации репликации (Ori) плазмиды pBR322 и маркерный ген β-лактамазы, детерминирующий устойчивость трансформированных плазмидой pET-His8-TrxL-Acip1 клеток Escherichia coli к ампициллину и позволяющий проводить отбор клеток, содержащих векторную ДНК, путем выращивания на соответствующей селективной питательной среде.
Конструирование плазмидного вектора pET-His8-TrxL-Acip1, экспрессирующей гибридный белок His8-TrxL-Acip1, содержащий последовательность аципенсина-1, может быть осуществлено путем лигирования BglII/XhoI-фрагмента плазмиды рЕТ-31b(+) (Novagen), содержащего область инициации репликации, Т7 терминатор, гены β-лактамазы и lacI, со вставкой, кодирующей ген гибридного белка. Искусственный ген, который кодирует гибридный белок, может быть получен химическим синтезом набора олигонуклеотидных фрагментов с последующей сборкой и амплификацией промежуточных и конечного продуктов при помощи полимеразной цепной реакции (ПЦР). Выбор структуры олигонуклеотидных праймеров для синтеза каждого из структурных элементов (промотора, оператора, сайта связывания рибосомы, тиоредоксина, аффинной последовательности, аципенсина-1) основывают на данных по их нуклеотидным последовательностям, доступных из открытых источников (банки данных GenBank, EMBL-Bank, DDBJ). Матрицей для амплификации последовательности тиоредоксина служит бактериальный геном либо плазмида рЕТ-32а(+) (Novagen). Замену метионинового кодона в составе тиоредоксина (M37L) при необходимости осуществляют на стадии сборки методом направленного мутагенеза при помощи ПЦР. Перед лигированием для получения липких концов очищенный ампликон и плазмидный вектор обрабатывают рестриктазами. Продуктами лигазной реакции трансформируют компетентные клетки штамма Escherichia coli с выключенной системой рекомбинации и рестрикции ДНК, например, DH5α, DH10B или XL1-Blue. Отбор клонов, содержащих плазмидный вектор со вставкой, проводят при помощи ПЦР и рестрикционного анализа выделенной векторной ДНК. Правильность сборки конструкции определяют секвенированием векторной ДНК.
Штамм-продуцент гибридного белка His8-TrxL-Acip1, содержащего последовательность целевого пептида аципенсина-1, получают путем трансформации препаратом векторной ДНК pET-His8-TrxL-Acip1 компетентных клеток Escherichia coli и отбора клонов, обладающих способностью экспрессировать рекомбинантный белок. Наличие и уровень экспрессии рекомбинантного белка контролируют с помощью ПААГ-электрофореза в денатурирующих условиях. В качестве родительского штамма для создания штамма-продуцента используют Escherichia coli BL21(DE3). Преимущество использования данного штамма в качестве основы для создания штамма-продуцента заключается в том, что BL21 (DE3) обладает фенотипом Lon OmpT, что исключает возможность протеолитического расщепления синтезируемого гибридного белка His8-TrxL-Acip1 и загрязнения препарата наиболее активными протеазами Escherichia coli. В хромосомную ДНК BL21(DE3) интегрируют ген Т7-РНК полимеразы, который совместно с Т7 промотором и Т7 терминатором в плазмиде pET-His8-TrxL-Acip1 обеспечивает продукцию гибридного белка His8-TrxL-Acip1 клетками Escherichia coli при индукции изопропилтио-β-D-галактозидом или лактозой. Базальная экспрессия (до момента добавления индуктора) Т7 РНК-полимеразы и гибридного белка His8-TrxL-Acip1 поддерживается на минимальном уровне благодаря наличию системы контроля на основе lac-операторов и генов lac-репрессора, присутствующих как в плазмиде pET-His8-TrxL-Acip1, так и в хромосоме штамма-продуцента.
Клетки штамма-продуцента сохраняют культурально-морфологические и физиолого-биохимические признаки родительского штамма Escherichia coli. Клетки мелкие, палочковидной формы, грамотрицательные, 1×3,5 мкм, подвижные, хорошо растут на обычных питательных средах (ΜΠΑ, МПБ, LB-бульон, LB-arap, минимальная среда с глюкозой). Рост в жидких средах характеризуется ровным помутнением, осадок легко седиментирует. Клетки растут при температуре от 4°С до 42°С при оптимуме рН от 6,8 до 7,5; в качестве источника азота используют как минеральные соли аммония, так и органические соединения: аминокислоты, пептон, триптон, дрожжевой экстракт. В качестве источника углерода при росте на минимальной среде используют аминокислоты, глицерин, углеводы. Клетки проявляют устойчивость к ампициллину (до 500 мкг/мл), обусловленную наличием в плазмиде pET-His8-TrxL-Acip1 гена β-лактамазы.
Штамм-продуцент хранят на чашках и косяках при температуре 4°С, пересевая на свежие среды один раз в месяц, а также при температуре минус 70°С в среде LB с добавлением 10-30% глицерина.
Биосинтез продукта (экспрессию) проводят следующим образом: клетки штамма-продуцента выращивают в питательной среде (например, LB, MBL или М9) с добавлением необходимого селектирующего агента (100 мкг/мл ампициллина) при температуре 20-37°С до достижения культурой средней или поздней логарифмической фазы роста, ступенчато увеличивая объем культуральной жидкости путем последовательных пересевов материала, после чего индуцируют синтез гибридного белка добавлением изопропилтио-β-D-галактозида или лактозы и инкубируют дополнительно в течение 2-24 ч при температуре 20-37°С. Увеличения выхода гибридного белка достигают с помощью принудительной аэрации культуральной жидкости и культивирования штамма-продуцента на обогащенных питательных средах (например, с добавлением глюкозы, глицерина, дикарбоновых кислот, аминокислот, неорганических солей, в т.ч. содержащих микроэлементы).
Очистка антимикробного пептида аципенсина-1 включает следующие обязательные стадии: разрушение клеток, металлохелатную очистку гибридного белка TrxL-Acip1, обработку гибридного белка бромцианом, разделение продуктов реакции с помощью повторной металлохелатной очистки и очистку целевого пептида методом обращенно-фазовой ВЭЖХ.
Для очистки клеточного материала от примесей, содержащихся в культуральной жидкости, особенно при выделении гибридного белка из клеточной культуры с низкой плотностью, желательным является предварительное концентрирование клеток с помощью центрифугирования или фильтрации. Разрушение (лизис) клеток осуществляют физическим или химическим способом или комбинацией способов, например, с помощью ультразвукового дезинтегратора, Френч-пресса, дезинтегратора Гаулина, либо с использованием осмотического шока, детергентов, хаотропных агентов, гидролитических ферментов (лизоцим, ДНКаза). С целью снижения нагрузки на аффинный сорбент нерастворимые примеси из клеточного лизата должны быть удалены центрифугированием или фильтрацией. Для металлохелатной очистки может быть использован сорбент, содержащий такие хелатирующие группы, как иминодиацетат (IDA), нитрилотриацетат (NTA) или карбоксиметиласпартат (СМА, TALON) в комплексе с катионами Ni2+, Со2+ или Cu2+ [Chaga G.S. (2001) J Biochem Biophys Methods. 49(1-3): 313-34]. Элюирование гибридного белка проводят, уменьшая рН буферного раствора или увеличивая концентрацию имидазола либо добавляя в буферный раствор ЭДТА. Реакцию с бромцианом проводят в стандартных условиях: растворяют белок в 60-90% трифторуксусной, уксусной или муравьиной кислоте или в 6М хлориде гуанидина с добавлением 0,1 M соляной кислоты, вносят бромциан в 10-200-кратном стехиометрическом избытке по отношению к числу остатков метионина в образце, инкубируют в темноте в течение 16-20 ч. После этого проводят очистку продуктов реакции расщепления гибридного белка с помощью повторной металлохелатной хроматографии, разделяя таким образом целевой пептид, белок-носитель и нерасщепленный гибридный белок. Очистку аципенсина-1 проводят методом обращенно-фазовой ВЭЖХ в системе ацетонитрил-вода с добавлением 0,1% ТФУ, используя градиент концентрации ацетонитрила. Степень чистоты пептида может быть повышена путем повторной очистки методом обращенно-фазовой ВЭЖХ.
Соответствие полученного препарата природному аципенсину-1 устанавливают методами ПААГ-электрофореза в денатурирующих услових, МАЛДИ-времяпролетной масс-спектрометрии, секвенированием N-концевой аминокислотной последовательности по методу Эдмана, тестированием антимикробной активности методом серийных разведений в жидкой питательной среде. Степень очистки определяют методами ПААГ-электрофореза в денатурирующих условиях и МАЛДИ-времяпролетной масс-спектрометрии, а также с помощью повторной обращенно-фазовой ВЭЖХ.
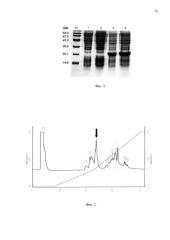
На фиг. 1 представлена физическая карта плазмидного вектора для экспрессии антимикробного пептида аципенсина-1: BglII, XhoI - сайты рестрикции; pBR322 Ori - участок инициации репликации плазмиды; bla - ген устойчивости к β-лактамным антибиотикам; lacI - ген lac-penpeccopa; Т7 promoter - промотор транскрипции; Т7 terminator - терминатор транскрипции; lac operator - сайт связывания lac-penpeccopa; RBS - сайт связывания рибосомы; His8-TrxL-Acip1 - последовательность, кодирующая гибридный белок, содержащий аципенсин-1. На фиг. 2 показана электрофореграмма клеточного лизата, содержащего гибридный белок His8-TrxL-Acip1: M - стандарт молекулярных масс; 1, 2 - суммарный клеточный белок до индукции IPTG (0,1 и 0,2 о.е. соответственно); 3, 4 - суммарный клеточный белок после индукции IPTG (0,1 и 0,2 о.е. соответственно). На фиг. 3 представлена хроматограмма очистки рекомбинантного аципенсина-1 методом обращенно-фазовой ВЭЖХ (стрелкой указан пик, соответствующий целевому пептиду). На фиг. 4 приведен MALDI масс-спектр аципенсина-1, полученного генно-инженерным способом.
Изобретение иллюстрируют примеры.
Пример 1.
Конструирование плазмидного вектора pET-His8-TrxL-Acip1.
Нуклеотидную последовательность SEQ ID No. 2, содержащую промотор транскрипции Т7 РНК-полимеразы, lac-оператор, участок связывания рибосомы и участок, кодирующий гибридный полипептид (последовательно связанные гистидиновый октамер, тиоредоксин с заменой M37L, сайт расщепления бромцианом и аципенсин-1), получают химико-ферментативным синтезом с помощью ПЦР. Олигонуклеотиды, используемые в ПЦР, синтезируют твердофазным фосфоамидитным методом с наращиванием олигонуклеотидной цепи в направлении от 3′-конца к 5′-концу с помощью защищенных фосфамидитов - 5′-диметокситритил-N-ацил-2′-дезоксинуклеозид-3′-O-(β-цианэтилдиизопропиламино)-фосфитов, активированных тетразолом.
Фрагмент, кодирующий белок-носитель тиоредоксин (M37L), получают методом ПЦР-амплификации и направленного мутагенеза с помощью ген-специфических праймеров, используя в качестве исходной матрицы плазмиду рЕТ32а(+), содержащую ген тиоредоксина. Остальные участки последовательности pE-TrxL-Acip1 получают путем последовательного отжига и элонгации взаимно перекрывающихся олигонуклеотидов, а также отжига, элонгации и амплификации промежуточных продуктов синтеза. На завершающей стадии синтеза последовательность амплифицируют с помощью праймеров, несущих на 5′-концах сайты узнавания рестриктаз BglII и XhoI. Продукт амплификации гидролизуют указанными рестриктазами, очищают электрофорезом в 1,5% агарозном геле, полосу ДНК величиной 659 п.н. выделяют из геля методом электроэлюции в 15% раствор ПЭГ-6000 и лигируют с фрагментом ДНК размером 5,25 тыс. п.н., полученным в результате обработки плазмиды pET31b(+) рестриктазами BglII и XhoI. В результате лигазной реакции получают кольцевую ковалентно замкнутую ДНК размером 5912 п.н. (фиг. 1). Продуктами лигазной реакции трансформируют компетентные клетки Escherichia coli DH10B, приготовленные с помощью 0,1 M хлорида кальция. После трансформации суспензию бактерий смешивают с питательной средой LB, растят 1 ч при 37°С и высевают на чашки Петри с LB-агаром, содержащим 50 мкг/мл ампициллина.
Первичный отбор клонов, содержащих нужную плазмиду, осуществляют методом «ПЦР с клонов» с использованием праймеров на плазмидный остов и вставку. Отобранные клоны подращивают в жидкой питательной среде и выделяют плазмидную ДНК, которую анализируют на наличие вставки с помощью рестрикционного анализа. Окончательное строение плазмид, содержащих требуемый фрагмент, подтверждают определением нуклеотидной последовательности с помощью секвенирования по Сэнгеру. По данным секвенирования отбирают плазмиду со вставкой, нуклеотидная последовательность которой полностью соответствует запланированной (SEQ ID No. 2).
Пример 2.
Получение штамма-продуцента Escherichia coli BL21(DE3)/pET-His8-TrxL-Acip1, вырабатывающего гибридный белок His8-TrxL-Acip1, и определение его продуктивности.
Проводят трансформацию компетентных клеток Escherichia coli BL21(DE3), приготовленных с помощью 0,1 M хлорида кальция, плазмидой pET-His8-TrxL-Acip1, описанной в примере 1. После трансформации суспензию бактерий смешивают с питательной средой LB, растят 1 ч при 37°С и высевают на чашки Петри с LB-агаром, содержащим 50 мкг/мл ампициллина и 0,5% глюкозы. Чашки инкубируют при 37°С в течение 18 ч.
Бактериологической петлей переносят выросшие колонии в 10 мл жидкой среды LB, содержащей 150 мкг/мл ампициллина, подращивают до оптической плотности OD600 0,7 на термостатируемой качалке со скоростью вращения 200 об·мин-1 при температуре 37°С, отбирают 0,3 мл культуры для последующего электрофоретического анализа, добавляют индуктор - изопропилтио-β-D-галактозид до концентрации 0,2 мМ и продолжают инкубацию при температуре 37°С в течение 5 ч, отбирая каждый час пробы по 0,3 мл для определения оптической плотности OD600 и последующего электрофоретического анализа. Равные аликвоты суспензии клеток, отобранных до внесения индуктора и после завершения роста, центрифугируют, отделяют супернатант и анализируют осадок клеток ПААГ-электрофорезом в денатурирующих условиях. Для этого образцы лизируют буфером, содержащим 2% додецилсульфат натрия (SDS), на водяной бане в течение 5 мин. Электрофорез проводят в 15% ПААГ в присутствии SDS. Гель прокрашивают 0,1% кумасси G-250 в присутствии 25% изопропилового спирта. Появление отчетливой полосы в районе 18,9 кДа в образцах, отобранных после индукции, свидетельствует о способности штамма синтезировать гибридный полипептид His8-TrxL-Acip1 (фиг. 2). Относительное содержание гибридного белка, составляющее около 30%, определяют путем сканирования и денситометрического анализа окрашенных гелей.
Пример 3.
Получение рекомбинантного антимикробного пептида аципенсина-1.
Клетки штамма-продуцента Escherichia coli BL21(DE3)/pET-His8-TrxL-Acip1, полученного согласно примеру 2, выращивают в жидкой среде LB с добавлением 100 мкг/мл ампициллина и 1% глюкозы до достижения культурой оптической плотности OD600 0,7 при температуре 37°С. Индукцию синтеза белка проводят с помощью изопропил-β-D-галактозида в концентрации 1,0 мМ, после чего инкубируют 4 ч при температуре 37°С. Уровень экспрессии гибридного белка, а также содержание гибридного белка, белка-носителя и аципенсина-1 в препарате на последующих стадиях очистки определяют с помощью ПААГ-электрофореза в трис-трициновой буферной системе в денатурирующих условиях.
По окончании ферментации клеточную биомассу отделяют центрифугированием при 4000 g в течение 10 мин, ресуспендируют в буфере А (50 мМ трис-HCl, 0,5 M NaCl, 20 мМ имидазол, рН 7,8, 1 мМ PMSF) и разрушают клетки с помощью ультразвукового гомогенизатора. Полученный лизат центрифугируют (осветляют) при 25000 g в течение 20 мин. Все работы по получению осветленного лизата проводят при температуре 4°С. Очистку гибридного белка His8-TrxL-Acip1, содержащего в качестве аффинной метки октагистидиновую последовательность, осуществляют с помощью металлохелатной хроматографии на препаративной колонке с Ni-NTA агарозой, уравновешенной буфером А. Для этого осветленный лизат наносят на колонку и элюируют связавшийся с носителем гибридный белок буфером В (50 мМ трис-HCl, 0,5 M NaCl, 0,5 M имидазол, рН 7,8). Детектирование ведут при длине волны 280 нм. Элюат, содержащий гибридный белок, диализируют относительно воды в течение 16 ч через мембрану с размером пор 12 кДа и лиофильно высушивают.
Очищенный гибридный белок His8-TrxL-Acip1 растворяют в 80% трифторуксусной кислоте в концентрации 10 мг/мл, добавляют равную массу бромциана (1 г бромциана на 1 г белка) и выдерживают при температуре 25°С в защищенном от света месте в течение 16 ч. Реакцию останавливают добавлением пятикратного объема деионизированной воды, после чего образец лиофильно высушивают. Процедуру добавления воды и упаривания повторяют трижды.
Продукты реакции растворяют в 80% трифторуксусной кислоте в концентрации 5%. Нерастворимый осадок отделяют центрифугированием при 10000 g в течение 10 мин и отбрасывают. Разделение продуктов реакции расщепления и очистку аципенсина-1 проводят с помощью обращенно-фазовой ВЭЖХ на препаративных колонках в системе ацетонитрил-вода с добавлением 0,1% ТФУ (фиг. 3). Детектирование ведут при длине волны 214 нм. Фракцию, содержащую аципенсин-1, собирают и лиофильно высушивают. Выход пептида в пересчете на 1 л клеточной культуры составляет 10 мг.
Для определения N-концевой аминокислотной последовательности аципенсина-1 применяют автоматическое микросеквенирование на приборе Procise 491 cLC Protein Sequencing System (PE Applied Biosystems). Идентификацию фенилтиогидантоин-производных аминокислот проводят на анализаторе 120А РТН Analyzer (РЕ Applied Biosystems). В основе методики автоматического определения аминокислотной последовательности пептидов и белков лежит метод химической деградации полипептидной цепи по методу Эдмана, позволяющий последовательно отщеплять N-концевые аминокислотные остатки в виде фенилтиогидантоинов и идентифицировать отщепленные производные аминокислот методом обращенно-фазовой ВЭЖХ. В результате автоматического микросеквенирования устанавливают идентичность аминокислотных последовательностей генно-инженерного и природного аципенсина-1.
Для определения молекулярной массы очищенного белка используют МАЛДИ-времяпролетный масс-спектрометрический анализ на приборе Reflex III (Bruker Daltonics), оснащенном УФ-лазером с длиной волны 336 нм. В качестве матрицы используют 2,5-дигидроксибензойную кислоту в смеси, содержащей 20% ацетонитрил и 0,1% трифторуксусную кислоту. Полученный пик с m/z 5295,9 (фиг. 4) соответствует молекулярному иону природного аципенсина-1 (расчетная молекулярная масса 5295,2).
Пример 4.
Тестирование антимикробной активности рекомбинантного аципенсина-1.
Антимикробную активность рекомбинантного аципенсина-1 определяют методом двукратных серийных разведений пептида в жидкой питательной среде LB/2 и инкубации с тестовыми культурами {Staphylococcus aureus 209Р и Escherichia coli С600).
Тест-культуры высевают из консерва в 10 мл жидкой среды LB без антибиотика и растят в течение 16 ч при 37°С и 220 об·мин-1. Аликвоту культуры объемом 300 мкл добавляют к 6 мл среды LB и инкубируют на роторной качалке при 37°С до достижения культурой оптической плотности OD600~1,0. После этого осаждают клетки центрифугированием, промывают культуру 10 мМ фосфатным буфером (рН 7,4), ресуспендируют клетки в этом же буфере в концентрации 2·105 КОЕ/мл.
Тестирование проводят в полистироловых 96-луночных планшетах. Аликвоты тест-культур объемом 50 мкл добавляют к 10 мкл растворов предварительно приготовленных разведений тестируемого пептида. После добавления культуры планшет инкубируют в течение 2 ч при 37°С и интенсивном перемешивании с частотой 1000 об·мин-1. После этого добавляют 60 мкл питательной среды LB (до суммарного объема в лунке 120 мкл) и продолжают инкубацию при 30°С и 1000 об·мин-1 в течение 20 ч. Значение МИК определяют визуально как минимальную концентрацию пептида, при которой отсутствует рост микроорганизмов.
Значение МИК аципенсина-1, определенное по вышеописанной методике, в отношении Staphylococcus aureus 209Р и Escherichia coli С600 составляет 0,6±0,1 мкМ.
SEQUENCE LISTING
<110> ИБХ РАН
Овчинникова, Татьяна
Баландин, Сергей
Кокряков, Владимир
Пантелеев, Павел
Шамова, Ольга
Болосов, Илья
<120> ПЛАЗМИДНЫЙ ВЕКТОР pET-His8-TrxL-Acip1, ШТАММ БАКТЕРИИ Escherichia
coli ДЛЯ ЭКСПРЕССИИ АНТИМИКРОБНОГО ПЕПТИДА АЦИПЕНСИНА-1 И СПОСОБ
ПОЛУЧЕНИЯ УКАЗАННОГО ПЕПТИДА
<130> (Reference Number)
<160> 3
<170> PatentIn version 3.5
<210> 1
<211> 50
<212> PRT
<213> Acipenser gueldenstaedtii
<400> 1
Ser Gly Arg Gly Lys Thr Gly Gly Lys Ala Arg Ala Lys Ala Lys Thr
1 5 10 15
Arg Ser Ser Arg Ala Gly Leu Gln Phe Pro Val Gly Arg Val His Arg
20 25 30
Leu Leu Arg Lys Gly Asn Tyr Ala Gln Arg Val Gly Ala Gly Ala Pro
35 40 45
Val Tyr
50
<210> 2
<211> 665
<212> DNA
<213> Artificial Sequence
<220>
<223> Expression cassette
<220>
<221> BglII restriction site
<222> (1)..(6)
<220>
<221> T7 promoter
<222> (30)..(46)
<220>
<221> His8-TrxL-Acip1 coding sequence
<222> (117)..(641)
<220>
<221> XhoI restriction site
<222> (660)..(665)
<400> 2
agatctgcgg gatctcgatc ccgcgaaatt aatacgactc actatagggg aattgtgagc 60
ggataacaat tcccctctag agtcgacgga tcttacttta agaaggagat atacatatga 120
gccatcacca ccaccatcac catcacggat ctagcgataa aattattcac ctgactgacg 180
acagttttga cacggatgta ctcaaagcgg acggggcgat cctcgtcgat ttctgggcag 240
agtggtgcgg tccgtgcaaa ctgatcgccc cgattctgga tgaaatcgct gacgaatatc 300
agggcaaact gaccgttgca aaactgaaca tcgatcaaaa ccctggcact gcgccgaaat 360
atggcatccg tggtatcccg actctgctgc tgttcaaaaa cggtgaagtg gcggcaacca 420
aagtgggtgc actgtctaaa ggtcagttga aagagttcct cgacgctaac ctggccggat 480
ctgatccgat gtctggaaga ggaaagactg gcggtaaagc tcgtgctaag gcaaagactc 540
gctcctccag ggcaggactg cagttcccag tcggccgtgt ccacaggctg ctgcggaagg 600
gaaactatgc ccagcgtgtc ggcgctggag ccccggtcta ttaaggatcc gcgaattctc 660
tcgag 665
<210> 3
<211> 175
<212> PRT
<213> Artificial Sequence
<220>
<223> Fusion protein
<400> 3
Met Ser His His His His His His His His Gly Ser Ser Asp Lys Ile
1 5 10 15
Ile His Leu Thr Asp Asp Ser Phe Asp Thr Asp Val Leu Lys Ala Asp
20 25 30
Gly Ala Ile Leu Val Asp Phe Trp Ala Glu Trp Cys Gly Pro Cys Lys
35 40 45
Leu Ile Ala Pro Ile Leu Asp Glu Ile Ala Asp Glu Tyr Gln Gly Lys
50 55 60
Leu Thr Val Ala Lys Leu Asn Ile Asp Gln Asn Pro Gly Thr Ala Pro
65 70 75 80
Lys Tyr Gly Ile Arg Gly Ile Pro Thr Leu Leu Leu Phe Lys Asn Gly
85 90 95
Glu Val Ala Ala Thr Lys Val Gly Ala Leu Ser Lys Gly Gln Leu Lys
100 105 110
Glu Phe Leu Asp Ala Asn Leu Ala Gly Ser Asp Pro Met Ser Gly Arg
115 120 125
Gly Lys Thr Gly Gly Lys Ala Arg Ala Lys Ala Lys Thr Arg Ser Ser
130 135 140
Arg Ala Gly Leu Gln Phe Pro Val Gly Arg Val His Arg Leu Leu Arg
145 150 155 160
Lys Gly Asn Tyr Ala Gln Arg Val Gly Ala Gly Ala Pro Val Tyr
165 170 175
1. Плазмидный вектор pET-His8-TrxL-Acip1 для экспрессии в клетках Escherichia coli антимикробного пептида аципенсина-1 в составе гибридного белка His8-TrxL-Acip1, состоящий из двух фрагментов ДНК:- BglII/XhoI-фрагмента с нуклеотидной последовательностью SEQ ID No. 2, содержащего промотор транскрипции Т7 РНК-полимеразы, lac-оператор, участок связывания рибосомы и участок, кодирующий аффинную метку, белок тиоредоксин и аципенсин-1;- BglII/XhoI-фрагмента плазмиды pET31b(+), содержащего терминатор транскрипции Т7 РНК-полимеразы, сайт инициации репликации, ген β-лактамазы и ген lac-peпpeccopa (lacI).
2. Штамм бактерии Escherichia coli BL21(DE3)/pET-His8-TrxL-Acip1 - продуцент гибридного белка His8-TrxL-Acip1, получаемый путем трансформации клеток родительского штамма BL21(DE3) плазмидным вектором pET-His8-TrxL-Acip1 по п. 1.
3. Способ получения антимикробного пептида аципенсина-1, включающий экспрессию гибридного белка His8-TrxL-Acip1 в штамме-продуценте Escherichia coli BL21(DE3)/pET-His8-TrxL-Acip1 по п. 2, лизис клеток, аффинную очистку гибридного белка His8-TrxL-Acip1 на металлохелатном носителе, расщепление гибридного белка His8-TrxL-Acip1 бромцианом по остатку метионина, введенному между последовательностями аципенсина-1 и тиоредоксина, повторную металлохелатную очистку и очистку целевого пептида методом обращенно-фазовой ВЭЖХ.