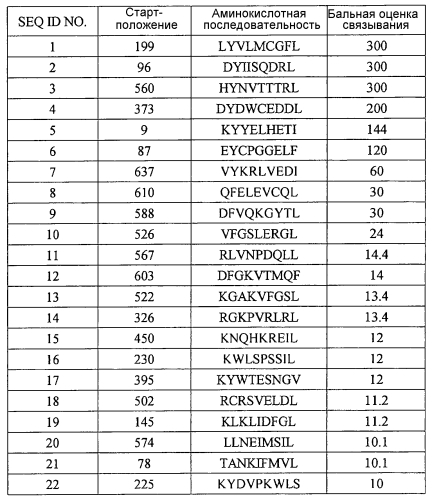
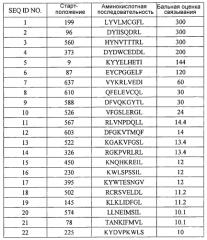
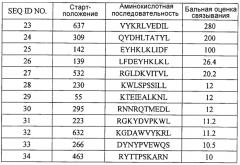
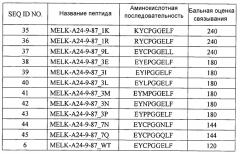
Модифицированные пептиды melk и содержащие их вакцины
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к иммуногенным эпитопам MELK, и может быть использовано в медицине для лечения пациента, страдающего раком или эндометриозом. Получают модифицированные эпитопные пептиды MELK, которые связываются с HLA-A*2402 и обладают более высокой способностью индуцирования цитотоксических T-лимфоцитов (ЦТЛ), чем у эпитопного пептида MELK дикого типа. 12 н.п. ф-лы, 10 ил., 2 табл., 15 пр.
Реферат
Область техники
[0001] Настоящее изобретение относится к области биологической науки, более конкретно, к области противораковой терапии. Конкретно, настоящее изобретение относится к новым пептидам, которые чрезвычайно эффективны в качестве противораковых вакцин, а также в качестве лекарственных средств для лечения и предотвращения опухолей (или заболеваний, связанных со сверхэкспрессией MELK).
Приоритет
Это заявка заявляет интересы предварительной заявки США № 61/297996 от 25.01.2010, содержание которой включено в данный документ ссылкой в полном объеме и для всех целей.
Уровень техники
[0002] Было продемонстрировано, что CD8-положительные цитотоксические Т-лимфоциты (ЦТЛ) распознают эпитопные пептиды, произошедшие из опухолеспецифических антигенов (TAA), обнаруженных на молекуле главного комплекса гистосовместимости (MHC) класса I, и затем убивают опухолевые клетки. После открытия семейства меланомных антигенов (MAGE) в качестве первого примера TAA, многие другие TAA были открыты посредством иммунологических методов (НПЛ 1, 2). Некоторые из этих TAA в настоящее время подвергаются клинической разработке в качестве иммунотерапевтических мишеней.
[0003] Предпочтительные TAA необходимы для пролиферации и жизнеспособности раковых клеток. Применение таких TAA в качестве мишеней для иммунотерапии может минимизировать хорошо описанный риск избегания раковыми клетками иммунного ответа, вызванного делецией, мутацией или отрицательной регуляцией TAA как следствия получаемой терапевтическими методами иммунной селекции. Соответственно, идентификация новых TAA, способных индуцировать мощный и специфичный противоопухолевый иммунный ответ, обеспечивает продолжение дальнейших разработок и клинических исследований стратегии пептидной вакцинации для различных типов рака (НПЛ 3-10). К настоящему времени, существует несколько сообщений о клинических испытаниях с использованием этих пептидов, произошедших из TAA (НПЛ 11-13). Хотя в этой области наблюдается некоторый успех, при этом сохраняется необходимость создания новых TAA в качестве иммунотерапевтических мишеней.
[0004] MELK, материнская эмбриональная киназа с доменом "лейциновая застежка", ранее была идентифицирована в качестве нового члена семейства серин-треониновых киназ snf1/AMPK, которые вовлечены в эмбриональное развитие млекопитающих (НПЛ 14). Было продемонстрировано, что этот ген играет важную роль в процессе возобновления стволовых клеток (НПЛ 15), в развитии клеточного цикла (НПЛ 16, 17) и в сплайсинге мРНК-предшественника (НПЛ 18). В этой связи с помощью профиля генной экспрессии с использованием полномасштабного геномного кДНК-микроэррея, содержащего 23040 генов, авторы настоящего изобретения идентифицировали MELK, который положительно регулируется при раке груди (НПЛ 19).
[0005] MELK положительно регулируется в некоторых раковых клетках, например, в раковых клетках легкого, мочевого пузыря, лимфомы и шейки матки. Нозерн-блот анализ множества человеческих тканей и раковых клеточных линий продемонстрировал, что MELK сверхэкспрессируется на значительно высоком уровне в огромном большинстве случаев рака груди и в клеточных линиях рака груди, но при этом не экспрессируется в нормальных жизненно важных органах, таких как сердце, печень, легкое и почки. Кроме того, что особенно важно, было продемонстрировано, что супрессия экспрессии MELK с помощью киРНК (siRNA) приводит в результате к росту клеток рака груди человека.
Опубликовано множество исследований на тему модификации аминокислотных остатков пептидов, которые являются критическими для взаимодействия с MHC или с Т-клеточным рецептором, для повышения иммуногенности пептидов (НПЛ 20, 21).
Список процитированной литературы
Документы патентной литературы
[0006] [ПТЛ 1] WO2005/073374
Непатентная литература
[0007] [НПЛ 1] Boon T, Int J Cancer 1993 May 8, 54(2): 177-80
[НПЛ 2] Boon T & van der Bruggen P, J Exp Med 1996 Mar 1, 183(3): 725-9
[НПЛ 3] Harris CC, J Natl Cancer Inst 1996 Oct 16, 88(20): 1442-55
[НПЛ 4] Butterfield LH et al., Cancer Res 1999, 59(13): 3134-42
[НПЛ 5] Vissers JL et al., Cancer Res 1999 Nov 1, 59(21): 5554-9
[НПЛ 6] van der Burg SH et al., J Immunol 1996 May 1, 156(9): 3308-14
[НПЛ 7] Tanaka F et al., Cancer Res 1997 Oct 15, 57(20): 4465-8
[НПЛ 8] Fujie T et al., Int J Cancer 1999 Jan 18, 80(2): 169-72
[НПЛ 9] Kikuchi M et al., Int J Cancer 1999 May 5, 81(3): 459-66
[НПЛ 10] Oiso M et al., Int J Cancer 1999 May 5, 81(3): 387-94
[НПЛ 11] Belli F et al., J Clin Oncol 2002 Oct 15, 20(20): 4169-80
[НПЛ 12] Coulie PG et al., Immunol Rev 2002 Oct, 188: 33-42
[НПЛ 13] Rosenberg SA et al., Nat Med 2004 Sep, 10(9): 909-15
[НПЛ 14] Heyer BS et al., Dev Dyn. 1999 Aug 215(4):344-51
[НПЛ 15] Nakano I et al., J Cell Biol. 2005 Aug 1, 170(3):413-27)
[НПЛ 16] Blot J et al., Dev Biol. 2002 Jan 15, 241(2):327-38
[НПЛ 17] Seong HA et al., Biochem J. 2002 Feb 1, 361(Pt 3):597-604
[НПЛ 18] Vulsteke V et al., J Biol Chem. 2004 Mar 5, 279(10):8642-7. Epub 2003 Dec 29
[НПЛ 19] Lin ML et al., Breast Cancer Res. 2007; 9 (1):R17
[НПЛ 20] Valmori D, et al., J Immunol. 1998 Feb 15;160(4):1750-8
[НПЛ 21] Salazar E, et al., Int J Cancer. 2000 Mar 15;85(6):829-38
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0008] Настоящее изобретение частично основано на открытии новых пептидов, которые могут служить в качестве подходящих мишеней иммунотерапии. Так как TAA, как правило, воспринимаются иммунной системой как "свои", и поэтому часто они не обладают иммуногенностью, поэтому открытие соответствующих мишеней имеет чрезвычайную важность. Осознавая, что MELK (как описано, например, в SEQ ID NO: 47, (кодируемый с помощью гена с регистрационным номером GenBank No.NM_014791 (SEQ ID NO: 46)) был идентифицирован по его положительной регуляции в тканях эндометриоза и в тканях рака, включающих, в частности, рак груди, рак мочевого пузыря, рак шейки матки, холангиоцеллюлярный рак, хронический миелоидный лейкоз (CML), колоректальный рак, рак пищевода, рак желудка, рак печени, немелкоклеточный рак легкого (NSCLC), лимфому, остеосаркому, рак яичника, рак поджелудочной железы, рак предстательной железы, светлоклеточный рак и мелкоклеточный рак легкого (SCLC) (WO2010/013485), настоящее изобретение фокусируется на MELK в качестве мишени противораковой иммунотерапии.
[0009] Для этой цели, настоящее изобретение направлено, по меньшей мере, частично на идентификацию специфических модифицированных эпитопных пептидов MELK, которые обладают способностью индуцировать цитотоксические T-лимфоциты (ЦТЛ), специфичные к MELK. Как обсуждается подробно ниже, мононуклеары периферической крови (PBMC), полученные от здоровых доноров, стимулировали с помощью пептидов-кандидатов, связывающих A*2402, и произошедших из эпитопного пептида MELK, т.e. из пептида дикого типа MELK-A24-9-87_WT (SEQ ID NO: 6). Затем создавали клеточные линии ЦТЛ со специфической цитотоксичностью против положительных по HLA-A24 клеток-мишеней, стимулированные с помощью каждого из пептидов-кандидатов. Все вместе эти результаты демонстрируют, что эти пептиды представляют собой рестриктированные по HLA-A24 эпитопные пептиды, которые могут индуцировать мощный и специфичный иммунный ответ против клеток, экспрессирующих MELK. Результаты дополнительно демонстрируют, что MELK является чрезвычайно иммуногенным, и что его эпитопы представляют собой эффективные мишени для противоопухолевой иммунотерапии.
[0010] Соответственно, целью настоящего изобретения является предложение выделенных пептидов модифицированного эпитопного пепида, полученного из MELK (SEQ ID NO: 47), специфически модифицированного эпитопного пептида для MELK-A24-9-87_WT дикого типа (SEQ ID NO: 6), или их иммунологически активных фрагментов, которые связываются с HLA-антигенами. Пептиды по настоящему изобретению обладают способностью индуцирования ЦТЛ. Такие пептиды могут использоваться для индуцирования CTL ex vivo или могут вводиться субъекту для индуцирования иммунного ответа против эндометриоза и раковых заболеваний, примеры которых включают, в частности, рак груди, рак мочевого пузыря, рак шейки матки, холангиоцеллюлярный рак, CML, колоректальный рак, рак пищевода, рак желудка, рак печени, NSCLC, лимфому, остеосаркому, рак яичника, рак поджелудочной железы, рак предстательной железы, светлоклеточный рак и SCLC. Предпочтительные пептиды представляют собой нонапептиды и, как правило, состоят из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 35-45. Из них пептиды, содержащие аминокислотную последовательность, выбранную из SEQ ID NO: 35, 41 и 44, демонстрировали особенно сильную способность индуцирования ЦТЛ, и, таким образом, они конкретно применяются по настоящему изобретению.
Настоящее изобретение также охватывает модифицированные пептиды, имеющие аминокислотные последовательности SEQ ID NO: 35-45, где одна, две или более аминокислот заменены, делетированы или добавлены при условии, что модифицированные пептиды сохраняют необходимую исходную способность исходного пептида индуцировать ЦТЛ.
[0011] Кроме того, в настоящем изобретении предлагаются выделенные полинуклеотиды, кодирующие любые из пептидов по настоящему изобретению. Эти полинуклеотиды могут использоваться для индуцирования антиген-экспрессирующих клеток (АПК) со способностью индуцирования ЦТЛ подобно пептидам по настоящему изобретению, или могут вводиться субъекту для индуцирования иммунного ответа против раковых заболеваний.
При введении субъекту, пептиды по настоящему изобретению презентируются на поверхности АПК так, чтобы индуцировать ЦТЛ, нацеленные на соответствующие пептиды. Таким образом, целью настоящего изобретения является предложение веществ, которые индуцируют ЦТЛ, причем такие вещества включают один или более пептидов по настоящему изобретению или полинуклеотиды, кодирующие такие пептиды. В настоящем изобретении дополнительно предлагаются фармацевтические агенты, включающие один или более пептидов по настоящему изобретению, или включающие полинуклеотиды, кодирующие такие пептиды, такие агенты применяются для лечения и/или профилактики эндометриоза и раковых заболеваний, примеры которых включают, в частности, рак груди, рак мочевого пузыря, рак шейки матки, холангиоцеллюлярный рак, CML, колоректальный рак, рак пищевода, рак желудка, рак печени, NSCLC, лимфому, остеосаркому, рак яичника, рак поджелудочной железы, рак предстательной железы, светлоклеточный рак и SCLC. Таким образом, еще одной целью настоящего изобретения является предложение фармацевтической композиции, составленной для лечения и/или предотвращения эндометриоза или рака, и/или для предотвращения его послеоперационного рецидива, и включающих любые из пептидов или полинуклеотидов по настоящему изобретению. Вместо них или дополнительно к пептидам или полинуклеотидам по настоящему изобретению вещества или лекарственные средства по настоящему изобретению необязательно могут включать в качестве активного ингредиента АПК или экзосомы, которые презентируют любые из пептидов по настоящему изобретению.
[0012] Пептиды и полинуклеотиды по настоящему изобретению могут использоваться для индуцирования АПК, которые презентируют на своей поверхности комплекс HLA-антигена и пептида по настоящему изобретению, например, путем приведения АПК, полученных из субъекта, в контакт с пептидом по настоящему изобретению, или путем введения полинуклеотида, кодирующего пептид по настоящему изобретению, в АПК. Такие АПК обладают высокой способностью индуцирования ЦТЛ против пептидов-мишеней и, таким образом, применяются для противораковой иммунотерапии. Соответственно, другой целью настоящего изобретения является предложение способов индуцирования АПК со способностью индуцирования ЦТЛ, а также АПК, полученных такими способами.
[0013] Следующей целью настоящего изобретения является предложение способов индуцирования ЦТЛ, которые включает стадию совместного культивирования CD8-положительных клеток с АПК или экзосомами, презентирующими пептид по настоящему изобретению на своей поверхности, или которые включают стадию введения гена, который включает полинуклеотид, кодирующий субъединицу T-клеточного рецептора (TCR), связывающуюся с пептидом по настоящему изобретению. ЦТЛ, получаемые с помощью способов по настоящему изобретению, также находят применение в лечении и/или предотвращении заболеваний, при которых сверхэкспрессируется MELK, таких как, в частности, эндометриоз, рак груди, рак мочевого пузыря, рак шейки матки, холангиоцеллюлярный рак, CML, колоректальный рак, рак пищевода, рак желудка, рак печени, NSCLC, лимфома, остеосаркома, рак яичника, рак поджелудочной железы, рак предстательной железы, светлоклеточный рак и SCLC. Таким образом, другой целью настоящего изобретения является предложение ЦТЛ, полученных способами по настоящему изобретению.
[0014] Кроме того, следующей целью настоящего изобретения является предложение способов индуцирования иммунного ответа против рака у нуждающегося в этом субъекта, причем такие способы включают стадию введения субъекту вещества или композиций, содержащих модифицированный MELK или его иммунологически активные фрагменты, полинуклеотиды, кодирующие модифицированный MELK или его фрагменты, и экзосомы или АПК, презентирующие модифицированный MELK или его фрагменты.
Применимость настоящего изобретения охватывает любое из ряда заболеваний, связанных со сверхэкспрессией MELK или произошедших в результате нее, включающих эндометриоз и раковые заболевания, примеры которых включают, в частности, рак груди, рак мочевого пузыря, рак шейки матки, холангиоцеллюлярный рак, CML, колоректальный рак, рак пищевода, рак желудка, рак печени, NSCLC, лимфому, остеосаркому, рак яичника, рак поджелудочной железы, рак предстательной железы, светлоклеточный рак и SCLC.
[0015] Более конкретно, в настоящем изобретении предлагается следующее:
[1] Выделенный пептид, связывающийся с HLA-антигеном или обладающий способностью индуцирования циотоксических T-лимфоцитов (ЦТЛ), где пептид состоит из аминокислотной последовательности SEQ ID NO: 6 или состоит из аминокислотной последовательности, включающей одну или более аминокислотных замен в аминокислотной последовательности SEQ ID NO: 6.
[2] Выделенный пептид [1], где HLA-антиген представляет собой HLA-A24.
[3] Выделенный пептид [1], где полипептид включает одну или более аминокислотных замен в положениях, выбранных из группы, состоящей из (a)-(d), в аминокислотной последовательности SEQ ID NO: 6:
(a) N-концевая аминокислота,
(b) третья аминокислота с N-конца,
(c) третья аминокислота с C-конца и
(d) C-концевая аминокислота.
[4] Выделенный пептид [3], где полипептид включает одну или несколько аминокислотных замен, выбранных из группы, состоящей из (i)-(iv):
(i) аминокислотная замена E на K или R в N-концевом положении аминокислотной последовательности SEQ ID NO: 6,
(ii) аминокислотная замена C на E, I, L, M, N или P в третьем положении с N-конца аминокислотной последовательности SEQ ID NO: 6,
(iii) аминокислотная замена E на N или Q в третьем положении с С-конца аминокислотной последовательности SEQ ID NO: 6, и
(iv) аминокислотная замена F на L в C-концевом положении аминокислотной последовательности SEQ ID NO: 6.
[5] Выделенный пептид [4], где пептид включает единственную аминокислотную замену.
[6] Выделенный пептид [4], где пептид включает две аминокислотные замены.
[7] Выделенный пептид [4], где пептид включает три аминокислотные замены.
[8] Выделенный пептид [4], где пептид включает четыре аминокислотных замены.
[9] Выделенный пептид [4]-[5], который включает аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 35-45.
[10] Выделенный пептид, связывающийся с HLA-антигеном и обладающий способностью индуцирования цитотоксических T-лимфоцитов (ЦТЛ), где указанный пептид состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 35-45, где 1, 2 или более аминокислот вставлены, заменены, делетированы или добавлены.
[11] Пептид [10], обладающий одной или двумя из следующих характеристик:
(a) вторая аминокислота от N-конца выбрана из группы, состоящей из фенилаланина, тирозина, метионина и триптофана; и
(b) C-концевая аминокислота выбрана из группы, состоящей из фенилаланина, лейцина, изолейцина, триптофана и метионина.
[12] Выделенный полинуклеотид, кодирующий пептид по любому из [1]-[11].
[13] Вещество для индуцирования ЦТЛ, где вещество включает один или более пептидов по любому из [1]-[11], или один или более полинуклеотидов [12].
[14] Фармацевтическая композиция для лечения и/или профилактики раковых заболеваний или эндометриоза, и/или для предотвращения их послеоперационных рецидивов, где композиция включает один или более пептидов по любому из [1]-[11], или один или более полинуклеотидов [12].
[15] Фармацевтическая композиция [14], где указанную композицию составляют для введения субъекту, чей HLA-антиген представляет собой HLA-A24.
[16] Фармацевтическая композиция [14] или [15], где указанную композицию составляют для лечения рака или эндометриоза.
[17] Способ индуцирования антиген-презентирующей клетки (АПК) со способностью индуцирования ЦТЛ, где способ включает одну из следующих стадий:
(a) приведения АПК в контакт с пептидом по любому из [1]-[11] in vitro, ex vivo или in vivo; и
(b) введение в АПК полинуклеотида, кодирующего пептид по любому из [1]-[9].
[18] Способ индуцирования ЦТЛ с помощью любого из способов, включающих, по меньшей мере, одну из следующих стадий:
(a) совместное культивирование CD8-положительных T-клеток с АПК, которые презентируют на своей поверхности комплекс HLA-антигена и пептида по любому из [1]-[11];
(b) совместное культивирование CD8-положительных T-клеток с экзосомами, которые презентируют на своей поверхности комплекс HLA-антигена и пептида по любому из [1]-[11]; и
(c) введение в Т-клетку гена, который включает полинуклеотид, кодирующий полипептид субъединицы T-клеточного рецептора (TCR), связывающегося с пептидом по любому из [1]-[9].
[19] Выделенная АПК, которая презентирует на своей поверхности комплекс HLA-антигена и пептида по любому из [1]-[11].
[20] АПК [19], где указанную АПК индуцируют с помощью способа [17].
[21] Выделенный ЦТЛ, мишенью которого является пептид по любому из [1]-[11].
[22] ЦТЛ [21], который индуцируют с помощью способа по [18], и
[23] Способ индуцирования у субъекта иммунного ответа против рака или эндометриоза, включающий введение субъекту композиции, включающей пептид по любому из [1]-[11], его иммунологически активный фрагмент или полинуклеотид, кодирующий пептид или его фрагмент.
[0016] Следует понимать, что и вышеописанная сущность изобретения и последующее подробное описание представляют собой типичные воплощения, и не ограничивают изобретения или других альтернативных воплощений изобретения.
Дополнительно к вышеописанным другие цели и признаки изобретения станут более очевидны после рассмотрения следующего подробного описания совместно с приложенными чертежами и примерами. Однако следует понимать, что и вышеописанная сущность изобретения и последующее подробное описание представляют собой типичные воплощения, и не ограничивают изобретения или других альтернативных воплощений изобретения. Конкретно, в то время как изобретение описывается в данном документе со ссылкой на ряд определенных воплощений, понятно, что описание является иллюстрацией изобретения и не рассматривается как ограничение изобретения. Разнообразные модификации и применения могут осуществляться специалистами в данной области, не выходя за рамки сущности и смысла изобретения, описанного в прилагаемой формуле изобретения. Аналогично, другие цели, признаки, приоритеты и преимущества настоящего изобретения будут очевидны из данной сущности изобретения и из конкретных воплощений, описанных ниже, и будут полностью понятны специалистам в данной области. Такие цели, признаки, приоритеты и преимущества будут очевидны из вышеописанного вместе с приложенными примерами, данными, чертежами и со всеми обоснованными выводами, которые могут быть из них сделаны, при индивидуальном рассмотрении или при рассмотрении совместно со ссылками, включенными в данный документ.
Краткое описание чертежей
[0017] Различные аспекты и применения настоящего изобретения будут очевидны специалисту в данной области при рассмотрении краткого описания чертежей и подробного описания настоящего изобретения и его предпочтительных воплощений, которые приведены далее.
[0018] [Фиг.1] На Фиг.1 изображены фотографии, демонстрирующие результаты анализов иммуноферментных пятен (ELISPOT) для IFN-гамма на ЦТЛ донора А, индуцированных с помощью пептидов, полученных из MELK. ЦТЛ, стимулированные с помощью MELK-A24-9-87 (SEQ ID NO: 6) (a) MELK-A24-10-637 (SEQ ID NO: 23) (b) MELK-A24-9-199 (SEQ ID NO: 1) (d) и MELK-A24-9-78 (SEQ ID NO: 21) (e), демонстрировали потенциальную способность продуцирования IFN-гамма. Напротив, в качестве типичных отрицательных данных, было продемонстрировано отсутствие специфичного продуцирования IFN-гамма из ЦТЛ, стимулированных с помощью MELK-A24-9-96 (SEQ ID NO: 2) (c). На чертежах "+" обозначает продуцирование IFN-гамма против клеток-мишеней, стимулированных с помощью родственного пептида, и "-" обозначает продуцирование IFN-гамма против клеток-мишеней, не стимулированных с помощью каких-либо пептидов.
[0019] [Фиг.2] На Фиг.2 изображены линейные графики, демонстрирующие результат получения клеточных линий ЦТЛ. Мощное продуцирование IFN-гамма детектировали с помощью анализа ELISA для IFN-гамма из линий ЦТЛ, стимулированных с помощью MELK-A24-9-87 (SEQ ID NO: 6) (a), MELK-A24-10-637 (SEQ ID NO: 23) (b) и MELK-A24-9-199 (SEQ ID NO: 1) (c). На чертежах "черный ромб" обозначает продуцирование IFN-гамма против клеток-мишеней, стимулированных с помощью родственных пептидов, и "белый квадрат" обозначает продуцирование IFN-гамма против клеток-мишеней, не стимулированных с помощью каких-либо пептидов.
[0020] [Фиг.3] На Фиг.3 изображен линейный график, демонстрирующий результат получения клона ЦТЛ. Мощное продуцирование IFN-гамма детектировали с помощью анализа ELISA для IFN-гамма из клона ЦТЛ, стимулированного с помощью MELK-A24-9-87 (SEQ ID NO: 6) (a) и MELK-A24-9-199 (SEQ ID NO: 1) (b). На чертежах "черный ромб" обозначает продуцирование IFN-гамма против клеток-мишеней, стимулированных с помощью MELK-A24-9-87 (SEQ ID NO: 6), и "белый квадрат" обозначает продуцирование IFN-гамма против клеток-мишеней, не стимулированных с помощью каких-либо пептидов.
[0021] [Фиг.4] На Фиг.4 изображен линейный график, демонстрирующий специфическую активность ЦТЛ против клеток-мишеней, которые экзогенно экспрессируют MELK и HLA-A*2402. Клетки COS7, трансфицированные HLA-A*2402 или полноразмерным геном MELK, получали в качестве контролей. Клон ЦТЛ, созданный с использованием MELK-A24-9-87 (SEQ ID NO: 6), демонстрировал специфическую активность ЦТЛ против клеток COS7, трансфицированных обоими MELK и HLA-A*2402 (черный ромб). С другой стороны, не детектировали никакой значительной специфической активности ЦТЛ против клеток-мишеней, экспрессирующих или HLA-A*2402 (белый треугольник) или MELK (белый круг).
[0022] [Фиг.5А] На Фиг.5А изображены фотографии, демонстрирующие результат анализов иммуноферментных пятен (ELISPOT) для IFN-гамма на ЦТЛ донора В, индуцированных с помощью модифицированных пептидов, полученных из MELK-A24-9-87_WT (SEQ ID NO: 6). ЦТЛ, стимулированные с помощью MELK-A24-9-87_1K (SEQ ID NO: 35) (a), MELK-A24-9-87_3M (SEQ ID NO: 41) (b) и MELK-A24-9-87_7N (SEQ ID NO: 44) (c), демонстрировали потенциальную способность продуцирования IFN-гамма, что обозначено квадратом. С другой стороны, не детектировали пептидо-специфичного продуцирования IFN-гамма из ЦТЛ, стимулированных с помощью MELK-A24-9-87_WT (SEQ ID NO: 6) (d). На чертежах "+" обозначает продуцирование IFN-гамма против клеток-мишеней, стимулированных с помощью родственного пептида, и "-" обозначает продуцирование IFN-гамма против клеток-мишеней, не стимулированных с помощью каких-либо пептидов.
[0023] [Фиг.5B] На Фиг.5В изображены фотографии, демонстрирующие результат анализов иммуноферментных пятен (ELISPOT) для IFN-гамма на ЦТЛ донора С, индуцированных с помощью модифицированных пептидов, полученных из MELK-A24-9-87_WT (SEQ ID NO: 6). ЦТЛ, стимулированные с помощью MELK-A24-9-87_7N (SEQ ID NO: 44) (a), демонстрировали потенциальную способность продуцирования IFN-гамма. С другой стороны, не детектировали пептидо-специфичного продуцирования IFN-гамма из ЦТЛ, стимулированных с помощью MELK-A24-9-87_WT (SEQ ID NO: 6) (b). На чертежах "+" обозначает продуцирование IFN-гамма против клеток-мишеней, стимулированных с помощью родственного пептида, и "-" обозначает продуцирование IFN-гамма против клеток-мишеней, не стимулированных с помощью каких-либо пептидов. Клетки в лунке номер #14, стимулированные с помощью MELK-A24-9-87_7N (SEQ ID NO: 44), наращивали для получения линий ЦТЛ. Клетки в лунке номер #4, стимулированные с помощью MELK-A24-9-87_WT (SEQ ID NO: 6), которые также демонстрировали минорное продуцирование IFN-гамма, также наращивали.
[0024] [Фиг.6] На Фиг.6a-c изображены линейные графики, демонстрирующие результат получения линий ЦТЛ, индуцированных из PBMC донора B. Мощное продуцирование IFN-гамма детектировали с помощью анализа ELISA для IFN-гамма из линий ЦТЛ, стимулированных с помощью MELK-A24-9-87_1K (SEQ ID NO: 35) (a), MELK-A24-9-87_3M (SEQ ID NO: 41) (b) и MELK-A24-9-87_7N (SEQ ID NO: 44) (c). На чертежах "черный ромб" обозначает продуцирование IFN-гамма против клеток-мишеней, стимулированных с помощью MELK-A24-9-87_WT (SEQ ID NO: 6), и "белый квадрат" обозначает продуцирование IFN-гамма против клеток-мишеней, стимулированных с помощью постороннего HIV-пептида. На Фиг.6d-e изображены линейные графики, демонстрирующие результат получения линий ЦТЛ, индуцированных из PBMC донора C. Продуцирование IFN-гамма детектировали с помощью анализа ELISA для IFN-гамма из линий ЦТЛ, стимулированных с помощью MELK-A24-9-87_7N (SEQ ID NO: 44) (d). Линию ЦТЛ не получали из PBMC, стимулированных с помощью MELK-A24-9-87_WT (SEQ ID NO: 6) (e). На чертежах "черный ромб" обозначает продуцирование IFN-гамма против клеток-мишеней, стимулированных с помощью MELK-A24-9-87_WT (SEQ ID NO: 6), и "белый квадрат" обозначает продуцирование IFN-гамма против клеток-мишеней, стимулированных с помощью постороннего HIV-пептида.
[0025] [Фиг.7] На Фиг.7a-c изображены линейные графики, демонстрирующие результат получения клонов ЦТЛ, индуцированных из PBMC донора B. Мощное продуцирование IFN-гамма детектировали с помощью анализа ELISA для IFN-гамма из линий ЦТЛ, стимулированных с помощью MELK-A24-9-87_1K (SEQ ID NO: 35) (a), MELK-A24-9-87_3M (SEQ ID NO: 41) (b) и MELK-A24-9-87_7N (SEQ ID NO: 44) (c) На чертеже "черный ромб" обозначает продуцирование IFN-гамма против клеток-мишеней, стимулированных с помощью MELK-A24-9-87_WT (SEQ ID NO: 6), и "белый квадрат" обозначает продуцирование IFN-гамма против клеток-мишеней, стимулированных с помощью посторонних HIV-пептидов. На Фиг.7d изображен линейный график, демонстрирующий результат получения клона ЦТЛ, индуцированного из PBMC донора C. Продуцирование IFN-гамма детектировали с помощью анализа ELISA для IFN-гамма из клона ЦТЛ, стимулированных с помощью MELK-A24-9-87_7N (SEQ ID NO: 44). На чертеже, "черный ромб" обозначает продуцирование IFN-гамма против клеток-мишеней, стимулированных с помощью MELK-A24-9-87_WT (SEQ ID NO: 6), и "белый квадрат" обозначает продуцирование IFN-гамма против клеток-мишеней, стимулированных с помощью посторонних HIV-пептидов.
[0026] [Фиг.8] На Фиг.8 изображены линейные графики, демонстрирующие специфическую активность ЦТЛ против клеток-мишеней, которые эндогенно экспрессируют MELK и HLA-A*2402. (a) Линия ЦТЛ, полученная с помощью MELK-A24-9-87_7N (SEQ ID NO: 44), демонстрировала специфическую активность ЦТЛ против опухолевых клеточных линий, экспрессирующих оба, MELK и HLA-A*2402 (черный ромб; KLM-1, черный треугольник; MDA-MB-435S), по сравнению с другими клеточными линиями, которые экспрессировали MELK, но не экспрессировали HLA-A*2402 (белый круг; T47D, белый квадрат; KP-1N). (b) Было продемонстрировано ингибирование ответа ЦТЛ с помощью обработки mAb, связывающим HLA класса I. Клон ЦТЛ, полученный с помощью MELK-A24-9-87_7N (SEQ ID NO: 44), продемонстрировал специфическую активность ЦТЛ против KLM-1 (черный ромб) по сравнению с KP-1N (белый квадрат). Продуцирование IFN-гамма против KLM-1 (черный ромб) ингибировалось с помощью обработки с mAb, связывающим HLA класса I (белый ромб) по сравнению с обработкой нормальным мышиным IgG в качестве контроля (Hyphen).
[0027] [Фиг.9] На Фиг.9 изображены линейные графики, демонстрирующие результат реактивности клона ЦТЛ, специфичного к MELK-A24-9-199 (SEQ ID NO: 1). На Фиг.9(а), "черный ромб" обозначает продуцирование IFN-гамма против клеток-мишеней, стимулированных с помощью MELK-A24-9-199 (SEQ ID NO: 1), и "белый квадрат" обозначает продуцирование IFN-гамма против клеток-мишеней, не стимулированных с помощью каких-либо пептидов. На фигуре Фиг.9(b), продуцирование IFN-гамма против опухолевых клеточных линий, которые экспрессируют оба, MELK и HLA-A*2402 (черный ромб; KLM-1) и которые экспрессируют MELK, но не экспрессируют HLA-A*2402 (белый квадрат; KP-1N).
Описание воплощений
[0028] Хотя любые материалы и методы, подобные или эквивалентные тем, что описаны в настоящем документе, также могут использоваться на практике или при тестировании настоящего изобретения, далее будут описаны предпочтительные методы, устройства и материалы. Однако, перед тем как описывать материалы и методы настоящего изобретения, следует понимать, что настоящее изобретение не ограничено конкретными размерами, формами, направлениями, материалами, методологиями, протоколами и т.д., описанными в данном документе, поскольку они могут варьироваться согласно стандартной процедуре эксперимента и его оптимизации. Также следует понимать, что использованная здесь терминология необходима только для целей описания конкретных вариантов или воплощений и не предназначена для ограничения рамок настоящего изобретения, которые будут ограничены только прилагаемой формулой изобретения.
[0029] Описание каждой публикации, патента или патентной заявки, упомянутой в данном описании изобретения, включено в данный документ конкретной ссылкой в полном объеме. Однако ничто в данном документе не должно быть истолковано как признание того, что изобретение не имеет право датировать более ранним числом такие раскрытия посредством предшествующего изобретения.
Если не определено иначе, то все технические и научные термины, использованные в данном документе, имеют тот же смысл, который вкладывается в них обычным специалистом в области, к которой принадлежит настоящее изобретение. В случае противоречий, они будут урегулированы настоящим описанием изобретения, включающим определения. Кроме того, материалы, методы и примеры представлены только для иллюстрации, и не предназначены для ограничения.
[0030] I. Определения
Слова "а", "an" и "the", используемые в данном документе, означают "по меньшей мере, один" если конкретно не указано иначе.
Термины "полипептид", "пептид" и "белок" применяются взаимозаменяемо в данном документе для обозначения полимера из аминокислотных остатков. Термины применяются к аминокислотным полимерам, в которых один или более аминокислотных остатков являются модифицированными остатками или искусственным остатком, таким как искусственный химический миметик соответствующей естественной аминокислоты, а также термины применяются к естественным аминокислотным полимерам.
Термин "олигопептид", иногда используемый в настоящем описании, используется для обозначения пептидов по настоящему изобретению, длина которых составляет 20 остатков или менее, как правило, 15 остатков или менее, и которые как правило содержат от примерно 8 до примерно 11 остатков, часто 9 или 10 остатков.
[0031] При использовании в данном документе, термин "аминокислота" относится к естественным и синтетическим аминокислотам, а также к аналогам аминокислот и аминокислотным миметикам, которые функционируют так же как и естественные аминокислоты. Аминокислоты могут представлять собой либо L-аминокислоты, либо D-аминокислоты. Естественными аминокислотами являются те, которые кодируются генетическим кодом, а также те аминокислоты, которые модифицируются в клетках после трансляции (например, гидроксипролин, гамма-карбоксиглутамат и O-фосфосерин). Термин "аминокислотный аналог" относится к соединениям, которые имеют такую же основную химическую структуру, что и естественная аминокислота, (альфа-углеродный атом, связанный с водородом, карбоксильной группой, аминогруппой и R-группой), но содержат модифицированную R-группу или модифицированные остовы (например, гомосерин, норлейцин, метионин сульфоксид, метионин метил сульфоний). Термин "аминокислотный миметик" относится к химическим соединениям, которые имеют разные структуры, но аналогичные функции с естественными аминокислотами.
[0032] Аминокислоты могут обозначаться в данном документе либо по их широко известному трехбуквенному коду, либо по однобуквенному коду, рекомендованному Комиссией по биохимической номенклатуре IUPAC-IUB.
Термины "ген", "полинуклеотид", "нуклеотид" и "нуклеиновая кислота" применяются в данном документе взаимозаменяемо и до тех пор, пока конкретно не определено иначе, аналогично аминокислотам обозначаются с помощью их широко применяемых однобуквенных кодов.
[0033] Термины "композиция", "вещество" или "агент" используются в данном документе взаимозаменяемо для обозначения продукта, который включает конкретные ингредиенты в конкретном количестве, а также любой продукт, который получают прямо или косвенно из конкретных ингредиентов в конкретном количестве. Подразумевается, что такой термин в отношении "фармацевтической композиции" охватывает продукт, включающий активный ингредиент(ы) и любой инертный ингредиент(ы), который составляет носитель, а также любой продукт, который получают прямо или косвенно в результате комбинации, комплексообразования или агрегации любых двух или более ингредиентов, или в результате диссоциации одного или более ингредиентов, или в результате реакций других типов или в результате взаимодействий одного или более ингредиентов. Соответственно, в контексте настоящего изобретения термин "фармацевтическая композиция" обозначает любую композицию, полученную путем примешивания соединения по настоящему изобретению и фармацевтически или физиологически приемлемого носителя. При использовании в данном документе термин "фармацевтически приемлемый носитель" или "физиологически приемлемый носитель", обозначает фармацевтически или физиологически приемлемый материал, композицию, вещество или носитель, включающие, в частности, жидкий или твердый наполнитель, разбавитель, вспомогательное вещество, растворитель или инкапсулирующий материал, вовлеченный в перенос или в транспорт целевых переносимых полифармакофоров от одного органа или области организма в другой орган или в другую область организма.
[0034] Термин "активный ингредиент" обозначает в данном документе вещество в агенте или в композиции, которое биологически или физиологически активно. Конкретно, в фармацевтическом агенте или в композиции "активный ингредиент" обозначает вещество, которое демонстрирует целевой фармакологический эффект. Например, в случае фармацевтических агентов или композиций для применения в лечении или предотвращении рака, активные ингредиенты в агентах или композициях могут приводить к получению, по меньшей мере, одного биологического или физиологического воздействия прямого или косвенного на раковые клетки и/или ткани. Предпочтительно, такое воздействие может включать уменьшение или ингибирование роста раковых клеток, разрушение или уничтожение раковых клеток и/или тканей и так далее. Как правило, косвенный эффект активных ингредиентов это индуцирование ЦТЛ, распознающих или уничтожающих раковые клетки. Перед включением в состав, "активный ингредиент" также обозначается как "активное вещество", "лекарственное вещество" или "технический продукт".
Фармацевтические агенты или композиции по настоящему изобретению находят конкретное применение в качестве вакцин. В контексте настоящего изобретения термин "вакцина" (также обозначаемый как "иммуногенная композиция") обозначает вещество, которое обладает функцией индуцирования противоопухолевого иммунитета при введении животным.
[0035] До тех пор, пока не определено иначе, термин "рак" обозначает раковые заболевания, при которых сверхэкспрессируется ген MELK, примеры которых включают, в частности, эндометриоз и раковые заболевания, примеры которых включают, в частности, рак груди, рак мочевого пузыря, рак шейки матки, холангиоцеллюлярный рак, CML, колоректальный рак, рак пищевода, рак желудка, рак печени, NSCLC, лимфому, остеосаркому, рак яичника, рак поджелудочной железы, рак предстательной железы, светлоклеточный рак и SCLC.
До тех пор, пока не определено иначе, термин "эндометриоз" обозначает эндометриоз, при котором сверхэкспресссируется ген MELK, причем примеры эндометриоза включают, в частности, стадию I (минимальный), II (спокойный), III (умеренный), или IV (тяжелый) эндометриоза, классифицированного с помощью классификации пересмотренной шкалы Американского общества Фертильности. Альтернативно, примеры эндометриоза включают, в частности, стадию I, II, III, или IV эндометриоза, классифици