Способ оценки цитотоксичности рибосом-инактивирующих белков ii типа in vitro
Иллюстрации
Показать всеИзобретение относится к области токсикологии и может быть использовано для определения в образцах жидкости или растений токсичных веществ, а именно рибосом-инактивирующих белков II типа. Для повышения селективности способа и сокращения времени его осуществления культивирование клеток в опытной культуре осуществляют 15 и более мин, забирают лизаты клеток из опытной и контрольной культур клеток, выделяют РНК, определяют общего содержания рибосомальной 28S РНК и содержание модифицированных фрагментов 28S рибосомальной РНК методом ПЦР-РВ, при этом общее содержание 28S рибосомальной РНК определяют с использованием олигонуклеотидов, соответствующих прямому праймеру к дистальному фрагменту 28S рРНК SEQ1 и обратному праймеру к дистальному фрагменту 28S рРНК SEQ2 соответственно; содержание модифицированных 28S рибосомальных РНК определяют с использованием олигонуклеотидов, соответствующих прямому праймеру к модифицированному фрагменту 28S рРНК SEQ3, и обратному праймеру к модифицированному фрагменту 28S рРНК SEQ4; при превышении содержания модифицированных 28S рибосомальных РНК в опытной культуре в сравнении с контрольной делают заключение о цитотоксичности рибосом-инактивирующих белков II типа; определяют общее количество 28S рибосомальных РНК и количество модифицированных 28S рибосомальных РНК в опытной культуре клеток, и по доле модифицированных 28S рибосомальных РНК в процентах оценивают уровень цитотоксичности. 6 з.п. ф-лы, 3 ил., 1 табл.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области токсикологии и может быть использовано для определения в образцах жидкости или растений токсичных веществ, а именно рибосом-инактивирующих белков.
Рибосом-инактивирующие белки (РИБ) представлены во многих растениях. Согласно своей первичной структуре РИБ могут быть разделены на две категории - тип I и тип II. РИБ II типа обладают высокой цитотоксичностью и имеют похожие механизмы действия.
К РИБ II типа относятся абрин, рицин, вискумин и шига-токсин. РИБ II типа состоят из двух гликопротеинов, таких как A-цепь и В-цепь, которые соединены дисульфидной связью. В-цепь опосредует клеточную интернализацию токсина посредством высокой аффинности к клеточным фрагментам и позволяет обратимо связываться со специфическим рецептором на поверхности клеточной мембраны. При связывании со специфическим рецептором проникновение A-цепи внутрь клетки происходит посредством эндоцитоза. A-цепь гидролизует N-гликозидную связь по аденозину в положении 4324 в 28S рибосомной РНК большой субъединице эукариотической РНК. Впоследствии депуринизация предотвращает связывание фактора элонгации EF-2 на рибосоме, в результате чего останавливается синтез белка. РИБ II типа обладают высокой токсичностью даже при низких концентрациях. Наиболее низкий предел LD50 известен для рицина и составляет приблизительно 3 мг/кг при пероральном введении для человека [1].
На клеточном уровне РИБ II типа убивают клетку через ингибирование белкового синтеза в течение 1-3 ч. В зависимости от дозы и пути введения в организм клинические признаки обнаруживаются через 8-24 ч. Среди многих известных токсинов II типа - абрин, рицин и II типа - токсин классифицируются как биологически опасные вещества, в виду их широкой доступности и легкости производства. Кроме того, эти белки обладают высокой стабильностью и устойчивостью при распространении в окружающей среде.
РИБ II типа, включая рицин, были исследованы и протестированы в качестве биологического оружия. Природная высокая токсичность делает их потенциальными кандидатами для использования во время войны или при террористических актах. Поэтому для определения цитотоксичности РИБ II типа требуются методы, позволяющие фиксировать проявление специфической N-гликозидазной активности в определяемом образце.
Под цитотоксичностью понимают появление патологических изменений в клетках при действии физических, химических и биологических агентов [2]. Наиболее часто используемыми методами цитотоксичности РИБ является определение активности лактатдегидрогеназы [3], включения [3Н] тимидина в ДНК [4], МТТ-тест [5, 6], которые входят в «золотой стандарт» оценки жизнеспособности клеток. Недостатком известных способов является то, что они не обладают селективностью в отношении РИБ II типа.
Известен способ определения цитотоксичности рицина на клетках рака легкого А549 с применением МТТ-теста в качестве референсного метода. МТТ-тест основан на способности митохондриальных и цитоплазматических дегидрогеназ живых метаболически активных клеток восстанавливать бесцветный водорастворимый 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолиум бромид (МТТ) в формазан, который кристаллизуется внутри клеток. Кристаллы формазана переводят в раствор с помощью органических растворителей, таких как диметилсульфоксид (ДМСО), с последующей спектрофотометрией. Восстановление клетками нитросинего тетразолия показывает метаболическую активность дегидрогеназ и является адекватным показателем жизнеспособности клеток в культуре, что позволяет оценить специфическую гибель клеток, вызванную тем или иным цитотоксическим агентом. Заявляемый авторами способ предполагает культивирование клеток на 12 мм MgF2, помещенных в специальную камеру (Attofluor cell chamber) с 25 мм подложкой из MgF2 в качестве основания под Рамановским микроспектрометром. Клетки культивируются в HBBSS буфере при снятии Рамановского спектра. Технология позволяет мониторировать биохимические особенности живой клетки в течение длительных периодов по измерению спектра Рамановского рассеяния. Способ неинвазивный, быстрый и не предполагает использование меток, однако, несмотря на чувствительность и высокое разрешение метода с точки зрения выявления признаков клеточной гибели, данный способ не обладает специфичностью к воздействующему токсическому веществу, в данном случае, РИБ II типа [7].
Известен способ определения in vitro цитотоксичности коклюшного токсина в субстанции, включающий культивирование дендритных клеток, введение в культуру клеток тестируемого образца токсина, разведенного в культуральной среде, определение в клетках уровня экспрессии IL2, IFNg, ХСК1, CD69, CSF2 и CXCL10 и сравнение с рефересным значением в контрольной культуре, не содержащей тестируемого образца. При возрастании уровня экспрессии хотя бы для одного гена из указанного перечня более чем в два раза делают заключение о наличии в тестируемой субстанции токсина [8]. Коклюшный токсин относится к семейству АВ5-токсинов - шестикомпонентных белковых комплексов, секретируемых патогенными бактериями. Из рассматриваемых РИБ II типа только шига-токсин относится к этому семейству, однако механизм цитотоксического действия их различен, и указанный способ является недостаточно селективным по отношению к шига-токсину.
Известен способ оценки цитотоксичности рицина, включающий помещение клеток Vero в планшеты для культивирования клеток, снабженные микроэлектродами, соединенными с датчиком сопротивления электронной системы детектирования клеток (RT-CES) в режиме реального времени, подают низкое напряжение, возбуждающее слабое электрическое поле, детектируют сопротивление, по которому определяют жизнеспособность клеток: чем больше клеток прикреплено к поверхности, тем выше детектируемое сопротивление, фиксируемое системой RT-RES как жизнеспособность клеток [9]. Способ позволяет детектировать активный рицин и аналогичные белки через 3,5 ч после введения тестируемого вещества в течение 24-60 часов. Недостатком известного способа является то, что он не обладает селективностью к РИБ II типа. Другим недостатком способа является то, что заявленную чувствительность - 0,4 нг/мл достигают через 24 ч воздействия рицина на клетки Vero. Это обусловлено тем временем, через которое начинается отслаивание гибнущих клеток от поверхности планшета под действием токсина. Кроме того, для проведения анализа требуется специальное оборудование, коммерчески доступное у единственного производителя.
Известен способ оценки цитотоксичности рицина (прототип), включающий введение в лунки с культурой клеток Vero или СНО раствора рицина в культуральной среде в различных концентрациях, культивирование клеток в опытной культуре с добавлением рицина и в контрольной культуре без добавления рицина в течение 24 часов, затем инкубирование клеток с МТТ в течение 4 часов, отмывание клеток и введение диметилсульфоксида, измерение методом спектрофотометрии, как указано выше, жизнеспособности клеток в опытной культуре в сравнении с контрольной. При превышении доли нежизнеспособных клеток в опытной культуре делают заключение о цитотоксичности рицина. Способ может быть дополнен оценкой цитотоксичности по способности рицина подавлять образование колоний клеток, для чего клетки культивируют с раствором рицина в течение 5-7 дней и окрашивают метиленовым синим, позволяющим определить жизнеспособность клеток [10]. Недостатком данного способа, как и предыдущего, является то, что он не является селективным, чувствительным для РИБ II типа, требует достаточно много времени для анализа.
Задачей, на решение которой направлено изобретение, является повышение селективности способа, сокращение длительности анализа.
Решение поставленной задачи достигается тем, что в качестве биомаркера цитотоксического действия РИБ II типа используется уровень числа модифицированных 28S рибосомных РНК (рРНК) в результате осуществления реакции по N-гликозидазной активности токсина. Предложенный способ включает культивирование клеток млекопитающих или человека в контрольной и опытной культуре, введение тестируемого образца, содержащего рибосом-инактивирующие белки II типа, в опытную культуру клеток, культивирование клеток в опытной культуре клеток не менее 15 мин, забор лизатов клеток из опытной и контрольной культур клеток, выделение РНК, определение общего содержания рибосомальной 28S рРНК и содержания модифицированных фрагментов 28S рРНК методом ПЦР-РВ в лизатах из контрольной и опытной культур клеток, при этом общее содержание рибосом определяют с использованием олигонуклеотидов, имеющих нуклеотидную последовательность SEQ1, SEQ2; содержание модифицированных 28S рРНК определяют с использованием олигонуклеотидов, имеющих нуклеотидную последовательность SEQ3, SEQ4. Количественное определение рРНК проводят со стадией накопления калибратора на образце кДНК опытной культуры с использованием олигонуклеотидов, имеющих нуклеотидную последовательность SEQ1, SEQ4 методом ПЦР-РВ; после накопления калибратора проводят расчет его концентрации в очищенном ПЦР-продукте в копиях на мкл через число Авогадро; проводят ПЦР-РВ на кДНК из контрольной культуры с добавлением известного числа копий калибратора и строят калибровочную кривую зависимости значения порогового цикла для дистального и модифицированного фрагментов 28S рРНК от числа внесенных копий калибратора; проводят аппроксимацию полученной зависимости по логарифмической функции вида у=k·ln(x)+а, где у - это значение порогового цикла для модифицированного или дистального фрагментов, k и а - подобранные коэффициенты, и определяют количество копий дистального и модифицированного фрагментов 28S рРНК в объеме ПЦР-реакции; по калибровочной кривой пересчитывают значение порогового цикла для дистального фрагмента 28S рРНК в количество всех рРНК, а по значению порогового цикла модифицированного фрагмента 28S рРНК в количество модифицированных 28S рРНК; пересчет на количество рибосом в клетке ведут на основании данных о выходе массы РНК с известного числа клеток в культуре, количества взятой РНК на проведение обратной транскрипции и степени разбавления кДНК в ПЦР. При превышении содержания модифицированных 28S рРНК в опытной культуре в сравнении с контрольной культурой клеток тестируемый образец считают цитотоксичным. Определяют уровень цитотоксичности по отношению числа модифицированных рибосом к общему числу рибосом в процентах по формуле:
Раскрытие изобретения
Способ осуществляют следующим образом.
Помещают клетки в лунки культурального планшета или флакона. Готовят рабочий раствор тестируемого вещества в питательной среде для клеток до фиксированной концентрации/разбавления. Для этого смешивают в стерильных условиях исследуемое вещество с питательной средой для клеток либо с натриево-фосфатным буфером, тщательно перемешивают. Работают в стерильных условиях ламинарного потока, растворы используют немедленно после приготовления. Аккуратно отбирают среду от клеток и добавляют к клеткам раствор питательной среды с тестируемым веществом (опытная культура) или питательную среду без добавления последнего (контроль) и инкубируют клетки в CO2-инкубаторе (37°С, 5% СО2) в течение 15 минут и более. Через фиксированное время инкубации аккуратно отбирают среду в опытной и контрольной лунках практически досуха и лизируют. Затем выделяют РНК и проверяют ее качество (уровень интактности RIN). После этого проводят обратную транскрипцию и ПЦР-РВ с использованием специфических праймеров к модифицируемому и дистальному фрагментам 28S рРНК.
Для осуществления способа используют культуру клеток млекопитающих или человека.
В качестве праймеров используют две пары олигонуклеотидных последовательностей к различным фрагментам 28S субъединицы РНК, описанным в работе [11]:
Последовательность SEQ1 соответствует прямому праймеру, а последовательность SEQ2 соответствует обратному праймеру для определения дистального фрагмента 28S рРНК методом ПЦР-РВ, необходимого для нормировки данных между разными образцами.
Последовательность SEQ3 соответствует прямому праймеру, а последовательность SEQ4 соответствует обратному праймеру для определения количества модифицированного фрагмента 28S рРНК методом ПЦР-РВ, выполняющего роль биомаркера цитотоксического действия РИБ II типа.
Анализ результатов ПЦР-РВ проводят с использованием калибровочной кривой, полученной при определении пороговых значений циклов в образцах кДНК с известным числом копий модифицированного фрагмента. Для этого проводят накопление модифицированного фрагмента с использованием образца кДНК, полученного после инкубации клеток с определяемым РИБ II типа с использованием следующей последовательности праймеров:
После накопления продукта, содержащего дистальный и модифицированный фрагменты 28S рРНК в одном ампликоне, методом ПЦР-РВ, очищают ПЦР-продукт, измеряют его концентрацию, и определяют число копий в полученном калибраторе через число Авогадро. Затем проводят ПЦР-РВ на кДНК из контрольной культуры с добавлением известного числа копий калибратора и строят калибровочную кривую зависимости значения порогового цикла для дистального и модифицированного фрагментов 28S рРНК от числа внесенных копий калибратора; проводят аппроксимацию полученной зависимости по логарифмической функции вида у=k·ln(x)+а, где у - это значение порогового цикла для модифицированного или дистального фрагментов (Ct), k и а - подобранные коэффициенты, и пересчитывают значение порогового цикла для дистального фрагмента 28S рРНК в общее количество 28S рРНК, а по значению порогового цикла модифицированного фрагмента 28S рРНК в количество модифицированных 28S рРНК; пересчет на количество рибосом в клетке ведут на основании данных о выходе массы РНК с известного числа клеток в культуре, количества взятой РНК на проведение обратной транскрипции и степени разбавления кДНК в ПЦР. При превышении содержания модифицированных 28S рРНК в опытной культуре в сравнении с контрольной культурой клеток тестируемый образец считают цитотоксичным. Определяют уровень цитотоксичности по отношению числа модифицированных рибосом к общему числу рибосом в процентах по формуле:
Длительность осуществления способа существенно меньше, чем в прототипе. Селективность способа обусловлена тем, что при оценке цитотоксичности учитывают ранние стадии поражения рибосом под действием РИБ II типа. Это обусловлено тем, что A-цепь РИБ II типа гидролизует N-гликозидную связь по аденозину в положении 4324 в 28S рибосомной РНК. Впоследствии депуринизация предотвращает связывание фактора элонгации EF-2 на рибосоме, в результате чего рибосомы модифицируются (повреждаются) и останавливается синтез белка, что впоследствии приводит к гибели клеток.
Перечень фигур, чертежей и иных материалов
Фиг. 1. Зависимость значений пороговых циклов для дистального и модифицированного фрагментов через 6 ч инкубации с вискумином.
Фиг. 2. Зависимость значения порогового цикла модифицированного фрагмента от времени инкубации для разных концентраций вискумина.
Фиг. 3. Калибровочная кривая зависимости значений порогового цикла модифицированного фрагмента от числа копий калибратора в 1 ПЦР-реакции.
Осуществление изобретения
Образец 1. Объем тестируемого образца, содержащего РИБ II типа 100 мкл. Концентрация 0,43 мг/мл.
Для осуществления способа использовали клетки кишечного эпителия человека Сасо2 в качестве клеточной модели, которые культивировали в питательной среде DMEM (Gibco, США) с добавлением 10% FBS (РАА, Австрия), заменимых аминокислот (Gibco, США), пенициллина (100 U/мл, Gibco, США) и стрептовидина (100 мкг/мл, Gibco, США). Рассеяли по 500 тыс клеток в 24-луночный планшет в 6 повторах за 24 ч до добавления анализируемого белка.
Непосредственно перед добавлением токсина к клеткам приготовили рабочий раствор тестируемого образца разбавлением до концентраций 10-13÷10-7 M с шагом в порядок. Отобрали от клеток старую среду и добавили по 500 мкл рабочего раствора в три лунки. В три других лунки добавили по 500 мкл питательной среды. Инкубировали клетки с рабочим раствором тестируемого образца в течение 6 ч в СО2-инкубаторе. По окончании инкубации отобрали среду от клеток и лизировали в 700 мкл Qiazol Lysis Buffer (Qiagen, Германия). Далее выделили РНК из 6 образцов клеток коммерческим набором реагентов miRNeasy Mini Kit (Qiagen, Германия). Проверили качество РНК (для всех образцов RIN составил более 9). Провели синтез кДНК с использованием коммерческого набора SuperScriptVILO™ cDNASynthesisKit (Invitrogen, США) с 200 нг РНК на одну реакцию. Далее с использованием коммерческого набора «2,5-кратная смесь для ПЦР-РВ» («Синтол», Россия) произвели накопление калибратора, содержащего дистальный и модифицированный фрагмент 28S рРНК по программе 94°С - 10 мин, 50 циклов 94°С - 20 сек, 64°С - 10 сек, 72°С - 15 сек, затем 10°С - охлаждение. Почистили ПЦР-продукт с использованием коммерческого набора Qiaquick PCR Purification Kit (Qiagen, Германия). Концентрацию двухцепочечных фрагментов определили с помощью Qubit® dsDNA HS Assay Kit (Life technologies, США). Провели ПЦР-РВ с определением уровня амплификации дистального и модифицированного фрагментов 28S рРНК с добавлением известного числа копий модифицированного фрагмента 28S рРНК и определили значения пороговых циклов для всех образцов.
Определена зависимость значений пороговых циклов от концентрации вискумина, представленная на Фиг. 1. Линейный участок зависимости аппроксимируется уравнением у=-1.41Ln(x)-13.853, где у - значение порогового цикла, а x - концентрация вискумина. Зависимость имеет сигмоидальный вид, IC50=7,6·10-12 М. Из данных Фиг. 1 мы видим, что через 6 ч инкубации детектируется образование модифицированной 28S рРНК даже на концентрации 10-13 M (Ct=28,1), на плато же зависимость выходит, начиная с концентрации в 10-8 M (Ct=14,3) при значении Ct для дистального фрагмента 28S рРНК в 10,4. В контрольной культуре клеток значение Ct для модифицированного фрагмента составляет 31,2, а для дистального фрагмента - 10,2. Таким образом, вещество признано цитотоксичным на основании данных о превышении числа модифицированных 28S рРНК в опытной культуре по сравнению с контрольной на всем диапазоне исследованных концентраций вискумина.
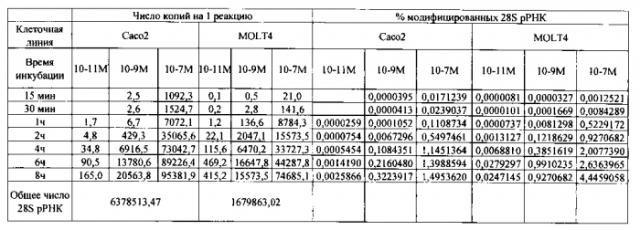
При пересчете значений пороговых циклов в число модифицированных 28S рРНК с использованием калибратора для опытных культур с 10-13 M и 10-7 M вискумина были получены значения в 192 и 1919634 соответственно при общем числе 28S рРНК в 29585705. Следовательно, уровень цитотоксичности по формуле отношения числа модифицированных 28S рРНК к общему числу 28S рРНК соответствует 6,4·10-4 и 6,5% 6 ч инкубации для клеток Сасо2 с вискумином в 10-13 М и 10-7 М.
Образец 2. Объем образца с вискумином с концентрацией 0,1 мг/мл. Необходимо определить цитотоксичность вискумина на клеточных линиях кишечника человека Сасо2 и злокачественных человеческих Т-лимфобластов линии MOLT4.
Клетки Сасо2 культивировали в питательной среде DMEM (Gibco, США) с добавлением 10% FBS (РАА, Австрия), заменимых аминокислот (Gibco, США), пенициллина (100 U/мл, Gibco, США) и стрептовидина (100 мкг/мл, Gibco, США). Клетки MOLT4 культивировали в среде RPMI-1640 (ПанЭко, Россия) с добавлением 10% FBS (РАА, Австрия), пенициллина (100 U/мл, Gibco, США) и стрептовидина (100 мкг/мл, Gibco, США). Рассеяли по 1 млн в 12-луночный планшет за 24 ч до добавления анализируемого белка. В день эксперимента поместили по 1 млн клеток MOLT4 в 12-луночный планшет в 6 повторах. Приготовили рабочий раствор вискумина с концентрацией 10-7, 10-9 и 10-11 М в своих питательных средах. Отобрали старую среду из культуры клеток Сасо2 и внести по 1 мл рабочего раствора с вискумином. К клеткам MOLT4 также добавили 1 мл среды с 10-9 М вискумина. Инкубировали опытные и контрольные культуры 15 минут, 1 ч, 2 ч, 4 ч, 6 ч и 8 ч в СО2-инкубаторе. По окончании инкубации отобрали среду от клеток и лизировали в 700 мкл Qiazol Lysis Buffer (Qiagen, Германия). Далее выделили РНК из всех образцов клеток коммерческим набором реагентов miRNeasy Mini Kit (Qiagen, Германия). Проверили качество РНК (для всех образцов PvIN составил более 9). Провели синтез кДНК с использованием коммерческого набора QuantiTect Reverse Transcription Kit (Qiagen, Германия) с 200 нг РНК на одну реакцию. Далее с использованием коммерческого набора «2,5-кратная смесь для ПЦР-РВ» («Синтол», Россия) произвели накопление калибратора, содержащего дистальный и модифицированный фрагмент. Почистили ПЦР-продукт с использованием коммерческого набора Qiaquick PCR Purification Kit (Qiagen, Германия). Концентрацию двухцепочечных фрагментов определили с помощью Qubit® dsDNA HS Assay Kit (Life technologies, США). Провели ПЦР-РВ с определением уровня амплификации дистального и модифицированного фрагментов с добавлением известного числа копий модифицированного фрагмента и определили значения пороговых циклов для всех образцов.
На фиг. 2 представлена зависимость значения порогового цикла модифицированного фрагмента от времени инкубации для разных концентраций вискумина. Из графика видно, что с течением времени зависимость выходит на плато, и для каждой концентрации может быть получено не более заданного значения числа порушенных рибосом. Для пересчета значений пороговых циклов в копии было произведено накопление калибратора в четырех повторах. После очистки ПЦР-продуктов измеренная концентрация калибратора была в диапазоне 3,4·109÷9,2·109 молекул/ мкл. После проведения ПЦР-РВ с добавлением в кДНК опытной культуры известного числа копий была получена следующая зависимость, отображенная на Фиг. 3.
По уравнению калибровочной кривой были найдены следующие данные:
Для расчета доли модифицированных рибосом был произведен подсчет среднего значения массы РНК из клеток, каждого типа, где было получено, что в одной клетке Сасо2 содержится 16 пг, а в MOLT4 - 5,3 пг РНК. В контрольной культуре значения пороговых циклов для модифицированного фрагмента 28S рРНК составляет 34,4 и 38,6 для Сасо2 и MOLT4 соответственно. В опытных культурах клеток Сасо2 число модифицированных 28S рРНК было превышено по сравнению с контрольной через 15 минут для 10-7 М вискумина (Ct модифицированного 28S рРНК = 25,5), через 1 ч для 10-9 М вискумина (Ct модифицированного 28S рРНК = 33,1) и через 2 ч для 10-11 М вискумина (Ct модифицированного 28S рРНК = 33,6). В опытных культурах клеток MOLT4 число модифицированных 28S рРНК было превышено по сравнению с контрольной через 15 минут для 10-7 М вискумина (Ct модифицированного 28S рРНК=31,4), через 15 минут для 10-9 М вискумина (Ct модифицированного 28S рРНК=36,9) и через 1 ч для 10-11 М вискумина (Ct модифицированного 28S рРНК=35,7). Таким образом все три исследованные концентрации являются цитотоксичными для обеих клеточных моделей.
При пересчете значений пороговых циклов для дистального фрагмента в опытных и контрольных культурах клеток Сасо2 и MOLT4 по калибровочной кривой средние значения общего числа 28S рРНК составили соответственно 6378513 и 1679863 соответственно. Из фиг. 2 видно, что с течением времени значения Ct для дистального фрагмента выходят на плато. При пересчете значений пороговых циклов для модифицированного фрагмента в опытных культурах клеток Сасо2 и MOLT4 по калибровочной кривой через 8 ч инкубации с вискумином в концентрации 10-7 М, 10-9 М и 10-11 М расчетные значения числа модифицированных 28S рРНК составили 165, 20563, 95381 и 415, 15573, 74685 соответственно для клеток Сасо2 и MOLT4 или в процентном выражении по доле модифицированных 28S рРНК - 2.5·10-3, 0.3, 1.5 и 0.024, 0.9, 4,4%.
Список литературы
1. The lectins: carbohydrate-binding proteins of plants and animals. Goldstein IJ, Hayes CE. Adv Carbohydr Chem Biochem. 1978;35:127-340.
2. Оценка цитотоксичности фармацевтических субстанций с использованием клеточных культур, Е.О. Данченко. Иммунопатология, аллергология, инфектология. 2012 г. №2:22-31.
3. Effects of Shiga toxin type 2 on a bioengineered three-dimensional model of human renal tissue, DesRochers T.M., Kimmerling E.P., Jandhyala D.M., El-Jouni W., Zhou J., Thorpe С.М., Leong J.M., Kaplan D.L., Infect Immun. 2015. 83(1):28-38.
4. Comparative Study on the Cytotoxic Effect of Viscotoxin and Mistletoe Lectin on Tumour Cells in Culture, K. Urech, G. Schaller, P. Ziska, M. Giannattasio. Phytotherapy research. 1995. V. 9. 49-55.
5. Effect of fetal calf serum on the cytotoxic activity of mistletoe (Viscum albumL.) lectins in cell culture, G. Ribéreau-Gayon, M.L. Jung, J. Beck, R. Anton. Phytotherapy Research. 1995. V. 9 (5):336-339.
6. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays, Mosmann T.J Immunol Methods. 1983 Dec 16; 65(1-2):55-63.
7. Discrimination between ricin and sulphur mustard toxicity in vitro using Raman spectroscopy. Notingher I., Green C, Dyer C, Perkins E., Hopkins N., Lindsay C, Hench L.L., J.R. Soc. Interface. 2004.22;1(1):79-90.
8. In vitro method for determining pertussis toxin activity. A.M. Akkermans, J.L. Antonius Pennings, S.F. Vaessen, M.P. Bruysters, S. Verkoeijen, C. Anna Maria Krul, R. Jan Vandebriel. EP 2700943 A1. 26.02.2014.
9. Real-Time Cytotoxicity Assay for Rapid and Sensitive Detection of Ricin from Complex Matrices, Diana Pauly, Sylvia Worbs, Sebastian Kirchner, Olena Shatohina, Martin B. Dorner, and Brigitte G. Dorner, PLoS One. 2012; 7(4): e35360.
10. Cell lysis induced by ricin D and ricin Ε in various cell lines. Oda Τ, Komatsu Ν, Muramatsu Τ (1997). Biosci Biotechnol Biochem 61: 291-297.
11. A functional quantitative polymerase chain reaction assay for ricin, Shiga toxin, and related ribosome-inactivating proteins, Anal Biochem. Melchior W.B. Jr, Tolleson W.H. 2010. 396(2):204-11.
Перечень нуклеотидных последовательностей
Все нуклеотидные последовательности указаны в направлении от 5′ к 3′ концу.
SEQ ID NO 1. Нуклеотидная последовательность, кодирующая олигонуклеотид, соответствующий прямому праймеру к дистальному фрагменту 28S рРНК
SEQ ID NO 2. Нуклеотидная последовательность, кодирующая олигонуклеотид, соответствующий обратному праймеру к дистального фрагменту 28S рРНК
SEQ ID NO 3. Нуклеотидная последовательность, кодирующая олигонуклеотид, соответствующий прямому праймеру к модифицированному фрагменту 28S рРНК
SEQ ID NO 4. Нуклеотидная последовательность, кодирующая олигонуклеотид, соответствующий обратному праймеру к модифицированному фрагменту 28S рРНК
1. Способ оценки цитотоксичности рибосом-инактивирующих белков II типа in vitro, включающий культивирование клеток в контрольной и опытной культуре, введение тестируемого образца, содержащего рибосом-инактивирующие белки II типа, в опытную культуру клеток, отличающийся тем, что культивирование клеток в опытной культуре осуществляют не менее 15 мин, забирают лизаты клеток из опытной и контрольной культур клеток, выделяют РНК, определяют общее содержание рибосомальной 28S РНК и содержание модифицированных фрагментов 28S рибосомальной РНК методом ПЦР-РВ, при этом общее содержание 28S рибосомальной РНК определяют с использованием олигонуклеотидов, соответствующих прямому праймеру к дистальному фрагменту 28S рРНК SEQ1 и обратному праймеру к дистальному фрагменту 28S рРНК SEQ2 соответственно; содержание модифицированных 28S рибосомальных РНК определяют с использованием олигонуклеотидов, соответствующих прямому праймеру к модифицированному фрагменту 28S рРНК SEQ3, и обратному праймеру к модифицированному фрагменту 28S рРНК SEQ4; при превышении содержания модифицированных 28S рибосомальных РНК в опытной культуре в сравнении с контрольной делают заключение о цитотоксичности рибосом-инактивирующих белков II типа; определяют общее количество 28S рибосомальных РНК и количество модифицированных 28S рибосомальных РНК в опытной культуре клеток и по доле модифицированных 28S рибосомальных РНК в процентах оценивают уровень цитотоксичности.
2. Способ по п. 1, отличающийся тем, что в качестве культуры клеток используют клетки млекопитающих, включая человека.
3. Способ по п. 1, отличающийся тем, что полимеразно-цепную реакцию проводят в условиях, когда нуклеиновая кислота амплифицируется.
4. Способ по п. 1, отличающийся тем, что детектируют присутствие амплифицированной последовательности нуклеиновой кислоты.
5. Способ по п. 1, отличающийся тем, что определение количества копий дистального и модифицируемого фрагментов 28S РНК проводят с использованием калибровочной кривой с олигонуклеотидных последовательностей SEQ1, SEQ4.
6. Способ по п. 5, отличающийся тем, что построение калибровочной кривой проводят на контрольной культуре клеток, где для стадии выполнения полимеразно-цепной реакции добавляют известные количества копий ампликона, полученного с помощью указанных в п. 5 олигонуклеотидных последовательностей.
7. Способ по п. 1, отличающийся тем, что определение общего количества 28S рибосомальной РНК в клетке ведут на основании данных о выходе массы РНК с известного числа клеток в культуре, количества взятой РНК на проведение обратной транскрипции и степени разбавления кДНК в ПЦР.