Противовирусное средство на основе нуклеазы бактерий рода serratia
Иллюстрации
Показать всеИзобретение касается средства, обладающего противовирусной активностью относительно вирусов гриппа, осповакцины (ВОВ), вируса оспы мышей (ВОМ) и вируса герпеса 2-го типа (ВПГ-2) Представлено средство на основе нуклеазы бактерий рода Serratia. В качестве источника нуклеазы бактерий рода Serratia оно содержит очищенную культуральную жидкость штамма бактерий Serratia plymuthica, имеющую РНКазную активность от 109,0 до 926 ед/мл и содержание белка от 3,6 до 13,5 мг/мл. В качестве штамма бактерий Serratia plymuthica может быть использован штамм бактерий Serratia plymuthica Dg-91, или Dg-98, или Bp-868, или Az-372, депонированные в коллекции бактерий, бактериофагов и грибов Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии «Вектор» под регистрационными номерами B-1288, или B-1297, или B-1296, или B-1285 соответственно. Изобретение может быть использовано в медицине, микробиологической промышленности. 5 з.п. ф-лы, 4 табл., 22 пр.
Реферат
Изобретение относится к новому средству, обладающему противовирусной активностью относительно вирусов гриппа, осповакцины (ВОВ), вируса оспы мышей (ВОМ) и вируса герпеса 2-го типа (ВПГ-2) и может быть использовано в медицине, микробиологической промышленности и биотехнологии. Указанное противовирусное средство представляет собой культуральную жидкость (КЖ) штаммов Serratia plymuthica Вр-868, или штамма Serratia plymuthica Dg-91, или штамма Serratia plymuthica Dg-98, или Serratia plymuthica Az-372.
В связи с широким распространением вирусных заболеваний, вызванных вирусами различной этиологии, в настоящее время особую актуальность имеет поиск средств противовирусной защиты с широким спектром действия против РНК- и ДНК-содержащих вирусов, углубленное изучение вирусных инфекций и создание препаратов, направленных на их подавление.
Известны данные об антивирусной активности панкреатической рибонуклеазы в отношении ряда РНК- и ДНК-содержащих вирусов, а также об их применении в клинике для лечения вирусных заболеваний. Рядом исследователей изучаются антивирусные свойства нуклеаз, выделенных из микроорганизмов, которые обладают более выраженными антивирусными свойствами, чем панкреатическая рибонуклеаза [Шапот В.С., Нуклеазы. М., 1968; Нуклеазы микроорганизмов, под ред. A.M. Безбородова. М., 1974 Nucleuses, ed. by S.M. Linn, R.J. Roberts, Cold Spring Harbour, 1982].
Известны сообщения об антивирусной, в частности антигриппозной, активности веществ, имеющих природное происхождение. Так, авторы И.Д. Макаренкова и др. (2010) сообщают о способности сульфатированного полисахарида - фукоидана из морской бурой водоросли Laminaria japonica подавлять продукцию высокопатогенного вируса гриппа птиц A/H5N1 в течение 24 ч инфекции при профилактической и лечебно-профилактической схемах применения. [Противовирусная активность сульфатированного полисахарида из бурой водоросли LAMINARIA JAPONICA в отношении инфекции культур клеток, вызванной вирусом гриппа A птиц (H5N1). Макаренкова И.Д., Дерябин П.Г., Львов Д.К., Звягинцева Т.Н., Беседнова Н.Н. Вопросы вирусологии. 2010. Т. 55. №1. С. 41-45].
Показана противовирусная активность препаратов грибного происхождения [Разумов И.А., Косогова Т.А., Казачинская Е.В., Пучкова Л.И., Щербакова Н.С., Горбунова И.А., Михайловская И.Н., Локтев В.Б., Теплякова Т.В. Противовирусная активность водных экстрактов и полисахаридных фракций, полученных из мицелия и плодовых тел высших грибов. // Антибиотики и Химиотерапия, т. 55, №9-10, 2010].
Рибонуклеазы обладают выраженной противовирусной активностью в отношении таких РНК-содержащих вирусов, как вирусы гриппа, полиомиелита, клещевого энцефалита, бешенства [ГРИБЕНЧА С.В. Противовирусная активность РНКазы Bacillus intermedius у морских свинок и кроликов, зараженных вирусом бешенства // Вопросы вирусологии, 2006, №5, с. 41-43]. Дезоксирибонуклеазы тормозят синтез и размножение ДНК-содержащих вирусов, осповакцины, аденовируса, герпеса.
Одним из наиболее изученных энзимов этого класса является секретируемая эндонуклеаза Serratia marcescens. Грамотрицательные бактерии рода Serratia, в культуральной жидкости отдельных штаммов которых обнаружены высокие РНК-азная и ДНК-азная активности широко известны как продуценты различного рода препаратов [Габдуллина Г.К. Действие нуклеазы Serratia marcescens на клетки и рост асцитной опухоли Эрлиха: Автореф. дис… канд. биол. наук. - Казань, 1980. - 20 с.; Патент РФ №2148645, МПК C12N 9/20, опубл. 10.05.2000 г. «Штамм бактерий Serratia marcescens - продуцент липазы»]. Фермент тормозит размножение вирусов везикулярного стоматита и осповакцины в культуре клеток куриных фибробластов.
Известен штамм Serratia marcescens B-10 M-1 продуцент дезоксирибонуклеазы наиболее часто используемой в лабораторных условиях. [Нуклеазы микроорганизмов и их практическое использование. Рига, 1989, с. 3. 2. Биосинтез микроорганизмами нуклеаз и протеаз. М.: Наука, 1979, с. 7].
Первый созданный на основе эндонуклеазы Serratia marcescens противовирусный препарат получил название эндонуклеаза бактериальная. В настоящее время нуклеазы из бактерий Sarratia marcescens используют для лечения вирусных заболеваний пчел [Патент РФ №2038776, МПК A01K 51/00, опубл. 09.07.1995 г., «Средство "Эндоглюкин" для профилактики и лечения вирусных заболеваний пчел и стимуляции развития пчелиных семей»]
Наиболее близким аналогом (прототипом) является средство на основе культуральной жидкости штамма бактерий Serratia marcescens [патент РФ №2420309, МПК A61K 39/00, опубл. 10.06.2011 г.].
Однако не известны опубликованные данные о том, что выше приведенные аналоги, в том числе и прототип, обладают ингибирующим действием против вирусов осповакцины (ВОВ), вируса оспы мышей (ВОМ) и вируса герпеса 2-го типа (ВПГ-2), а также высокопатогенных вирусов гриппа птиц A/H5N1 и человека A/H3N2.
Техническим результатом предлагаемого изобретения является создание нового противовирусного средства на основе нуклеазы бактерий рода Serratia, обладающего ингибирующей активностью в отношении вирусов осповакцины (ВОВ), вируса оспы мышей (ВОМ) и вируса герпеса 2-го типа (ВПГ-2), а также высокопатогенных вирусов гриппа птиц A/H5N1 и человека A/H3N2.
Указанный технический результат достигается тем, что в противовирусном средстве на основе нуклеазы бактерий рода Serratia, согласно изобретению, в качестве источника нуклеазы бактерий рода Serratia оно содержит очищенную культуральную жидкость штамма бактерий Serratia plymuthica, имеющую РНКазную активность от 109,0 до 926 ед/мл и содержание белка от 3,6 до 13,5 мг/мл.
Очищенная культуральная жидкость штамма бактерий Serratia plymuthica получена центрифугированием при 10000-12000 об/мин и ультрафильтрацией через фильтр с размерами пор 0,1-0,3 мкм.
В качестве штамма бактерий Serratia plymuthica оно содержит штамм бактерий Serratia plymuthica Dg-91, депонированный в коллекции бактерий, бактериофагов и грибов Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии «Вектор» под регистрационным номером В-1288. Средство обладает ингибирующей активностью против вируса гриппа птиц типа А и вирусов ВОМ и ВПГ-2.
В качестве штамма бактерий Serratia plymuthica оно содержит штамм бактерий Serratia plymuthica Dg-98, депонированный в коллекции бактерий, бактериофагов и грибов Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии «Вектор» под регистрационным номером В-1297. Средство обладает ингибирующей активностью против вируса гриппа типа А и вирусов ВОВ и ВПГ-2. В качестве штамма бактерий Serratia plymuthica оно содержит штамм бактерий Serratia plymuthica Вр-868, депонированный в коллекции бактерий, бактериофагов и грибов Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии «Вектор» под регистрационным номером В-1296. Средство обладает ингибирующей активностью против вируса гриппа типа А и вируса ВПГ-2.
В качестве штамма бактерий Serratia plymuthica оно содержит штамм бактерий Serratia plymuthica Az-372, депонированный в коллекции бактерий, бактериофагов и грибов Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии «Вектор» под регистрационным номером В-1285. Средство обладает ингибирующей активностью против вируса гриппа типа А и вирусов ВОМ и ВПГ-2.
Штаммы, использованные для получения противовирусного средства, изолированы при высеве исследуемых образцов на среду РПА (pH 7,0-7,2, температура инкубирования 30-37°C). Характеристика заявляемых штаммов, связанная с источниками их выделения, представлена в таблице 1.
Штаммы являются факультативными анаэробами, хорошо растут при температуре 30-37°C. Согласно результатам определения нуклеотидной последовательности 16S рРНК бактерии данной группы отнесены к роду Serratia.
Совокупные данные по фенотипическим и геномным признакам позволяют идентифицировать штаммы Dg-91, Dg-98, Вр-868, Az-372, как принадлежащие к виду Serratia plymuthica.
Субкультуры штаммов хранят периодическими пересевами на среде LB ("Difco") с добавлением агара до 1,5%, pH 7,0-7,2) и в 15%-ном растворе глицерина в LB при низкотемпературном замораживании при минус 65°C. Справки о депонировании штаммов прилагаются.
Свойства средства на основе продуктов метаболизма штаммов Serratia plymuthica, обладающих активностью против вирусов гриппа, ВОВ, ВПГ-2, ВОМ обнаружены впервые, в связи с чем можно сделать вывод о соответствии предлагаемых технических решений критериям изобретения «новизны» и «изобретательский уровень».
При культивировании применяли питательную среду "S" следующего состава в г/л: (Пептон Difco - 16,0; NaCI - 5,0; MgCl2 - 0,1-, Трис - 6,05; pH 8.0) или "Lb" (дрожжевой экстракт Difco - 10,0; пептон - 5,0; NaCI - 5,0; pH 7,2).
Для получения образцов культуральной жидкости (КЖ) штаммы культивировали в среде "S" или "LB" в течение 18 час при температуре 28-30°C с последующим центрифугированием в течение 20 мин при 8000 об/мин на центрифуге JA-21. Полученные образцы КЖ и биомассы хранили до использования в замороженном состоянии при температуре минус 20°C.
Количественную оценку нуклеазной активности проводили по превращению субстратных нуклеиновых кислот (дрожжевой РНК или ДНК из молок лосося, «Медиген», Россия) во фрагменты, растворимые в 4%-ной HClO4, с появлением кислоторастворимого материала с адсорбцией при 260 нм. (Лещинская И.Б., Балабан Н.П., Капранова М.Н., Голубенко И.А. Методы определения активности нуклеаз и родственных ферментов. В кн.: Современные методы изучения нуклеиновых кислот и нуклеаз микроорганизмов. Казань: Изд-во КГУ - 1980. - С. 53-60).
Удельную активность измеряли в Е/мг белка. Концентрацию белка в образцах определяли по формуле: С мг/мл = (D228,5-D234,5) : 3 × n, где n - разведение образца []. (Ehresman Е., Imbault P. and Weil L.N.. // Anal. Biochem. 1973. V. 54. №2. P. 454-463).
Получение и анализ культуральной жидкости (КЖ) на содержание внеклеточных нуклеаз.
Клетки выращивали в колбах со средой LB или средой S на качалке со скоростью перемешивания 150 об/мин. Время культивирования при температуре 30-37°C составляло 18-20 часов. КЖ собирали центрифугированием и замораживали до использования при температуре минус 20°C. Анализировали КЖ на наличие нуклеаз методом скрининга в агарозе с последующим определением ферментативной активности.
Анализ биомассы на содержание нуклеаз.
Для анализа использовали клеточные экстракты (КЭ). Для этого биомассу, полученную после центрифугирования и отбора КЖ в количестве 0,3-0,5 г, подвергали разрушению в 4-х мл дистиллированной воды на ультразвуковом дезинтеграторе («MSE», Англия) при температуре 4-5°C. Контролируя на спектрофотометре падение величины D560 обработку суспензии ультразвуком проводили до уменьшения оптической плотности суспензии на 80-90% от исходной. Далее суспензию клеток освобождали от клеточных остатков центрифугированием при 8000 об/мин, в течение 20 мин, при температуре 4°C. Полученный экстракт клеток замораживали и хранили при температуре минус 20°C.
Результаты анализа субстанций культуральной жидкости (КЖ) и клеточного экстракта (КЭ) представлены в таблице 1.
В таблице 1 приведены средние данные по 2-м экспериментам. В качестве контроля использовали культуральную жидкость (кж) музейного штамма S.marcescens.
Изучение противовирусной активности образцов на основе бактериальных штаммов Serratia plymuthica
Подготовка вируса и культуры клеток к тестированию штамма.
Для тестирования токсичности и противовирусной эффективности бактериальных метаболитов относительно ортопоксвирусов и вируса простого герпеса 2-го типа (ВПГ-2) использовали перевиваемую культуру клеток Vero, полученных из «Коллекции культур клеток» ФБУН ГНЦ ВБ «Вектор». Суспензию клеток с концентрацией 1×105 кл./мл питательной среды DMEM, содержащей 10% сыворотки крови плодов коровы фирмы «Gibco», вносили в объеме 100 мкл/лунку 96-луночного планшета. Планшеты с клетками помещали в термостат на 4 суток до образования монослоя при температуре 37°C, 5% CO2 и 100% влажности.
В качестве ДНК-содержащих вирусов в работе использовали ортопоксвирусы: вирус осповакцины (ВОВ, штамм Л-ИВП) и вирус оспы мышей (ВОМ, штамм К-1), а также вирус простого герпеса 2-го типа (ВПГ-2, штамм MS), полученные из «Коллекции микроорганизмов» ФБУН ГНЦ ВБ «Вектор». Концентрация вирусов на культуре клеток Vero по разным экспериментам составляла (4,4-5,5) lgТЦД50/мл (50% тканевых цитоплазматических доз в мл).
Определение токсических доз и противовирусного действия препаратов.
Для определения токсических доз препараты разводили в 2, 5, 10, 20, раз средой DMEM, вносили по 100 мкл в соответствующие лунки планшета с клетками Vero и инкубировали в термостате при температуре 37°C, 5% CO2 и 100% влажности на 4 суток. Через 4 суток с помощью инвертированного микроскопа оценивали наличие токсического действия в монослоях клеток Vero, инкубированных с разными концентрациями препаратов. Для определения противовирусной активности препаратов использовали максимально переносимые концентрации (МПК). Данные по токсичности образцов представлены в табл. 2
Исследование противовирусной активности образцов проводили по профилактической схеме: сначала на культуру клеток вносится образец и затем вирус. В монослой культуры клеток вносили по 50 мкл/лунку выбранного разведения образца, через 1 ч инкубации при температуре +37°C, 5% CO2 и 100% влажности вносили по 50 мкл/лунку разведенной ВСЖ. Клетки инкубировали 4 сут при температуре +37°C в атмосфере 5% CO2 в термостате ТС-1/80 СПУ (Россия). Через 4 сут в каждой лунке с помощью инвертированного микроскопа регистрировали ЦПД в монослое клеток. Определяли инфекционность вирусов в клетках, то есть титры вирусов в lgТЦД50/мл в опыте и контроле (ИД50 in vitro с образцом и без него), а затем высчитывали индекс нейтрализации (ИН) вирусов под влиянием образца: ИН = ИД50 контроль (lg) - ИД50 опыт (lg). Каждый вариант опыта выполняли в трех параллельных повторах, для анализа использовали средние величины полученных данных.
В качестве контроля использовали:
1. Контроль клеток, культивируемых в питательной среде DMEM.
2. Контроль репродукции ДНК-геномных вирусов в разведениях с 1 до 8 с десятикратным шагом без внесения препаратов, но с предварительным внесением питательной среды DMEM соответственно в объеме 50 мкл/лунку.
Ниже приведены примеры исследования противовирусной активности образцов препаратов на основе КЖ бактерий Serratia plymuthica Dg-91, Serratia plymuthica Az-372, Serratia plymuthica Bp-868, Serratia plymuthica Dg-98 относительно вирусов BOB, BOM, ВПГ-2.
Пример 1. Подготовка препарата (12-118) на основе водорастворимых метаболитов штамма Serratia plymuthica Dg-91 для испытания на противовирусную активность. Препарат получен на основе культуральной жидкости (КЖ). Суспензию клеток штамма Serratia plymuthica Dg-91, наработанных на агаризованной среде «LB» в течение 18 часов при температуре 28-30°C, вносили в количестве 2% в колбы с 50 мл среды LB и культивировали в течение 24 часов на термостатированной качалке (КТ 104, Россия). Полученную КЖ штамма Serratia plymuthica Dg-91 центрифугировали при 10000 об/мин в течение 30 мин на центрифуге JA-21. Осветленную надосадочную жидкость стерилизовали ультрафильтрацией через миллипоровские фильтры Whatman с размерами пор 0,22 мкм и использовали для испытания в качестве противовирусного препарата в профилактической схеме. Хранили препарат до использования при температуре минус 20°C.
Пример 2. Определение токсичности препарата №12-118.
Для определения токсических доз препарат №12-118 разводили в 5 и 10, раз средой DMEM, вносили по 50 мкл в соответствующие лунки планшета и ставили в термостат при температуре 37°C, 5% СО2 и 100% влажности на 4 суток. Через 4 суток с помощью инвертированного микроскопа оценивали наличие токсического действия в монослоях клеток DMEM, инкубированных с разными концентрациями препарата. Препарат был не токсичен на клеточной культуре MDCK при разведении в 5 и 10 раз (табл. 2).
Пример 3. Испытание противовирусного действия препарата 12-118.
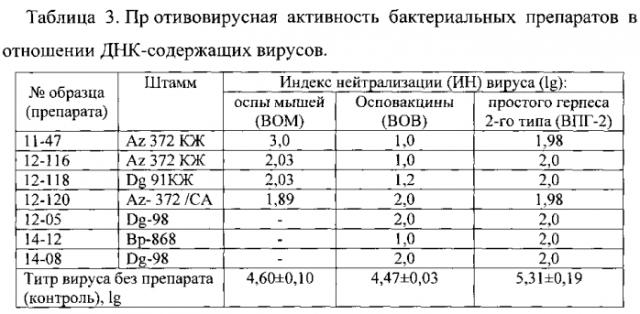
Перед использованием препарат разводили на среде DMEM в 10 раз. Исследование противовирусной активности образцов проводили по профилактической схеме. В монослой культуры клеток вносили по 50 мкл/лунку выбранного разведения образца, через 1 ч инкубации при температуре +37°C, 5% СО2 и 100% влажности вносили по 50 мкл/лунку разведенной ВСЖ. Клетки инкубировали 4 сут при температуре +37°C в атмосфере 5% CO2 в термостате ТС-1/80 СПУ (Россия). Через 4 сут в каждой лунке с помощью инвертированного микроскопа регистрировали ЦПД в монослое клеток. Индекс нейтрализации составил для вируса ВОМ - 2,03 lg, для вируса ВПГ-2 - 2,0 lg (табл. 3).
Пример 4. Испытание противовирусного действия препарата 12-116, приготовленного на основе культуральной жидкости штамма Serratia plymuthica Az-372. Клетки штамма выращивали в LB pH 7,2. Препарат готовили, как в примере 1. Перед использованием препарат разводили в 10 раз. При инфекционности вируса ВОМ (титр составил 4,6 lgТЦД50/мл) его нейтрализация на клетках Vero в профилактической схеме под влиянием препарата 12-116 составила 2,03 lg, а для вируса ВПГ-2 (титр 5,31)-индекс нейтрализации - 2,0 lg.
Пример 5. Получение препарата 11-47, приготовленного на основе культуральной жидкости штамма Serratia plymuthica Az-372. Клетки штамма выращивали в среде S при pH 7,8 в течение 18 ч. Далее образец получали как в примере 1.
Пример 6. Испытание противовирусного действия препарата 11-47, приготовленного на основе культуральной жидкости штамма Serratia plymuthica Az-372. Перед использованием препарат разводили в 10 раз. При инфекционности вируса ВОМ (титр 4,6 lgТЦД50/мл) его нейтрализация на клетках Vero в профилактической схеме под влиянием препарата 11-47 составила 3,0 lg, а для вируса ВПГ-2 (титр 5,31)-индекс нейтрализации - около 2,0 lg (табл. 3).
Пример 7. Получение препарата 12-05 и испытание его на противовирусную активность. Препарат получен на основе культуральной жидкости (КЖ) штамма Serratia plymuthica Dg-98. Суспензию клеток штамма, наработанных на агаризованной среде «S» в течение 20 часов при температуре 28-30°C, вносили в количестве 2% в колбы с 50 мл среды S и культивировали в течение 24 часов на термостатированной качалке (КТ 104, Россия). Полученную КЖ штамма Serratia plymuthica Dg-98 центрифугировали при 10000 об/мин в течение 30 мин на центрифуге JA-21. Осветленную надосадочную жидкость стерилизовали ультрафильтрацией через миллипоровские фильтры Whatman с размерами пор 0,22 мкм и использовали для испытания в качестве противовирусного препарата в профилактической схеме. Хранили препарат до использования при температуре минус 20°C. Перед использованием препарат разводили в 10 раз. При инфекционности вируса ВОВ (титр 4,47±0,03 lgТЦД50/мл) и вируса ВПГ-2 (титр 5,31±0,19) нейтрализация на клетках Vero в профилактической схеме под влиянием препарата 12-05 составила 2,0 lg для обоих вирусов (табл. 3).
Пример 8. Получение препарата 14-08 и испытание его на противовирусную активность. Препарат получен на основе культуральной жидкости (КЖ) штамма Serratia plymuthica Dg-98. Суспензию клеток штамма, наработанных на агаризованной среде «LB» в течение 20 часов при температуре 28-30°C, вносили в количестве 2% в колбы с 50 мл среды LB и культивировали в течение 24 часов на термостатированной качалке (КТ 104, Россия). Полученную КЖ штамма Serratia plymuthica Dg-98 центрифугировали при 10000 об/мин в течение 30 мин на центрифуге JA-21. Осветленную надосадочную жидкость стерилизовали ультрафильтрацией через миллипоровские фильтры Whatman с размерами пор 0,22 мкм и использовали для испытания в качестве противовирусного препарата в профилактической схеме. Хранили препарат до использования при температуре минус 20°C. Перед использованием препарат разводили в 5 раз. При инфекционности вируса ВОВ (титр 4,47±0,03 lgТЦД50/мл) и вируса ВПГ-2 (титр 5,31±0,19) нейтрализация на клетках Vero в профилактической схеме под влиянием препарата 14-08 составила 2,0 lg для обоих вирусов (табл. 3).
Пример 9. Получение препарата 14-12 и испытание его на противовирусную активность. Препарат получен на основе культуральной жидкости (КЖ) штамма Serratia plymuthica Вр-868. Суспензию клеток штамма, наработанных на агаризованной среде «LB» в течение 20 часов при температуре 28-30°C, вносили в количестве 2% в колбы с 50 мл среды LB и культивировали в течение 24 часов на термостатированной качалке (КТ 104, Россия). Полученную КЖ штамма Serratia plymuthica Вр-868 центрифугировали при 10000 об/мин в течение 30 мин на центрифуге JA-21. Осветленную надосадочную жидкость стерилизовали ультрафильтрацией через миллипоровские фильтры Whatman с размерами пор 0,22 мкм и использовали для испытания в качестве противовирусного препарата в профилактической схеме. Хранили препарат до использования при температуре минус 20°C. Перед использованием препарат разводили в 5 раз. Нейтрализация вирусов на клетках Vero под влиянием препарата 14-12 составила в профилактической схеме для ВОВ - 1,0 lg, а для вируса ВПГ-2 - 2,0 lg (табл. 3).
Пример 10. Получение препарата 12-120. В образец КЖ полученный как препарат 12-116 (пример 4) добавили сульфат аммония до 60% для осаждения белков. Хранили препарат до использования при температуре минус 20°C. Перед использованием его стерилизовали ультрафильтрацией и разводили в 5 раз стерильной средой DMEM. Противовирусную активность испытали на 3-х вирусах. Данные по активности представлены в табл. 3.
Подготовка к тестированию штаммов вируса гриппа и культуры клеток.
Для оценки противовирусной эффективности полученных препаратов использовали высокопатогенный вирус гриппа птиц A/chicken/Kurgan/05/2005 (A/H5N1) из коллекции ФБУН ГНЦ ВБ «Вектор, наработанный на 10-суточных развивающихся куриных эмбрионах (РКЭ). Концентрация вируса составила: 103,5-6,5 lg ТЦД50/мл. Вирус гриппа человека A/Aichi/2/68(A/H3N2) (из коллекции ФБУН ГНЦ ВБ «Вектор»), титр 102,5-6,5 lg ТЦД50/мл вирусаллантоисной жидкости (ВАЖ)). Для тестирования токсичности и противовирусной активности препаратов использовали перевиваемую культуру клеток MDCK.
Определение токсичности препаратов. Для определения токсических доз препараты разводили в 2, 5, 10, раз средой Axcevir-MDCK, вносили по 150 мкл в соответствующие лунки планшета с клетками MDCK и ставили в термостат при температуре 37°C, 5% CO2 и 100% влажности на 2 суток.
Через 2 суток с помощью инвертированного микроскопа оценивали наличие токсического действия в монослоях клеток MDCK, инкубированных с разными концентрациями препаратов.
Для определения противовирусной активности препаратов использовали максимально переносимые концентрации (МПК).
Определение противовирусной активности препаратов. Для определения противовирусной активности препаратов готовили десятикратные разведения ВАЖ от 1 до 8 с использованием среды Axcevir-MDCK, содержащей 2 мкг/мл трипсина. В монослой культуры клеток MDCK вносили по 50 мкл выбранного разведения препарата и 100 мкл от 1 до 8 разведения ВАЖ. Клетки инкубировали 2 суток при температуре 37°C в атмосфере 5% CO2 в термостате ТС-1/80 СПУ (Россия). Через 2 суток в каждой лунке с помощью инвертированного микроскопа регистрировали ЦПД в монослое клеток и определяли наличие вируса в среде культивирования по реакции гемагглютинации (РГА) с 1% эритроцитами петуха. Ниже приведены примеры конкретного применения заявляемых штаммов.
Пример 11. Получение препарата (образец 11-13), на основе экстракта клеток (КЭ) штамма Serratia plymuthica. Вр-868.
Биомассу клеток штамма (0,4 г), полученную после культивирования в «LB» и последующего центрифугирования и освобождения от надосадочной жидкости, ресуспендировали в 4 мл дистиллированной воды и обрабатывали 4 раза по 30″ с интервалом 30″, на ультразвуковом (УЗ)-дезинтеграторе. (с амплитудой 18), добиваясь максимально возможного разрушения клеток После УЗ-обработки разрушенные клетки осаждали центрифугированием 10 мин при 12000 об/мин на микроцентрифуге "Eppendorf", КЭ отбирали и стерилизовали ультрафильтрацией через Whatman-фильтр с размерами пор 0,1 мкм. Полученный препарат хранили до использования при температуре минус 20°C. Концентрация белка в образце составила 3,6 мг/мл, активность РНКазы 332,2 ед/мл или 3322 ед/г влажной биомассы.
Пример 12. Испытание противовирусного действия препарата №11-13, приготовленного на основе КЭ штамма Serratia plymuthica Вр-868 (в профилактической схеме) на вирусе гриппа человека (A/H3N2).
Для испытания препарат №11-13 развели в 5 раз и внесли на клетки MDCK в объеме 50 мкл на лунку 96-луночного планшета. Инкубация 2 часа. Удалили препарат, затем в лунки внесли среду RPMI-1640 без сыворотки и без трипсина. Добавили вирус A/Aichi/2/68 (H3N2) с -1 по -7 по 50 мкл на лунку. Инкубация 2 сут. Учет с 1% эритроцитами петуха.
Планшеты с обработанными клетками и вирусом помещали в термостат при температуре 37°C, 5% CO2 и 100% влажности на 2-3 суток до образования монослоя. Индекс нейтрализации составил 2,5 lg при исходной концентрации вируса 102,5 lg ТЦД50/мл (табл. 4).
Пример 13. Получение препарата (образца) 12-16, на основе экстракта клеток (КЭ) штамма Serratia plymuthica Dg-91.
Биомассу клеток штамма Serratia plymuthica Dg-91. (0,4 г), полученную после культивирования в «LB» и последующего центрифугирования и освобождения от надосадочной жидкости, ресуспендировали в 4 мл стерильной дистиллированной воды и обрабатывали 4 раза по 30″ с интервалом 30″, на ультразвуковом (УЗ)-дезинтеграторе. После УЗ-обработки разрушенные клетки осаждали центрифугированием 10 мин при 12000 об/мин на микроцентрифуге "Eppendorf", КЭ отбирали и стерилизовали ультрафильтрацией через Whatman-фильтр с размерами пор 0,2 мкм. Полученный препарат хранили до использования при температуре минус 20°C. Концентрация белка в образце составила 7,4 мг/мл, активность РНКазы 574,75 ед/мл, а ДНКазы - 463,1 ед/мл.
Пример 14. Испытание противовирусного действия КЭ штамма Serratia plymuthica Dg-91 на вирусе гриппа человека A/Aichi/2/68(A/H3N2). Анализ противовирусной активности штамма как в примере 12.
Клеточный экстракт (КЭ) штамма Serratia plymuthica Dg-91 (препарат №12-16) проверили в профилактической схеме на противовирусную активность. Индекс нейтрализации составил 6,5 lg при исходной концентрации вируса 106,5 lg ТЦД50/мл (табл. 4).
Пример 15. Получение препарата (образца) 12-01 на основе культуральной жидкости (КЖ) штамма Serratia plymuthica Dg-91.
Суспензию клеток готовили с использованием культуры штамма Serratia plymuthica Dg-91, наработанного на агаризованной среде «LB» в течение 18 часов при температуре 28-30°C. Суспензию вносили в количестве 2% в колбы с 50 мл среды LB и культивировали в течение 24 часов на термостатированной качалке (КТ 104, Россия). Для приготовления препарата на основе культуральной жидкости полученную КЖ штамма Serratia plymuthica Dg-91 центрифугировали при 10000 об/мин в течение 30 мин на центрифуге JA-21. Осветленную надосадочную жидкость стерилизовали ультрафильтрацией через Whatman-фильтр с размерами пор 0,2 мкм и использовали для испытания в качестве противовирусного препарата в профилактической схеме. РНКазная активность в КЖ составила 220,5 ед/мл. Хранили препарат до использования при температуре минус 20°C.
Пример 16. Испытание противовирусного действия КЖ штамма Serratia plymuthica Dg-91 на вирусе гриппа человека A/Aichi/2/68(A/H3N2). Анализ противовирусной активности штамма как в примере 12.
Культуральную жидкость штамма Serratia plymuthica Dg-91 (препарат №12-01) проверили в профилактической схеме на противовирусную активность. Индекс нейтрализации составил 6,5 lg при исходной концентрации вируса 106,5 lg ТЦД50/мл (табл. 4).
Пример 17. Испытание противовирусного действия КЖ штамма Serratia plymuthica Dg-91 на вирусе гриппа птиц A/chicken/Kurgan/05/2005 (A/H5N1). Для испытания препарат №12-01 развели в 5 раз и внесли на клетки MDCK в объеме 50 мкл на лунку 96-луночного планшета. Инкубация 2 часа. Удалили препарат, затем в лунки внесли среду RPMI-1640 без сыворотки и без трипсина. Добавили вирус A/Aichi/2/68 (H3N2) с -1 по -7 по 50 мкл на лунку. Инкубация 2 сут. Учет с 1% эритроцитами петуха.
Планшеты с обработанными клетками и вирусом помещали в термостат при температуре 37°C, 5% CO2 и 100% влажности на 2-3 суток до образования монослоя. Индекс нейтрализации составил 6,5 lg (табл. 4) при исходной концентрации вируса 106,5 lg ТЦД50/мл.
Пример 18. Получение препарата (образца) 12-25 на основе культуральной жидкости (КЖ) штамма Serratia plymuthica. Az-372.
Образец 12-25 получен как в примере 15.
Испытание противовирусного действия препарата 12-25 на вирусе гриппа человека (A/H3N2) (профилактическая схема) как в примере 8. Индекс нейтрализации составил 3,0 lg при исходной концентрации вируса гриппа человека (A/H3N2) 106,5 lg ТЦД50/мл Концентрация белка составила 10,2 мг/мл, РНКазная активность - 108,9 ед/мл кж. (табл. 4).
Пример 19. Испытание КЖ Serratia plymuthica. Az-372. на вирусе гриппа птиц (A/H5N1). Препарат (образец) штамма под №11-41 получен как в примере 5 на среде «S». Концентрация белка составила 8,8 мг/мл, а РНКазная активность - 185,3 ед/мл. Индекс нейтрализации вируса гриппа (A/H5N1) составил 3,5 lg при исходной концентрации вируса 103,5 lg ТЦД50/мл (табл. 4)
Пример 20. Получение препарата (образца) 12-54 на основе культуральной жидкости (КЖ) штамма Serratia plymuthica Dg-91.
Образец получали, как в примере 15, за исключением того, что клетки культивировали на среде «S».
Для приготовления препарата полученную КЖ штамма Serratia plymuthica Dg-91 центрифугировали при 10000 об/мин в течение 30 мин на центрифуге JA-21. Осветленную надосадочную жидкость стерилизовали ультрафильтрацией через Whatman-фильтр с размерами пор 0,2 мкм и использовали для испытания в качестве противовирусного препарата.
Хранили препарат до использования при температуре минус 20°C. РНКазная активность в КЖ составила 129,8 ед/мл.
Испытание противовирусного действия образца 12-54 проводили на вирусе гриппа птиц A/chicken/Kurgan/05/2005 (A/H5N1), как в примере 17. Индекс нейтрализации составил 6,5 lg при исходной концентрации вируса 106,5 ТЦД50/мл (табл. 4).
Пример 21. Образец (12-20) получали как описано в примере 11. За исключением того, что использовали штамм Serratia plymuthica Dg-98. Осадок клеток штамма, полученный после центрифугирования и освобождения от надосадочной жидкости, как в примере 11, ресуспендировали в 4 мл дистиллированной воды и обрабатывали 4 раза по 30″ с интервалом 30″, на ультразвуковом (УЗ)-дезинтеграторе Процент разрушения 90%. После УЗ-обработки разрушенные клетки осаждали центрифугированием при 10000 об/мин на микроцентрифуге "Eppendorf", КЭ отбирали и стерилизовали ультрафильтрацией через Whatman-фильтр с размерами пор 0,2 мкм. Полученный препарат хранили до использования при температуре минус 20°C.
Полученный КЭ после размораживания разводили в 2 раза дистиллированной водой и использовали для испытания на противовирусное действие на вирусе гриппа человека A/Aichi/2/68(A/H3N2): Индекс нейтрализации составил 3,5 lg при исходной концентрации вируса 103,5 lg ТЦД50/мл (табл. 4).
Пример 22. Для испытания использовали чистые стерильные среды «LB» и «S» в качестве противовирусного агента. Испытание проводили для исключения влияния компонентов среды на вирусы гриппа. Обработку клеток проводили как в примере 12. Данные среды не оказывали противовирусного эффекта и не влияли на культуру клеток MDCK. Титр вирусов не изменился по сравнению с контролем и составил: A/chikenKurgan/05/2005 (H5N1) 103,5-6,5 lg ТЦД50/мл, а вируса гриппа человека A/Aichi/2/68(A/H3N2): 102,5-6,5 lg ТЦД50/мл в зависимости от эксперимента.
Таким образом, из приведенных таблиц 3 и 4 видно, что заявляемое средство на основе нуклеазы бактерий штаммов бактерий Serratia plymuthica обеспечивает достижение технического результата, а именно обеспечивает ингибирующую активность в отношении вирусов осповакцины (ВОВ), вируса оспы мышей (ВОМ) и вируса герпеса 2-го типа (ВПГ-2), а также высокопатогенных вирусов гриппа птиц A/H5N1 и человека A/H3N2.
1. Противовирусное средство на основе нуклеазы бактерий рода Serratia, отличающееся тем, что в качестве источника нуклеазы бактерий рода Serratia оно содержит очищенную культуральную жидкость штамма бактерий Serratia plymuthica, имеющую РНКазную активность от 109,0 до 926 ед/мл и содержание белка от 3,6 до 13,5 мг/мл.
2. Противовирусное средство по п. 1, отличающееся тем, что очищенная культуральная жидкость штамма бактерий Serratia plymuthica получена центрифугированием при 10000-12000 об/мин и ультрафильтрацией через фильтр с размерами пор 0,1-0,3 мкм.
3. Противовирусное средство по п. 1, отличающееся тем, что в качестве штамма бактерий Serratia plymuthica оно содержит штамм бактерий Serratia plymuthica Dg-91, депонированный в коллекции бактерий, бактериофагов и грибов Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии «Вектор» под регистрационным номером В-1288.
4. Противовирусное средство по п. 1, отличающееся тем, что в качестве штамма бактерий Serratia plymuthica оно содержит штамм бактерий Serratia plymuthica Dg-98, депонированный в коллекции бактерий, бактериофагов и грибов Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии «Вектор» под регистрационным номером В-1297.
5. Противовирусное средство по п. 1, отличающееся тем, что в качестве штамма бактерий Serratia plymuthica оно содержит штамм бактерий Serratia plymuthica Вр-868, депонированный в коллекции бактерий, бактериофагов и грибов Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии «Вектор» под регистрационным номером В-1296.
6. Противовирусное средство по п. 1, отличающееся тем, что в качестве штамма бактерий Serratia plymuthica оно содержит штамм бактерий Serratia plymuthica Az-372, депонированный в коллекции бактерий, бактериофагов и грибов Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии «Вектор» под регистрационным номером В-1285.