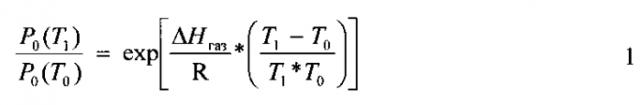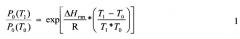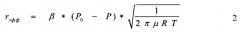Способ получения наноразмерных порошков лекарственных веществ и устройство для его осуществления
Иллюстрации
Показать всеГруппа изобретений относится к способу получения наноразмерных порошков лекарственных веществ, включающему перевод исходного вещества в газовую фазу, организацию направленного потока молекул соединения и последующую конденсацию вещества в виде наноразмерных частиц на охлаждаемой поверхности, и устройству для его осуществления. Перевод исходного вещества в газовую фазу и организацию направленного потока молекул соединения осуществляют в динамическом режиме за счет захвата паров вещества потоком нагретого инертного газа-носителя при приведенном мольном расходе газа-носителя в интервале от 0,01 до 2,0 моль/(м2*с), степени расширения потока газа-носителя (К) от значений Kmin=10 до Кmax=3060, расстоянии между соплом генератора молекулярного потока и поверхностью конденсора в интервале 0,005-1,0 м, причем нагрев газа-носителя осуществляют ступенчато - сначала до начальной температуры, соответствующей давлению насыщенных паров исходного вещества в интервале 10-2-104 Па (Тн), затем по выходе потока газа-носителя из контейнера, содержащего исходное вещество, до рабочей температуры, превышающей начальную на 5-300°C (Тк), а конденсацию проводят на поверхности с температурой в интервале от -269C° до Тmax, где Тmax определяется природой соединения и соответствует давлению насыщенных паров осаждаемого соединения не выше чем 10-4 Па. 2 н. и 4 з.п. ф-лы, 103 пр., 2 табл., 10 ил.
Реферат
Область техники
Изобретение относится к области наномедицины, в частности к технологии получения высокодисперсных порошков органических лекарственных соединений с заданным средним размером частиц и малой дисперсией распределения частиц по размерам, и может быть использовано при изготовлении высокоэффективных лекарственных форм, косметики и производстве биологически активных добавок (БАДов).
В последние годы развитие нанотехнологии от материаловедения и электроники смещается в сторону биологии и медицины. Наночастицы в медицине находят применение в нескольких направлениях. Одно из них - ранняя диагностика заболеваний [U.H.F. Bunz, V.M. Rotello, "Gold nanoparticle - Fluorophor Complexes: Sensitive and Discerning "Noses" for Byosystems Sensing", Angev. Chem. Int. Ed., 2010, V. 49, Is. 19, pp. 3268-3279]. Другие активно развиваемые применения наночастиц в медицине - направленная доставка лекарственных средств к больным органам [Е. Ruoslahti, S.N. Bhatia, M.J. Sailor, "Targeting of drugs and nanoparticles to tumors", J. Cell Biol., 2010, V. 188, No 6, pp. 759-768], регенеративная [S. Rannarda, A. Owenb, "Nanomedicine: Not case One size fits all", Nano Today, 2009, V. 4, pp. 382-384] и персональная [K.K. Jain, Textbook of Personalized medicine, 2009, New York, Springer] медицина.
Развитие наномедицины показало, что эффективность действия лекарственных веществ в большой степени зависит от размера частиц препарата.
Многие современные лекарственные средства плохо растворимы в воде [C. Lipinski, Poor aqueous solubilty - an industry wide problem in drug discovery, Am. Pharm. Rev., 2002, v. 5, pp. 82-85], хотя одним из основных свойств, определяющих эффективность применения органических соединений в качестве лекарственных препаратов, является их растворимость и скорость растворения, которая сильно зависит от размера частицы. Поэтому синтез наночастиц лекарственных веществ - одно из основных направлений создания новых высокоэффективных лекарственных препаратов. Кроме того, перевод в наноразмерное состояние создает возможность создания лекарственных форм, пригодных для новых путей введения в организм: аэрозольного, трансдермального, внутривенного, внутримышечного и др. Наночастицы, за счет специфического взаимодействия с некоторыми тканями, могут усилить селективность действия лекарства, увеличить адсорбцию и биодоступность.
Применение наночастиц в медицине связано с рядом проблем. Прежде всего это проблема стабилизации. В настоящее время для этих целей применяются стабилизаторы различной природы, причем побочные эффекты, связанные со стабилизаторами зачастую игнорируются [L. Wu, J. Chang, W. Watanabe, "Physical and chemical stability of drug nanoparticles", Adv. Drug Del. Rev., 2011, V. 63, pp. 456-469]. He решены проблемы увеличения производительности методов, снижения материальных затрат и уменьшения стоимости наноразмерных активных фармацевтических ингредиентов. Ни один из применяемых методов не позволяет получать конечный продукт с заданным в широких пределах средним размером частиц и малой дисперсией распределения их по размерам.
Уровень техники
Большинство методов детально разработанных для получения неорганических наночастиц, например химическое восстановление в растворе, неприменимо для получения наночастиц органических соединений, являющихся основой новых лекарственных препаратов.
Наиболее распространенная технология получения наночастиц органических соединений - сухое и мокрое механическое измельчение [G.H. Ward, Pharm. Res., 1995, V. 12, p. 773] [M.T.H. Nutan, I.K. Reddy, "Pharmaceutical suspensions: from formulation development to Manufacturing", Springer, 2009, pp. 39-66]. Эта технология доведена до промышленного внедрения и активно применяется фирмами для приготовления микросуспензий лекарственных соединений. Эта технология, однако, имеет целый ряд существенных недостатков:
- возможны частичное растворение лекарственного вещества и его неконтролируемая рекристаллизация при высушивании,
- неизбежное попадание материала измельчающего устройства в конечный продукт,
- возможно разрушение термически неустойчивых веществ из-за выделения тепла в процессе измельчения,
- широкая дисперсия распределения частиц по размерам и наличие относительно большого количества частиц с размерами >5 мкм,
- для стабилизации суспензий используются вещества проявляющие дополнительные побочные эффекты.
Для получения наночастиц лекарственных соединений также применяют: методы замены растворителя и контролируемого испарения капель [Н-K. Chan, P.C.L. Kwok, "Production methods for nanodrug particles using the bottom-up approach", Advanced Drug Delivery Reviews, 2011, V. 63, pp. 406-416], лазерную абляцию [Y. Tamaki, T. Asahi, H. Masuhara, App. Surf. Sci, 2000, V. 168, p. 85], водно-масляные эмульсии [E. Kwon, H. Oikawa, H. Kasai, H. Nakanishi, Cryst. Growth Des., 2007, V. 7, p. 600].
Все более активно, для получения наноформ лекарственных веществ используются сверхкритические флюиды [Е. Reverchon, R. Adami, "Nanomaterials and supercritical fluids", J. of supercrit. fluids, 2006, V. 37, pp. 1-22]. Однако, поскольку круг органических веществ хорошо растворяющихся в сверхкритическом диоксиде углерода и других неполярных флюидах, весьма ограничен, использование прямого метода RESS (Rapid Expansion of Supercritical Solution) для получения наночастиц большинства лекарственных соединений невозможно. Применение для этих целей флюидов на основе полярных соединений, например воды, невозможно вследствие высокой критической температуры (373°C для воды), при которой неизбежно химическое разложения органических соединений.
Для получения наночастиц малорастворимых веществ используют варианты, в которых сверхкритический флюид выполняет функции антирастворителя - метод SAS (Supercritical Anti-Solvent). Исходное лекарственное соединение растворяют в органическом растворителе, который полностью или частично смешивается со сверхкритическим флюидом. Получившийся раствор вводят при контролируемых условиях через распылительную насадку в емкость со сверхкритическим флюидом. В результате резкого уменьшения растворимости соединение кристаллизуется с образованием микро- и наночастиц. Существенным недостатком метода является загрязнение конечного продукта остаточными количествами используемых органических растворителей, при этом для уменьшения размеров получаемых наночастиц необходимо увеличение концентрации исходного вещества в органическом растворителе [I. De Marco, Е. Reverchon, "Influence of pressure, temperature and concentration on the mechanism of particle precipitation in supercritical antisolvent micronization", J. of Supercrit. fluids, 2011, V. 58, pp. 295-302], что ведет к росту степени загрязнения конечного продукта, снижению его выхода и росту затрат на производство единицы продукции.
Известны способы получения микронизированных и наноразмерных форм органических лекарственных соединений, использующие перевод исходного соединения в газовую фазу и осаждение ее на холодной поверхности. Например, из патента [B.C. Комаров, «Способ микронизации органической лекарственной субстанции», Патент РФ №2301058 от 19.07.2006] известен способ микронизации органической лекарственной субстанции, согласно которому производят испарение исходной субстанции в газовой среде с разрежением 133-1,3 Па и ее осаждение со скоростью 1014-5*1017 молекул/(см2*с) на поверхность осаждения, имеющую стабильную температуру - 175-100°C под углом 5-90 градусов относительно направления вектора осаждения. Метод обеспечивает одностадийное получение порошков органических лекарственных субстанций с узким диапазоном размеров частиц в микронной и субмикронной областях размеров. Принципиальным ограничением способа является невозможность получения наноразмерных порошков лекарственных субстанций - средний размер частиц, как следует из описания изобретения, превышает 1 мкм.
Наиболее близким по своей технической сути к предложенному способу получения наноразмерных порошков лекарственных препаратов является известный из патента [Г.Б. Сергеев, B.C. Комаров, В.П. Шабатин, «Способ получения порошков лекарственных препаратов», Патент РФ №2195264 от 05.07.2001] способ, согласно которому исходные лекарственные препараты испаряют при температуре 160-220°C в вакууме 7*10-4…10-5 Торр (10-1-1,33*10-3 Па) и конденсируют на охлажденной до -180…-196°C поверхности. Изобретение позволяет получать порошки лекарственных препаратов с диаметром частиц 0,008-0,010 мкм. Недостатком вышеуказанного способа является то, что частицы получаемого порошка лекарственного соединения размером 0,008-0,018 мкм находятся в сросшемся состоянии и для перевода их в свободно-дисперсное состояние требуется приложение дополнительных усилий.
Раскрытие изобретения
Целью настоящего изобретения является получение стабильных нанодисперсных порошков органических лекарственных соединений с заданным средним размером частиц в интервале 10-2000 нм и малой дисперсией распределения частиц по размерам.
Поставленная цель достигается предложенным способом, который включает перевод исходного вещества в газовую фазу, организацию направленного потока молекул соединения и последующую конденсацию вещества в виде наноразмерных частиц на охлаждаемой поверхности при этом перевод исходного вещества в газовую фазу и организацию направленного потока молекул соединения осуществляют в динамическом режиме за счет захвата паров вещества потоком нагретого инертного газа-носителя при приведенном мольном расходе газа-носителя в интервале от 0,01 до 2,0 моль/(м2*с), степени расширения потока газа-носителя (К) от значений Kmin=10 до Kmax=3060, расстоянии между соплом генератора молекулярного потока и поверхностью конденсора в интервале 0,005-1,0 м, причем нагрев газа-носителя осуществляют ступенчато - сначала до начальной температуры соответствующей давлению насыщенных паров исходного вещества в интервале 10-2-104 Па (Тн), затем по выходе потока газа-носителя из контейнера, содержащего исходное вещество, до рабочей температуры, превышающей начальную на 5-300°C (Тк), а конденсацию проводят на поверхности с температурой в интервале от -269C° до Tmax, где Tmax определяется природой соединения и соответствует давлению насыщенных паров осаждаемого соединения не выше чем 10-4 Па.
Дополнительно возможно в качестве газа-носителя использовать смесь двух или более газов, отличающихся по теплофизическим и адсорбционным характеристикам.
Дополнительно возможно в качестве газа-носителя использовать индивидуальные вещества или смеси веществ, которые при используемых экспериментальных параметрах конденсируются на охлаждаемой поверхности, в том числе и те, что при стандартных условиях (температуре 25°C и атмосферном давлении 1,013*105 Па), находятся в жидком или твердом состояниях, а для получения целевого продукта дополнительно проводят удаление сконденсированных носителей посредством сублимации.
Дополнительно возможно в качестве газа-носителя использовать смесь двух или более веществ, включающую вещества, одна часть которых конденсируется на охлаждаемой поверхности при используемых экспериментальных параметрах, а другая часть не конденсируется, а для получения целевого продукта дополнительно проводят удаление сконденсированных носителей посредством сублимации.
Для осуществления способа получения наноразмерных порошков лекарственных веществ предложено устройство, включающее блок задания потока газа-носителя, блок генератора молекулярного потока с программаторами температурного режима, блок низкотемпературного конденсора, вакуумный блок, при этом:
- блок генератора молекулярного потока выполнен по ступенчатой схеме и включает предварительный регулируемый нагреватель потока газа-носителя, контейнер для размещения исходного вещества, конечный регулируемый нагреватель газа-носителя, выходное сопло, геометрическая форма которого обеспечивает параллельность струи потока газа-носителя,
- конструкция блока низкотемпературного конденсора обеспечивает возможность плавной регулировки температуры его поверхности,
- блок задания потока газа-носителя состоит из двух или нескольких параллельных линий для независимой регулировки расхода каждого компонента газовой смеси, используемой в качестве газа-носителя,
- вакуумный блок, представляющий собой вакуумные насосы, вакуумные краны, вакуумные коммуникации, вакуумные датчики и вакуумметр, с возможностью измерения вакуума и регулирования степени расширения потока газа-носителя (К).
Дополнительно возможно в генераторе молекулярного потока для размещения исходного вещества использовать сеточные сублиматоры, в которых слой исходного вещества наносят на сетку из токопроводящего материала - металла и механически прижимают полученный слой к сетке, а для перевода вещества в газовую фазу сетку нагревают до определенной температуры за счет пропускания через сетку регулируемого электрического тока.
Прототип устройства описан в работе [Ю.Н. Морозов, А.Ю. Утехина, В.П. Шабатин, В.В. Чернышев, Г.Б. Сергеев, «Криосинтез наноразмерных лекарственных соединений», ЖРХО им. Д.И. Менделеева, 2012, т. LVI, №5-6, сс. 43-51] и в патенте: [B.C. Комаров, С.П. Михалев, Ю.Н. Морозов, Г.Б. Сергеев, «Способ сублимации труднолетучих органических соединений», Патент РФ №2295511 от 30.12.2005]. Суть их работы состоит в том, что слой органического материала наносят на сетку из токопроводящего материала и механически прижимают полученный слой к сетке. Нагревание слоя осуществляют посредством пропускания через сетку электрического тока. В качестве электропроводящего материала использовали металл с достаточно высоким электрическим сопротивлением. Предотвращение термического разложения органического лекарственного соединения достигается за счет нагревания только тонкого поверхностного слоя вещества, с которого и происходит сублимация.
Суть предложенного способа заключается в том, что при приближении к охлаждаемой поверхности поток газа-носителя с парами вещества быстро охлаждается, газовая фаза оказывается многократно пересыщенной относительно равновесной упругости паров соединения и в системе создаются условия для быстрого газофазного зародышеобразования, причем эти условия за счет высокого температурного градиента постоянно воссоздаются. В свою очередь, высокая скорость зародышеобразования обедняет газовую фазу парами соединения, что ограничивает дальнейший рост кристаллитов. Возникшие зародыши новой фазы растут за счет потока молекул или кластеров вещества из газовой фазы. Растущие частицы могут сталкиваться в газовой фазе и агрегировать. Далее сформировавшиеся в газовой фазе наночастицы захватываются холодной поверхностью и стабилизируются.
В качестве выходных параметров, характеризующих эффективность процесса, будем использовать следующие:
- средний размер частиц получаемого вещества (1), и дисперсия распределения частиц по размерам,
- выход конечного продукта - отношение массы полученного наноразмерного порошка к массе исходного соединения,
- приведенная мольная скорость выноса вещества в газовую фазу, характеризующая производительность процесса - (S-1*dn/dt, моль/с).
Для обеспечения воспроизводимо высоких характеристик конечного продукта, экспериментальные режимы процесса должны в максимальной степени предотвращать гетерогенное зарождение и рост частиц на поверхности конденсора, для чего концентрация вещества в потоке газа-носителя, достигающем поверхности должна быть пренебрежимо малой. Для этого на начальных стадиях процесса должны быть созданы условия, обеспечивающие высокую скорость зародышеобразования, а сформировавшиеся зародыши должны иметь достаточное для их роста время.
Основными экспериментальными параметрами, изменение которых позволяет регулировать средний размер получаемых частиц и поддержание которых обеспечивает малую дисперсию распределения частиц по размерам, являются:
- начальная температура контейнера, содержащего исходное вещество,
- рабочая температура потока газа-носителя, выходящего из сопла генератора молекулярного потока (Т0) и начальная концентрация вещества в газовой фазе (C0),
- температура конденсора (Tc),
- приведенный мольный расход газа-носителя (S-1*dN/dt),
- расстояние между соплом генератора молекулярного потока и поверхностью конденсора (d),
- степень разрежения потока газа-носителя (К).
Разогрев исходного вещества, размещенного в контейнере, осуществляется потоком нагретого газа-носителя, проходящего через контейнер, температура газа-носителя должна обеспечивать перевод исходного вещества в газовую фазу, давление насыщенных паров соединения должно лежать в интервале 10-2-104 Па. Понижение давления насыщенных паров ниже 10-2 Па нецелесообразно, поскольку скорость выноса вещества, а следовательно, производительность процесса будет недопустимо малой. Повышение давления насыщенных паров выше 104 Па нецелесообразно, поскольку скорость выноса вещества будет слишком высокой и на практике это приводит к тому, что все исходное вещество будет вылетать из контейнера до достижения искомой температуры.
Давление насыщенных паров является однозначной функцией температуры, эта зависимость индивидуальна для каждого вещества. Для подавляющего числа лекарственных веществ данных по экспериментальному определению этих параметров не имеется. Для оценки давления насыщенных паров и ее зависимости от температуры для используемых лекарственных соединений использовали программу ACD/Labs. В этой программе производится теоретическая оценка температуры кипения (Тк) и энтальпии испарения (ΔHисп) вещества. При расчете давления насыщенных паров при определенной температуре использовали уравнение Клайперона-Клаузевица:
Здесь P0(T1), Р0(Т2) - давление насыщенных паров соединения при температурах T1 и Т2, ΔHгаз - энтальпия перехода вещества в газовую фазу. При расчете давления насыщенных паров в интервале от температуры кипения (согласно данным расчета по программе ACD/Lab) до температуры плавления в качестве ΔHгаз использовали энтальпию испарения (согласно данным расчета по программе ACD/Lab): ΔHгаз=ΔHисп. При расчете давления насыщенных паров ниже температуры плавления в качестве ΔHгаз использовали сумму энтальпий испарения и плавления: ΔHгаз=ΔHисп+ΔHпл. Температуру и энтальпию плавления определяли экспериментально методом дифференциальной сканирующей калориметрии. Рассчитанные по программе ACD/Lab и экспериментально определенные физико-химические данные по использованным в работе лекарственным соединениям приведены в Табл. 1.
Для экспериментальной оценки давления насыщенных паров использовали данные по скорости выноса вещества из патрона и ее зависимости от температуры, полученные на установке №1 (Фиг. 1), в предположении, что поток газа-носителя по выходе из контейнера является насыщенным относительно паров исходного соединения, что можно показать, используя уравнение Герца-Кнудсена [М. Knudsen, «Die Gesetze der Molekularströmung und der inneren Reibungsströmung der Gase durch Röhren», Ann. Phys., 1909, V. 333, pp. 75-130], описывающего сублимационно-десублимационные процессы:
Здесь Р0 - упругость насыщенных паров вещества при температуре Т, Р - реальное давление паров вещества в газовой фазе, µ - молекулярный вес вещества, β - коэффициент сублимации - конденсации (0≤β≤1), rэфф - скорость сублимации. Размерность rэфф - моль на квадратный метр за секунду.
Рассматривая контейнер с исходным веществом как реактор идеального смешения, полагая, что его температура во всех точках постоянна и равна Т, можно получить соотношение:
Здесь Р0 - упругость насыщенных паров вещества при температуре Т, Р - упругость паров вещества в потоке по выходе из контейнера генератора молекулярного потока, Sэфф - эффективная суммарная площадь поверхности сублимируемого вещества, dV/dt=K*dv/dt - объем газа-носителя, проходящий через контейнер в единицу времени, dv/dt - расход газа-носителя, задаваемый блоком задания потока газа-носителя, K - степень расширения потока газа-носителя.
Например, для моногидрата 5-андростен-3β,17β-диола (µ=308,4 г/моль) при температуре 403 К, загрузке контейнера с исходным веществом в 0,1 г, среднем размере частиц сублимируемого вещества 100 мкм (S/m=5,2*10-2 м2/г), β=0,1, K=1000, dV/dt=0,9/3600*1000*403/293=0,34 л/с=0,34*10-3 м3/с. Здесь 0,9 л/ч - объемный расход газа-носителя, задаваемый газовой магистралью (расход соответствует температуре 293 К и давлению 1,013*105 Па), 1000 - степень расширения потока газа-носителя, 403/293 - температурная поправка. Подставляя величины в уравнение 2, получаем:
Таким образом, состав потока газа-носителя, вылетающего из сопла генератора молекулярного потока, должен быть близок к насыщенному относительно температуры контейнера, содержащего исходное вещество. Для расчета давления насыщенных паров использовали уравнение:
откуда следует
Здесь dn/dt - мольная скорость выноса вещества в газовую фазу, С0 - начальная концентрация вещества в газовой фазе.
Повторный разогрев потока газа-носителя по выходе из контейнера необходим для предотвращения осаждения вещества из газовой фазы на выходном сопле генератора молекулярного потока, обращенном к холодной поверхности, а также для перевода в газовую фазу мелких частиц или капелек исходного соединения, захваченных потоком газа-носителя. Кроме того, повышение начальной температуры потока газа-носителя, вылетающего из сопла, приводит к смещению зоны эффективного зародышеобразования ближе к холодной поверхности в область более высоких значений температурного градиента, что служит дополнительным фактором управления процессами газофазного зарождения и роста наночастиц. Разность температур предварительно и повторно нагретого потока газа-носителя должна лежать в пределах 5-300°C. Понижение разницы температур ниже 5°C может приводить к частичному осаждению вещества из газовой фазы на выходном сопле генератора молекулярного потока и падению выхода конечного продукта. Повышение ее выше 300°C может приводить к подавлению процессов зародышеобразования в газовой фазе и, как следствие, к смене механизма зародышеобразования и роста частиц с газофазного гомогенного на поверхностный гетерогенный, что ведет к невоспроизводимости результатов эксперимента. Кроме того, для ряда лекарственных веществ значительное повышение температуры может приводить к частичному разложению соединения.
Для минимизации дисперсии распределения конечного продукта по размерам необходимо обеспечение максимально возможной идентичности физических условий по сечению потока газа-носителя перпендикулярному направлению его движения. Это достигается за счет формирования в вакуумных условиях соплом генератора молекулярного потока практически не расходящейся струи газа-носителя заданной геометрии. Малая расходимость струи газа-носителя при движении от сопла генератора молекулярного потока к охлаждаемой поверхности подтверждается тем фактом, что при поддержании оптимальных экспериментальных параметров более 95% осажденного на конденсоре вещества находилось в области лежащей напротив сопла генератора молекулярного потока и строго повторяющей его геометрическую конфигурацию.
При условии нерасходимости потока газа-носителя и идентичности физических параметров по сечению потока газа-носителя перпендикулярному направлению его движения, для расчета стационарного теплового поля потока газа-носителя в рабочей области, можно применить одномерное дифференциальное уравнение теплопроводности, учитывающее перенос массы:
Здесь ν → - линейная скорость фронта газа-носителя, Cv, µ, ρ, λ - теплоемкость при постоянном объеме, молекулярная масса, плотность и теплопроводность газа-носителя, соответственно. Координата x направлена от сопла генератора молекулярного потока (x=0) к поверхности низкотемпературного конденсора (x=d).
Предполагается, что теплопроводность газа-носителя является функцией только температуры (λ ~ Т0,5) и не зависит от его плотности.
В стационарном режиме - поэтому:
Принимая во внимание, что мольный расход газа-носителя можно записать в виде: (здесь dN/dt - мольный расход газа-носителя, задаваемый газовой магистралью, S - площадь сопла генератора молекулярного потока), дифференциальное уравнение теплопроводности можно записать в виде:
Здесь S-1*dN/dt - приведенный (к единице площади сопла генератора молекулярного потока) мольный расход газа-носителя. Из вида уравнения следует, что именно этот параметр определяет стационарное тепловое поле в области между соплом генератора молекулярного потока и поверхностью низкотемпературного конденсора.
Приведенное дифференциальное уравнение теплопроводности можно решить при наложении граничных условий: Т(0)=Т0, T(d)=ТС, где Т0 - начальная температура газа-носителя по выходе из сопла генератора молекулярного потока, T(d) - температура поверхности низкотемпературного конденсора.
Из вышеизложенного следует, что вид решения данного дифференциального уравнения теплопроводности задается набором следующих параметров:
- приведенным к единице площади сопла генератора молекулярного потока мольным расходом газа-носителя (S-1*dN/dt),
- начальной температурой газа-носителя, вылетающего из сопла генератора молекулярного потока (Т0),
- температурой конденсора (ТС),
- расстоянием между соплом генератора молекулярного потока и конденсором (d),
- теплофизическими характеристиками газа-носителя (λ, Cv).
Процесс газофазного зарождения и роста наночастиц в струе газа-носителя можно описывать как результат изменения температуры при движении фронта газа-носителя с определенной линейной скоростью ( ν → ) в сформированном стационарном температурном поле.
Приведенный мольный расход газа-носителя (S-1*dN/dt) должен лежать в пределах от 0,01 до 2 моль/(м2*с). Использование параметра S-1*dN/dt ниже 0,01 моль/(м2*с) нецелесообразно в силу следующих причин:
- скорость вылета вещества из генератора молекулярного потока пропорциональная S-1*dN/dt и, следовательно, производительность процесса падает ниже допустимых пределов,
- падение линейной скорости движения фронта газа-носителя, ( ν → ) , приблизительно пропорциональной S-1*dN/dt, приводит к понижению скорости зародышеобразования, вследствие уменьшения скорости снижения температуры, при одновременном увеличении времени эффективного роста частиц, что приводит к росту размеров частиц выше наноразмерного диапазона,
- при уменьшении параметра S-1*dN/dt расходимость потока газа-носителя возрастает, что приводит к росту дисперсии распределения конечного продукта по размерам.
Использование параметра S-1*dN/dt выше 2 моль/(м2*с) нецелесообразно в силу следующих причин:
- выход конечного продукта падает ниже разумных пределов вследствие того, что линейная скорость движения фронта газа-носителя становится настолько большой, что сформировавшиеся частицы приобретают большую кинетическую энергию и не могут удержаться на поверхности конденсора при первом соударении. Визуально это выглядит таким образом, что меньшая часть вещества в результате повторных соударений осаждается тонким слоем по всем поверхностям реактора, в том числе и не охлаждаемым, а большая часть вылетает в вакуумную систему,
- увеличение параметра S-1*dN/dt приводит к росту линейной скорости потока газа-носителя, снижению времени эффективного зародышеобразования, уменьшению времени нахождения растущих частиц в газовой фазе и, следовательно, увеличению концентрации молекул соединения в потоке газа-носителя, достигающем поверхности конденсора, что ведет к дополнительному гетерогенному поверхностному зародышеобразованию и неконтролируемому росту зафиксированных на поверхности частиц, что, в свою очередь, приводит к ухудшению выходных характеристик конечного продукта и росту их невоспроизводимости.
Охлаждение потока газа-носителя осуществляется за счет передачи тепла от него к холодной поверхности конденсора по механизму теплопроводности, поэтому уменьшение температуры поверхности конденсора приводит к равномерному росту температурного градиента в области между соплом генератора молекулярного потока и поверхностью конденсора, и, следовательно, к росту эффективной скорости зародышеобразования и к уменьшению среднего размера частиц конечного продукта, рост температуры поверхности конденсора, соответственно, приводит к обратному результату.
Минимальная температура конденсора, при которой проводились опыты, составляет - 269C°, что соответствует температуре кипения гелия. Проведение экспериментов при более низкой температуре практически не осуществимо из-за технологических трудностей. Верхний предел температуры конденсора определяется принципиальной возможностью осаждения вещества на его поверхности. Опыт показывает, что максимальная температура поверхности должна соответствовать давлению насыщенных паров осаждаемого соединения не выше чем 10-4 Па.
От расстояния между соплом генератора молекулярного потока и конденсором (d) зависит время, отводимое на процессы зародышеобразования и роста наночастиц, распределение градиента температуры по стационарному температурному полю, а также расходимость потока газа-носителя, несущего молекулы и наночастицы лекарственного соединения. Уменьшение параметра d менее 0,005 м нецелесообразно в силу того, что время движения фронта потока газа-носителя от сопла генератора молекулярного потока до поверхности конденсора недостаточно для эффективного зародышеобразования и роста частиц, в связи с чем поток газа-носителя, достигающий поверхности конденсора, оказывается обогащенным молекулами соединения, что ведет, во-первых, к быстрому неконтролируемому росту частиц на поверхности и, во-вторых, к снижению выхода конечного продукта ниже допустимых пределов.
Увеличение параметра d более 1,0 м нецелесообразно в силу того, что на большей части пути движения фронта газа-носителя температурный градиент оказывается слишком малым для обеспечения эффективного зародышеобразования, а большое время нахождения сформировавшихся частиц в пути приводит к тому, что размеры частиц, достигающих поверхности конденсора, выходят из нанометрового диапазона. Кроме того, при увеличении параметра d увеличивается расходимость потока газа-носителя, что ведет к росту дисперсии распределения частиц по размерам, а также к уменьшению выхода конечного продукта.
Непосредственное дистанционное определение линейной скорости движения фронта газа-носителя ( ν → ) внутри реактора является сложной экспериментальной задачей, которая, как показывает анализ доступной литературы, до сих пор не решена. Для косвенного определения ( ν → ) проводили оценку степени расширения газа-носителя - K. Действительно, выражение для приведенного мольного расход газа-носителя можно представить в виде:
откуда следует: здесь ρ - плотность потока газа-носителя, выходящего из сопла генератора молекулярного потока, ρ0 - начальная плотность газа-носителя (приблизительно равная плотности при комнатной температуре 298 К и стандартном давлении 1,01325*105 Па), и - соответствующие мольные объемы газа-носителя.
Газ-носитель, при движении через внутренние полости генератора молекулярного потока, преодолевает определенное газодинамическое сопротивление, нагревается, вследствие чего степень его расширения - K постоянно меняется. Для оценки эффективного значения K использовали соотношение:
K=Тн/293*Pат/Pэфф, Pэфф=0,5*(Pнач+Pкон),
здесь Рат - атмосферное давление (1,013*105 Па), Рнач и Ркон - давление на входе в реактор и на выходе из него в вакуумную систему, соответственно, Тн - температура контейнера с исходным веществом. Температура газа-носителя на входе в реактор и на выходе из него близка к комнатной.
Степень расширения потока газа-носителя определяется соотношением расхода газа-носителя (dN/dt), задаваемого газовой магистралью, производительности применяемого вакуумного насоса и суммарного газодинамического сопротивления внутренней полости генератора молекулярного потока и вакуумных коммуникаций. В установках первого типа (Фиг. 1) поток газа-носителя проходит непосредственно через контейнер, поэтому по мере вылета из него исходного вещества газодинамическое сопротивление генератора молекулярного потока уменьшается, что приводит к росту K в ходе опыта. В установках второго типа (Фиг. 2) поток газа-носителя проходит параллельно поверхности сеточных сублиматоров, содержащих исходное вещество, поэтому изменение газодинамического сопротивления и K в ходе опыта не происходит.
Для смонтированной стационарной вакуумной системы, при полностью открытых коммуникациях, можно достичь некого максимального значения K - Kmax. Применение управляемых вакуумных затворов позволяет регулировать газодинамическое сопротивление вакуумной системы и тем самым изменять значение K в пределах от 1 до Kmax. В этом качестве можно, например, использовать многооборотные тефлоновые вакуумные краны.
При проведении опытов с неконденсирующимися газами-носителями, для создания вакуума, использовали только форвакуумные насосы (2НВР-5ДМ, 2НВР-60ДМ). При проведении опытов с конденсирующимися в условиях эксперимента газами-носителями подавляющая их часть осаждается на поверхности низкотемпературного конденсора. В этих условиях значение Kmax при открытых вакуумных коммуникациях практически полностью определяется расходом газа-носителя (dN/dt) и газодинамическим сопротивлением содержимого генератора молекулярного потока. Величина Kmax при этом мало зависит от типа и производительности используемых вакуумных насосов. Использование других типов вакуумных насосов, помимо форвакуумного, целесообразно для обеспечения эффективной теплоизоляции, например в опытах с использованием гелиевого проточного криостата.
Проведение экспериментов при полностью открытых вакуумных коммуникациях во всех случаях приводило к эффективному синтезу наноформ лекарственных веществ с высоким выходом.
Уменьшение значения К приводит к снижению линейной скорости движения фронта газа-носителя ( ν → ) и, как следствие, к росту размеров получаемых частиц, поскольку эффективная скорость зародышеобразования падает, а предоставляемое для роста частиц время растет. Таким образом, изменение параметра К позволяет регулировать размер частиц. Уменьшение значения К в определенных пределах приводит также к росту выхода конечного продукта. Дальнейшее уменьшение К приводит к снижению выхода, поскольку растет степень рассеивания потока газа-носителя и вещество начинает осаждаться то