Противовирусное средство на основе сухого экстракта плодового тела ксилотрофного базидиомицета bjerkandera adusta
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, а именно к противовирусному средству на основе экстракта ксилотрофного базидиомицета Bjerkandera adusta (Willd.) P. Karst, представляющему собой сухой экстракт гриба, приготовленный методом высушивания водного извлечения биологически активных веществ из измельченного и гомогенизированного сырья, при определенном содержании компонентов в сухом экстракте. Вышеописанное средство обладает противовирусной активностью в отношении РНК-геномного вируса гриппа А субтипов H1N1, H3N2 и H5N1. 6 табл., 4 пр.
Реферат
Изобретение относится к средству, полученному на основе сухого экстракта ксилотрофного базидиального гриба Bjerkandera adusta (Бьеркандера опаленная - Трутовик опаленный), с противовирусной активностью в отношении РНК-геномного вируса (вируса гриппа А), и ДНК-геномных вирусов (ортопоксвирусов: вирусов осповакцины и оспы мышей - эктромелии; и вируса простого герпеса 2-го типа) и может быть использовано в фармацевтике, биотехнологии, вирусологии и ветеринарии.
Вирус гриппа A является единственным вирусом, способным вызвать пандемию в современном мире. В прошлом столетии зарегистрированы три пандемии, различающиеся по своей тяжести, а именно: пандемии «испанского гриппа» в 1918-1919 гг., «азиатского гриппа» в 1957-1959 гг. и «гонконгского гриппа» в 1968-1970 гг.
Первая в новом веке пандемия «свиного гриппа» (2009-2010 гг.; A/California/07/09 (H1N1) swl) на конец марта 2010 г., по данным ВОЗ, стала причиной гибели более 17 тыс. человек, потребовала масштабных затрат и усилий международного сообщества на проведение противоэпидемических мероприятий [Щелканов М.Ю. Эволюция высоковирулентного вируса гриппа A (H5N1) в экосистемах Северной Евразии (2005-2009 гг.): Автореферат дис. д-ра биол. наук. - М., 2010. - 53 с.].
Существует угроза возникновения новой пандемии гриппа, вызванной вирусом гриппа птиц субтипов H5N1, H7N9 и др. По данным ВОЗ на 07.10.13 г. вирусы гриппа H5N1, циркулирующие среди дикой и домашней птицы в Юго-Восточной Азии и других регионах мира, вызвали заболевание 641 человека в 15 странах со смертностью 59% [http://www.who.int/entity/influenza/human_animal_interface/Influenza_Summary_IRA_HA_interface_7October13.pdf].
В связи с вышеизложенным необходимость создания средств защиты от гриппозной инфекции чрезвычайно актуальна. В настоящее время борьба с гриппозной инфекцией основывается на вакцинопрофилактике и на лечении с комплексным применением этиотропных, патогенетических и симптоматических средств [Ершов Ф.И., Романцев М.Г. Лекарственные средства, применяемые при вирусных заболеваниях. М., 2007, 368]. Однако для лечения и профилактики пандемического гриппа ВОЗ рекомендует использовать препараты этиотропного действия, оказывающие непосредственное прямое воздействие на размножение вируса. В настоящее время не существует достаточно эффективных средств предотвращения эпидемий и пандемий гриппа. Так, известно, что применение ингибиторов М2-каналов (амантадин и ремантадин) часто является малоэффективным в отношении штаммов вируса гриппа птиц и совсем не эффективным в отношении вируса гриппа B, что связано с возникновением мутаций в гене М2 белка, приводящих к появлению резистентности вируса гриппа к ремантадину [Watts J. Asian nations step up action to curb spread of avian influenza. Lancet. 2004, 363, 9406: 373]., 430, 6996: 209-213]. Селективные ингибиторы вирусной нейраминидазы озельтамивир (Тамифлю) и занамивир (Реленза) эффективны в отношении вирусов гриппа A и B [WHO Rapid Advice Guidelines on pharmacological management of humans infected with avian influenza A (H5N1) virus, WHO., 2006]. Однако варианты вируса гриппа, резистентные к озельтамивиру, возникают довольно часто.
В связи с этим поиск новых эффективных в отношении гриппозной инфекции лекарственных веществ является одной из приоритетных задач здравоохранения.
Несмотря на уничтожение натуральной оспы в 1980 г., потенциальная опасность возрождения этой инфекции сохраняется и в наши дни, так как во многих районах Центральной Африки, Южной Америки и Евразии распространены близкие к вирусу натуральной оспы патогенные для человека зоонозные ортопоксвирусы такие, как вирусы осповакцины, оспы коров, оспы буйволов и оспы обезьян, природным резервуаром которых являются разные виды грызунов. Кроме того, у населения отсутствует поствакцинальный иммунитет к вирусу натуральной оспы после прекращения более 30 лет назад вакцинации и производства вакцин по рекомендации ВОЗ, - все это создает риск обострения эпидемической ситуации [Львов Д.К., Зверев В.В, Гинцбург А.Л., Маренникова С.С., Пальцев М.А. Натуральная оспа - дремлющий вулкан // Вопросы вирусологии. - 2008. - №4. - С. 4-8].
В связи с вышеизложенным, а также с тем, что научное сообщество и органы здравоохранения не располагают эффективными, адаптированными для массового применения профилактическими и лечебными препаратами против ортопоксвирусов, необходимы исследования по поиску и разработке таких препаратов.
Среди вирусных заболеваний герпетическая инфекция, вызываемая вирусами 1 и 2 типов, занимает одно из лидирующих мест. Так, согласно статистике ВОЗ, в последние годы заражение вирусами простого герпеса (ВПГ) составляет 75-95% населения Земли, при этом смертность от диссеминированных форм болезни, вызванной ВПГ, составляет 15,8% от всех вирусных заболеваний и занимает 2-е место после показателя смертности от гриппа (35,8%) [Самгин М.А. Простой герпес. Дерматологические аспекты / М.А. Самгин, А.А. Халдин. М.: МЕДпресс информ, 2002. 160 с. ]. Герпесвирусная этиология, обусловленная ВПГ-1 и ВПГ-2, прослеживается у 10,0% всех энцефалитов и 20,0% менингоэнцефалитов на территории нашей страны. Летальность при энцефалитах герпетической этиологии составляет 80,0%. В России число госпитализированных больных с диагнозом ВПГ ежегодно превышает 2,5 млн. чел., а трудопотери исчисляются более 40 млрд. руб. в год. Больные с хроническими поражениями кожных покровов, вызванных вирусами герпеса, а также больные с генитальным герпесом составляют более 10,0% от всего населения России; в 2008 г. заболеваемость составила 18,1 на 100 тыс. населения [Самгин М.А. Простой герпес. Дерматологические аспекты / М.А. Самгин, А.А. Халдин. М.: МЕДпресс информ, 2002. 160 с. ].
Для лечения герпетической инфекции используют: химиопрепараты, действующие непосредственно на вирусы; иммуномодуляторы; симптоматические, а также патогенетические средства [Исаков В.А., Архипова Е.И., Исаков Д.В. Герпесвирусные инфекции человека. СПб., 2006; с. 12-150]. Многие из применяемых в настоящее время противогерпетических препаратов имеют ряд существенных недостатков, среди них такие, как низкая биодоступность, высокая нефротоксичность, быстрое развитие устойчивости штаммов ВПГ к препаратам. Все это обусловливает актуальность проблемы создания более эффективных препаратов против герпеса.
Таким образом, одной из главных проблем профилактики и лечения вирусных инфекций является высокая скорость изменчивости многих вирусов, особенно вируса гриппа, что позволяет им, с одной стороны, ускользать от иммунного ответа хозяина, а с другой - в течение нескольких вирусных поколений вырабатывать устойчивость к противовирусным препаратам. Поэтому поиск наиболее эффективных средств для профилактики и лечения вирусных инфекций является чрезвычайно актуальным.
Предшествующий уровень техники
Известно, что экстракты, полученные из плодовых тел и культивированного мицелия гриба Трутовика лекарственного (Fomitopsis officinalis), обладают антивирусной активностью в отношении ортопоксвирусов: вируса оспы коров (Cowpox virus) и вируса вакцины (Vaccinia virus) [P. Stamets. Antipox Properties of Fomitopsis officinalis (Vill.: Fr.) Bond. And Singer (Agaricon) from the Pacific Northwest of North America // International Journal of Medicinal Mushrooms, 2005, Vol. 7, pp. 495-506]. Однако в данном исследовании установлено, что экстракты, полученные из плодовых тел и культивированного мицелия гриба Fomitopsis officinalis, обладают ингибирующей активностью только в отношении ортопоксвирусов: вируса оспы коров (Cowpox virus) и вируса вакцины (Vaccinia virus) и не обладают аналогичной активностью в отношении вирусов гриппа и простого герпеса 2-го типа. Кроме того, не изучался качественный и количественный химический состав экстрактов этого гриба.
Установлена антивирусная активность экстракта европейского гриба Ganoderma pfeifferi BRES в отношении вирусов гриппа типа A и простого герпеса 1-го типа [Mothana R.A.A., Awadh Аli N.A., Jansen R., Wegner U., Mentel R., Lindequist U. Antiviral lanostanoid triterpenes from the fungus Ganoderma preifferi // Fitoterapia. - 74 (2003). - P. 177-180]. Противовирусными компонентами экстракта были тритерпеноиды: ганодермадиол, луцидодиол и апланоксиновая кислота G, которые все проявили активность in vitro против вируса гриппа (уровень IC50 в MDCK клетках>0.22; 0.22 и 0.19 ммоль/л соответственно), а первое из упомянутых выше соединений было также активно и в отношении вируса простого герпеса 1-го типа [Jordan K. Zjawiony. Biologically Active Compounds from Aphyllophorales (Polypore) Fungi // J. Nat. Prod. - 2004. - V. 67. - N 2. - P. 300-310; Timo H.J. Niedermeyer, Ulrike Lindequist, Renate Mentel, Dirk Gordes, Enrico Schmidt, Kerstin Thurow, and Michael Lalk. Antiviral Terpenoid Constituents of Ganoderma pfeifferi // J. Nat. Prod. - 2005. - V. 68. - P. 1728-1731]. При этом в работе не показана ингибирующая активность экстрактов, полученных из гриба Ganoderma pfeifferi, в отношении ДНК-геномных вирусов (вируса простого герпеса 2-го типа и ортопоксвирусов).
Выделены изопрены хиспидин и хисполон из этанольных экстрактов как плодового тела, так и мицелия трутового гриба Inonotus hispidus, которые проявляли антивирусную активность в отношении вируса гриппа А и В [Ali N.A.A., Jansen R., Pilgrim Н., Liberra K., Lindequist U. Hispolon, a yellow pigment from Inonotus hispidus // Phytochemistry. 1996. - V. 41, I. 3, P. 927-929; Awadh Ali N.A., Mothana R.A.A., Lesnau A., Pilgrim H., Lindequist. Antiviral activity of Inonotus hispidus // Fitoterapia. - 74 (2003). - P. 483-485]. Следует отметить, что в данной работе установлена ингибирующая активность изопренов, выделенных из этанольных экстрактов плодовых тел и мицелия гриба Inonotus hispidus, только в отношении вирусов гриппа и не показана их вирусингибирующая активность в отношении ДНК-геномных вирусов (ортопоксвирусов и вируса простого герпеса 2-го типа). Кроме того, не изучалась противовирусная активность водных экстрактов гриба Inonotus hispidus.
Наиболее близким аналогом (прототипом) по назначению и совокупности существенных признаков является публикация статьи [Костина Н.Е., Ибрагимова Ж.Б., Проценко М.А., Макаревич Е.В., Скарнович М.А., Филиппова Е.И., Горбунова И.А., Власенко В.А., Трошкова Г.П., Мазуркова Н.А., Шишкина Л.Н. Выделение, характеристика и противовирусные свойства биологически активных вееств из высших грибов Западной Сибири // Современные проблемы науки и образования. - 2013. - №.3], в которой раскрыт водный и этанольный сухой экстракт гриба Bjerkandera adusta.
Однако в вышеуказанном аналоге не исследовалась противовирусная активность экстракта плодового тела ксилотрофного базидиомицета Bjerkandera adusta, полученного методом водного извлечения, в отношении вируса гриппа А субтипов H1N1, H3N2 и H5N1.
Техническим результатом заявляемого изобретения является расширение спектра противовирусных средств на основе экстракта плодового тела ксилотрофного базидиомицета Bjerkandera adusta с активностью в отношении РНК-геномного вируса гриппа А субтипов H1N1, H3N2 и H5N1.
Указанный технический результат достигается созданием противовирусного средства на основе экстракта ксилотрофного базидиомицета Bjerkandera adusta (Willd.) P. Karst, представляющего собой сухой экстракт гриба, приготовленного методом высушивания водного извлечения биологически активных веществ из измельченного и гомогенизированного сырья, при следующем содержании компонентов в сухом экстракте:
| сухие экстрактивные вещества | не менее 200 мг/г |
| полисахариды | не менее 94 мг/г |
| суммарные белки | не менее 33 мг/г |
| фенольные соединения | не более 5 мг/г |
водный раствор которого в концентрации не менее 0,5 мг/мл при водном извлечении обладает противовирусной активностью в отношении РНК-содержащего вируса гриппа А субтипов H1N1, H3N2 и H5N1.
Таким образом, по сравнению с прототипом, разработано средство, обладающее противовирусной активностью для ингибирования репродукции РНК-геномного вируса гриппа А субтипов H1N1, H3N2 и H5N1.
Известно, что полисахариды базидиомицетов способны ингибировать репродукцию вирусов, блокируя процесс их адсорбции на клетках [Полiщук О.М., Коваленко О.Г. Бiологична актiвнiсть глiкополiмерiв базидiальных грибiв // Biopolymers and Cell, 2009. - vol. 25. - N 3. - P. 181-193]. Другие биологически активные вещества - тритерпены, выделенные из Ganoderma applanatum (Pers.) Pat., были эффективны в ингибировании герпетического вируса Эпштейна-Барра в клетках линии Raji [Chairul J.C., Tokuyama Т., Hayashi Y. Nishizawa M, Tokuda H, Chairul SM, et al. Applanoxidic acids А, В, С and D, biologically active tetracyclic triterpenes from Ganoderma applanatum // Phytochemistry. 1991. Vol. 30. P. 4105-4109; Chairul S.M., Hayashi Y. Lanostanoid triterpenes from Ganoderma applanatum // Phytochemistry. 1994. Vol. 35. P. 1305-1308].
Ниже приведен пример 1 получения экстрактивных веществ из плодовых тел гриба Bjerkandera adusta (Willd.) P. Karst.
Пример 1. Получение сухого экстракта из плодовых тел гриба методом высушивания водного извлечения из измельченного и гомогенизированного сырья. 10 г измельченных и гомогенизированных плодовых тел гриба суспендировали в 600 мл стерильной дистиллированной воды в течение 1 часа при периодическом помешивании при температуре (95°C). Использование температуры экстрагирования 95°C при прочих равных условиях было оптимальным для максимального извлечения ЭВ из гриба Bjerkandera adusta (табл. 1).
Затем надосадочную жидкость отделяли фильтрованием, а осадок повторно обрабатывали 400 мл воды в течение 1 часа при температуре 95°C, далее экстракты объединяли, выпаривали на ротационном испарителе и высушивали при температуре 60°C в сушильном шкафу.
Пример 2. Определение органолептических и физико-химических показателей экстракта гриба
Определение органолептических и физико-химических показателей водных экстрактов проводили следующим образом: потерю в массе при высушивании определяли по фармакопейной методике, содержание тяжелых металлов определяли по ГФ XII, содержание полисахаридов определяли спектрофотометрически модифицированным антроновым методом Дрейвуда.
Результаты определения органолептических и физико-химических показателей экстрактов приведены в таблице 2.
Пример 3. Определение характеристик водного экстракта гриба
Определение суммы экстрактивных веществ проводили по методике ГФ XII изд., вып. 2. Для качественного обнаружения флавоноидных соединений в экстрактах гриба применяли качественные реакции с раствором натрия гидроксида, алюминия хлорида, железа хлорида, а также метод тонкослойной хроматографии (ТСХ). Для обнаружения тритерпенов и каротиноидов использовали метод ТСХ.
Количественное содержание белка в образцах определяли по Бредфорду по фармакопейной методике.
Суммарное содержание полисахаридов определяли спектрофотометрически модифицированным антроновым методом Дрейвуда, включающем кислотный гидролиз полисахаридов серной кислотой с получением моносахаридов, образующих с антроном окрашенные комплексы сине-зеленого цвета с максимумом спектра поглощения при 520-625 нм. При разбавлении реакционной смеси этиловым спиртом максимум спектра поглощения смещается до 430 нм. Определение содержания полисахаридов проводили в пересчете на глюкозу, используя предварительно построенный калибровочный график зависимости величины оптической плотности глюкозы (λ=430 нм) от концентрации.
Результаты определения химических характеристик водного извлечения из гриба Bjerkandera adusta (Willd.) P. Karst. приведены в таблице 3.
Пример 5. Определение противовирусной активности экстрактов гриба Bjerkandera adusta в культурах клеток MDCK и Vero
Культура клеток. Для тестирования противовирусной активности препаратов использовали перевиваемые культуры клеток MDCK и Vero, полученные из коллекции культур клеток ФБУН ГНЦ ВБ «Вектор». По 100 мкл суспензии клеток MDCK в среде RPMI-1640 (или Vero в среде DMEM) вносили в 96-луночные планшеты 12-канальной автоматической пипеткой. Планшеты с клетками помещали в термостат при температуре +37°C, 5% CO2 и 100% влажности на 2-3 сут до образования клеточного монослоя.
Определение токсичности экстрактов. Для определения токсических концентраций экстрактов образцы разводили в несколько раз и оценивали наличие токсического действия в монослоях культур клеток MDCK и Vero с помощью инвертированного микроскопа. Для этого делали разведения исходного образца в 5 раз, в 10, 100, 1000, 10000, 100000, 1000000 раз средой RPMI-1640 (для клеток MDCK) или средой DMEM (для клеток Vero), содержащей 5% сыворотки крови плодов коровы, вносили по 150 мкл в соответствующие лунки планшета и ставили в термостат при температуре +37°C, 5% CO2 и 100% влажности на 2-4 сут. Через 2-4 сут с помощью инвертированного микроскопа оценивали наличие токсического действия в монослоях клеток MDCK и Vero, инкубированных с разными концентрациями грибных экстрактов.
В опытах по определению противовирусной активности грибных экстрактов на культурах клеток MDCK и Vero использовали предварительно определенные их максимально переносимые концентрации (МПК) для этих клеточных культур.
Определение противовирусной активности экстрактов. В работе использовали штаммы РНК-геномного вируса: штамм вируса гриппа птиц A/chicken/Kurgan/05/2005 (H5N1) и штаммы вируса гриппа человека A/Aichi/2/68 (H3N2) и A/Moscow/226/2009 (H1N1)v, полученные из Государственной коллекции возбудителей вирусных инфекций и риккетсиозов ФБУН ГНЦ ВБ «Вектор» (п. Кольцово, Новосибирская обл.).
Определение противовирусной активности экстрактов в отношении РНК-содержащих вирусов. Наработку вируса гриппа производили на 10-суточных куриных эмбрионах (КЭ), титрование вируса гриппа проводили на культуре клеток MDCK. Концентрация разных субтипов вируса гриппа в вирусаллантоисной жидкости (ВАЖ) составляла от 6,0 до 8,2 lg ТЦД50/мл (десятичных логарифмов 50% тканевых цитопатических доз в мл). В опытах по определению противовирусной активности грибных экстрактов в отношении вируса гриппа готовили разведения ВАЖ каждого вируса от 1 до 8 с десятикратным шагом с использованием среды RPMI-1640 (ООО «Биолот», Россия), содержащей 2 мкг/мл трипсина TPCK (Sigma, США). Для определения противовирусной активности образцов в монослой культуры клеток MDCK вносили по 50 мкл выбранного разведения экстракта на среде RPMI-1640, содержащей 2 мкг/мл трипсина и 100 мкл разведенного от 1 до 8 или неразведенного ВАЖ. В случае использования неразведенных грибных экстрактов или ВАЖ трипсин вносили до конечной концентрации 2 мкг/мл поддерживающей среды в лунке 96-луночного планшета. Клетки инкубировали 2 сут при температуре 37°C в атмосфере 5% CO2 в термостате ТС-1/80 СПУ (Россия). Через 2 сут в каждой лунке с помощью инвертированного микроскопа регистрировали цитопатическое действие (ЦПД) в монослое клеток и определяли наличие вируса в среде культивирования по реакции гемагглютинации (РГА) с 1%-й суспензией эритроцитов кур. Определяли титры вируса в lg ТЦД50/мл в контроле (50%-я инфицирующая доза - ИД50 in vitro без препарата) и в опыте (ИД50 in vitro с препаратом), а затем высчитывали индекс нейтрализации (ИН) вирусов под влиянием экстракта: ИН=ИД50контроль-ИД50опыт (lg).
В качестве контроля использовали:
1. Контроль клеток MDCK, культивируемых в питательной среде RPMI-1640 (ООО «Биолот», С-Петербург), содержащей 2 мкг/мл трипсина TPCK (Sigma, США).
2. Контроль репродукции штаммов вируса гриппа A/Aichi/2/68 (H3N2), A/Moscow/226/2009 (H1N1)v и A/chicken/Kurgan/05/2005 (H5N1) с 1 до 8 разведения с десятикратным шагом без внесения грибных экстрактов.
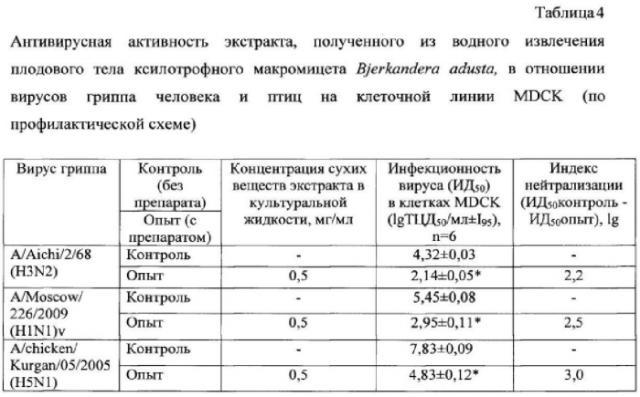
В таблице 4 представлены результаты определения противовирусной активности экстракта, полученного из водного извлечения плодового тела гриба Bjerkandera adusta, в отношении штаммов A/Aichi/2/68 (H3N2) и A/Moscow/226/2009 (H1N1)v вируса гриппа человека и штамма A/chicken/Kurgan/05/2005 (H5N1) вируса гриппа птиц по профилактической схеме в монослое клеток MDCK.
Как видно из таблицы 4, экстракт, полученный из водного извлечения данного гриба, проявил выраженный противовирусный эффект в отношении используемых в эксперименте штаммов вируса гриппа субтипов H3N2, H1N1 и H5N1. Индексы нейтрализации для штаммов вируса гриппа A/Aichi/2/68 (H3N2), A/Moscow/226/2009 (H1N1)v и A/chicken/Kurgan/05/2005 (H5N1) под действием экстракта, полученного из водного извлечения Бьеркандеры опаленной, в концентрации 0,5 мг/мл составили 2,2; 2,5 и 3,0 lg соответственно. Экстракт, полученный из водного извлечения плодового тела гриба Bjerkandera adusta, проявивший противогриппозный эффект, содержал 21% экстрактивных веществ, 37,0 мг/г суммарных белков и 104 мг/г суммарных сахаров (табл. 3) 5 раз, в 10, 100, 1000, 10000, 100000, 1000000 раз средой RPMI-1640 (для клеток MDCK) или средой DMEM (для клеток Vero), содержащей 5% сыворотки крови плодов коровы, вносили по 150 мкл в соответствующие лунки планшета и ставили в термостат при температуре +37°C, 5% СО2 и 100% влажности на 2-4 сут. Через 2-4 сут с помощью инвертированного микроскопа оценивали наличие токсического действия в монослоях клеток MDCK и Vero, инкубированных с разными концентрациями грибных экстрактов.
В опытах по определению противовирусной активности грибных экстрактов на культурах клеток MDCK и Vero использовали предварительно определенные их максимально переносимые концентрации (МПК) для этих клеточных культур.
Определение противовирусной активности экстрактов. В работе использовали штаммы РНК-геномного вируса: штамм вируса гриппа птиц A/chicken/Kurgan/05/2005 (H5N1) и штаммы вируса гриппа человека A/Aichi/2/68 (H3N2) и A/Moscow/226/2009 (H1N1)v, и ДНК-геномные вирусы: ортопоксвирусы (вирус осповакцины, штамм ЛИВП, и вирус оспы мышей - эктромелии, штамм К-1) и вирус простого герпеса 2-го типа (штамм MS), полученные из Государственной коллекции возбудителей вирусных инфекций и риккетсиозов ФБУН ГНЦ ВБ «Вектор» (п. Кольцово, Новосибирская обл.).
Определение противовирусной активности экстрактов в отношении РНК-содержащих вирусов. Наработку вируса гриппа производили на 10-суточных куриных эмбрионах (КЭ), титрование вируса гриппа проводили на культуре клеток MDCK. Концентрация разных субтипов вируса гриппа в вирусаллантоисной жидкости (ВАЖ) составляла от 6,0 до 8,2 lg ТЦД50/мл (десятичных логарифмов 50% тканевых цитопатических доз в мл). В опытах по определению противовирусной активности грибных экстрактов в отношении вируса гриппа готовили разведения ВАЖ каждого вируса от 1 до 8 с десятикратным шагом с использованием среды RPMI-1640 (ООО «Биолот», Россия), содержащей 2 мкг/мл трипсина ТРСК (Sigma, США). Для определения противовирусной активности образцов в монослой культуры клеток MDCK вносили по 50 мкл выбранного разведения экстракта на среде RPMI-1640, содержащей 2 мкг/мл трипсина, и 100 мкл разведенного от 1 до 8 или неразведенного ВАЖ. В случае использования неразведенных грибных экстрактов или ВАЖ трипсин вносили до конечной концентрации 2 мкг/мл поддерживающей среды в лунке 96-луночного планшета. Клетки инкубировали 2 сут при температуре 37°C в атмосфере 5% СО2 в термостате ТС-1/80 СПУ (Россия). Через 2 сут в каждой лунке с помощью инвертированного микроскопа регистрировали цитопатическое действие (ЦПД) в монослое клеток и определяли наличие вируса в среде культивирования по реакции гемагглютинации (РГА) с 1%-й суспензией эритроцитов кур. Определяли титры вируса в lg ТЦД50/мл в контроле (50%-я инфицирующая доза - ИД50 in vitro без препарата) и в опыте (ИД50 in vitro с препаратом), а затем высчитывали индекс нейтрализации (ИН) вирусов под влиянием экстракта: ИН = ИД50контроль - ИД50опыт (lg).
В качестве контроля использовали:
1. Контроль клеток MDCK, культивируемых в питательной среде RPMI-1640 (ООО «Биолот», С-Петербург), содержащей 2 мкг/мл трипсина ТРСК (Sigma, США).
2. Контроль репродукции штаммов вируса гриппа A/Aichi/2/68 (H3N2), A/Moscow/226/2009 (H1N1)v и A/chicken/Kurgan/05/2005 (H5N1) с 1 до 8 разведения с десятикратным шагом без внесения грибных экстрактов.
Определение противовирусной активности экстрактов в отношении ДНК-содержащих вирусов.
Наработку и титрование ортопоксвирусов и вируса простого герпеса 2-го типа проводили на культуре клеток Vero. Концентрация вирусов в вируссодержащей культуральной жидкости (ВКЖ) составляла от 6,0 до 7,2 lg ТЦД50/мл (десятичных логарифмов 50% тканевых цитопатических доз в мл). Для определения противовирусной активности грибных экстрактов in vitro в среде DMEM (ООО «Биолот», Россия) готовили 8 разведений ВКЖ каждого вируса с десятикратным шагом. На монослой клеток Vero вносили разведения экстракта в объеме 100 мкл/лунку и разведения ВКЖ (с 1-го по 8-е) в объеме 100 мкл/лунку. Клетки инкубировали 4 сут при температуре 37°C в атмосфере 5% CO2 в термостате. Затем в каждой лунке с помощью инвертированного микроскопа регистрировали цитопатическое действие в монослое клеток. Определяли титры вируса в lg ТЦД50/мл в контроле (50%-я инфицирующая доза - ИД50 in vitro без препарата) и в опыте (ИД50 in vitro с препаратом), а затем высчитывали индекс нейтрализации (ИН) вирусов под влиянием экстракта: ИН = ИД50контроль - ИД50опыт (lg).
В качестве контроля использовали:
1. Контроль клеток Vero, культивируемых в питательной среде DMEM (ООО «Биолот»).
2. Контроль репродукции ортопоксвирусов (вирус осповакцины, штамм ЛИВП и вирус оспы мышей - эктромелии, штамм К-1) и вируса простого герпеса 2-го типа (штамм MS) с 1 до 8 разведения с десятикратным шагом без внесения грибных экстрактов.
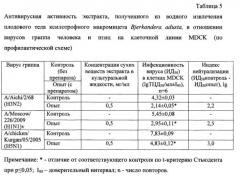
В таблице 5 представлены результаты определения противовирусной активности экстракта, полученного из водного извлечения плодового тела гриба Bjerkandera adusta, в отношении штаммов A/Aichi/2/68 (H3N2) и A/Moscow/226/2009 (H1N1)v вируса гриппа человека и штамма A/chicken/Kurgan/05/2005 (H5N1) вируса гриппа птиц по профилактической схеме в монослое клеток MDCK.
Как видно из таблицы 5, экстракт, полученный из водного извлечения данного гриба, проявил выраженный противовирусный эффект в отношении используемых в эксперименте штаммов вируса гриппа субтипов H3N2, H1N1 и H5N1. Индексы нейтрализации для штаммов вируса гриппа A/Aichi/2/68 (H3N2), A/Moscow/226/2009 (H1N1)v и A/chicken/Kurgan/05/2005 (H5N1) под действием экстракта, полученного из водного извлечения Бьеркандеры опаленной, в концентрации 0,5 мг/мл составили 2,2; 2,5 и 3,0 lg соответственно. Экстракт, полученный из водного извлечения плодового тела гриба Bjerkandera adusta, проявивший противогриппозный эффект, содержал 21% экстрактивных веществ, 37,0 мг/г суммарных белков и 104 мг/г суммарных сахаров (табл. 4). Экстракт, полученный из этанольного извлечения этого же гриба, не проявил противовирусного эффекта в отношении ни одного из используемых штаммов вируса гриппа (данные не приведены). Это связано с меньшим содержанием экстрактивных веществ (на 25%) и суммарных белков (в 7 раз) в экстракте, полученном из этанольного извлечения Бьеркандеры опаленной, по сравнению с экстрактом, полученным из водного извлечения этого гриба.
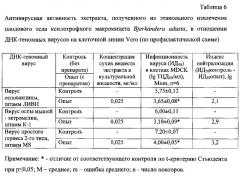
В таблице 6 представлены результаты определения противовирусной активности экстракта, полученного из этанольного извлечения плодового тела гриба Bjerkandera adusta, на культуре клеток Vero в отношении ДНК-содержащих вирусов: ортопоксвирусов (вирусов осповакцины и оспы мышей - эктромелии) и вируса простого герпеса 2-го типа в профилактической схеме.
Как видно из таблицы 6, экстракт, полученный из этанольного извлечения Бьеркандеры опаленной, в концентрации 0,025 мг/мл проявил высокий противовирусный эффект в отношении ДНК-геномных вирусов. Индексы нейтрализации вирусов осповакцины, оспы мышей - эктромелии и простого герпеса 2-го типа составили 2,1; 2,9 и 3,2 lg соответственно. Экстракт, полученный из водного извлечения этого гриба, даже с концентрацией в 20 раз большей (0,5 мг/мл), по сравнению с экстрактом, полученным из этанольного извлечения, не ингибировал репродукцию ни одного из используемых ДНК-содержащих вирусов. Это связано с меньшим содержанием суммарных сахаров, включая полисахариды, (в 1,9 раз) и отсутствием тритерпенов в экстракте, полученном из водного извлечения Бьеркандеры опаленной, по сравнению с экстрактом, полученным из этанольного извлечения этого гриба.
1. Противовирусное средство на основе экстракта ксилотрофного базидиомицета Bjerkandera adusta (Willd.) P. Karst, представляющее собой сухой экстракт гриба, приготовленный методом высушивания водного извлечения биологически активных веществ из измельченного и гомогенизированного сырья, при следующем содержании компонентов в сухом экстракте:
| сухие экстрактивные вещества | не менее 200 мг/г |
| полисахариды | не менее 94 мг/г |
| суммарные белки | не менее 33 мг/г |
| фенольные соединения | не более 5 мг/г |