Способ получения частиц с пониженным электростатическим зарядом
Иллюстрации
Показать всеГруппа изобретений относится к фармацевтике. Первое изобретение относится к способу получения частиц носителя для сухой порошковой композиции для ингаляции. Указанная композиция включает фракцию совместно микронизированных частиц, изготовленную из смеси альфа-лактозы моногидрата и стеарата магния, причем указанная смесь имеет масс-медианный диаметр менее 20 микрон; а также фракцию крупнодисперсных частиц альфа-лактозы моногидрата, имеющую массовый диаметр от 210 до 355 микрон. Указанный способ включает совместную микронизацию частиц альфа-лактозы моногидрата и стеарата магния. Затем смешивание указанных совместно микронизированных частиц с указанными крупнодисперсными частицами альфа-лактозы моногидрата в течение по меньшей мере четырех часов для их сферонизирования. Причем перед указанным смешиванием указанные совместно микронизированные частицы сначала кондиционируют под воздействием относительной влажности 50-70% при температуре 22±2°C в течение промежутка времени, составляющего 48 часов. Также описан еще один вариант способа получения сухой порошковой композиции для ингаляции, дополнительно включающий стадию смешения указанных частиц носителя с одним или более активными ингредиентами. Группа изобретений обеспечивает уменьшение электростатической заряженности частиц. 2 н. и 4 з.п. ф-лы, 2 ил., 6 табл., 6 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способу получения сухих порошковых композиций для ингаляции. В частности, настоящее изобретение относится к способу получения частиц носителя для сухих порошковых композиций, имеющих пониженный электростатический заряд.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Терапия посредством ингаляции лекарственных средств в виде сухих порошков (DPI) уже в течение многих лет применяется для лечения респираторных состояний, таких как астма, хроническое обструктивное заболевание легких (COPD) и аллергический ринит.
Лекарственные средства, предназначенные для ингаляции в виде сухих порошков, следует применять в форме микронизированных частиц, которые обычно получают путем измельчения или другими методами, такими как распылительная сушка.
Сухие порошковые композиции, предназначенные для ингаляции, обычно получают путем смешивания микронизированного лекарственного средства с крупнодисперсными частицами носителя, что приводит к получению упорядоченной смеси, где микронизированные активные частицы сцепляются с поверхностью частиц носителя, когда они находятся в ингаляторе.
Носитель делает микронизированный порошок в меньшей степени способным к когезии и улучшает его текучесть, облегчая манипулирование порошком в ходе производственного процесса (засыпание, заполнение и т.д.).
Однако известно, что сухие порошки имеют тенденцию электризоваться. Трибоэлектризация в фармацевтических порошках является очень сложным и не до конца понятным процессом, хотя известно, что на нее влияют многие факторы.
В ходе выполнения различных производственных операций (измельчение, смешение, транспортировка и заполнение) порошки аккумулируют электростатические заряды в результате столкновений частиц и при контакте с твердыми поверхностями (например, стенками сосуда).
Этот процесс электризации, индуцированной как столкновениями, так и трением, вовлечен в механизмы потерь лекарственных средств из-за сегрегации, адгезии и агломерации. Кроме того, чем больше энергии задействовано в ходе процесса, тем более склонны материалы накапливать значительные уровни электростатических зарядов.
В приведенной ниже таблице представлены некоторые типичные значения заряда сухой порошковой композиции для разных производственных операций.
| Типичное генерирование заряда во время операций по переработке порошков. Ссылка: Code of practice for control of undesirable static electricity, BS 5958 (British Standards Institute, London, 1991) | |
| Операция | Массовая плотность заряда (мкКл/кг) |
| Просеивание | 10-3-10-6 |
| Засыпание | 10-1-10-3 |
| Перенос подаваемого материала | 1-10-2 |
| Микронизация | 102-10-1 |
| Пневматическая транспортировка | 103-10-1 |
Результирующий электростатический заряд порошковой смеси в высокой степени зависит от частоты столкновений частиц с подложкой и частиц друг с другом в ходе производственного процесса, что неизменно приводит к генерированию на образце порошка суммарного заряда, который может быть положительным, отрицательным или и тем, и другим.
В WO 01/78693 и WO 01/78695 раскрыты сухие порошковые композиции, содержащие в качестве носителя фракцию крупнодисперсных частиц и фракцию, изготовленную из мелкодисперсных частиц и добавки, такой как стеарат магния или лейцин, и способы их получения.
Указанные композиции могут быть получены простым путем, являются химически и физически стабильными и обладают хорошими ингаляционными характеристиками.
Однако в указанных документах нет никакой информации, относящейся к электростатическим зарядам.
С другой стороны, снижение электростатической заряженности может обеспечить улучшение текучести в ходе выполнения операций производственного процесса (просеивание, засыпание) и в ходе заполнения ингалятора.
Это, в свою очередь, может привести к повышению гомогенности активного ингредиента в композиции и, следовательно, к повышению воспроизводимости и точности доставляемой дозы и дозы мелкодисперсных частиц.
С учетом приведенных выше соображений было бы весьма полезно создать способ получения порошковых композиций, таких как композиции, описанные в WO 01/78693 и WO 01/78695, обеспечивающий снижение электростатических зарядов и, следовательно, улучшение эксплуатационных характеристик таких композиций.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Изобретение относится к способу получения частиц носителя для сухой порошковой композиции для ингаляции, содержащих: 1) фракцию совместно микронизированных частиц, изготовленную из смеси эксципиента и добавки, причем указанная смесь имеет MMD менее 20 микрон; 2) фракцию крупнодисперсных частиц эксципиента, имеющих MMD, равный или выше 80 микрон, включающему следующие стадии:
а) совместная микронизация частиц эксципиента и частиц добавки;
б) добавление и смешивание полученных совместно микронизированных частиц с крупнодисперсными частицами эксципиента;
отличающийся тем, что совместно микронизированные частицы из стадии (а) сначала кондиционируют под воздействием относительной влажности 50-75% при комнатной температуре в течение промежутка времени, составляющего от 24 до 60 часов.
Во втором аспекте данное изобретение относится к способу получения сухой порошковой композиции для ингаляции, включающему стадию смешивания вышеуказанных частиц носителя с одним или более активными ингредиентами.
В третьем аспекте данное изобретение относится к смеси совместно микронизированных частиц, изготовленной из эксципиента и добавки, для применения в сухой порошковой композиции для ингаляции, причем указанная смесь имеет массовую плотность заряда, составляющую от -9×10-10 и -5×10-8 нКл/г, и может быть получена способом, включающим кондиционирование посредством воздействия относительной влажности 50-75% при комнатной температуре в течение промежутка времени, составляющего от 24 до 60 часов.
В четвертом аспекте данное изобретение относится к сухой порошковой композиции для ингаляции, содержащей вышеупомянутую смесь совместно микронизированных частиц и одного или более активных ингредиентов.
В пятом аспекте данное изобретение относится к сухому порошковому ингалятору, заполненному вышеуказанной сухой порошковой композицией.
В шестом аспекте данное изобретение относится к применению заявленной смеси совместно микронизированных частиц для изготовления лекарственного средства для профилактики и/или лечения легочного заболевания, такого как астма или хроническое обструктивное заболевание легких (COPD).
ОПРЕДЕЛЕНИЯ
Термины “активное лекарственное средство”, “активный ингредиент”, “активный” и “активный агент”, “активное соединение” и “терапевтический агент” использованы как синонимы.
Термин “гигроскопический” относится к активному соединению, которое всегда полностью высыхает при контакте с воздухом, имеющим влагосодержание выше 0% относительной влажности, но всегда содержит некоторое количество адсорбционно связанной воды (Н.Sucker, P.Fuchs and P.Speiser: Pharmaceutical Technology, Georg Thieme Verlag, Stuttgart, New York, 2nd edition 1991, page 85).
Термин “гидрофильный” относится к активному ингредиенту, который легко смачивается водой.
Термин “кондиционирование” означает воздействие на порошок, помещенный в подходящий контейнер, комбинации условий температуры и относительной влажности, которые держат под контролем.
Под “терапевтически эффективной дозой” подразумевается количество активного ингредиента, вводимое за один раз посредством ингаляции при приведении в действие ингалятора.
Под “приведением в действие” подразумевается высвобождение активного ингредиента из устройства посредством однократного приведения в действия (например, механического или посредством вдоха).
Термин “активный ингредиент, применяемый в низких дозах”, означает активный ингредиент, доставляемый с использованием сухого порошкового ингалятора (DPI), чья доза, доставляемая после каждого приведения в действие ингалятора, равна или ниже 12 мкг, предпочтительно равна или ниже 6 мкг, более предпочтительно равна или ниже 4 мкг, еще более предпочтительно ниже 2 мкг.
Обычно размер частиц количественно определяют путем измерения характеристического эквивалентного диаметра сферы, известного как объемный диаметр, методом лазерной дифракции.
Размер частиц может быть также количественно определен путем измерения массового диаметра с помощью подходящего известного прибора, такого как, например, ситовый анализатор.
Объемный диаметр (VD) связан с массовым диаметром (MD) через плотность частиц (с допущением, что плотность частиц не зависит от размера частиц).
В настоящей заявке размер частиц выражен через массовый диаметр, и распределение частиц по размерам выражено через масс-медианный диаметр (MMD), который соответствует диаметру 50 массовых процентов частиц [d(0,5)], и возможно также через массовый диаметр в микронах 10% и 90% частиц соответственно [d(0,1) и d(0,9)].
Термин “твердые гранулы” относится к сферическим или полусферическим объектам, чье ядро состоит из крупнодисперсных частиц эксципиента.
Термин “сферонизация” относится к процессу округления частиц, который осуществляется во время обработки.
Термин “псевдоожижение” относится к способности основанного на носителе препарата для DPI “псевдоожижаться”, т.е. легко транспортироваться в воздушном потоке во время образования аэрозоля. Указанная способность зависит от сопротивляемости (когезивности) смеси.
Термин “хорошая текучесть” относится к композиции, которой легко управлять в ходе производственного процесса и которая способна обеспечивать точную и воспроизводимую доставку терапевтически эффективной дозы.
Реологичесикие характеристики могут быть оценены разными тестами, такими как определение угла естественного откоса, индекса уплотняемости Карра, коэффициента Хауснера или скорости прохождения через отверстие.
В контексте настоящей заявки реологические свойства тестировали путем измерения скорости прохождения через отверстие в соответствии с методом, описанным в Европейской Фармакопее (Eur. Ph.).
Выражение “хорошая гомогенность” относится к композиции, где после смешивания однородность распределения активного ингредиента, выраженная в виде коэффициента вариации (CV), также известного как относительное стандартное отклонение (RSD), составляет менее 2,5%, предпочтительно равна или менее 1,5%.
Выражение “вдыхаемая фракция” относится к показателю процентного содержания активных частиц, которые могут достигать нижних отделов легких у пациента.
Вдыхаемую фракцию, также называемую фракцией мелкодисперсных частиц, оценивают с использованием подходящего аппарата in vitro, такого как многоступенчатый каскадный импактор или многоступенчатый жидкостной импинджер (MLSI), по методикам, приведенным в общеизвестных Фармакопеях.
Ее рассчитывают как соотношение между вдыхаемой дозой и доставляемой дозой.
Доставляемую дозу рассчитывают по кумулятивному осаждению в аппарате, тогда как вдыхаемую дозу (дозу мелкодисперсных частиц) рассчитывают по осаждению на Ступени 3 (S3) для фильтрования (AF), соответствующего частицам размером не более 4,7 микрон.
“Доставляемая доза” означает дозу, выраженную в процентах от отмеренной дозы лекарственного средства, доставляемую в легкие пациента. Для активных ингредиентов, применяемых в низких дозах, таких как формотерол, указанный процент теоретически считается равным 75%.
Выражение “точный” со ссылкой на дозу активного ингредиента относится к разнице между теоретической доставляемой дозой и реальной доставляемой дозой. Чем незначительней разница, тем выше точность. Для активных ингредиентов, применяемых в низких дозах, хорошей точностью считается разница не более ±5%, предпочтительно менее ±2,5%.
Термин “воспроизводимость” относится к степени близости результатов измерений и определяется коэффициентом вариации (CV), также известным как относительное стандартное отклонение (RSD).
Чем меньше CV, тем выше воспроизводимость. Хорошей воспроизводимостью считается CV менее 10%, предпочтительно менее 5%, более предпочтительно менее 2,5%.
Термин “покрытие” относится к нанесению покрытия на поверхность частиц эксципиента путем образования тонкой пленки стеарата магния вокруг указанных частиц.
ГРАФИЧЕСКИЕ МАТЕРИАЛЫ
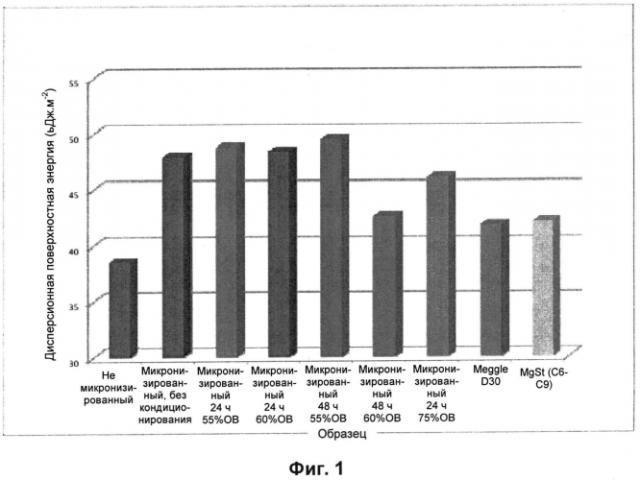
Фиг.1 - Поверхностная энергия микронизированных частиц и контрольных материалов по результатам определения методом IGC (обращенная газовая хроматография).
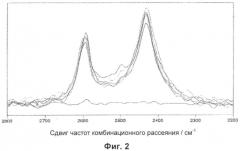
Фиг.2 - Сравнение полосы валентных колебаний OD в Фурье-спектрах комбинационного рассеяния света образцов #1, #2, #3, #4 и #7.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к способу получения частиц носителя для сухой порошковой композиции для ингаляции, содержащих 1) фракцию совместно микронизированных частиц, изготовленных из смеси эксципиента и добавки, 2) фракцию крупнодисперсных частиц эксципиента и один или более активных ингредиентов, включающему следующие стадии:
а) совместная микронизация частиц эксципиента и частиц добавки;
б) добавление и смешивание совместно микронизированных частиц с крупнодисперсными частицами эксципиента; отличающемуся тем, что совместно микронизированные частицы из стадии (а) сначала кондиционируют под воздействием конкретных условий.
В результате осуществления стадии кондиционирования накопление заряда совместно микронизированными частицами и, следовательно, всеми частицами носителя снижается. Соответствующие порошковые композиции, содержащие указанные частицы носителя, демонстрируют лучшие реологические свойства, чем композиции, содержащие носитель, содержащий не кондиционированные совместно микронизированные частицы.
Кроме того, композиции, содержащие частицы носителя, подвергнутые обработке способом по изобретению, демонстрируют повышенную гомогенность активного ингредиента, а также лучшую точность доставляемой дозы и лучшую воспроизводимость дозы мелкодисперсных частиц по сравнению с композицией, не подвергнутой кондиционированию.
Даже если композиция содержит активный ингредиент, применяемый в низких дозах, для композиции, содержащей частицы носителя, подвергнутые обработке способом по изобретению, точность доставляемой дозы обычно лучше, чем ±5%, предпочтительно лучше, чем ±2,5%.
Неожиданно в результате кондиционирования фракция совместно микронизированных частиц также демонстрирует снижение когезионных взаимодействий между частицами, что подтверждается снижением энергии основного потока и энергии, требуемой для преодоления сопротивления материала псевдоожижению, измеряемого энергией псевдоожижения.
Благодаря всем этим преимуществам вдыхаемая фракция релевантной композиции тоже оказалась слегка повышенной.
В результате кондиционирования также существенно снижается количество аморфного вещества, образующегося во время стадии микронизации, что свидетельствует о том, что указанная стадия индуцирует эффективную перекристаллизацию частиц эксципиента.
С другой стороны, идентифицированные условия воздействия не оказывают существенного влияния на размер частиц и влагосодержание совместно микронизированных частиц.
Последний аспект полезен для стабильности активного(ых) ингредиента(ов) в релевантной композиции, так как известно, что увеличение влагопоглощения может влиять на физико-химическую стабильность активных ингредиентов, в частности гигроскопических и/или гидрофильных активных ингредиентов.
Совместно микронизированные частицы должны быть кондиционированы под воздействием при комнатной температуре относительной влажности, составляющей от 50 до 75%, в течение промежутка времени, составляющего от 6 до 60 часов.
Комнатной температуре соответствует температура 22±2°С, предпочтительно ±1°С.
Предпочтительно, воздействие осуществляют при относительной влажности от 55 до 70% в течение промежутка времени, составляющего от 12 до 48 часов, предпочтительно от 24 до 48 часов, более предпочтительно в течение 48 часов. В предпочтительном воплощении указанное воздействие проводят при относительной влажности 55% в течение 24 часов, тогда как в другом предпочтительном воплощении воздействие проводят при относительной влажности 75% в течение 24 часов. В других предпочтительных воплощениях воздействие проводят при относительной влажности по меньшей мере 55% в течение 48 часов, так как было установлено, что снижение поверхностной энергии совместно микронизированных частиц больше, начиная с указанного значения относительной влажности и в течение более длительных промежутков времени.
Значения относительной влажности могут варьировать в диапазоне ±5%.
Без какого-либо ограничения теорией можно предполагать, что чем выше поверхностная энергия, тем выше реакционная способность вещества и, следовательно, выше вероятность образования электростатических зарядов.
Предпочтительно, мелкодисперсные и крупнодисперсные частицы эксципиента могут состоять из любого фармакологически приемлемого инертного вещества или комбинации таких веществ. Предпочтительными эксципиентами являются эксципиенты, изготовленные из кристаллических сахаров, в частности лактозы, и наиболее предпочтительными являются эксципиенты, изготовленные из α-лактозы моногидрата.
Предпочтительно, крупнодисперсные частицы эксципиента и мелкодисперсные частицы эксципиента состоят из одного и того же физиологически приемлемого фармакологически инертного вещества.
Фракция совместно микронизированных частиц, изготовленная из смеси эксципиента и добавки, должна иметь MMD менее 20 микрон, преимущественно равный или менее 15 микрон, предпочтительно равный или менее 10 микрон, еще более предпочтительно равный или менее 6 микрон.
Предпочтительно, массовый диаметр 90% частиц составляет менее 35 микрон, более предпочтительно менее 25 микрон, предпочтительно менее 15 микрон, еще более предпочтительно менее 10 микрон.
Соотношение между эксципиентом и добавкой во фракции микронизированных частиц будет варьировать в зависимости от природы и свойств вещества, являющегося добавкой.
Предпочтительно, указанная фракция совместно микронизированных частиц состоит из от 90 до 99,5 масс. % эксципиента и от 0,5 до 10 масс. % вещества, являющегося добавкой, предпочтительно от 95 до 99% эксципиента и от 1 до 5% добавки. Предпочтительное соотношение составляет 98% эксципиента и 2% добавки.
Предпочтительно, вещество, являющееся добавкой, может содержать или состоять из одного или более смазывающих веществ, выбранных из группы, состоящей из стеариновой кислоты и ее солей, таких как стеарат магния, лаурилсульфат натрия, стеарилфумарат натрия, стеариловый спирт, монопальмитат сахарозы.
Предпочтительно, смазывающее вещество представляет собой стеарат магния.
Альтернативно, вещество, являющееся добавкой, может представлять собой антиадгезивное вещество, такое как аминокислота, предпочтительно выбранная из группы, состоящей из лейцина, изолейцина, лизина, валина, метионина, фенилаланина. Добавка может представлять собой соль производного аминокислоты, например аспартам или ацесульфам К.
Вещество, являющееся добавкой, может также содержать или состоять из одного или более водорастворимых поверхностно-активных веществ, например лецитина, в частности соевого лецитина.
Другие возможные вещества, являющиеся добавками, включают тальк, диоксид титана, диоксид алюминия и диоксид кремния.
Предпочтительно, по меньшей мере 90 масс. % частиц добавки имеет исходный массовый диаметр не более 35 микрон и MMD не более 15 микрон, предпочтительно не более 10 микрон.
Частицы эксципиента и частицы добавки, составляющие фракцию микронизированных частиц, совместно микронизируют путем измельчения, преимущественно в шаровой мельнице. В некоторых случаях совместную микронизацию в течение по меньшей мере двух часов можно считать предпочтительной, хотя понятно, что время обработки обычно будет зависеть от исходного размера частиц эксципиента и желаемого снижения размера получаемых частиц.
В предпочтительном воплощении изобретения частицы совместно микронизируют, начиная с частиц эксципиента, имеющих массовый диаметр менее 250 микрон, и частиц добавки, имеющих массовый диаметр менее 35 микрон, используя струйную мельницу, предпочтительно в инертной атмосфере, например в атмосфере азота.
В качестве примера, в качестве исходного эксципиента можно использовать коммерчески доступный альфа-лактозы моногидрат, такой как Meggle D 30 или Spherolac 100 (Meggle, Wasserburg, Germany).
Крупнодисперсные частицы эксципиента в способе по изобретению должны иметь MMD по меньшей мере 80 микрон, более предпочтительно больше 90 микрон, предпочтительно больше 100 микрон, более предпочтительно больше 175 микрон.
Предпочтительно, все крупнодисперсные частицы имеют массовый диаметр в пределах 50-1000 микрон, предпочтительно от 60 до 500 микрон.
В некоторых воплощениях данного изобретения массовый диаметр указанных крупнодисперсных частиц может составлять от 80 до 200 микрон, предпочтительно от 90 до 150 микрон, а в другом воплощении массовый диаметр может составлять от 200 до 400 микрон, предпочтительно от 210 до 355 микрон.
Обычно специалист в данной области будет отбирать надлежащий размер крупнодисперсных частиц эксципиента путем просеивания, используя надлежащий классификатор.
Когда массовый диаметр крупнодисперсных частиц составляет от 200 и 400 микрон, тогда крупнодисперсные частицы эксципиента предпочтительно имеют поверхность с относительно большим количеством трещин, то есть поверхность, на которой имеются трещины и борозды и другие участки с выемками, в совокупности называемые здесь трещинами. Крупнодисперсные частицы с “относительно большим количеством трещин” могут быть охарактеризованы индексом трещин или коэффициентом шероховатости, как описано в WO 01/78695 и WO 01/78693, включенных в данное описание посредством ссылки, и они могут быть определены в соответствии с приведенным здесь описанием. Указанные крупнодисперсные частицы могут быть также охарактеризованы показателями насыпной плотности или общего объема пор, измеряемыми как указано в WO 01/78695.
Насыпная плотность указанных крупнодисперсных частиц предпочтительно составляет менее 0,8 г/см3, предпочтительно от 0,8 до 0,5 г/см3. Общий объем пор составляет по меньшей мере 0,8 см3, предпочтительно по меньшей мере 0,9 см3.
Соотношение между фракцией микронизированных частиц и фракцией крупнодисперсных частиц составляет от 1:99 до 40:60 масс. %, предпочтительно от 2:98 до 30:70 масс. %, еще более предпочтительно от 5:95 до 20:80 масс. %. В предпочтительном воплощении соотношение составляет от 10:90 до 15:85 масс. %.
Стадию смешивания крупнодисперсных частиц эксципиента и фракции микронизированных частиц обычно проводят в подходящем смесителе, например в барабанном смесителе, таком как Turbula, роторном смесителе или в смесителе мгновенного действия, таком как Diosna, в течение по меньшей мере 5 минут, предпочтительно в течение по меньшей мере 30 минут, более предпочтительно в течение по меньшей мере двух часов. Специалист в данной области обычным путем будет регулировать время смешивания и скорость вращения смесителя для получения гомогенной смеси.
Когда для получения твердых гранул желательными являются сферонизированные крупнодисперсные частицы эксципиента, тогда стадию смешивания обычно следует проводить в течение по меньшей мере четырех часов.
В предпочтительном воплощении изобретение относится к способу получения частиц носителя для сухой порошковой композиции для ингаляции, содержащих: 1) фракцию совместно микронизированных частиц, имеющую MMD, равный или менее 10 микрон, изготовленную из смеси от 98 до 99 масс. % α-лактозы моногидрата и от 1 до 2 масс. % стеарата магния; 2) фракцию крупнодисперсных частиц, изготовленную из α-лактозы моногидрата, имеющую массовый диаметр, составляющий от 212 до 355 микрон, причем соотношение между совместно микронизированными частицами и крупнодисперсными частицами составляет от 10:90 до 15:85 масс. %, включающему следующие стадии:
а) совместная микронизация частиц α-лактозы моногидрата и частиц стеарата магния;
б) добавление и смешивание совместно микронизированных частиц с крупнодисперсными частицами; отличающийся тем, что совместно микронизированные частицы стадии (а) кондиционируют под воздействием при комнатной температуре относительной влажности от 55 до 75% в течение промежутка времени, составляющего от 24 до 48 часов.
Настоящее изобретение также относится к способу изготовления сухой порошковой композиции для ингаляции, включающему стадию смешивания частиц носителя, полученных заявленным способом, с одним или более активными ингредиентами.
Предпочтительно, по меньшей мере 90% частиц лекарственного средства (активного ингредиента) имеют размер частиц менее 10 микрон, предпочтительно менее 8 микрон, более предпочтительно менее 6 микрон.
В некоторых воплощениях данного изобретения, в частности когда используют активные ингредиенты, применяемые в низких дозах, не более чем 50% частиц имеют объемный диаметр менее 1,7 микрон, и по меньшей мере 90% частиц имеют объемный диаметр менее 8 микрон.
Смесь частиц носителя с частицами активного ингредиента будут получать путем смешивания компонентов в подходящих смесителях, подобных тем, которые упомянуты выше.
Возможно при использовании по меньшей мере двух активных ингредиентов один активный ингредиент сначала смешивают с порцией частиц носителя, и полученную смесь просеивают через сито, затем активные ингредиенты и оставшуюся часть частиц носителя смешивают с просеянной смесью, и, наконец, полученную смесь просеивают через сито и снова смешивают.
Специалист в данной области будет выбирать размер ячейки сита в зависимости от размера частиц крупнодисперсных частиц эксципиента.
Соотношение между частицами носителя и активного ингредиента будет зависеть от типа используемого ингалятора и требуемой дозы.
Количество активного ингредиента будет способно обеспечивать доставку терапевтически эффективной дозы в легкое.
Подходящими активными агентами могут быть лекарственные средства для терапевтического и/или профилактического применения. Активные агенты, которые могут входить в состав композиции, включают те продукты, которые обычно вводят перорально посредством ингаляции для лечения заболевания, такого как респираторное заболевание.
Таким образом, подходящие активные агенты включают, например, агонисты β2-адренорецептора, такие как сальбутамол, тербуталин, римитерол, фенотерол, репротерол, битолтерол, сальметерол, формотерол, кленбутерол, прокатерол, броксатерол, пикуметерол, кармотерол, индакатерол, милветерол, мабутерол, олодатерол, вилантерол и т.п.; кортикостероиды, такие как будесонид, флутиказон, в частности в виде пропионата или фуроата, мометазон, в частности в виде фуроата, беклометазон, в частности в виде 17-пропионата или 17,21-дипропионата, циклесонид, триамцинолона ацетонид, флунизолид, зотиказон, флумоксонид, рофлепонид, бутиксокорт в виде пропионата, преднизолон, преднизон, типредан; антихолинергические бронходилататоры, такие как ипратропия бромид, тиотропия бромид, окситропия бромид, гликопиррония бромид в форме (3R,2R') энантиомера или рацемической смеси (3S,2R') и (3R,2S'), оксибутинина хлорид, аклидиния бромид, троспия хлорид, соединения, известные под кодами GSK 573719 и GSK 1160274, или соединения, описанные в WO 2010/015324; ингибиторы фосфодиэстеразы IV (PDE-IV), такие как филаминаст, пикламиласт, рофлумиласт, или соединения, раскрытые в WO 2008/006509 и в WO 2009/018909; антигистаминные средства; отхаркивающие средства; муколитические средства; ингибиторы циклооксигеназы; ингибиторы синтеза лейкотриенов; антагонисты лейкотриенов; ингибиторы фосфолипазы-А2; антагонисты фактора агрегации тромбоцитов (PAF).
Другие активные агенты, которые могут быть использованы для доставки посредством ингаляции, включают антиаритмические лекарственные средства, транквилизаторы, статины, сердечные гликозиды, гормоны, антигипертензивные лекарственные средства, противодиабетические средства, противопаразитические средства и противораковые лекарственные средства, седативные и аналгезические лекарственные средства, антибиотики, противоревматические лекарственные средства, иммунотерапевтические средства, противогрибковые средства и антигипотензивные лекарственные средства, вакцины, противовирусные лекарственные средства, белки, полипептиды и пептиды, например пептидные гормоны и факторы роста, полипептидные вакцины, ферменты, эндорфины, липопротеины и полипептиды, вовлеченные в каскад коагуляции крови, витамины и другие, например блокаторы рецепторов клеточной поверхности, антиоксиданты и акцепторы свободных радикалов. Некоторые из этих соединений можно вводить в форме фармакологически приемлемых эфиров, ацеталей, солей, сольватов, таких как гидраты, или сольватов таких эфиров или солей, если они есть. Рацемические смеси, так же как и один или более оптических изомеров вышеуказанных соединений входят в объем изобретения.
Подходящие физиологически приемлемые соли включают соли присоединения кислоты, образованные с неорганическими и органическими кислотами, например соли хлорид, бромид, сульфат, фосфат, малеат, фумарат, цитрат, тартрат, бензоат, 4-метоксибензоат, 2- или 4-гидроксибензоат, 4-хлорбензоат, лара-толуолсульфонат, метансульфонат, аскорбат, ацетат, сукцинат, лактат, глутарат, трикарбаллилат, гидроксинафталин-карбоксилат (ксинафоат) или олеат или их сольваты.
Многие фармакологически активные соединения из вышеупомянутых классов можно вводить в комбинации.
Композиции, содержащие активные ингредиенты, применяемые в низких дозах, и их комбинации являются предпочтительными.
Композиции, содержащие бетаг-агонист, антихолинергическое средство или кортикостероид для ингаляции, одни или в любой их комбинации, составляют конкретное воплощение данного изобретения.
Предпочтительные комбинации включают формотерола фумарат дигидрат/беклометазона дипропионат, вилантерол/флутиказона фуроат, сальметерола ксинафоат/флутиказона пропионат, формотерола фумарат дегидрат/циклесонид, формотерола фумарат дегидрат/мометазона фуроат, формотерола фумарат дегидрат/будесонид, формотерола фумарат дегидрат/флутиказона пропионат, формотерола фумарат дегидрат/тиотропия бромид, формотерола фумарат дигидрат/гликопиррония бромид и формотерола фумарат дигидрат/гликопиррония бромид/беклометазона дипропионат, формотерола фумарат дигидрат/тиотропия бромид/беклометазона дипропионат.
Комбинации, содержащие формотерола фумарат дигидрат, беклометазона дипропионат и возможно антихолинергический бронходилататор, такой как тиотропия бромид или гликопиррония бромид, являются особенно предпочтительными.
Изобретение также относится к смеси совместно микронизированных частиц, изготовленных из эксципиента и добавки, с очень низкими остаточными отрицательными электростатическими зарядами, причем указанная смесь получена способом, включающим кондиционирование под воздействием относительной влажности 50-75% при комнатной температуре в течение промежутка времени, составляющего от 24 до 60 часов. Массовая плотность заряда должна составлять от -9×10-10 до -5×10-8 нКл/г, предпочтительно от -9×10-9 до -1×10-9.
Массовую плотность заряда будут определять с использованием клетки Фарадея, как описано в Примере 2.
Заявленные смеси также характеризуются улучшенными свойствами псевдоожижения, о чем свидетельствуют их энергия основного потока (BFE) и их энергия псевдоожижения, которые значительно ниже, чем у не кондиционированной смеси.
BFE преимущественно составляет от 15 до 30 мДж, предпочтительно от 18 до 26 мДж, тогда как энергия псевдоожижения преимущественно составляет от 5 до 15 мДж, предпочтительно от 8 до 12 мДж.
В результате кондиционирования количество аморфного вещества составляет преимущественно менее 5% масс./масс., предпочтительно менее 3% масс./масс., более предпочтительно менее 2% масс./масс., еще более предпочтительно равно или менее 1% масс./масс. Количество аморфного вещества может быть определено известными методами.
Например, оно может быть определено, как описано в Примере 4, с использованием спектроскопического подхода, включающего обмен H/D (водород/дейтерий) и Фурье-спектроскопию комбинационного рассеяния. Иначе его можно определить путем проведения экспериментов по динамической сорбции пара (DVS) с использованием, например, анализатора влагосодержания Hiden Igasorb или посредством изотермической газовой проточной калориметрии (IGPC) с использованием, например, калориметра 2277 Thermal Activity Monitor (ТА Instrument Ltd).
В общем, количество добавки будет составлять не более 10 масс.% в расчете на общую массу смеси совместно микронизированных частиц.
Однако представляется, что для большинства добавок количество вещества, являющегося добавкой, должно составлять не более 5%, предпочтительно не более 2% или даже не более 1 масс. % или не более 0,5% в расчете на общую массу смеси. Как правило, количество вещества, являющегося добавкой, составляет по меньшей мере 0,01 масс.% в расчете на общую массу смеси.
В одном из предпочтительных воплощений данного изобретения эксципиентом является α-лактозы моногидрат, и веществом, являющимся добавкой, является стеарат магния, присутствующий в количестве, составляющем от 0,5 до 2%, предпочтительно 2 масс. % в расчете на общую массу смеси.
Добавка может образовывать покрытие поверхности частиц эксципиента или может образовывать сплошное покрытие, как описано в WO 96/23485.
Если используют стеарат магния, то добавка покрывает поверхность частиц эксципиента таким образом, что степень покрытия поверхности составляет по меньшей мере 5%, предпочтительно более 10%, более предпочтительно более 15%, еще более предпочтительно равно или более 35%.
Степень покрытия поверхности, выраженная в процентах от общей поверхности частиц эксципиента, покрытой стеаратом магния, может быть определена путем измерения краевого угла смачивания водой и затем применения уравнения, известного в литературе как уравнение Касси и Бакстера (Colombo I et al II Farmaco 1984, 39(10), 328-341) и приведенного ниже.
cosϑSсмесь=fMgStCOSϑMgSt+fЛактозаCOSϑлактоза
где fMgSt и fлактоза означают отражения от поверхности стеарата магния и лактозы;
ϑMgSt означает краевой угол смачивания водой стеарата магния;
ϑлактоза означает краевой угол смачивания водой лактозы;
ϑсмесь означает значение краевого угла в эксперименте.
Для целей данного изобретения краевой угол может быть определен методами, которые по существу основаны на тригонометрическом измерении. Эти измерения предусматривают прямое определение угла, образованного между твердой поверхностью и жидкостью в условиях тестирования. Поэтому этот метод является простым с точки зрения его проведения и ограничен только возможным смещением, проистекающим из-за вариабельности от измерения к измерению. Однако следует подчеркнуть, что этот недостаток можно преодолеть за счет применения полностью автоматизированной методики, такой как анализ полученных с помощью компьютера изображений. Особенно полезным подходом является метод лежачей или неподвижной капли, который обычно проводят путем нанесения капли жидкости на поверхность порошка в форме диска, полученного прессование (метод с использованием диска из спрессованного порошка).
Степень, в которой стеарат магния покрывает поверхность частиц лактозы, может быть также определена методом сканирующей электронной микроскопии (SEM), общеизвестным универсальным аналитическим методом.
Такая микроскопия может быть обеспечена анализатором EDX (электронный дисперсионный рентгеновский анализатор), который может создавать изображение, избирательное по отношению к некоторым типам атомов, например атомов магния. Этим методом можно получить совокупность незашифрованных дан