Композиции для респираторной доставки активных веществ и связанные с ними способы и системы
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и представляет собой косуспензию для респираторной доставки активного вещества с помощью ингалятора с отмеряемой дозой, причем косуспензия содержит: суспензионную среду, содержащую фармацевтически приемлемый пропеллент; множество твердых микронизированных частиц активного вещества; и множество пригодных для вдыхания суспендирующих частиц, иных, чем частицы активного вещества, и включающих сухие перфорированные микроструктуры частиц фосфолипида, которые по существу нерастворимы в пропелленте, и где частицы активного вещества присоединены к суспендирующим частицам с образованием косуспензии путем диспергирования с суспендирующими частицами в суспензионной среде. Изобретение обеспечивает расширение ассортимента стабильных при хранении лекарственных препаратов, представляющих собой суспензию для ингаляции. 9 н. и 60 з.п. ф-лы, 39 ил., 27 табл., 26 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится, главным образом, к фармацевтическим составам и способам доставки одного или нескольких активных веществ через дыхательные пути. В определенных аспектах настоящее изобретение относится к композициям, способам и системам для легочной доставки активных веществ через ингалятор с отмеряемой дозой.
Уровень техники
Часто являются желательными способы направленной доставки лекарственных средств, которые доставляют активное вещество в область действия. Например, направленная доставка активных веществ может снизить нежелательные побочные эффекты, уменьшить требуемые дозировки и снизить стоимость лечения. В контексте респираторной доставки ингаляторы представляют собой хорошо известные устройства для введения активного вещества в дыхательные пути индивидуума, и в настоящее время доступно несколько различных ингаляторных систем. Три общеизвестных ингаляторных системы включают ингаляторы сухого порошка, небулайзеры и ингаляторы с отмеряемой дозой (MDI).
MDI можно использовать для доставки лекарственных средств в солюбилизированной форме или в виде суспензии. Как правило, в MDI используется пропеллент с относительно высоким давлением пара для выталкивания аэрозолированных капель, содержащих активное вещество, в дыхательные пути, когда MDI активируют. Ингаляторы сухих порошков, как правило, основаны на дыхательных усилиях пациента для введения лекарственного порошка в дыхательные пути в форме сухого порошка. С другой стороны, небулайзеры образуют аэрозоль лекарственного средства, подлежащего ингаляции, путем сообщения энергии жидкому раствору или суспензии.
MDI представляют собой устройства для доставки активного вещества, в которых используется давление, создаваемое пропеллентом. Обычно в качестве пропеллентов в системах MDI используют хлорфторуглероды (CFC) вследствие их низкой токсичности, желаемого давления пара и пригодности для образования стабильных суспензий. Однако понятно, что традиционные CFC-пропелленты имеют отрицательное влияние на окружающую среду, которое привело к разработке альтернативных пропеллентов, которые, как полагают, являются более экологически благоприятными, таких как перфторированные соединения (PFC) и гидрофторалканы (HFA).
Активное вещество, подлежащее доставке с помощью MDI, как правило, предоставляют в виде тонких частиц, диспергированных в пропелленте или комбинации двух или более пропеллентов (т.е. в пропеллентной "системе"). Для образования тонких частиц активное вещество, как правило, микронизируют. Тонкие частицы активного вещества, суспендированные в пропелленте или пропеллентной системе, имеют тенденцию к быстрой агрегации или оседанию в виде хлопьев. Это особенно справедливо для активных веществ, присутствующих в микронизированной форме. В свою очередь, агрегация или оседание в виде хлопьев этих тонких частиц может осложнять доставку активного вещества. Например, агрегация или оседание в виде хлопьев может приводить к механическим повреждениям, таким как повреждения, которые могут быть вызваны закупоркой отверстия клапана контейнера с аэрозолем. Нежелательная агрегация или оседание в виде хлопьев частиц лекарственного средства также может привести к быстрому оседанию или отслаиванию частиц лекарственного средства, и такое поведение может привести к нестабильной доставке дозы, что, в свою очередь, может вызвать особые трудности в случае высоко сильнодействующих лекарственных средств малой дозы. Другая проблема, связанная с такими суспензионными составами для MDI относится к росту кристаллов лекарственного средства в процессе хранения, что приводит к снижению с течением времени аэрозольных свойств и единообразия доставляемой дозы из таких MDI. Позднее были предложены подходы для решения этих проблем, такие как подходы, описанные в патенте США 6964759 для составов MDI, содержащих антихолинэргетики.
Одним из подходов для улучшения характеристик аэрозоля в ингаляторах сухого порошка являлось включение частиц-носителей тонких частиц, таких как лактоза. Использование таких высокодисперсных эксципиентов не было исследовано в большой степени для MDI. В недавнем сообщении Young et al., "The influence of micronized particulates on the aerosolization properties of pressurized metered dose inhalers"; Aerosol Science 40, pgs. 324-337 (2009), указано, что применение таких носителей тонких частиц в MDI в действительности приводит к ухудшению характеристик аэрозоля.
В традиционных системах CFC, когда активное средство, присутствующее в составе MDI, суспендируют в пропелленте или пропеллентной системе, часто используют поверхностно-активные вещества для покрытия поверхностей активного средства, чтобы минимизировать или предупредить проблемы агрегации и сохранения по существу единообразной дисперсии. Применение поверхностно-активных веществ, таким образом, иногда называют "стабилизацией" суспензии. Однако многие поверхностно-активные вещества, которые являются растворимыми и, таким образом, эффективными в системах CFC, не являются эффективными в пропеллентных системах HFA и PFC, поскольку такие поверхностно-активные вещества показывают отличающиеся характеристики растворимости в не-CFC пропеллентах.
Краткое описание чертежей
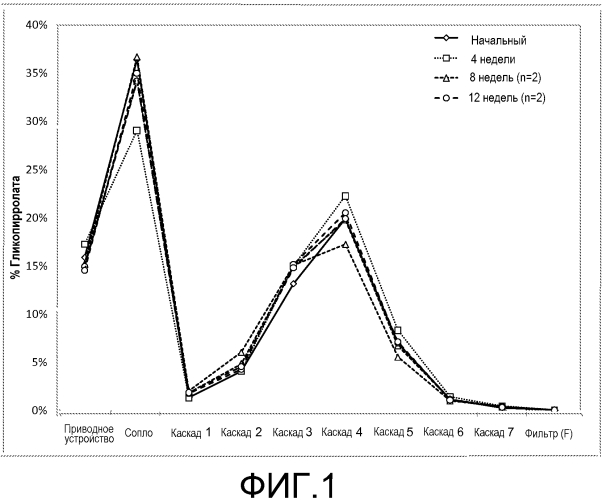
На фиг.1 представлен график, изображающий распределение размера частиц, которое проявляла иллюстративная косуспензионная композиция согласно настоящему изобретению, которая включала гликопирролат, антагонист мускариновых рецепторов длительного действия, в качестве активного вещества. MDI с косуспензией подвергали циклическому изменению температурных условий (чередование выдерживания в течение 6 ч при -5 или 40°С) в течение 12 недель.
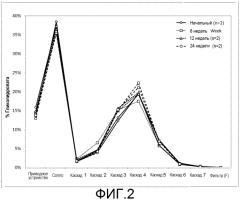
На фиг.2 представлен график, изображающий распределение размера частиц, которое проявляла иллюстративная косуспензионная композиция согласно настоящему изобретению, которая включала гликопирролат, антагонист мускариновых рецепторов длительного действия, в качестве активного вещества. MDI с косуспензией подвергали циклическому изменению температурных условий (чередование выдерживания в течение 6 ч при -5 или 40°С) в течение 24 недель.
На фиг.3 представлена микрофотография, иллюстрирующая морфологию различных суспендирующих частиц, полученных согласно примеру 5.
На фиг.4 представлена фотография двух флаконов, которая позволяет визуализацию косуспензии, образовавшейся при использовании частиц активного вещества, сформированных с использованием гликопирролата, и суспендирующих частиц, сформированных с использованием сахарида.
На фиг.5 представлен график, изображающий распределение размера частиц иллюстративной косуспензии гликопирролата, полученной согласно настоящему изобретению, содержащей 4,5 мкг гликопирролата на доставляемую при приведении в действие дозу и 6 мг/мл суспендирующих частиц и подвергнутой циклическому изменению температурных условий (чередование выдерживания в течение 6 ч при -5 или 40°С).
На фиг.6 представлен график, изображающий распределение размера частиц иллюстративной косуспензии гликопирролата, полученной согласно настоящему изобретению, содержащей 36 мкг гликопирролата на доставляемую при приведении в действие дозу и 6 мг/мл суспендирующих частиц и подвергнутой циклическому изменению температурных условий (чередование выдерживания в течение 6 ч при -5 или 40°С).
На фиг.7 представлен график, на котором изображена доставляемая доза на протяжении нахождения в емкости иллюстративной косуспензии гликопирролата, полученной согласно настоящему изобретению, содержащей 4,5 мкг гликопирролата на доставляемую при приведении в действие дозу и 6 мг/мл суспендирующих частиц.
На фиг.8 представлен график, на котором изображена доставляемая доза на протяжении нахождения в емкости иллюстративной косуспензии гликопирролата, полученной согласно настоящему изобретению, содержащей 36 мкг гликопирролата на доставляемую при приведении в действие дозу и 6 мг/мл суспендирующих частиц.
На фиг.9 представлен график, на котором изображено распределение размера частиц иллюстративной косуспензии гликопирролата, полученной согласно настоящему изобретению, содержащей 36 мкг гликопирролата на доставляемую при приведении в действие дозу и 6 мг/мл суспендирующих частиц и подвергнутой хранению в течение 12 месяцев при 25°C/60% RH в отсутствие защиты.
На фиг.10 представлен график, на котором изображена доставляемая доза на протяжении нахождения в емкости иллюстративной косуспензии гликопирролата, полученной согласно настоящему изобретению, содержащей 32 мкг гликопирролата на доставляемую при приведении в действие дозу и 6 мг/мл суспендирующих частиц и подвергнутой циклическому изменению температурных условий (чередование выдерживания в течение 6 ч при -5 или 40°С).
На фиг.11 представлен график, на котором изображено распределение размера частиц иллюстративной косуспензии гликопирролата, полученной согласно настоящему изобретению, содержащей 32 мкг гликопирролата на доставляемую при приведении в действие дозу и 6 мг/мл суспендирующих частиц и подвергнутой циклическому изменению температурных условий (чередование выдерживания в течение 6 ч при -5 или 40°С).
На фиг.12 представлен график, изображающий распределение размера частиц иллюстративной косуспензии гликопирролата, полученной согласно настоящему изобретению, содержащей 24 мкг гликопирролата на доставляемую при приведении в действие дозу и 6 мг/мл суспендирующих частиц и подвергнутой хранению в течение 6 недель при 50°C/относительной влажности окружающей среды и в течение 12 недель при 40°С.
На фиг.13 представлена фотография, которая дает возможность визуализации косуспензионных композиций, полученных согласно настоящему изобретению, которые включают частицы активного вещества формотеролфумарата.
На фиг.14 представлен график, на котором представлено единообразие доставляемой дозы, достигаемое с помощью косуспензионных композиций формотерола, полученных согласно настоящему изобретению.
На фиг.15 представлен график, на котором показано распределение аэродинамического размера частиц, определенное с помощью каскадного импактора иллюстративных косуспензионных композиций формотерола, полученных согласно настоящему изобретению и хранившихся в течение трех месяцев при 25°С/75% RH с защитной оберткой или при 40°С/75% RH с защитной оберткой.
На фиг.16 представлен график, на котором изображена химическая стабильность иллюстративных косуспензионных композиций, включающих кристаллический формотерол в качестве активного вещества. Результаты, представленные на этой фигуре, дают возможность сравнить химическую стабильность формотерола, достигаемую в косуспензионной композиции, изготовленной с использованием материала в виде кристаллического формотерола, с химической стабильностью суспензионных составов, полученных с использованием высушенного распылительной сушкой формотеролфумарата.
На фиг.17-20 представлены электронные микрофотографии суспендирующих частиц, полученных из различных материалов, причем на фиг.17 представлена микрофотография суспендирующих частиц трегалозы, на фиг.18 представлена микрофотография суспендирующих частиц HP-β-циклодекстрина, на фиг.19 представлена микрофотография суспендирующих частиц Ficoll MP70, и на фиг.20 представлена микрофотография суспендирующих частиц инулина.
На фиг.21 представлен график, на котором показано распределение аэродинамического размера частиц, определенное путем последовательного сжатия иллюстративных косуспензионных композиций, полученных согласно настоящему изобретению и включающих частицы активного вещества гликопирролата.
На фиг.22 представлен график, на котором показано распределение аэродинамического размера частиц, определенное путем последовательного сжатия иллюстративных косуспензионных композиций, полученных согласно настоящему изобретению и включающих частицы активного вещества формотерола.
На фиг.23 представлен график, на котором изображено единообразие доставляемой дозы, достигаемое с помощью косуспензионных композиций формотерола сверхнизкой дозы, полученных согласно настоящему изобретению.
На фиг.24 представлен график, на котором изображено единообразие доставляемой дозы, достигаемое с помощью косуспензионного состава, содержащего гликопирролат и формотеролфумарат, полученного согласно настоящему изобретению.
На фиг.25 представлен график, на котором изображено соотношение доставляемой дозы для косуспензионного состава, описанного для фиг.24.
На фиг.26 представлен график, на котором изображено единообразие доставляемой дозы второго косуспензионного состава, содержащего формотеролфумарат и гликопирролат, полученного согласно настоящему изобретению.
На фиг.27 представлен график, на котором изображено соотношение доставляемой дозы для второго косуспензионного состава, описанного для фиг.26.
На фиг.28 представлен график, на котором изображено единообразие доставляемой дозы гликопирролата и формотеролфумарата в косуспензионном составе, полученном согласно настоящему изобретению, при хранении в различных условиях, как указано.
На фиг.29 представлен график, изображающий распределение размера частиц гликопирролата (сверху) и формотерола (снизу) в иллюстративных косуспензионных составах, полученных согласно настоящему изобретению, при хранении в различных условиях, как указано.
На фиг.30 представлены графики, иллюстрирующие распределение размера частиц гликопирролата (сверху) и формотерола (снизу), достигаемое с помощью иллюстративной косуспензии при хранении в указанных условиях.
На фиг.31 представлены графики, иллюстрирующие распределение размера частиц гликопирролата (сверху) и формотерола (снизу), достигаемое с помощью иллюстративной двойной косуспензии, по сравнению с распределением размера частиц, достигаемым с помощью составов, включающих либо только гликопирролат, либо только формотеролфумарат.
На фиг.32 представлен график, на котором изображено распределение размера частиц формотеролфумарата, достигаемое с помощью косуспензии, полученной согласно настоящему изобретению, которая включала частицы активного вещества, представляющего собой микрокристаллический формотеролфумарат и гликопирролат, по сравнению с косуспензией, содержащей только кристаллический формотеролфумарат.
На фиг.33 представлен график, на котором показано распределение размера частиц гликопирролата, достигаемое с помощью двойной косуспензии, полученной согласно настоящему изобретению, которая включала частицы активного вещества, представляющего собой микрокристаллический гликопирролат, и частицы активного вещества, представляющего собой микрокристаллический формотеролфумарат, с двумя различными распределениями размера частиц (обозначенных как "тонкие" и "грубые") или высушенный распылительной сушкой формотеролфумарат.
На фиг.34 представлен график, на котором изображено распределение размера частиц формотеролфумарата, достигаемое с помощью второй двойной косуспензии, полученной согласно настоящему изобретению, которая включала микрокристаллические частицы активного вещества формотеролфумарата и микрокристаллические частицы активного вещества гликопирролата, по сравнению с косуспензией, которая содержала микрокристаллические частицы активного вещества гликопирролата и высушенные распылительной сушкой частицы формотеролфумарата.
На фиг.35 представлен график, на котором изображено единообразие доставляемой дозы гликопирролата и формотеролфумарата в иллюстративном двойном косуспензионном составе, полученном согласно настоящему изобретению.
На фиг.36 представлено единообразие доставляемой дозы для каждого активного вещества, включенного в иллюстративную тройную косуспензионную композицию, которая включала частицы активного вещества, представляющего собой микрокристаллический гликопирролат, формотеролфумарат и мометазонфуроат.
На фиг.37 представлен график, на котором изображено распределение аэродинамических размеров частиц формотеролфумарата, достигаемое в тройной косуспензии, полученной согласно настоящему изобретению, которая включала частицы активного вещества, представляющего собой микрокристаллический гликопирролат, формотеролфумарат и мометазонфуроат, по сравнению с распределением аэродинамических размеров частиц, достигаемым в двойной косуспензии, которая включала гликопирролат и формотеролфумарат.
На фиг.38 представлен график, на котором изображено распределение аэродинамических размеров частиц гликопирролата, достигаемое в тройной косуспензии, полученной согласно настоящему изобретению, которая включала частицы активного вещества, представляющего собой микрокристаллический гликопирролат, формотеролфумарат и мометазонфуроат, по сравнению с распределением аэродинамических размеров частиц, которые включали гликопирролат и формотеролфумарат.
На фиг.39 представлен график, на котором изображено распределение аэродинамических размеров частиц гликопирролата и тиотропийбромида, достигаемое с помощью тройной косуспензии, полученной согласно настоящему изобретению, которая, в дополнение к гликопирролату или тиотропийбромиду, включала частицы активного вещества, представляющего собой микрокристаллический формотеролфумарат и мометазонфуроат.
Подробное описание
Настоящее изобретение относится к композициям, способам и системам для респираторной доставки одного или нескольких активных веществ. В конкретных вариантах осуществления композиции, описанные в данном описании, изготавливают для легочной доставки одного или нескольких активных веществ с помощью MDI. В других вариантах осуществления композиции, описанные в данном описании, могут быть изготовлены для назальной доставки с помощью MDI. Способы, описанные в данном описании, включают способы стабилизации составов, включающих одно или несколько активных веществ для респираторной доставки, а также способы легочной доставки активных веществ. В конкретных вариантах осуществления способы, описанные в данном описании, включают способы стабилизации составов, включающих одно или несколько активных веществ, имеющих конкретные характеристики, таких как сильнодействующие и высоко сильнодействующие активные вещества и активные вещества с конкретными характеристиками в отношении растворимости. В других вариантах осуществления способы, описанные в данном описании, включают способы обеспечения доставки таких активных веществ пациенту. Также в данном описании описаны системы легочной доставки одного или нескольких активных веществ, причем конкретные варианты осуществления таких систем включают систему MDI, в которой используют композиция, как описано в данном описании.
В конкретных вариантах осуществления способы, описанные в данном описании, включают способы лечения легочного заболевания или нарушения, поддающихся лечению путем респираторной доставки косуспензионной композиции, как описано в данном описании. Например, композиции, способы и системы, описанные в данном описании, можно использовать для лечения воспалительных или обструктивных легочных заболеваний или состояний. В определенных вариантах осуществления композиции, способы и системы, описанные в данном описании, можно использовать для лечения пациентов, страдающих заболеванием или нарушением, выбранным из астмы, хронического обструктивного заболевания легких (COPD), обострения гиперреактивности дыхательных путей вследствие терапии другим лекарственным средством, аллергического ринита, синусита, сужения сосудов легких, воспаления, аллергии, затрудненного дыхания, респираторного дистресс-синдрома, легочной гипертензии, сужения сосудов легких и любого другого респираторного заболевания, состояния, признака, генотипа или фенотипа, которые могут отвечать на введение, например, LAMA, LABA, кортикостероида или другого активного вещества, как описано в данном описании, либо отдельно, либо в комбинации с другими способами терапии. В определенных вариантах осуществления композиции, системы и способы, описанные в данном описании, можно применять при лечении воспаления и обструкции легких, ассоциированных с кистозным фиброзом. Как используют в данном описании, термины "COPD" и "хроническое обструктивное заболевание легких" охватывают хроническое обструктивное заболевание легких (COLD), хроническое обструктивное заболевание дыхательных путей (COAD), хроническое ограничение воздушного потока (CAL) и хроническое обструктивное респираторное заболевание (CORD), и включают хронический бронхит, бронхоэктаз и эмфизему. Как используют в данном описании, термин "астма" относится к астме любого типа или генеза, включая эндогенную (неаллергическую) астму и экзогенную (аллергическую) астму, мягкую астму, умеренную астму, тяжелую астму, астму вследствие бронхита, индуцируемую физической нагрузкой астму, профессиональную астму и астму, индуцируемую бактериальной инфекцией. Также подразумевают, что астма охватывает детский астматический синдром.
Хорошо понятно, что варианты осуществления, как, главным образом, описано в данном описании, являются иллюстративными. Представленное ниже более подробное описание различных вариантов осуществления не предназначено для ограничения объема настоящего изобретения, и является только конкретным примером различных вариантов осуществления. По существу, подробности, приведенные в данном описании, могут включать независимо патентоспособный объект. Более того, порядок стадий или действий в способах, описанных применительно к вариантам осуществления, описанным в данном описании, может быть изменен специалистами в данной области без отклонения от объема настоящего изобретения. Иными словами, если для надлежащего эффекта вариантов осуществления требуется конкретные стадии или действия, порядок или применение конкретных стадий или действий может быть модифицирован.
Определения
Если конкретно не определено иное, технические термины, как используют в данном описании, имеют их обычное подразумеваемое в данной области значение. Представленные ниже термины определены конкретно для ясности.
Термин "активное вещество" используют в данном описании, как включающий любое вещество, лекарственное средство, соединение, композицию или другое вещество, которое может быть использовано на человеке или животном или введено человеку или животному для любой цели, включая терапевтические, фармацевтические, фармакологические, диагностические, косметические и профилактические средства и иммуномодуляторы. Термин "активное вещество" может быть использован взаимозаменяемо с терминами "лекарственное средство", "фармацевтическое средство", "медикамент", "лекарственное вещество" или "терапевтическое средство". Как используют в данном описании, "активное вещество" также может охватывать природные или гомеопатические продукты, которые обычно не рассматриваются как терапевтические.
Термины "ассоциировать", "ассоциировать с" или "ассоциация" относится к взаимодействию или взаимосвязи между химической структурной единицей, композицией или структурой в условиях близости к поверхности, такой как поверхность другой химической структурной единицы, композиции или структуры. Ассоциация включает, например, адсорбцию, адгезию, связывание ковалентной связью, связывание водородной связью, связывание ионной связью и электростатическое притяжение, взаимодействия Лифшица-Ван-дер-Ваальса и полярные взаимодействия. Термин "прикрепляться" или "адгезия" представляет собой форму ассоциации и их используют в качестве общего термина для всех сил, имеющих тенденцию к тому, чтобы вызывать привлечение частицы или массы к поверхности. "Прикрепляться" также относится к осуществлению контакта и поддержанию контакта частиц друг с другом, так чтобы по существу не было видимого разделения между частицами вследствие их различных выталкивающих сил в пропелленте в нормальных условиях. В одном варианте осуществления термином "прикрепляться" охватывается частица, которая присоединена к поверхности или связана с ней. Нормальные условия могут включать хранение при комнатной температуре или под действием ускоряющей силы вследствие гравитации. Как описано в данном описании, частицы активного вещества могут ассоциировать с суспендирующими частицами с образованием косуспензии, где по существу отсутствует видимое разделение между суспендирующими частицами и частицами активного вещества или их осадком в виде хлопьев вследствие различий в выталкивающей силе в пропелленте.
"Суспендирующие частицы" относятся к материалу или комбинации материалов, которые приемлемы для респираторной доставки и действуют в качестве носителя для частиц активного вещества. Суспендирующие частицы взаимодействуют с частицами активного вещества, способствуя повторяющемуся дозированию, доставке или транспорту активного вещества в заданную область доставки, т.е. в дыхательные пути. Суспендирующие частицы, описанные в данном описании, диспергированы в суспензионной среде, включающей пропеллент или пропеллентную систему, и им может быть придана конфигурация любой формы, размера или поверхностных характеристик, подходящих для достижения желаемой стабильности суспензии или эффективности доставки активного вещества. Примеры суспендирующих частиц включают частицы, которые имеют размер частиц, который упрощает доставку в дыхательные пути активного вещества, и имеют физические конфигурации, подходящие для изготовления и доставки стабилизированных суспензий, как описано в данном описании.
Термин "косуспензия" относится к суспензии двух или более типов частиц, имеющей различные композиции в суспензионной среде, где частицы одного типа ассоциируют по меньшей мере частично с частицами одного или нескольких других типов. Ассоциация приводит к поддающемуся выявлению изменению одной или нескольких характеристик по меньшей мере одного из отдельных типов частиц, суспендированных в суспензионной среде. Характеристики, модифицированные ассоциацией, могут включать, например, одно или несколько из скорости агрегации или оседания в виде хлопьев, скорости или характера разделения, т.е. оседания или отслаивания, плотности отслоившегося слоя или осадка, адгезии к стенкам контейнера, адгезии к компонентам клапана и скорости и уровня диспергирования при встряхивании.
Примеры способов оценки того, присутствует ли косуспензия, включают следующие: если один тип частиц имеет пикнометрическую плотность, превышающую пикнометрическую плотность пропеллента, и другой тип частиц имеет пикнометрическую плотность более низкую, чем пикнометрическая плотность пропеллента, для определения наличия косуспензии можно использовать визуальное исследование характера отслаивания или оседания. Термин "пикнометрическая плотность" относится к плотности материала, из которого состоит частица, за исключением пустот в частице. В одном варианте осуществления материалы могут быть изготовлены и перенесены в прозрачный флакон, как правило, в стеклянный флакон, для визуального исследования. После первоначального встряхивания флакон оставляют, не трогая, в течение времени, достаточного для образования осадка или отслоившегося слоя, как правило, на 24 часа. Если осадок или отслоившийся слой наблюдают в виде полностью или по большей части однородного единого слоя, то присутствует косуспензия. Термин "косуспензия" включает частичные косуспензии, где большая часть по меньшей мере из двух типов частиц ассоциируют с друг с другом, однако может наблюдаться некоторое разделение (т.е. меньше чем большая часть) по меньшей мере двух типов частиц.
Пример теста косуспензии может быть проведен при различных температурах пропеллента, уделяя внимание характеру оседания или отслаивания типов частиц с плотностью, близкой к плотности пропеллента при комнатной температуре. Если различные типы частиц имеют одинаковый характер разделения, т.е. все они выпадают в осадок или все отслаиваются, наличие косуспензии можно определять путем измерения других характеристик суспензии, таких как скорость агрегации или выпадения в осадок в виде хлопьев, скорость разделения, плотность отслоившегося слоя или слоя осадка, адгезия к стенкам контейнера, адгезия к компонентам клапана и скорость и уровень диспергирования при встряхивании, и сравнения их с соответствующими характеристиками сходным образом суспендированных отдельных типов частиц. Для измерения этих характеристик можно использовать различные аналитические способы, обычно известные специалистам в данной области.
В контексте композиции, содержащей или обеспечивающей пригодные для вдыхания агрегаты, частицы, капли и т.д., такой как композиции, описанные в данном описании, термин "доза тонких частиц" или "FPD" относится к дозе, либо в виде общей массы, либо в виде части номинальной дозы или отмеряемой дозы, которая находится в пригодном для вдыхания диапазоне. Дозу, которая находится в пределах пригодного для вдыхания диапазона, определяют in vitro как дозу, которая дает осадок за стадией сопла в каскадном импакторе, т.е. сумму дозы, доставляемой в 3 каскада через фильтр в импакторе Next Generation Impactor, работающем при скорости потока 30 л/мин.
В контексте композиции, содержащей или обеспечивающей пригодные для вдыхания агрегаты, частицы, капли и т.д., такой как композиция, описанная в данном описании, термин "фракция тонких частиц" или "FPF" относится к доле доставляемого материала относительно доставляемой дозы (т.е. количества, которое выходит из приводного механизма устройства для доставки, такого как MDI), которая находится в пределах пригодного для вдыхания диапазона. Количество доставляемого материала в пригодном для вдыхания диапазоне определяют in vitro как количество материала, который накапливается за стадией сопла в каскадном импакторе, т.е. сумму дозы, доставляемой в 3 каскада через фильтр в импакторе Next Generation Impactor, работающем при скорости потока 30 л/мин.
Как используют в данном описании, термин "ингибирует" относится к поддающемуся измерению уменьшению тенденции к возникновению явления, симптома или состояния или степени, с которой возникают такие явления, симптомы или состояния. Термин "ингибирует" или любую его форму используют в его наиболее широком значении, и он включает минимизацию, предупреждение, снижение, сдерживание, подавление, приостановку, ограничение, задерживание, замедление прогрессирования и т.п.
"Массовый средний аэродинамический диаметр" или "MMAD", как используют в данном описании, относится к аэродинамическому диаметру аэрозоля, ниже которого 50% массы аэрозоля состоит из частиц с аэродинамическим диаметром, меньшим, чем MMAD, где MMAD вычисляют согласно монографии 601 United States Pharmacopeia ("USP").
Когда используется в данном описании, термин "оптический диаметр" указывает на размер частиц при измерении с помощью режима дифракции Фраунгофера с использованием лазерно-дифракционного анализатора размера частиц, оборудованного распределителем сухого порошка (например, Sympatec GmbH, Clausthal-Zellerfeld, Германия).
Термин "опосредуемое раствором преобразование" относится к явлению, при котором более растворимая форма твердого материала (т.е. частицы с малым радиусом кривизны (движущая сила для оствальдовского созревания) или аморфный материал) растворяется и перекристаллизовывается в более стабильную кристаллическую форму, которая может сосуществовать в равновесии с ее насыщенным раствором пропеллента.
"Пациент" относится к животному, у которого одно или несколько активных веществ, как описано в данном описании, могут иметь терапевтический эффект. В одном варианте осуществления пациентом является человек.
"Перфорированные микроструктуры" относятся к суспендирующим частицам, которые включают структурную матрицу, которая проявляет, определяет или содержит пустоты, поры, дефекты, полости, пространства, внутрипоровые пространства, щели, отверстия или углубления, которые дают возможность окружающей суспензионной среде проникать, заполнять или пропитывать микроструктуру, такие как материалы и препараты, описанные в патенте США 6309623, выданном Weers et al., который включен в данное описание посредством ссылки в полном объеме. Преимущественная форма перфорированной микроструктуры, главным образом, не является важной, и в данном описании, предусматривается любая конечная конфигурация, которая обеспечивает желаемые характеристики состава. Таким образом, в одном варианте осуществления перфорированные микроструктуры могут обладать приближенно сферической формой, такой как полые, пористые, высушенные распылительной сушкой микросферы. Однако также могут быть пригодными сплющенные, рифленые, деформированные или имеющие трещины материалы в виде частиц с любой преобладающей формой или отношением размеров.
Как является справедливым для суспендирующих частиц, описанных в данном описании, перфорированные микроструктуры могут быть образованы из любого биосовместимого материала, который по существу не деградирует или не растворяется в выбранной суспензионной среде. Хотя можно использовать широкое множество материалов для формирования частиц, в некоторых вариантах осуществления структурная матрица ассоциирована с или включает поверхностно-активное вещество, такое как фосфолипид или фторированное поверхностно-активное вещество. Хотя это и не требуется, включение совместимого поверхностно-активного вещества в перфорированную микроструктуру или, более часто, в суспендирующие частицы, может повысить стабильность респираторных дисперсий, увеличить отложение в легких и упростить получение суспензии.
Термин "суспензионная среда", как используют в данном описании, относится к веществу, обеспечивающему непрерывную фазу, в которой частицы активного вещества и суспендирующие частицы могут быть диспергированы с образованием косуспензионного состава. Суспензионная среда, используемая в косуспензионных составах, описанных в данном описании, включает пропеллент.
Как используют в данном описании, термин "пропеллент" относится к одному или нескольким фармакологически инертным веществам, которые обеспечивают достаточно высокое давление пара при нормальной комнатной температуре для продвижения лекарственного средства из емкости MDI к пациенту при приведении в действие отмеряющего клапана MDI. Таким образом, термин "пропеллент" относится как к единичному пропелленту, так и к комбинации двух или более различных пропеллентов, образующих "пропеллентную систему".
Термин "пригодный для вдыхания", главным образом, относится к частицам, агрегатам, каплям и т.д., имеющим такой размер, чтобы они могли ингалироваться и достигать дыхательных путей легкого.
При использовании в отношении косуспензионных композиций, описанных в данном описании, термины "физическая стабильность" и "физически стабильный" относятся к композиции, которая является устойчивой к одному или нескольким из агрегации, оседания в виде хлопьев и изменений размера частиц вследствие опосредуемого раствором преобразования и способна по существу сохранять MMAD суспендирующих частиц и дозу тонких частиц. В одном варианте осуществления физическую стабильность можно оценивать, подвергая композиции условиям ускоренной деградации, таких как циклическое изменение температуры, как описано в данном описании.
При указании на активные вещества термин "сильнодействующий" указывает на активные вещества, которые являются терапевтически эффективными при дозах или ниже доз, составляющих диапазон приблизительно от 0,01 мг/кг до приблизительно 1 мг/кг. Конкретные дозы сильнодействующих активных веществ, как правило, составляют диапазон приблизительно от 100 мкг до приблизительно 100 мг.
При указании на активные вещества термин "высоко сильнодействующий" указывает на активные вещества, которые являются терапевтически эффективными при или ниже дозы приблизительно 10 мкг/кг. Конкретные дозы высоко сильнодействующих активных веществ, как правило, составляют диапазон приблизительно впло