Пептидные пролекарства, принадлежащие к суперсемейству амид-содержащих глюкагонов
Иллюстрации
Показать всеИзобретение относится к пролекарственным препаратам, состоящим из пептидов, принадлежащих к суперсемейству глюкагонов, где указанный пептид, принадлежащий к суперсемейству глюкагонов, был модифицирован путем присоединения дипептида к пептиду, принадлежащему к суперсемейству глюкагонов, посредством амидной связи. Описанные здесь пролекарства имеют длительное время полужизни и могут превращаться в активную форму в физиологических условиях посредством неферментативной реакции, инициированной химической нестабильностью. 15 з.п. ф-лы, 18 ил., 19 табл., 19 пр.
Реферат
Перекрестная ссылка на родственные заявки
В настоящей заявке испрашивается приоритет предварительной заявки на патент США No. 61/358188, поданной 24 июня, 2010, которая во всей своей полноте вводится в настоящее описание посредством ссылки.
Введение материала в электронной форме посредством ссылки
Электронная версия списка нуклеотидных/аминокислотных последовательностей, прилагаемая к описанию настоящей заявки вместе с распечатанным списком этих последовательностей, была создана 21 июня 2010 в виде одного файла размером 957 кb ACII (текст) под именем «Sequence_Listing_213134» и во всей своей полноте вводится в настоящее описание посредством ссылки.
Предшествующий уровень техники
Пептидные лекарственные средства представляют собой высокоэффективные препараты, которые обладают относительно кратковременным действием и имеют вариабельный терапевтический индекс. Настоящее изобретение относится к пептидным пролекарствам, где производное пролекарства было получено в целях замедления начала его действия и увеличения времени полужизни лекарственного средства. Замедленное начало действия лекарственного средства является преимущественным свойством, так как оно позволяет обеспечивать системное распределение пролекарства перед его активацией. В соответствии с этим, введение пролекарств позволяет избежать осложнений, вызываемых в период максимальной активности лекарственного средства после его введения, и повысить терапевтический индекс родительского лекарственного средства.
Распознавание рецептора и последующий процессинг пептидных и белковых агонистов являются главным путем разложения многих пептидных и белковых лекарственных средств. Таким образом, связывание пептидного лекарственного средства с его рецептором будет приводить к биологической стимуляции, а также к инициации последующей дезактивации пептида/белка, фармакологически индуцируемой посредством ферментативного разложения пептида или белка. В соответствии с настоящим изобретением, пролекарства с пролонгированным временем биологической полужизни пептида или белка могут быть получены с применением стратегии, направленной на ингибирование распознавания пролекарства соответствующим рецептором.
Описанные здесь пролекарства, в конечном счете, подвергаются химическому превращению в структуры, которые могут распознаваться рецептором, где скорость такого химического превращения определяет время начала и продолжительности биологического действия in vivo. Молекулярное конструирование, описанное в настоящей заявке, основано на внутримолекулярной химической реакции, которая не зависит от вспомогательных химических добавок или ферментов.
Пре-проглюкагон представляет собой полипептид-предшественник, состоящий из 158 аминокислот, который процессируется в различных тканях с образованием ряда различных пептидов, происходящих от проглюкагона, включая глюкагон (SEQ ID NO: 701), глюкагон-подобный пептид-1 (GLP-1; аминокислоты 7-36, представленные здесь последовательностями SEQ ID NO: 703 и SEQ ID NO: 704), глюкагон-подобный пептид-2 (GLP-2; SEQ ID NO: 708) и оксинтомодулин (OXM; SEQ ID NO: 706), которые обладают физиологическими функциями широкого ряда, включая гомеостаз глюкозы, секрецию инсулина, опорожнение желудка и увеличение объема тонкого кишечника, а также регуляцию потребление пищи.
Глюкагон представляет собой пептид, состоящий из 29 аминокислот, которые соответствуют аминокислотам 33-61 в последовательности пре-проглюкагона, а GLP-1 продуцируется как пептид, состоящий из 37 аминокислот, соответствующих аминокислотам 72-108 пре-проглюкагона. GLP-1 (7-36) в виде амида (SEQ ID NO: 704; C-конец представляет собой амид аргинина) или GLP-1 (7-37) в виде кислоты (SEQ ID NO: 703; C-конец представляет собой глицин) являются биологически активными формами GLP-1, которые обладают, по существу, эквивалентной активностью по отношению к рецептору GLP-1.
Глюкагон представляет собой жизненно необходимое лекарственное средство, которое используется в экстренной терапии для лечения гипогликемии в тяжелой форме. Сообщалось, что оксинтомодулин обладает фармакологической активностью, направленной на подавление аппетита и снижение массы тела. Клинические исследования агонистов рецептора GLP-1 или стабилизированных аналогов GLP-1 подтвердили, что такое семейство пептидов может оказаться эффективным для лечения диабета типа II. Кроме того, такое лечение, из-за его глюкозозависимого действия, является более безопасным, чем инсулиновая терапия, а поэтому устраняет какой-либо риск развития гипогликемии. Исследование взаимосвязи «структура - активность» показало, что N-концевой гистидин для каждого из этих пептидов (глюкагона, GLP-1 и оксинтомодулина) играет особенно важную роль во всех их функциях, и что N-концевые удлиненные формы значительно снижают биологическую активность.
Известно, что существуют другие пептиды, которые по своей структуре и активности напоминают глюкагон и GLP-1. Так, например, экзендин-4 представляет собой пептид, который присутствует в слюне ядозуба и, по своей структуре, напоминает GLP-1, и так же, как глюкагон и GLP-1, повышает уровень высвобождения инсулина.
Кроме того, полипептид, угнетающий секрецию желудочного сока, (GIP) также известен как глюкозозависимый инсулинотропный пептид и является членом семейства гормонов секретинов. GIP происходит от пробелка, состоящего из 153 аминокислот, кодируемых геном GIP и циркулирует в кровотоке как биологически активный пептид, состоящий из 42 аминокислот (SEQ ID NO: 707). Ген GIP экспрессируется в тонком кишечнике, а также в слюнных железах и является слабым ингибитором секреции желудочного сока. GIP, помимо его ингибирующего действия в желудке в присутствии глюкозы, повышает уровень высвобождения инсулина β-клетками панкреатических островков при введении в физиологических дозах. Очевидно, что GIP функционирует как кишечный фактор, который стимулирует высвобождение инсулина поджелудочной железы и может играть физиологически важную роль в поддержании гомеостаза глюкозы.
Остеокальцин (SEQ ID NO: 709) представляет собой неколлагеновый белок, обнаруживаемый в костях и в дентине. Этот белок секретируется остеобластами и, очевидно, играет определенную роль в минерализации и в гомеостазе ионов кальция. Сообщалось, что остеокальцин функционирует как гормон в организме, стимулирует высвобождение большего количества инсулина бета-клетками поджелудочной железы, и в то же самое время регулирует высвобождение гормона адипонектина жировыми клетками, что приводит к повышению чувствительности к инсулину.
Одним из недостатков терапевтического применения биологически активных пептидов, таких как остеокальцин, GIP, глюкагон, GLP-1 и оксинтомодулин является их очень короткое время полужизни (приблизительно две минуты для глюкагона и GLP-1) в плазме. В соответствии с этим, для осуществления соответствующей регуляции уровня глюкозы, нативные родственные глюкагону пептиды должны вводиться непрерывно в течение длительного периода времени. Короткое время полужизни родственных глюкагону пептидов и GLP-1 обусловлено их быстрым разложением дипептидил-пептидазой IV (DPP-IV), которая расщепляет эти пептиды между второй и третьей аминокислотами. Такое расщепление приводит не только к инактивации нативных пептидов, но, в случае глюкагона и GLP-1, их укороченные формы могут служить функциональными антагонистами их соответствующих рецепторов. В соответствии с этим, для реализации всего терапевтического потенциала механизмов действия этих лекарственных средств необходимо получить варианты GIP, глюкагона, GLP-1 и оксинтомодулина, а также родственных пептидов, которые обладали бы более продолжительным временем действия.
Описание сущности изобретения
В соответствии с некоторыми своими вариантами, настоящее изобретение относится к пролекарственному производному биологически активного полипептида, выбранного из группы, состоящей из глюкагона, экзендина-4, GLP-1, GLP-2, GIP, вазоактивного кишечного пептида (VIP), полипептида 27, активирующего аденилатциклазу гипофиза (PACAP-27), пептида, состоящего из гистидина-метионина (PHM), оксинтомодулина, секретина, остеокальцина, рилизинг-фактора гормона роста, а также аналогов, производных и конъюгатов вышеуказанных соединений. Производное пролекарства включает дипептидный элемент пролекарства, ковалентно связанный с активным центром биологически активного полипептида посредством амидной связи. В некоторых вариантах изобретения, дипептид ковалентно связан с биологически активным полипептидом в положении, которое нарушает способность биологически активного полипептида взаимодействовать с его соответствующим рецептором или кофактором. В некоторых вариантах изобретения, дипептидный элемент пролекарства связан с амино-концом биологически активного пептида. Последующее удаление пептида в физиологических условиях и в отсутствии ферментативной активности будет приводить к полному восстановлению активности полипептида.
В некоторых своих вариантах, настоящее изобретение относится к пролекарству, имеющему общую структуру A-B-Q. В этом варианте, Q представляет собой биологически активный пептид, выбранный из группы пептидов, принадлежащих к суперсемейству глюкагонов, включая родственные глюкагону пептиды, остеокальцин, а также их аналоги, производные и конъюгаты, а A-B представляет собой дипептидное пролекарство, связанное с биологически активным пептидом посредством амидной связи. Более конкретно, в некоторых вариантах изобретения, A представляет собой аминокислоту или оксикислоту, а B представляет собой N-алкилированную аминокислоту, связанную с Q посредством амидной связи, образующейся между карбоксилом B (в A-B) и амином Q. Кроме того, в некоторых вариантах изобретения, A, B или аминокислота Q, к которой присоединена A-B, представляют собой некодируемую аминокислоту, а химическое отщепление A-B от Q, по меньшей мере примерно на 90%, происходит приблизительно за 1-720 часов в PBS в физиологических условиях. В другом варианте изобретения, химическое отщепление A-B от Q происходит по меньшей мере примерно на 50% приблизительно за 1 час или приблизительно за 1 неделю в PBS в физиологических условиях.
В некоторых вариантах изобретения, A и B выбирают так, чтобы они ингибировали ферментативное отщепление дипептида A-B от Q под действием ферментов, присутствующих в сыворотке млекопитающих. В некоторых вариантах изобретения, A и/или B выбирают так, чтобы полупериод отщепления A-B от Q в PBS в физиологических условиях не превышал более, чем в два раза полупериод отщепления и A-B от Q в растворе, содержащем протеазу DPP-IV (то есть, так, чтобы отщепление A-B от Q в присутствии протеазы DPP-IV и в физиологических условиях не происходило более, чем в 2 раза быстрее, чем в идентичных условиях в отсутствии фермента). В некоторых вариантах изобретения, A и/или B представляют собой аминокислоту в конфигурации стереоизомера D. В некоторых репрезентативных вариантах изобретения, A представляет собой аминокислоту в конфигурации стереоизомера D, а В представляет собой аминокислоту в конфигурации стереоизомера L. В некоторых репрезентативных вариантах изобретения, A представляет собой аминокислоту в конфигурации стереоизомера L, а В представляет собой аминокислоту в конфигурации стереоизомера D. В некоторых репрезентативных вариантах изобретения, A представляет собой аминокислоту в конфигурации стереоизомера D и В представляет собой аминокислоту в конфигурации стереоизомера D.
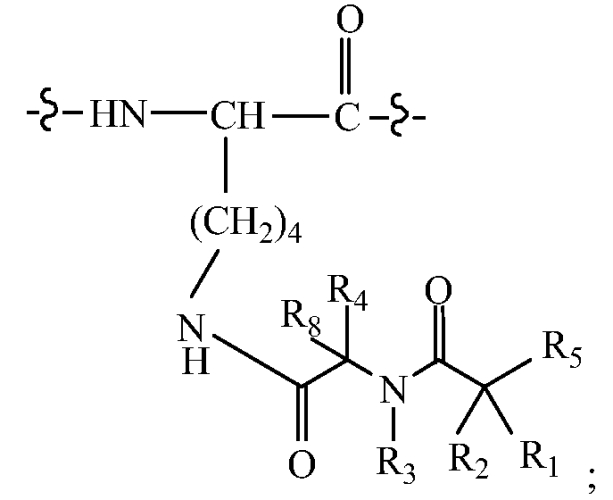
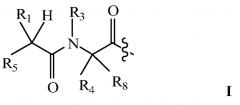
В некоторых вариантах изобретения, дипептидный элемент пролекарства (A-B) включает соединение, имеющее общую структуру формулы I:
где R1, R2, R4 и R8 независимо выбраны из группы, состоящей из H, С1-С18алкила, С2-С18алкенила, (С1-С18алкил)OH, (С1-С18алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкил), (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7, (C1-C4алкил)(C3-C9гетероарил) и C1-C12алкил(W1)C1-C12алкила, где W1 представляет собой гетероатом, выбранный из группы, состоящей из N, S и O, или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют C3-C12циклоалкил или арил; или R4 и R8, взятые вместе с атомами, с которыми они связаны, образуют C3-C6циклоалкил;
R3 выбран из группы, состоящей из С1-С18алкила, (С1-С18алкил)OH, (С1-С18алкил)NH2, (С1-С18алкил)SH, (C0-C4алкил)(C3-C6)циклоалкила, (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7, и (C1-C4алкил)(C3-C9гетероарил), или R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо;
R5 представляет собой NHR6 или ОН;
R6 представляет собой H, C1-C8алкил, или R6 и R2, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из H и OH.
Очевидно, что если W1 представляет собой N, то в физиологических условиях, атом азота связан с H.
В другом варианте изобретения, дипептидный элемент пролекарства (A-B) включает соединение, имеющее общую структуру формулы I:
где R1, R2, R4 и R8 независимо выбраны из группы, состоящей из H, С1-С18алкила, С2-С18алкенила, (С1-С18алкил)OH, (С1-С18алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкил), (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7, (C1-C4алкил)(C3-C9гетероарил) и C1-C12алкил(W1)C1-C12алкил, где W1 представляет собой гетероатом, выбранный из группы, состоящей из N, S и O, или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют C3-C12циклоалкил или арил; или R4 и R8, взятые вместе с атомами, с которыми они связаны, образуют C3-C6циклоалкил;
R3 выбран из группы, состоящей из С1-С18алкила, (С1-С18алкил)OH, (С1-С18алкил)NH2, (С1-С18алкил)SH, (C0-C4алкил)(C3-C6)циклоалкила, (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7, и (C1-C4алкил)(C3-C9гетероарил), или R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо;
R5 представляет собой NHR6 или ОН;
R6 представляет собой H, C1-C8алкил, или R6 и R2, взятые вместе с атомами, с которыми они связаны, образуют 4-, 5- или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из водорода, С1-С18алкила, С2-С18алкенила, (C0-C4алкил)CONH2, (C0-C4алкил)COOH, (C0-C4алкил)NH2, (C0-C4алкил)OH и галогена.
Как описано выше, в некоторых своих аспектах, настоящее изобретение относится к пролекарству, имеющему общую структуру A-B-Q, где Q представляет собой пептид, принадлежащий к суперсемейству глюкагонов (например, родственный глюкагону пептид, рилизинг-фактор гормона роста (GHRH; SEQ ID NO: 719), вазоактивный кишечный пептид (VIP; SEQ ID NO: 720), полипептид 27, активирующий аденилат-циклазу гипофиза (PACAP-27; SEQ ID NO: 721), пептид, состоящий из гистидина-метионина (PHM; SEQ ID NO: 722), или секретин (SEQ ID NO: 723), и/или их аналоги, производные и конъюгаты). Пептиды, принадлежащие к суперсемейству глюкагонов, могут иметь общие структурные свойства, включая, но не ограничиваясь ими, гомологию в N-концевых аминокислотах и/или альфа-спиральную структуру в С-концевой части. Очевидно, что С-конец обычно связывается с рецептором, а N-конец обычно участвует в передаче сигнала рецептору. Несколько аминокислот в N-концевой части и в С-концевой части являются в высокой степени консервативными среди членов суперсемейства глюкагонов, например, His1, Gly4, Phe6, Phe22, Val23, Trp25 и Leu26, причем, аминокислоты в этих положениях являются идентичными по консервативным заменам или имеют сходные аминокислотные боковые цепи. В некоторых вариантах изобретения, Q представляет собой родственный глюкагону пептид, например, глюкагон (SEQ ID NO: 701), оксинтомодулин (SEQ ID NO: 706), экзендин-4 (SEQ ID NO: 718), глюкагон-подобный пептид-1 (GLP-1) (аминокислоты 7-37, представленные в SEQ ID №№: 703 и 707), глюкагон-подобный пептид-2 (GLP-2) (SEQ ID NO: 708), GIP (SEQ ID NO: 707) или их аналоги, производные и конъюгаты. В некоторых вариантах изобретения, Q представляет собой родственный глюкагону пептид, содержащий аминокислотную последовательность, которая по меньшей мере примерно на 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична соответствующей последовательности нативного глюкагона, нативного оксинтомодулина, нативного экзендина-4, нативного (7-37)GLP-1, нативного GLP-2 или нативного GIP по всей длине нативного пептида (или во всех положениях, соответствующих глюкагону, см., например, фиг. 10). В других вариантах изобретения, пептид, принадлежащий к суперсемейству глюкагонов (Q), содержит аминокислотную последовательность нативного глюкагона, нативного экзендина-4, нативного (7-37)GLP-1, нативного GLP-2, нативного GHRH, нативного VIP, нативного PACAP-27, нативного PHM, нативного оксинтомодулина, нативного секретина или нативного GIP, имеющую до 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных модификаций. В других вариантах изобретения, Q содержит аминокислотную последовательность, которая представляет собой химеру из двух или более нативных последовательностей пептида, родственного глюкагону. В некоторых вариантах изобретения, Q содержит аминокислотную последовательность, которая по меньшей мере примерно на 50% идентична последовательности нативного глюкагона (SEQ ID NO: 701), и которая сохраняет альфа-спиральную конформацию аминокислот, соответствующих аминокислотам 12-29 SEQ ID NO:701.
Q может быть любым известным пептидом, принадлежащим к суперсемейству глюкагонов, включая, например, любые родственные глюкагону пептиды, известные специалистам, некоторые из которых описаны в настоящей заявке как неограничивающие примеры. Различные аналоги GLP-1 известны специалистам и представляют собой родственный глюкагону пептид согласно изобретению, см., например, заявки WO 2008023050, WO 2007030519, WO 2005058954, WO 2003011892, WO 2007046834, WO 2006134340, WO 2006124529, WO 2004022004, WO 2003018516, WO 2007124461, каждая из которых во всей своей полноте вводится в настоящее описание посредством ссылки, и в которых представлены последовательности или формулы аналогов или производных GLP-1. В некоторых вариантах изобретения, Q представляет собой родственный глюкагону пептид, принадлежащий к классу 1, 2, 3, 4 или 5, как подробно описано в настоящей заявке. В любом из описанных здесь вариантов, Q представляет собой любую из последовательностей SEQ ID NN: 1-684, 701-742, 801-919, 1001-1262, 1301-1371, 1401-1518, 1701-1776 и 1801-1908.
Хотя дипептидное пролекарство, например, A-B, может быть связано с Q в любом положении, которое блокирует активность Q, однако, в описанных здесь вариантах представлены примеры положений, которые являются подходящими для связывания A-B. Если представленные здесь положения пронумерованы со ссылкой на положения в нативной последовательности глюкагона (SEQ ID NO: 701), то соответствующее положение в аналогах глюкагона или в других пептидах, принадлежащих к суперсемейству глюкагона, может быть определено путем выравнивания. См., например, фиг. 10, где проиллюстрировано выравнивание некоторых пептидов, принадлежащих к суперсемейству глюкагонов. Так, например, положение 24 в нативном глюкагоне соответствует положению 24 (7-37) GLP-1.
В некоторых вариантах изобретения, пептид, принадлежащий к суперсемейству глюкагонов, может содержать С-конец или C-концевую аминокислотную последовательность, включая, но не ограничиваясь ими, COOH, CONH2, GPSSGAPPPS (SEQ ID NO: 710), GPSSGAPPPS-CONH2 (SEQ ID NO: 711), карбокси-концевое удлинение оксинтомодулина, KRNRNNIA (SEQ ID NO: 714) или KGKKNDWKHNITQ (SEQ ID NO: 713). Кроме того, C-концевые аминокислотные последовательности для пептидов, принадлежащих к семейству глюкагонов, более подробно описаны ниже.
В других аспектах изобретения, Q содержит остеокальцин (SEQ ID NO: 709) или аминокислотную последовательность, которая по меньшей мере примерно на 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична последовательности нативного остеокальцина по всей длине нативного пептида. Q может содержать аналог остеокальцина, в котором, по сравнению с нативным остеокальцином, имеются до 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных модификаций. В других аспектах изобретения, Q содержит рилизинг-фактор гормона роста (GHRH) (SEQ ID NO: 719) или аминокислотную последовательность, которая по меньшей мере примерно на 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична нативному GHRH по всей длине нативного пептида. Q может содержать аналог GHRH, в котором, по сравнению с нативным GHRH, имеется до 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных модификаций. В некоторых вариантах изобретения, Q может представлять собой любой аналог остеокальцина или GHRH, известный специалистам.
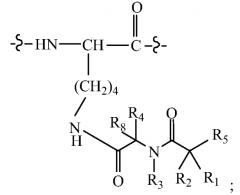
В других своих вариантах, настоящее изобретение относится к пролекарству, имеющему общую структуру A-B-Q, где Q представляет собой пептид, принадлежащий к суперсемейству глюкагонов, остеокальцин или их аналоги, производные или конъюгаты, а A-B имеет общую структуру:
,
где R1 и R8 независимо выбраны из группы, состоящей из H и С1-С8алкила;
R2 и R4 независимо выбраны из группы, состоящей из H, С1-С8алкила, С2-С8алкенила, (С1-С4алкил)OH, (С1-С4алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкил), (C0-C4алкил)(C6-C10арил)R7, СН2(C5-C9гетероарил), или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют C3-C6циклоалкил;
R3 выбран из группы, состоящей из С1-С8алкила, (С1-С4алкил)OH, (С1-С4алкил)NH2, (С1-С4алкил)SH, (C3-C6)циклоалкила, или R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо;
R5 представляет собой NHR6 или ОН;
R6 представляет собой H, или R6 и R2, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из H и OH.
Если R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо, то R1 и R2 не являются H.
В других своих вариантах, настоящее изобретение относится к пролекарству, имеющему общую структуру A-B-Q, где Q представляет собой пептид, принадлежащий к суперсемейству глюкагонов, остеокальцин или их аналоги, производные или конъюгаты, а A-B имеет общую структуру:
где R1 и R8 независимо представляют собой H или С1-С8алкил;
R2 и R4 независимо выбраны из группы, состоящей из H, С1-С8алкила, С2-С8алкенила, (С1-С4алкил)OH, (С1-С4алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкил), (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7 и СН2(C5-C9гетероарил), или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют C3-C12циклоалкил;
R3 выбран из группы, состоящей из С1-С8алкила, (С1-С4алкил)OH, (С1-С4алкил)NH2, (С1-С4алкил)SH, (C3-C6)циклоалкила, или R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо;
R5 представляет собой NHR6 или ОН;
R6 представляет собой H, С1-С8алкил, или R6 и R2, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из водорода, С1-С18алкила, С2-С18алкенила, (C0-C4алкил)CONH2, (C0-C4алкил)COOH, (C0-C4алкил)NH2, (C0-C4алкил)OH, галогена, при условии, что если R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо, то R1 и R2 не являются H.
В других вариантах изобретения, Q представляет собой пептид, выбранный из группы, состоящей из рилизинг-фактора гормона роста (GHRH; SEQ ID NO: 719), вазоактивного кишечного пептида (VIP; SEQ ID NO: 720), полипептида 27, активирующего аденилат-циклазу гипофиза (PACAP-27; SEQ ID NO: 721), пептида, состоящего из гистидина-метионина (PHM; SEQ ID NO: 722), или секретина (SEQ ID NO: 723), глюкагона (SEQ ID NO: 701), экзендина-4 (SEQ ID NO: 718), глюкагон-подобного пептида-1 (GLP-1) (аминокислоты 7-37, представленные в SEQ ID №№: 703 и 704), глюкагон-подобного пептида-2 (GLP-2) (SEQ ID NO: 708), GIP (SEQ ID NO: 707) или их аналогов, производных и конъюгатов. В некоторых вариантах изобретения, Q представляет собой пептид, родственный глюкагону.
В другом своем варианте, настоящее изобретение относится к аналогу пролекарства, а именно, пептида, принадлежащего к суперсемейству глюкагонов или остеокальцина или их аналога, производного или конъюгата, где молекула пролекарства (A-B) ковалентно связана с Q в одном или нескольких внутренних аминокислотных остатках в последовательности Q, например, в положении Q, соответствующем положениям 12, 16, 17, 18, 20, 28, или 29 нативного глюкагона (SEQ ID NO: 701). Так, например, в некоторых вариантах изобретения, молекула пролекарства (A-B) связана прямо или посредством линкера, с замещенным Lys в положении 20 в Q. В таких вариантах изобретения, Q может содержать в положении 20 (по сравнению с нативной последовательностью глюкагона) замену, имеющую структуру:
В других вариантах изобретения, молекула пролекарства (A-B) связана прямо или посредством линкера с замененным амино-Phe в положении 22. В таких вариантах изобретения, Q может содержать в положении 22 (по сравнению с нативной последовательностью глюкагона) замену, имеющую структуру:
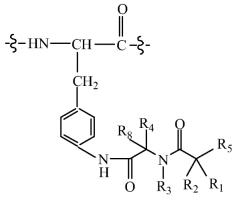
Альтернативно или дополнительно, молекула пролекарства (A-B) связана прямо или посредством линкера с амино-концом Q, где A-B имеет структуру:
,
где R1 и R8 независимо выбраны из группы, состоящей из H и С1-С8алкила;
R2 и R4 независимо выбраны из группы, состоящей из H, С1-С8алкила, С2-С8алкенила, (С1-С4алкил)OH, (С1-С4алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкил), (C0-C4алкил)(C6-C10арил)R7, СН2(C5-C9гетероарил), или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют C3-C6циклоалкил;
R3 выбран из группы, состоящей из С1-С8алкила, (С1-С4алкил)OH, (С1-С4алкил)NH2, (С1-С4алкил)SH, (C3-C6)циклоалкила, или R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо;
R5 представляет собой NHR6 или ОН;
R6 представляет собой H, или R6 и R2, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из H и OH, при условии, что если каждый из R1 и R2 не является Н, то R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо.
В других вариантах изобретения, молекула пролекарства (A-B) связана прямо или посредством линкера с амино-концом Q, где A-B имеет структуру:
,
где R1 и R8 независимо представляют собой H или С1-С8алкил;
R2 и R4 независимо выбраны из группы, состоящей из H, С1-С8алкила, С2-С8алкенила, (С1-С4алкил)OH, (С1-С4алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкил), (C0-C4алкил)(C2-C5гетероциклил), (C0-C4алкил)(C6-C10арил)R7 и СН2(C3-C9гетероарил) или R1 и R2, взятые вместе с атомами, с которыми они связаны, образуют C3-C12циклоалкил;
R3 выбран из группы, состоящей из С1-С8алкила, (С1-С4алкил)OH, (С1-С4алкил)NH2, (С1-С4алкил)SH, (C3-C6)циклоалкила, или R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо;
R5 представляет собой NHR6 или ОН;
R6 представляет собой H, С1-С8алкил, или R6 и R2, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из водорода, С1-С18алкила, С2-С18алкенила, (C0-C4алкил)CONH2, (C0-C4алкил)COOH, (C0-C4алкил)NH2, (C0-C4алкил)OH, галогена, при условии, что если оба R1 и R2 не являются Н, то R4 и R3, взятые вместе с атомами, с которыми они связаны, образуют 5- или 6-членное гетероциклическое кольцо.
В некоторых вариантах изобретения, лишь одна молекула пролекарства связана с Q. Так, например, в таких вариантах изобретения, если молекула пролекарства (A-B) связана с Q у N-конца, то молекулы пролекарства (A-B) не связаны с внутренним аминокислотным остатком в последовательности Q, и наоборот. В некоторых вариантах изобретения, две или три молекулы пролекарства связаны с Q, например, у N-конца и в одном или нескольких внутренних сайтах.
Краткое описание графического материала
На фиг. 1 представлен график изменения массы тела у мышей с ожирением, вызванным кормлением (DIO), которым раз в неделю внутрибрюшинно инъецировали дозу 15 или 70 нмоль/кг аналога глюкагона. Мышей ежедневно взвешивали (N=8) после первой инъекции: только носителя ▼, пептида А, принадлежащего к суперсемейству глюкагонов («Пептида A») в дозе 15 нмоль/кг (▷) или 70 нмоль/кг (►), или производного пролекарства Пептида A, где дипептид связан с N-концом Пептида А посредством амидной связи, и где указанный дипептид представляет собой Aib-1 Pro0 (вводимый в дозе 15 нмоль/кг (O) или 70 нмоль/кг (●)),Aib-1 Pro0 (вводимый в дозе 70 нмоль/кг (◇)), Lys-1 Sar0 (вводимый в дозе 70 нмоль/кг (♦)), dAla-1 Pro0 (вводимый в дозе 70 нмоль/кг (◄)) или Ac-Aib-1 Pro-1 (вводимый в дозе 70 нмоль/кг (■)).
На фиг.2 представлен график изменения массы тела у мышей с ожирением, вызванным кормлением (DIO), которым раз в неделю внутрибрюшинно инъецировали дозы 0,5, 3, 15 или 70 нмоль/кг только носителя (♦), Пептида А (в дозе 0,5 ▲, 3 ►, 15 ▼ или 70 ◄ нмоль/кг/день) или Lys-1 Sar0 - Пептида А (в дозе 0,5 Δ, 3 ▷, 15 ▽ или 70 ◁ нмоль/кг/день).
На фиг. 3 представлен график уровней глюкозы в крови (мг/дл) у DIO-мышей (N=8), которым сначала инъецировали пептид, родственный глюкагону, а затем раствор глюкозы. Мышам внутрибрюшинно инъецировали во время -60 минут либо только носитель (▲), либо дозу 15 или 70 нмоль/кг одного из следующих пептидов:
(A) Пептида А (в дозе 15 < или 70 ◄ нмоль/кг/день),
(B) Lys-1 Sar0 Пептида А (в дозе 15 ▷ или 70 ► нмоль/кг/ день), или
(C) dLys-1 Sar0 Пептида А (в дозе 15 □, или 70 ■ нмоль/кг/ день).
Физиологический раствор, содержащий 25% (об./об.) глюкозы, инъецировали в дозе 1,5 г/кг массы тела во время 0 минут. Уровни глюкозы в крови измеряли во время -60, 0, 15, 30, 60 и 120 минут.
На фиг. 4 представлен график уровней глюкозы в крови (мг/дл) у DIO-мышей (N=8), которым сначала инъецировали пептид, родственный глюкагону, а затем раствор глюкозы. Мышам внутрибрюшинно инъецировали во время -15 минут либо только носитель (▼), либо дозу 2 нмоль/кг одного из следующих соединений:
(A) Lys-1 Sar0-Пептида А (■),
(B) Lys-1 (X), Sar0-Пептида А (▲), (X представляет собой 1K ПЭГ-цепь, связанную с боковой цепью Lys)
(C) Lys-1 (Y), Sar0 Пептида А, (♦), (Y представляет собой трет-бутилглицин, связанный с боковой цепью Lys)
(D) dLys-1 Sar0-Пептида А (►).
Физиологический раствор, содержащий 25% (об./об.) глюкозы, инъецировали в дозе 1,5 г/кг массы тела во время 0 минут. Уровни глюкозы в крови измеряли во время -15, 0, 15, 30, 60 и 120 минут.
На фиг. 5 представлен график уровней глюкозы в крови (мг/дл) у DIO-мышей (N=8), которым сначала инъецировали пептид, родственный глюкагону, а затем раствор глюкозы. Мышам внутрибрюшинно инъецировали во время -15 минут либо только носитель (▼), либо дозу 20 нмоль/кг dLys-1 Sar0-Пептида А, (►), либо дозу 0,67 нмоль/кг одного из следующих соединений:
(A) Lys-1 Sar0-Пептида А (■),
(B) Lys-1 (X), Sar0-Пептида А (▲), (X представляет собой 1K ПЭГ-цепь, связанную с боковой цепью Lys)
(C) Lys-1 (Y), Sar0-Пептида А (♦), (Y представляет собой трет-бутилглицин, связанный с боковой цепью Lys).
Физиологический раствор, содержащий 25% (об./об.) глюкозы, инъецировали в дозе 1,5 г/кг массы тела во время 0 минут. Уровни глюкозы в крови измеряли во время -15, 0, 15, 30, 60, и 120 минут.
На фиг. 6 представлен график уровней глюкозы в крови (мг/дл) у DIO-мышей (N=8), которым сначала инъецировали пептид, родственный глюкагону, а затем раствор глюкозы. Мышам внутрибрюшинно инъецировали во время -60 минут либо только носитель (▼), либо дозу 15 или 70 нмоль/кг одного из следующих соединений:
(A) Пептида А (в дозе 15 Δ или 70 ▲ нмоль/кг/день),
(B) dLys-1 Sar0-Пептида А (в дозе 15 □, или 70 ■ нмоль/кг/день), или
(C) Lys-1 Sar0-Пептида А (в дозе 15 ▷ или 70 ► нмоль/кг/день).
Физиологический раствор, содержащий 25% (об./об.) глюкозы, инъецировали в дозе 1,5 г/кг массы тела во время 0 минут и через 24 часа (см. фиг.7). Указанные уровни глюкозы в крови были измерены во время -60, 0, 15, 30, 60 и 120 минут до или после первого введения раствора глюкозы (то есть, начало отсчета 0 минут).
На фиг. 7 представлен график уровней глюкозы в крови (мг/дл) у DIO-мышей (N=8), которым внутрибрюшинно, во время -60 минут, инъецировали либо только носитель (▼), либо дозу 15 или 70 нмоль/кг одного из следующих соединений:
(A) Пептида А (в дозе 15 Δ или 70 ▲ нмоль/кг/день),
(B) dLys-1 Sar0 Пептида А (в дозе 15 ◇ или 70 ▽ нмоль/кг/день), или
(C) Lys-1 Sar0 Пептида А (в дозе 15 ♦ или 70 ■ нмоль/кг/день).
Физиологический раствор, содержащий 25% (об./об.) глюкозы, инъецировали в дозе 1,5 г/кг массы тела во время 0 минут и через 24 часа. Указанные уровни глюкозы в крови были измерены через 0, 15, 30, 60 и 120 минут после второй инъекции раствора глюкозы, которую осуществляли через 24 часа.
На фиг. 8 представлены данные, указывающие на потерю массы у DIO-мышей (N=8), которым внутрибрюшинно инъецировали указанные соединения в дозе 15 или 70 нмоль/кг. Указанные массы тела измеряли через 7 дней после введения соединений.
На фиг. 9A-B представлены графики уровней глюкозы в крови (BG) (мг/дл) у DIO-мышей (n=8). Мышам внутрибрюшинно инъецировали только носитель или пептид-пролекарство за 24, 8, 4 или 1 час до введения провокационной дозы (указанной на фигуре) путем инъекции 25% глюкозы в