Получение промежуточных продуктов для синтеза позаконазола
Иллюстрации
Показать всеНастоящее изобретение относится к способу получения хирального соединения формулы (IX) или его соли, где Y1 и Y2 независимо обозначают F или Cl, предпочтительно F, а также к кристаллическому хиральному соединению формулы (IX) или его соли, в которой от 80 до 95%, предпочтительно от 85 до 95% молекул указанного кристаллического соединения или его соли содержатся в виде цис-изомера формулы (VII) или его соли и от 20 до 5%, предпочтительно от 15 до 5% молекул указанного кристаллического соединения или его соли содержатся в виде транс-изомера формулы (VIII) или его соли, и к его применению для получения фунгицидного средства. 4 н. и 19 з.п. ф-лы, 5 ил., 2 табл., 2 пр.
Реферат
Настоящее изобретение относится к получению хиральных соединений, в частности к получению хиральных соединений, которые можно использовать в качестве промежуточных продуктов для получения фунгицидных средств, предпочтительно позаконазола.
Уровень техники
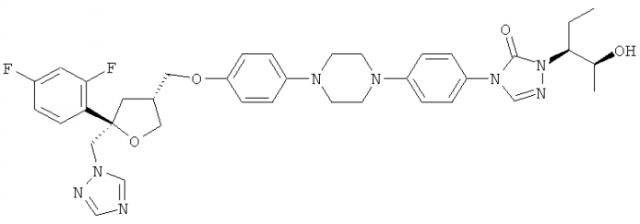
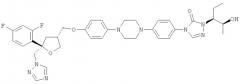
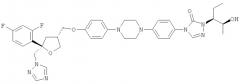
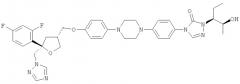
Позаконазол (регистрационный № CAS 171228-49-2; название CAS: 2,5-ангидро-1,3,4-тридезокси-2-C-(2,4-дифторфенил)-4-[[4-[4-[4-[1-[(1S,2S)-1-этил-2-гидроксипропил]-1,5-дигидро-5-оксо-4Н-1,2,4-триазол-4-ил]фенил]-1-пиперазинил]фенокси]метил]-1-(1Н-1,2,4-триазол-1-ил)-D-трео-пентит) является триазольным фунгицидным лекарственным средством, обладающим структурой:
.
Позаконазол используется, например, для предупреждения и/или лечения инвазивных грибковых инфекций, вызванных штаммами Candida, штаммами Mucor, штаммами Aspergillus, штаммами Fusarium или штаммами Coccidioides, у пациентов с ослабленным иммунитетом и/или у пациентов, у которых заболевание устойчиво к воздействию других фунгицидных средств, таких как амфотерицин B, флуконазол или итраконазол, и/или у пациентов, которые не переносят эти фунгицидные средства.
Одним из важных промежуточных продуктов для получения позаконазола является соединение формулы (IX)
где оба остатка Y1 и Y2 обозначают F. Поэтому постоянно требуются эффективные способы получения этого промежуточного продукта.
В соответствии с известными способами предшествующего уровня техники общим обычным исходным веществом для получения хирального соединения формулы (IX) является замещенный олефин следующей формулы (II)
где L обозначает подходящую отщепляющуюся группу, такую как Cl, Br и сульфонаты.
Однако указанные способы предшествующего уровня техники обеспечивают только сравнительно сложные способы получения этих соединений формулы (II), ниже обозначаемые как Ar-C(=CH2)-CH2-L, в частности соединений в которых Y1 и Y2 оба обозначают F.
В WO 94/25452 раскрыт способ, в котором Ar-C(=CH2)-CH2-L получают по реакции соответствующего аллилового спирта Ar-C(=СН2)-СН2-OH с бромирующим реагентом или сульфирующим реагентом. В свою очередь, для получения аллилового спирта в литературе предложены несколько методик.
В одной методике, описанной в WO 94/25452, в качестве исходного вещества используют Ar-C(=O)-CH2-L, из которого по трехстадийной методике получают аллиловый спирт. На первой стадии Ar-C(=O)-CH2-Cl вводят в реакцию с KOAc (ацетат калия) и получают Ar-С(=O)-СН2-OAc, который затем вводят в реакцию с CH3Ph3PBr (метилтрифенилфосфоний бромид) и NaHMDS (гексаметилдисилазан натрия) в присутствии THF (тетрагидрофуран) и получают Ar-С(=CH2)-СН2-OAc. На третьей стадии Ar-С(=CH2)-СН2-ОАс дополнительно вводят в реакцию с KOH (гидроксид калия) и в заключение получают Ar-C(=СН2)-СН2-OH. Кроме того, что в этой методике используют 3 последовательные стадии, каждую из которых необходимо проводить в отдельном сосуде, следует отметить, что на второй стадии продукт реакции нелегко отделить от побочного продукта, трифенилфосфиноксида.
В другой методике, описанной в публикации P. Blundell et al., Synlett 1994, pp.263-265, в качестве исходного вещества используют Ar-Br, который на первой стадии превращают в реагент Гриньяра, который в свою очередь, вводят в реакцию с (Cl-СН2)2C=O (1,2-дихлорацетон), из которого получают Ar-С(OH)(CH2Cl)2, который на второй стадии обрабатывают карбонатом калия и получают эпоксид. Этот эпоксид затем, в свою очередь, на третьей стадии, превращают в Ar-С(=СН2)-CH2-OH. Кроме того, что в этой методике получения аллилового спирта используют 3 последовательные стадии, каждую из которых необходимо проводить в отдельном сосуде, известно, что реагент Гриньяра, полученный из Ar-Br, т.е. 2,4-дифторбромбензол, является потенциально опасным соединением.
В WO 95/16658 А1 предложен другой способ получения Ar-C(=CH2)-CH2-L, в котором в качестве исходного вещества используют Ar-C(=O)-CH3. В реакции Гриньяра с последующим элиминированием получают олефин Ar-С(=CH2)-CH3, который затем вводят в радикальное галогенирование и получают Ar-С(=СН2)-CH2-L (где L=Cl, Br). ПО сравнению с двумя методиками, описанными выше, эту методику, которая хотя и включает 3 стадии, можно провести только в 2 реакционных сосудах, поскольку реакцию Гриньяра и последующее элиминирование можно провести в одном сосуде. Однако основным недостатком этой методики является то, что галогенирование дает нежелательную смесь аллилгалогенидов и винилгалогенидов.
Поэтому объектом настоящего изобретения является разработка улучшенного способа получения хирального соединения формулы (IX), в котором исходное вещество - соединение формулы (II), получают новым способом, который лучше указанных известных способов предшествующего уровня техники.
Согласно изобретению было установлено, что указанное исходное вещество можно получить способом, который можно провести только в одном реакционном сосуде с хорошими выходами, причем способ включает только 2 стадии реакции. Согласно изобретению неожиданно было установлено, что для получения указанного выше аллилхлорида можно использовать методологию олефинирования, известную, как олефинирование по Петерсону. По этой методологии олефинирования, впервые описанной в публикации "D.J. Peterson, Carbonyl olefination reaction using silyl-substituted organometallic compounds; J. Org. Chem. (1968) 33 (2) pp.780-784", альфа-силильный карбанион вводят в реакцию с кетонами или альдегидами с получением бета-гидроксисиланов, которые можно подвергнуть элиминированию с получением алкенов. Большинство известных примеров олефинирования по Петерсону проводят в диэтиловом эфире, который нельзя использовать в промышленных способах по соображениям безопасности. В редких случаях в качестве альтернативного растворителя описано использование тетрагидрофурана.
Как отмечено выше, соединения формулы (IX) и их соли являются важными промежуточными продуктами для получения фунгицидных средств. По ряду причин является желательным присутствие таких промежуточных продуктов в виде кристаллических соединений. Однако по известным из литературы способам соединения формулы (IX) и их соли, в частности соединения формулы (IX), где оба Y1 и Y2 обозначают F, не образуются в виде по меньшей мере частично кристаллических соединений.
Поэтому другим объектом настоящего изобретения является разработка способа, с помощью которого соединение формулы (IX) и их соли, в частности соединения формулы (IX), где оба Y1 и Y2 обозначают F, получают в виде по меньшей мере частично кристаллического соединения.
Другим объектом настоящего изобретения является получение соединения формулы (IX) и их соли, в частности соединения формулы (IX), где оба Y1 и Y2 обозначают F, в виде по меньшей мере частично кристаллического соединения.
Краткое изложение сущности изобретения
Поэтому настоящее изобретение относится к способу получения хирального соединения формулы (IX)
или его соли, где Y1 и Y2 независимо обозначают F или Cl, предпочтительно F, который включает:
(1.1) реакцию соединения формулы (I)
в которой L обозначает отщепляющуюся группу, предпочтительно галоген, более предпочтительно Cl, в растворителе с нуклеофильным соединением, содержащим нуклеофильный остаток RaRbRcSi-CH2, где Ra, Rb, и Rc являются одинаковыми или разными и выбраны из группы, включающей необязательно подходящим образом замещенные алкильные и арильные остатки, с получением реакционной смеси, содержащей в качестве промежуточного продукта бета-гидроксисилан формулы
(1.2) обработку полученной реакционной смеси, предпочтительно без замены растворителя, реагентом промотирующим реакцию элиминирования, с получением реакционной смеси, содержащей соединение формулы (II)
.
В особенно предпочтительном варианте осуществления настоящее изобретение относится к способу, описанному выше, в котором получают соединение формулы (IX) или его соль
которое содержит цис-изомер формулы (VII) или его соль
в виде смеси с его транс-изомеров формулы (VIII) или его солью
,
где предпочтительно от 80 до 95%, более предпочтительно от 85 до 95% молекул соединения формулы (IX) или его соли содержатся в виде цис-изомера формулы (VII) или его соли и предпочтительно от 20 до 5%, более предпочтительно от 15 до 5% молекул соединения формулы (IX) или его соли содержатся в виде транс-изомера формулы (VIII) или его соли.
Кроме того, настоящее изобретение относится к способу, в котором соединение (IX) и тем самым также соединение (VII), кристаллизуют из растворителя необязательно путем добавления подходящего антирастворителя, где растворителем предпочтительно является полярный не смешивающийся с водой растворитель, предпочтительно сложный эфир, такой как этилацетат или изопропилацетат, простой эфир, такой как тетрагидрофуран или метилтетрагидрофуран, кетон, такой как метилизобутилкетон, галогенированный растворитель, такой как дихлорметан, толуол или смесь двух или более этих растворителей, более предпочтительно сложный или простой эфир, более предпочтительно простой эфир, и еще более предпочтительно метилтетрагидрофуран, и где антирастворителем предпочтительно является насыщенный или ненасыщенный углеводород, такой как циклогексан, гексан или гептан или смесь двух или более из них.
Кроме того, настоящее изобретение относится к кристаллическому хиральному соединению формулы (IX) или его соли
где Y1 и Y2 независимо обозначают F или Cl, предпочтительно F, и где от 80 до 95%, предпочтительно от 85 до 95% молекул указанного кристаллического соединения или его соли содержатся в виде цис-изомера формулы (VII) или его соли
и от 20 до 5%, предпочтительно от 15 до 5% молекул указанного кристаллического соединения или его соли содержатся в виде транс-изомера формулы (VIII) или его соли
.
Кроме того, настоящее изобретение относится к применению соединения формулы (IX) или его соли, в частности предпочтительно по меньшей мере частично кристаллического, предпочтительно кристаллического соединения формулы (IX) или его соли, для получения фунгицидного средства, предпочтительно позаконазола:
Перечень чертежей
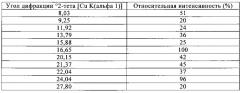
На фиг.1 приведена порошковая рентгенограмма (XRD) соединения формулы (IXa), полученного в примере 1. Отношение цис:транс, т.е. отношение соединение формулы (VIIa): соединение формулы (VIIIa) составляет 9:1.
На фиг.2 приведена XRD соли с HCl соединения формулы (IXa), полученной в примере 2(a). Отношение цис:транс, т.е. отношение соль с HCl соединения формулы (VIIa): соль с HCl соединения формулы (VIIIa) составляет 9:1.
На фиг.3 приведена XRD соли фумаровой кислоты соединения формулы (IXa), полученной в примере 2(b). Отношение цис:транс приведено в таблице, представленной в примере 2(b).
На фиг.4 приведена XRD соли щавелевой кислоты соединения формулы (IXa), полученной в примере 2(b). Отношение цис:транс приведено в таблице, представленной в примере 2(b).
На фиг.5 приведена XRD соли винной кислоты соединения формулы (IXa), полученной в примере 2(b). Отношение цис:транс приведено в таблице, представленной в примере 2(b).
На фиг.1-5 приведены интенсивности, измеренные в импульсах в секунду (линейная шкала), указанные по оси y, а положения, выраженные в значениях 2-тета в градусах, указаны по оси x.
Подробное описание изобретения
Согласно настоящему изобретению, соединение формулы (II), в частности реакционную смесь, содержащую соединение формулы (II), получают способом, который включает:
(1.1) реакцию соединения формулы (I)
в которой L обозначает отщепляющуюся группу, предпочтительно галоген, более предпочтительно Cl, в растворителе с нуклеофильным соединением, содержащим нуклеофильный остаток RaRbRcSi-CH2, где Ra, Rb, и Rc являются одинаковыми или разными и выбраны из группы, включающей необязательно подходящим образом замещенные алкильные и арильные остатки, с получением реакционной смеси, содержащей в качестве промежуточного продукта бета-гидроксисилан формулы
(1.2) обработку полученной реакционной смеси, предпочтительно без замены растворителя, реагентом промотирующим реакцию элиминирования, с получением реакционной смеси, содержащей соединение формулы (II)
Стадии (1.1) и (1.2)
На стадии (1.1) способа, предлагаемого в настоящем изобретении, соединение формулы (I) содержит остатки Y1 и Y2. Согласно настоящему изобретению, Y1 и Y2 независимо обозначают F или Cl. Таким образом, Y1 может обозначать F или С1 и независимо от химической природы Y1, Y2 может обозначать F или Cl. Предпочтительно, если оба Y1 и Y2 обозначают F или Cl. Более предпочтительно, если оба Y1 и Y2 обозначают F.
Термин "отщепляющаяся группа L" при использовании на стадии (1.1) настоящего изобретения, означает любые химические фрагменты L, которые при подходящих условиях проведения реакции, отщепляются от соединения (I) с парой электронов путем гетеролитического расщепления связи. Для этой цели соединение (I), использующееся в настоящем изобретении, может содержать любую отщепляющуюся группу L. Предпочтительно, если отщепляющаяся группа L после отщепления является нейтральным или анионным фрагментом, более предпочтительно анионным фрагментом. Еще более предпочтительно, если L обозначает галоген, такой как, например Cl, Br, I. В еще более предпочтительном варианте осуществления настоящего изобретения L обозначает Cl.
Нуклеофильное соединение, с которым соединение (I) взаимодействует на стадии (1.1), содержит нуклеофильный остаток RaRbRcSi-CH2. На химическую природу этого остатка не налагают специальных ограничений при условии, что получают промежуточный бета-гидроксисилан формулы
.
Термин "промежуточный продукт" при использовании в настоящем изобретении обычно означает бета-гидроксисилан, который содержится в реакционной смеси, полученной на стадии (1.1) и который образуется из реагентов стадии (1.1) и дополнительно реагирует на стадии (1.2). Термин "промежуточный продукт" при использовании здесь не исключает такие бета-гидроксисиланы, которые можно выделить из реакционной смеси, полученной на стадии (1.1)
Нуклеофильным соединением, использующимся на стадии (1.1), может быть любое подходящее соединение, содержащее нуклеофильный остаток RaRbRcSi-CH2, который при реакции с соединением (I) прямо или косвенно приводит к образованию промежуточного бета-гидроксисилана, обсужденного выше. Ra, Rb и Rc, содержащиеся в нуклеофильном соединении, являются одинаковыми или разными и выбраны из группы, включающей необязательно подходящим образом замещенные алкильные и арильные остатки. Термин "необязательно подходящим образом замещенный арильный остаток" при использовании в настоящем изобретении означает арильные остатки, которые содержат, например, до 6 или до 12 атомов углерода. Если такой арильный остаток представляет собой замещенный арильный остаток, количество атомов углерода означает количество атомов углерода в соответствующем незамещенном арильном остатке. Термин "необязательно подходящим образом замещенный алкильный остаток" при использовании в настоящем изобретении означает алкильные остатки, которые содержат, например, от 1 до 20, предпочтительно от 1 до 10 атомов углерода. Если такой алкильный остаток представляет собой замещенный алкильный остаток, то количество атомов углерода означает количество атомов углерода в соответствующем незамещенном алкильном остатке.
В предпочтительном варианте осуществления настоящего изобретения Ra, Rb и Rc, содержащиеся в нуклеофильном соединении, являются одинаковыми или разными и выбраны из группы, включающей алкильные остатки, более предпочтительно незамещенные алкильные остатки, содержащие от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутил, более предпочтительно 1 или 2 атома углерода, метил или этил, где предпочтительно Ra, Rb и Rc обозначают метил.
Предпочтительно, если нуклеофильным соединением, использующимся на стадии (1.1) является реагент Гриньяра. Термин "реагент Гриньяра" при использовании здесь означает любой подходящий нуклеофильный металлоорганический реагент, содержащий нуклеофильный остаток RaRbRcSi-СН2. Предпочтительно, если нуклеофильное соединение представляет собой соединение Гриньяра RaRbRcSi-CH2MgX, где X обозначает подходящий анион, который предпочтительно выбран из группы, включающей Cl, Br и I. Более предпочтительно, если соединением Гриньяра является соединение RaRbRcSi-CH2MgCl.
В качестве растворителя, который используется на стадии (1.1), можно использовать любой растворитель или смесь растворителей, предпочтительно растворитель или смесь растворителей, в котором можно провести реакцию Гриньяра. Приемлемыми растворителями являются, например, простые эфиры, такие как общеизвестные диэтиловый эфир и/или тетрагидрофуран (THF). Однако согласно изобретению неожиданно было установлено, что растворители, рассмотренные в предшествующем уровне техники для олефинирования по Петерсону, а именно диэтиловый эфир и THF, можно заменить на метил-трет-бутиловый эфир (МТВЕ). Этот растворитель обеспечивает значительное преимущество, поскольку по сравнению с соединениями, такими как диэтиловый эфир и THF, не образует пероксиды. Таким образом, применение МТВЕ является особенно подходящим в промышленных способах, для которых вопросы безопасности являются первостепенными по значению. Поэтому в особенно предпочтительном варианте осуществления растворитель, использующийся на стадии (1.1), является МТВЕ.
Поэтому в предпочтительном варианте осуществления настоящее изобретение относится к способу, определенному выше, в котором на стадии (1.1), соединением формулы (I) является соединение (Ia)
которое взаимодействует в MTBE в качестве растворителя с нуклеофильным соединением (H3C)3Si-CH2MgCl с получением реакционной смеси, содержащей в качестве промежуточного продукта бета-гидроксисилан формулы:
На температуру, при которой проводят реакцию на стадии (1.1), не налагают специальных ограничений при условии, что получают реакционную смесь, которая обеспечивает протекание реакции на стадии (1.2). Предпочтительно, если реакцию на стадии (1.1) проводят при температуре в диапазоне от -50 до +20°C, более предпочтительно от -40 до +15°C, более предпочтительно от -30 до +10°C, более предпочтительно от -20 до +10°C, более предпочтительно от -15 до +5°C, например при температуре в диапазоне от -15 до -10°C или от -10 до -5°C или от -5 до 0°C или от 0 до +5°C.
В качестве общей методики проведения олефинирования по Петерсону в литературе описан двухстадийный способ, в котором после проведения реакции Гриньяра проводят замену растворителя. Дается ссылка на публикацию Tetrahedron Letters 32 (1991), pp.7545-7548. Согласно изобретению неожиданно было установлено, что после стадии (1.1) настоящего изобретения не требуется замена растворителя и что промежуточный продукт, полученный на стадии (1.1), можно обработать подходящим реагентом, который промотирует реакцию элиминирования с помощью значительного упрощенного способа.
Поэтому согласно настоящему изобретению, реакционную смесь, полученную на стадии (1.1), обрабатывают на стадии (1.2), предпочтительно без замены растворителя, реагентом промотирующим реакцию элиминирования, с получением реакционной смеси, содержащей соединение формулы (II)
.
Поскольку по литературным данным вторая стадия олефинирования по Петерсону включает использование BF3∗Et2O (эфират трифторида бора), другим главным преимуществом настоящего изобретения является то, что на этой стадии реакции полностью исключено использование потенциально опасных химикатов, таких как эфират BF3. Как отмечено выше, осуществление способа, предлагаемого в настоящем изобретении, без замены растворителя после стадии (1.1) особенно предпочтительно, если в качестве растворителя на стадии (1.1) используют MTBE.
На температуру, при которой проводят реакцию на стадии (1.2), не налагают специальных ограничений при условии, что получают реакционную смесь, содержащую соединение формулы (II). Предпочтительно, если обработку на стадии (1.2) проводят при температуре в диапазоне от -20 до +70°C. Предпочтительные диапазоны температуры составляют, например, от -20 до -10°C или от -10 до 0°C, или от 0 до +10°C, или от +10 до +20°C, или от +20 до +30°C, или от +30 до +40°C, или от +40 до +50°C, или от +50 до +60°C, или от +60 до +70°C.
На реагент, промотирующий реакцию элиминирования, использующийся на стадии (12), не налагают специальных ограничений при условии, что получают соединение формулы (II), предпочтительно без замены растворителя после стадии (1.1). Предпочтительным реагентом является кислота или смесь двух или более кислот. Более предпочтительным реагентом является неорганическая кислота или смесь двух или более неорганических кислот. Особенно предпочтительным является использование серной кислоты. Предпочтительно, если в качестве реагента используют серную кислоту, температура, при которой проводят стадию (1.2), находится в диапазоне от +40 до +50°C.
Поэтому в предпочтительном варианте осуществления настоящее изобретение относится к способу, определенному выше, в котором на стадии (1.2), реакционную смесь, полученную на стадии (1.1), без замены растворителя обрабатывают серной кислотой, промотирующей реакцию элиминирования, с получением реакционной смеси, содержащей, в качестве соединения формулы (II) соединение (IIa):
Таким образом, в еще более предпочтительном варианте осуществления настоящее изобретение относится к способу, определенному выше, который включает:
(1.1) реакцию соединения формулы (Ia)
с (H3C)3Si-CH2MgCl в MTBE в качестве растворителя с получением реакционной смеси, содержащей в качестве промежуточного продукта бета-гидроксисилан формулы
(1.2) обработку полученной реакционной смеси без замены растворителя МТВЕ серной кислотой, промотирующей реакцию элиминирования, с получением реакционной смеси, содержащей соединение формулы (IIa)
.
В еще более предпочтительном варианте осуществления настоящее изобретение относится к способу, определенному выше, который включает
(1.1) реакцию соединения формулы (Ia)
с (H3C)3Si-CH2MgCl в MTBE в качестве растворителя при температуре в диапазоне от -15 до +5°C с получением реакционной смеси, содержащей в качестве промежуточного продукта бета-гидроксисилан формулы
(1.2) обработку полученной реакционной смеси без замены растворителя MTBE при температуре в диапазоне от +40 до +50°C серной кислотой, промотирующей реакцию элиминирования, с получением реакционной смеси, содержащей соединение формулы (IIa)
.
Из соединения, содержащегося в реакционной смеси, полученной на стадии (1.2), обсужденного выше, получают соединение формулы (IX). На конкретные последовательности стадий реакции, приводящей от соединения формулы (II) к соединению формулы (IX), не налагают специальных ограничений. При использовании предпочтительной последовательности стадий реакции способ, предлагаемый в настоящем изобретении, определенный выше, дополнительно включает
(2) реакцию соединения формулы (II) со сложным эфиром малоновой кислоты R1OOC-CH2-COOR2 с получением соединения формулы (III)
,
в которой R1 и R2 независимо обозначают необязательно подходящим образом замещенную алкильную группу, содержащую от 1 до 5 атомов углерода;
(3) восстановление соединения формулы (III) с получением соединения формулы (IV)
;
(4) ацилирование соединения формулы (IV) изомасляным ангидридом с получением соединения формулы (V)
;
(5) реакцию соединения формулы (V) с галогеном Hal2, выбранным из группы, включающей Cl2, Br2 и I2, предпочтительно I2, в присутствии основания в растворителе с получением соединения формулы (X)
;
(6.1) нагревание соединения формулы (X), предпочтительно при отсутствии DMPU (1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинон) в растворителе предпочтительно DMSO (диметилсульфоксид), с солью щелочного металла 1,2,4-триазола, предпочтительно натриевой солью, и обработку полученной реакционной смеси основанием с получением соединения формулы (IX)
;
(6.2) выделение соединения формулы (IX) из реакционной смеси, полученной на стадии (6.1), путем экстракции подходящим растворителем.
Стадия (2)
На стадии (2) настоящего изобретения соединение формулы (II) предпочтительно вводят в реакцию со сложным эфиром малоновой кислоты R1OOC-CH2-COOR2, в котором R1 и R2 независимо обозначают необязательно подходящим образом замещенную алкильную группу, содержащую от 1 до 5 атомов углерода. Количество атомов углерода означает количество атомов углерода в незамещенном алкильном остатке. Предпочтительные алкильные группы R1 и R2 содержат от 1 до 4 атомов углерода, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутил. Еще более предпочтительные алкильные группы R1 и R2 содержат 1 или 2 атома углерода, такие как метил или этил, и этил является особенно предпочтительным. Еще более предпочтительные алкильные группы R1 и R2 представляют собой незамещенные алкильные группы.
На стадии (2) еще более предпочтительно вводить сложный эфир малоновой кислоты R1OOC-CH2-COOR2 в реакцию с соединением (II) в присутствии подходящего сильного основания, предпочтительно сильного основания щелочного металла, обеспечивающего реакцию соответствующего аниона CH(COOR1)(COOR2), полученного из сложного эфира малоновой кислоты R1OOC-CH2-COOR2. В качестве щелочного металла предпочтительным является натрий. Подходящими основаниями являются, например, NaH или NaOH и NaOH является предпочтительным. NaOH можно использовать в любом подходящем виде. В предпочтительном варианте осуществления NaOH используют в виде твердого вещества, такого как, например, чешуйки NaOH. Растворитель, в котором проводят стадию (2), можно выбрать, например, в соответствии с конкретной химической природой сильного основания, обсужденного выше. Приемлемыми растворителями являются, например THF, DMSO и т.п. Согласно настоящему изобретению, DMSO является предпочтительным. Температуры, при которых проводят реакцию на стадии (2), можно выбрать в соответствии с растворителем и основанием. Предпочтительные температуры находятся в диапазоне от 0 до 35°C, более предпочтительно от 25 до 30°C.
Продукт реакции на стадии (2), соединение формулы (III)
,
предпочтительно подходящим образом выделять из реакционной смеси, полученной на стадии (2). В предпочтительном варианте осуществления это выделение включает стадию, на которой соединение (III) выделяют путем экстракции в подходящем растворителе. Согласно настоящему изобретению, из подходящих растворителей предпочтительным является циклогексан.
Органический слой, полученный в результате экстракции, можно промыть в одну или большее количество стадий. В качестве реагентов для промывки следует отметить воду и водные растворы щелочей, такие как, например, водные растворы оснований щелочных металлов, таких как гидроксид щелочного металла, предпочтительно гидроксид натрия.
Стадия (3)
В другом предпочтительном варианте осуществления настоящего изобретения соединение формулы (III), полученное на стадии (2), предпочтительно восстанавливают и из него получают соединение формулы (IV):
Восстановление на стадии (3) можно провести по любой подходящей методике с использованием любого подходящего восстановительного реагента. Согласно настоящему изобретению, использование гидридного восстановительного реагента является предпочтительным. Такими гидридными восстановительными реагентами является, например, борогидрид натрия (NaBH4), борогидрид лития (LiBH4), алюмогидрид лития (LiAlH4), диизобутилалюминийгидрид (ДИБАЛ) или триэтилборогидрид лития (LiEt3BH). В предпочтительном варианте осуществления настоящего изобретения на стадии (3) в качестве восстановительного реагента используют LiBH4.
В соответствии с предшествующим уровнем техники необходимо использовать не менее 3 мол. экв. LiBH4 в пересчете на соединение формулы (III) (см. WO 94/25452, стр.31, раздел "Получение 5"). Однако в отличие от данных предшествующего уровня техники, согласно изобретению неожиданно было установлено, что восстановительный реагент LiBH4 можно использовать в гораздо меньшем избытке в пересчете на сложный эфир малоновой кислоты (III). В улучшенном способе, предлагаемом в настоящем изобретении, используют не более 2 мол. экв. LiBH4 в пересчете на соединение формулы (III), что означает, что в отличие от предшествующего уровня техники можно сэкономить не менее 33% восстановительного реагента. Таким образом, в особенности для проводимого в промышленном масштабе способа, настоящее изобретение обеспечивает экономические и экологические преимущества. Таким образом, настоящее изобретение относится к способу, определенному выше, в котором LiBH4 используют в качестве восстановительного реагента и его предпочтительно используют в количестве, составляющем не более 2 мол. экв. в пересчете на соединение (III).
На растворитель, в котором проводят реакцию на стадии (3), не налагают специальных ограничений при условии, что получают соединение формулы (IV). Предпочтительные растворители выбраны из группы, включающей воду, спирт и смесь воды и по меньшей мере одного спирта. Предпочтительными спиртами являются метанол, этанол и изопропанол. Поэтому растворитель предпочтительно выбран из группы, включающей воду, метанол, этанол, изопропанол и смесь воды и по меньшей мере одного из этих спиртов, более предпочтительно из группы, включающей воду, этанол, изопропанол и смесь воды и по меньшей мере одного из этих спиртов, более предпочтительно из группы, включающей воду, изопропанол и смесь воды и изопропанола.
Согласно изобретению неожиданно было установлено, что в частности для наиболее предпочтительного восстановительного реагента, использующегося на стадии (3), LiBH4, смесь воды и изопропанола является наиболее подходящим растворителем. В отличие от известного факта, заключающегося в том, что вода разлагает гидридный восстановительный реагент, установлено, что присутствие воды благоприятно для стадии (3) способа, предлагаемого в настоящем изобретении. Если не ограничиваться какой-либо теорией, то можно полагать, что это может быть обусловлено тем, что некоторое количество воды повышает растворимость реагента LiBH4 и/или его предшественников NaBH4 и LiCl, и тем самым повышает скорость реакции и, таким образом, в свою очередь, с избытком компенсирует разложение восстановительного реагента. Поэтому в других предпочтительных вариантах осуществления растворитель, использующийся на стадии (3), содержит воду, причем растворитель предпочтительно содержит от 1 до 20 об.%, более предпочтительно от 5 до 15 об.% воды.
Температуры, при которых проводят реакцию на стадии (3), можно выбрать в соответствии с растворителем и восстановительным реагентом. Предпочтительные температуры находятся в диапазоне от 0 до 40°C, более предпочтительно от 20 до 35°C, более предпочтительно от 25 до 30°C.
Продукт восстановления на стадии (3), соединение формулы (IV), предпочтительно надлежащим образом выделяют из реакционной смеси, полученной на стадии (3). В предпочтительном варианте осуществления это выделение включает стадию, на которой соединение (IV) выделяют путем экстракции подходящим растворителем. Согласно настоящему изобретению, из подходящих растворителей толуол является предпочтительным.
Стадия (4)
На стадии (4) настоящего изобретения соединение формулы (IV) предпочтительно ацилируют изомасляным ангидридом с получением соединения формулы (V)
.
Более предпочтительно, если ацилирование на стадии (4) проводят в присутствии подходящего фермента, предпочтительно фермента Novo SP 435 в подходящем растворителе, предпочтительно ацетонитриле или толуоле, более предпочтительно толуоле, например по методике, аналогичной описанной в WO 97/22710. Выбор толуола в качестве растворителя также благоприятен для экстракционной обработки, поскольку не требуется дополнительный растворитель. При использовании ацетонитрила в качестве растворителя для экстракционной обработки требуется использование дополнительного несмешивающегося растворителя.
Температуры, при которых проводят ацилирование на стадии (4), можно выбрать в соответствии с растворителем, ацилирующим реагентом и ферментом. Предпочтительные температуры находятся в диапазоне от -20 до -5°C, более предпочтительно от -15 до -10°C, более предпочтительно от 25 до 30°C.
Полученную реакционную смесь предпочтительно дополнительно обрабатывают подходящим основанием, таким как, например, гидрокарбонат натрия.
В особенно предпочтительном варианте осуществления настоящего изобретения соединение формулы (V) предпочтительно кристаллизуют из реакционной смеси. Поэтому настоящее изобретение также относится к способу, описанному выше, в котором после стадии (4) и до стадии (5), соединение формулы (V) по меньшей мере частично кристаллизуют. Кристаллизацию можно провести по любой возможной методике. В предпочтительном варианте осуществления соединение формулы (V) кристаллизуют из н-гептана.
Стадия (5)
На стадии (5) настоящего изобретения соединение формулы (V) предпочтительно вводят в реакцию с галогеном Hal2, выбранным из группы, включающей Cl2, Br2 и I2, предпочтительно I2, в присутствии основания в растворителе с получением соединения формулы (VI)
.
Обычно можно провести реакцию на стадии (5) в присутствии основания, такого как пиридин, и в подходящем растворителе, таком как ацетонитрил, THF, EtOAc (этилацетат) или CH2Cl2 (дихлорметан, ДХМ) при температуре в диапазоне от -20 до +30°C (см. WO 94/25452 A1, стр.16 и 35). Однако согласно изобретению было установлено, что реакцию предпочтительно проводить в этилацетате в качестве растворителя, причем в качестве основания используют гидрокарбонат натрия. Таким образом, настоящее изобретение относится к способу, в котором можно заменить не