Способ получения комплекса включения дисульфирама с циклодекстрином
Иллюстрации
Показать всеИзобретение относится к области фармацевтической промышленности и касается способа получения комплекса включения дисульфирама (ДСФ) с незамещенным или замещенным циклодекстрином, для осуществления которого незамещенный циклодекстрин (нЦД) или замещенный циклодекстрин, выбранный из группы, состоящей из метилциклодекстрина (МЦД), диметилциклодекстрина (ДМЦД), триметилциклодекстрина (ТМЦД) и гидроксипропилциклодекстрина (ГПЦД), взятый в твердом виде или растворенный в воде или спирте, при перемешивании и температуре от 20 до 70°C объединяют с дисульфирамом (ДСФ) в виде твердого вещества, расплава или спиртового раствора, где спирт выбран из метанола, этанола, н-пропанола или изо-пропанола, мольное соотношении ГПβЦД и ДСФ составляет от 2,01:1 до 2,40:1, полученную смесь охлаждают до 0-25°C, подвергают фильтрации и лиофилизируют или испаряют растворитель. Техническим результатом является способ получения водорастворимого комплекса включения дисульфирама с циклодекстрином - активного вещества глазных капель, который может быть выделен со степенью чистоты, удовлетворяющей требованиям Государственной Фармакопеи РФ. 6 з.п. ф-лы, 5 пр., 6 ил., 2 табл.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области фармацевтической промышленности и касается способа получения комплекса включения дисульфирама с незамещенным или замещенным циклодекстрином, а также установки для осуществления предлагаемого способа. Способ позволяет получать комплекс, который может быть выделен в виде лекарственной субстанции для изготовления фармацевтической композиции.
Сведения о предшествующем уровне техники
Катаракта является одним из распространенных глазных заболеваний. По статистике, в Российской Федерации ей страдают около 10 миллионов человек. Эффективным препаратом для лечения катаракты является дисульфирам (ДСФ). Он значительно снижает действие гидроксильных радикалов и ингибирует перекисное окисление липидов [Noriaki Nagai, Yoshimasa Ito and Noriko Takeuchi «Correlation between Hyper-Sensitivity to Hydrogen Peroxide and Low Defense against Ca2+ Influx in Cataractogenic Lens of Ihara Cataract Rats» Biol. Pharm. Bull. 34(7) 1005-1010 (2011)]. К сожалению, возможность использования ДСФ в офтальмологии ограничена из-за его низкой растворимости в воде. С целью повышения растворимости ДСФ предложено использовать циклодекстрины (ЦД), которые увеличивают растворимость в воде за счет образования комплексов включения по типу «хозяин-гость». Таким образом, синтез комплексов включения подобного типа представляет собой актуальную задачу для терапии катаракты.
В статье Noriaki Nagai, Maki Takeda, Yoshimasa Ito, Noriko Takeuchi and Akira Kamei «Delay in ICR/f Rat Lens Opacification by the Instillation of Eye Drops Containing Disulfiram and Hydroxypropyl-β-cyclodextrin Inclusion Complex» (Biol. Pharm. Bull. 30(8) 1529-1534 (2007)) раскрыт состав и описан способ приготовления глазных капель, которые задерживают помутнение роговицы глаза и уменьшают его выраженность на крысиной модели катаракты. Капли содержат 0,25 или 0,5% дисульфирама, 3 или 5% гидроксипропил-β-циклодекстрина и 0,1% гидроксипропилметилцеллюлозы. Для приготовления капель гидроксипропил-β-циклодекстрин добавляют в солевой раствор, содержащий 0,005% хлорида бензалкония и дисульфирам, после чего в полученный раствор добавляют гидроксипропилметилцеллюлозу, перемешивают 24 часа в темноте при комнатной температуре и фильтруют через фильтр с размером пор 0,20 мкм.
В статье Noriaki Nagai, Yoshimasa Ito and Noriko Takeuchi «Pharmacokinetic and Pharmacodynamic Evaluation of the Anti-cataract Effect of Eye Drops Containing Disulfiram and Low-Substituted Methylcellulose Using ICR/f Rats as a Hereditary Cataract Model» (Biol. Pharm. Bull. 35(2) 239-245 (2012)) описан подобный состав, дополнительно содержащий низкозамещенную метилцеллюлозу, которую при изготовлении капель добавляют последний в виде раствора в стерильном физрастворе. Готовые капли содержат 0,5% дисульфирама, 5% гидроксипропил-β-циклодекстрина, 0,1% гидроксипропилметилцеллюлозы и 2% метилцеллюлозы.
В обеих статьях описано приготовление готовой лекарственной формы, композицию которой, в случае необходимости, будет невозможно изменить. Кроме того, присутствие в ней дисульфирама в виде комплекса включения с гидроксипропилциклодекстрином не обсуждается и не предполагается. Поэтому технической задачей изобретения является разработка способа, позволяющего получать водорастворимый комплекс включения дисульфирама в виде индивидуального соединения, которое может быть очищено до степени чистоты, удовлетворяющей требованиям фармакопеи, что позволит готовить глазные капли различного состава общепринятыми в данной области способами.
Краткое описание фигур
На фигуре 1 представлены порошковые рентгеновские дифрактограммы чистого ДСФ (кривая 1), чистого ГПβЦД (кривая 2), физической смеси ДСФ и ГПβЦД (кривая 3) и комплекса включения ДСФ с ГПβЦД (кривая 4).
На фигуре 2 представлены кривые дифференциальной сканирующей калориметрии для чистого ДСФ (1), физической смеси ДСФ и ГПβЦД (2) и комплекса включения ДСФ с ГПβЦД (3).
На фигуре 3 представлен спектр 13С ЯМР комплекса включения ДСФ с ГПβЦД.
На фигуре 4 приведено условное обозначение атомов углерода в молекулах ГПβЦД и ДСФ.
На фигуре 5 показана предполагаемая структура комплекса включения ДСФ с ГПβЦД.
На фигуре 6 изображена принципиальная схема установки для осуществления предлагаемого способа в лабораторном масштабе.
Сущность изобретения
В результате проведенных исследований авторы установили, что поставленная техническая задача может быть решена способом получения водорастворимого комплекса включения дисульфирама (ДСФ) с циклодекстрином (ЦД), для осуществления которого незамещенный циклодекстрин (нЦД) или замещенный циклодекстрин, выбранный из группы, состоящей из метилциклодекстрина (МЦД), диметилциклодекстрина (ДМЦЦ), триметилциклодекстрина (ТМЦЦ) и гидроксипропилциклодекстрина (ГПЦД), взятый в твердом виде или растворенный в воде или спирте, при перемешивании и температуре от 20 до 70°C объединяют с дисульфирамом (ДСФ) в виде твердого вещества, расплава или спиртового раствора, где спирт выбран из метанола, этанола, н-пропанола или изо-пропанола, мольное соотношении ЦД и ДСФ составляет от 2,01:1 до 2,40:1, полученную смесь охлаждают до 0-25°C, подвергают фильтрации и лиофилизируют или испаряют растворитель.
Техническим результатом является водорастворимый комплекс включения дисульфирама с циклодекстрином - активного вещества глазных капель, который может быть выделен со степенью чистоты, удовлетворяющей требованиям Государственной Фармакопеи РФ.
В контексте данного описания термин «циклодекстрин» включает любой из известных изомеров: α-циклодекстрин, β-циклодекстрин и γ-циклодекстрин.
Аналогично, каждый из терминов «метилциклодекстрин», «диметилциклодекстрин», «триметилциклодекстрин» и «гидроксипропилциклодекстрин» включает любой из известных изомеров. Например, термин «гидроксипропилциклодекстрин» относится к гидроксипропил-α-циклодекстрину, гидроксипропил-β-циклодекстрину и гидроксипропил-γ-циклодекстрину, среди которых гидроксипропил-β-циклодекстрин (ГПβЦД) является наиболее предпочтительным.
Для осуществления способа предпочтительна степень замещения циклодекстрина в пределах от 0,1 до 0,9; наиболее предпочтительна степень замещения, равная 0,6.
Получение комплекса можно осуществлять различными вариантами способа. В одном варианте способа замещенный циклодекстрин является гидроксипропил-β-циклодекстрином (ГПβЦД) и равные массы 30 масс. % водного раствора ГПβЦД и 3 масс. % спиртового раствора ДСФ объединяют при температуре 65°C, перемешивают 12 часов, охлаждают до 20-25°C, подвергают стерилизующей фильтрации и сушат лиофильно.
В другом варианте способа замещенный циклодекстрин является гидроксипропил-β-циклодекстрином (ГПβЦД) и 30 масс. % водный раствор ГПβЦД и расплав ДСФ, взятые так, что мольное соотношение ГПβЦД и ДСФ равно 2,10:1, объединяют при температуре 65°C, перемешивают 12 часов, охлаждают до 20-25°C, подвергают стерилизующей фильтрации и сушат лиофильно.
В следующем варианте способа замещенный циклодекстрин является гидроксипропил-β-циклодекстрином (ГПβЦД) и 30 масс. % водный раствор ГПβЦД и твердый ДСФ, взятые так, что мольное соотношение ГПβЦД и ДСФ равно 2,10:1, объединяют при температуре 20-65°C, перемешивают 24 часа, при необходимости охлаждают до 20-25°C, подвергают стерилизующей фильтрации и сушат лиофильно.
Еще в одном варианте способа замещенный циклодекстрин является гидроксипропил-β-циклодекстрином (ГПβЦД) и 30 масс. % спиртовой раствор ГПβЦД и твердый ДСФ, взятые так, что мольное соотношение ГПβЦД и ДСФ равно 2,10:1, объединяют при температуре 65°C, перемешивают 0,5 часа, охлаждают до 20-25°C, подвергают стерилизующей фильтрации и испаряют растворитель.
В предпочтительном варианте способа замещенный циклодекстрин является гидроксипропил-β-циклодекстрином (ГПβЦД) и твердые ГПβЦД и ДСФ, взятые так, что мольное соотношение ГПβЦД и ДСФ равно 2,10:1, объединяют в спирте, нагревают и перемешивают при 65°C 0,5 часа, охлаждают до 20-25°C, подвергают стерилизующей фильтрации и испаряют растворитель.
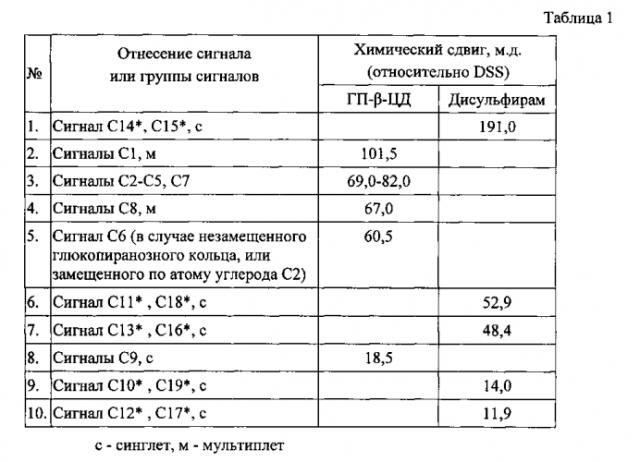
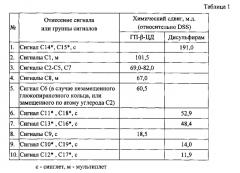
В результате осуществления предлагаемого способа авторам изобретения удалось выделить комплекс включения ДСФ с ГПβЦД стехиометрического состава 1:2 типа «хозяин-гость», у которого в спектре 13С ЯМР присутствуют сигналы при 12,0, 14,0, 18,5, 48,4, 52,9, 60,5, 66,7, 67,0, 72,1, 72,5, 73,6, 77,4, 78,8, 81,4, 100,3, 101,5, 102,5, 191,0 м.д., а методом дифференциальной сканирующей калориметрии определяется температурная депрессия в области 220-235°C с минимумом при 221°C и плечом при 231°C.
Среднему специалисту в области химии известно, что процесс образования комплексов в жидкой среде является равновесным. Поэтому для получения комплекса включения ДСФ с ЦД стехиометрического состава 1:2 необходим небольшой избыток ГПβЦД, например от 2,01 моль ЦД/моль ДСФ до 2,40 моль ЦД/моль ДСФ. Применяемые в соответствии с изобретением 30 масс. % раствор ГПβЦД и 3 масс. % раствор ДСФ, взятые в массовом соотношении 1:1, или соответствующие навески компонентов обеспечивают мольное соотношение ДСФ и ГПβЦД, равное 1:2,10, т.е. избыток в 10 мол. % ГПβЦД. Авторы установили, что при избытке ДСФ также образуется комплекс включения состава 1:2, а из реакционной массы при охлаждении самопроизвольно выделяется ДСФ, не включенный в комплекс.
Для осуществления способа в соответствии с изобретением предлагается вариант установки, которая включает смеситель 1 для смешения компонентов (ДСФ с ЦД или замещенным циклодекстрином), выходом по потоку смеси компонентов соединенный со входом реактора 2 для растворения смеси в растворителе, нагревания и перемешивания раствора для получения раствора комплекса включения, выходом по потоку раствора комплекса соединенный со входом реактора 3 для охлаждения раствора комплекса, выходом по потоку охлажденного раствора соединенный со входом фильтрующего устройства 4 для фильтрации раствора комплекса (в частности - стерилизующей фильтрации), выходом по потоку стерильного раствора комплекса соединенный со входом испарителя 5 для удаления растворителя с получением комплекса включения ДСФ в виде готового продукта.
В качестве примера на фиг. 6 изображена принципиальная схема установки для осуществления предлагаемого способа в лабораторном масштабе, включающая колбу 1, в которой твердые ГПβЦД и ДСФ объединяют в спирте. В колбе 2, снабженной обратным холодильником и помещенной на магнитную мешалку с нагревательным элементом, осуществляют получение спиртового раствора комплекса включения ДСФ. В колбе 3, помещенной в водяную баню, раствор комплекса охлаждают. На фильтрационной системе Millipore 4 охлажденный раствор подвергают стерилизующей фильтрации. На роторном испарителе 5 из стерильного раствора испаряют растворитель с получением комплекса включения ДСФ с ГПβЦД в виде субстанции для приготовления фармацевтической композиции.
Специалисту в данной области очевидны изменения, которые требуется внести в принципиальную схему установки для осуществления способа в соответствии с любым из раскрытых вариантов изобретения. Также специалисту известны принципы материальных и тепловых расчетов, которые должны быть выполнены для масштабирования предлагаемого способа, например, до полупромышленного объема производства. Недостающая или необходимая информация может быть без затруднений найдена в известных и общедоступных источниках, таких как монографии, справочники, каталоги и сайты производителей оборудования.
Факт отличия комплекса включения от чистых дисульфирама и ГПβЦД, а также от их физической смеси установлен методами порошковой рентгеновской дифракции (ПРД) и дифференциальной сканирующей калориметрии (ДСК). Методом 13С ЯМР-спектроскопии установлена стехиометрия этого комплекса.
Исследования ПРД проводили на порошковом диффрактометре X′Pert Pro MPD. Образцы были облучены при напряжении 50,0 кВ в токе 40,0 мА при скорости сканирования 2°C/мин, угол дифракции 2θ в пределах от 5° до 60.
На дифрактограммах (фиг. 1) для чистого ДСФ (кривая 1) наблюдается выраженная серия интенсивных пиков, что говорит о кристаллической структуре ДСФ, в то время как на дифрактограмме чистого ГПβЦД (2) интенсивные пики отсутствуют, демонстрируя аморфное гало, соответствующее аморфному состоянию ГПβЦД. Дифрактограмма физической смеси ДСФ и ГПβЦД (3) показывает как серию интенсивных пиков, идентифицирующих кристаллическую структуру ДСФ, так и аморфное гало, соответствующее аморфной природе ГПβЦД. Однако на дифрактограмме комплекса включения ДСФ с ГПβЦД (4) интенсивные пики, идентифицирующие кристаллическую структуру ДСФ, отсутствуют, что свидетельствует об отсутствии кристаллов ДСФ и его полном включении во внутреннюю полость ГПβЦД на молекулярном уровне.
Эксперименты ДСК проводили на дифференциальном сканирующем калориметре ДСК-500 в динамическом режиме при скорости нагрева 10°C/мин, в потоке аргона (скорость подачи газа 50 мл/мин) и диапазоне температур 50-330°C.
На кривых дифференциальной сканирующей калориметрии (фиг. 2) для чистого ДСФ (кривая 1) и физической смеси ДСФ и ГПβЦД (кривая 2) наблюдаются узкие пики температурной депресии в области 63-71°C, характеризующие процесс плавления ДСФ. На кривой 3 для комплекса включения ДСФ с ГПβЦД узкий пик в этой области не зарегистрирован. В высокотемпературной области для комплекса включения определяется температурная депрессия в области 220-235°C с минимумом при 221°C и плечом при 231°C. Для чистого ДСФ и физической смеси ДСФ и ГПβЦД характерны минимумы при 211°C и 248°C соответственно.
Исследования методом 13С ЯМР-спектроскопии проводили на спектрометре Avance Bruker DPX-300 при 313К с рабочей частотой 75 МГц на атомах углерода в режиме Inverse Gate (1000 сканирований), при котором происходит полное широкополосное подавление сигналов протонов и отсутствует ядерный эффект Оверхаузера. Для учета влияния релаксационных эффектов задавали задержку между импульсами по правилу 5T1 в 15 секунд.
Расшифровка и отнесение сигналов в спектрах ЯМР 13С комплекса включения ГПβЦД с ДСФ проведены с использованием спектральной базы данных SDBS [Спектральная база данных для органических соединений, SDBS - http://sdbs.db.aist.go.ip/] и представлены в таблице 1.
По причине обособленности сигналов, для расчетов мольного соотношения ГПβЦД к ДСФ авторы используют сигналы ядер углерода С1 метановой группы α-D-глюкопиранозного остатка ГПβЦД и метальных групп ДСФ (С10*, С19* или С12*, С17*). Условное обозначение атомов углерода в молекулах ГПβЦД и ДСФ приведено на фигуре 5. Для возможности определения мольного соотношения ГПβЦД к ДСФ в комплексе включения необходимо принять во внимание следующие факторы (1) и (2).
(1) Поскольку растворимость в воде (D2O) чистого ДСФ крайне низка (4,09 мг/л, при 25°C), а расчетное содержание ДСФ в образце для регистрации спектра составляет около 2 г/л (раствор прозрачный), можно сделать вывод, что речь идет именно о комплексе включения и содержанием не включенного в комплекс ДСФ можно пренебречь.
(2) Интегральные интенсивности сигналов ядер углерода в спектре ЯМР 13С, зарегистрированных в режиме Inverse Gate, пропорциональны их мольным соотношениям.
На основании вышеизложенного число молекул ГПβЦД, приходящихся на одну молекулу ДСФ, можно рассчитать по формуле:
,
где IC1 - интегральная интенсивность сигнала ядер углерода С1 метановой группы α-D-глюкопиранозного остатка ГПβЦД;
IC10*, С19* - интегральная интенсивность сигнала ядер углеродов С10*, С19* метальных групп ДСФ.
Значения интегральных интенсивностей сигналов ядер углерода С1 и С10*, С19* трех образцов комплекса включения ГПβЦД с ДСФ представлены в таблице 2.
Исходя из данных, представленных в таблице 2, стехиометрическое соотношение ДСФ к ГПβЦД в исследуемых образцах составляет 1:2 (с небольшим избытком свободного ГПβЦД), что позволяет предположить структуру комплекса включения, которая показана на фиг. 5.
ГПβЦД представляет собой смесь гидроксипропильных производных ЦД, средняя степень замещения которых в сумме составляет от 0,1 до 0,9, предпочтительно она составляет приблизительно 0,6. Из чего авторы предполагают, что ГПβЦД из этой смеси с высокой степенью замещения не образует комплекс включения из-за стерических затруднений и существует в свободном виде.
Не ограничиваясь конкретной теорией, авторы доказательно предполагают, что отклонение от стехиометрического соотношения ГПβЦД к ДСФ в сторону увеличения может быть связано с присутствием в исходном сырье фракций с высокой степенью замещения гидроксипропильных групп.
Принимая, что относительная погрешность определения для данного метода не превосходит 15% [Koichi Hatada, Tatsuki Kitayama. NMR Spectroscopy of Polymers. Springer Science & Business Media. 222 pages. P. 57], авторы доказательно утверждают, что в результате осуществления способа в соответствии с изобретением получен водорастворимый комплекс включения ДСФ с ГПβЦД стехиометрического состава 1:2.
Сведения, подтверждающие возможность осуществления изобретения
Далее изобретение будет проиллюстрировано следующими примерами, подтверждающими возможность его осуществления с достижением указанного в описании технического результата, а именно создания способа получения комплекса включения ДСФ с ГПβЦД стехиометрического состава 1:2, имеющего свойства, раскрытые и подтвержденные в описании.
Пример 1. Получение комплекса включения дисульфирама с циклодекстрином гомогенным способом (вариант 1)
При перемешивании со скоростью 450 об/мин и температуре 65°C к 1 масс. ч. 30 масс. % водного раствора ГПβЦД добавляют 1 масс. ч. 3 масс. % спиртового раствора ДСФ. При внесении спиртового раствора ДСФ наблюдается помутнение, которое со временем исчезает. Общее время перемешивания составляет 12 часов. После охлаждения до комнатной температуры, полученную смесь фильтруют через мембранный фильтр с размером пор 0,22 мкм и сушат лиофильно.
Пример 2. Получение комплекса включения дисульфирама с циклодекстрином гомогенным способом (вариант 2)
При перемешивании со скоростью 450 об/мин и температуре 65°C в 30 масс. % водный раствор ГПβЦД добавляют расплав ДСФ (т. пл. 71°C) в количестве, достаточном для получения конечной концентрации ДСФ в растворе 3 масс. %. Общее время перемешивания составляет 12 часов, после чего смесь охлаждают до комнатной температуры, полученную смесь фильтруют через мембранный фильтр с размером пор 0,22 мкм и сушат лиофильно.
Пример 3. Получение комплекса включения дисульфирама с циклодекстрином гетерогенным способом (вариант 1)
При перемешивании со скоростью 450 об/мин и температуре от комнатной до 65°C к 1 масс. ч. 30 масс. % водного раствора ГПβЦД порционно добавляют навеску сухого ДСФ, взятую так, чтобы его конечная концентрация в смеси составляла 3 масс. %. Общее время перемешивания составляет 24 часа и достигается полное растворение ДСФ. Полученный раствор охлаждают, если ранее он был нагрет, фильтруют через мембранный фильтр с размером пор 0,22 мкм и сушат лиофильно.
Пример 4. Получение комплекса включения дисульфирама с циклодекстрином гетерогенным способом (вариант 2)
К 30 масс. % спиртовому раствору ГПβЦД при постоянном перемешивании порционно добавляют навеску сухого ДСФ, взятую так, чтобы его конечная концентрация в смеси составляла 3 масс. %. Полученную суспензию перемешивают со скоростью 450 об/мин при температуре 65°C в течение 30 минут до полного растворения ДСФ. Смесь охлаждают до комнатной температуры в течение 30 минут, в результате из спиртового раствора комплекса выпадает незначительное количество ДСФ, не включившегося в комплекс. Полученную смесь фильтруют через мембранный фильтр с размером пор 0,22 мкм и органический растворитель выпаривают на роторном испарителе.
Пример 5. Получение комплекса включения дисульфирама с циклодекстрином гетерогенным способом (вариант 3, предпочтительный)
Навеску сухого ГПβЦД, взятую так, чтобы его конечная концентрация составляла 30 масс. %, и навеску сухого ДСФ, взятую так, чтобы его конечная концентрация составляла 3 масс. %, переносят в реактор и добавляют спирт. Полученную смесь нагревают и перемешивают со скоростью 450 об/мин при температуре 65°C в течение 30 минут до полного растворения ДСФ. Смесь охлаждают до комнатной температуры, в результате чего из спиртового раствора выпадает ДСФ, не включившийся в комплекс. Полученную смесь фильтруют через мембранный фильтр с размером пор 0,22 мкм и органический растворитель выпаривают на роторном испарителе.
Комплекс включения, полученный, как описано в любом из примеров 1-5, в соответствии с методикой ГФ XII (ОФС 42-0049-07), оценивается как «легко растворимый в воде».
1. Способ получения водорастворимого комплекса включения дисульфирама (ДСФ) с циклодекстрином (ЦД), характеризующийся тем, что для его осуществления незамещенный циклодекстрин (нЦЦ) или замещенный циклодекстрин, выбранный из группы, состоящей из метилциклодекстрина (МЦД), диметилциклодекстрина (ДМЦД), триметилциклодекстрина (ТМЦД) и гидроксипропилциклодекстрина (ГПЦД), взятый в твердом виде или растворенный в воде или спирте, при перемешивании и температуре от 20 до 70°C объединяют с дисульфирамом (ДСФ) в виде твердого вещества, расплава или спиртового раствора, где спирт выбран из метанола, этанола, н-пропанола или изо-пропанола, мольное соотношении ЦД и ДСФ составляет от 2,01:1 до 2,40:1, полученную смесь охлаждают до 0-25°C, подвергают фильтрации и лиофилизируют или испаряют растворитель.
2. Способ по п. 1, отличающийся тем, что степень замещения циклодекстрина находится в пределах от 0,1 до 0,9 и предпочтительно равна 0,6.
3. Способ по п. 1 или 2, отличающийся тем, что замещенный циклодекстрин является гидроксипропил-β-циклодекстрином (ГПРЦД) и равные массы 30 масс. % водного раствора ГПРЦД и 3 масс. % спиртового раствора ДСФ объединяют при температуре 65°C, перемешивают 12 часов, охлаждают до 20-25°C, подвергают стерилизующей фильтрации и сушат лиофильно.
4. Способ по п. 1 или 2, отличающийся тем, что замещенный циклодекстрин является гидроксипропил-β-циклодекстрином (ГПβЦД) и 30 масс. % водный раствор ГПβЦД и расплав ДСФ, взятые так, что мольное соотношение ГПРЦД и ДСФ равно 2,10:1, объединяют при температуре 65°C, перемешивают 12 часов, охлаждают до 20-25°C, подвергают стерилизующей фильтрации и сушат лиофильно.
5. Способ по п. 1 или 2, отличающийся тем, что замещенный циклодекстрин является гидроксипропил-β-циклодекстрином (ГПβЦД) и 30 масс. % водный раствор ГПβЦД и твердый ДСФ, взятые так, что мольное соотношение ГПβЦД и ДСФ равно 2,10:1, объединяют при температуре 20-65°C, перемешивают 24 часа, при необходимости охлаждают до 20-25°C, подвергают стерилизующей фильтрации и сушат лиофильно.
6. Способ по п. 1 или 2, отличающийся тем, что замещенный циклодекстрин является гидроксипропил-β-циклодекстрином (ГПβЦД) и 30 масс. % спиртовой раствор ГПβЦД и твердый ДСФ, взятые так, что мольное соотношение ГПβЦД и ДСФ равно 2,10:1, объединяют при температуре 65°C, перемешивают 0,5 часа, охлаждают до 20-25°C, подвергают стерилизующей фильтрации и испаряют растворитель.
7. Способ по п. 1 или 2, отличающийся тем, что замещенный циклодекстрин является гидроксипропил-β-циклодекстрином (ГПβЦД) и твердые ГПβЦД и ДСФ, взятые так, что мольное соотношение ГПβЦД и ДСФ равно 2,10:1, объединяют в спирте, нагревают и перемешивают при 65°C 0,5 часа, охлаждают до 20-25°C, подвергают стерилизующей фильтрации и испаряют растворитель.