Способ получения биоактивного покрытия с антибактериальным эффектом
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к способу получения биоактивного покрытия с антибактериальным эффектом, включающий электроискровую обработку поверхности токопроводящей подложки обрабатывающим электродом, состоящим из биоактивной добавки в количестве 5-40 вес.%; антибактериальной металлической добавки в количестве 0,5-5 вес.%; и биосовместимого тугоплавкого соединения в количестве остальное, при этом электроискровую обработку проводят при следующих условиях: 100 ≤ Ni ≤ 10000, 10 ≤ f ≤ 100000, 0,01 ≤ v ≤ 0,6, где Ni - мощность единичного импульсного разряда, Вт, f - частота импульсных разрядов, Гц, v - линейная скорость перемещения обрабатывающего электрода, м/мин. Изобретение обеспечивает получение на имплантатах сплошных биосовместимых, биоактивных покрытий с антибактериальным эффектом с высокой величиной адгезии (более 100 Н), высокой износостойкостью и с заданным рельефом. 3 з. п. ф-лы, 1 табл.
Реферат
Изобретение относится к поверхностной обработке металлов и их сплавов медицинского назначения и может быть использовано при изготовлении имплантатов, предназначенных для замены поврежденных участков костной ткани, к которым относятся, в частности, ортопедические и дентальные имплантаты, имплантаты для челюстно-лицевой хирургии и хирургии позвоночника, искусственные сочленения, фиксаторы и др.
Известен способ получения биосовместимого покрытия на остеофиксаторах из титана (RU 2332239, опублик. 27.08.2008).
В известном способе получение биосовместимого покрытия на остеофиксаторах из титана осуществляют путем оксидирования титана в атмосфере перегретого водяного пара при температуре 500-550°C в течение 1,5-2 часов под давлением 1,2-1,3 атм. После этого оксидированные титановые остеофиксаторы сначала охлаждают в печи в среде пара до температуры 250-300°C, а затем на воздухе до температуры 20-30°C.
Недостатком известного способа является необходимость применения печей для проведения процесса оксидирования, значительная длительность технологического цикла в связи с проведением охлаждения имплантатов в печи. При этом в способе не обеспечивается получение покрытий с антибактериальным эффектом.
Известен способ нанесения биоактивного нано- и микроструктурированного кальцийфосфатного покрытия на имплантат из титана и его сплавов (RU 2444376, опублик. 10.03.2012), включающий анодирование титана и его сплавов, стерилизацию поверхности имплантата при температуре 180-200°C в течение 30-60 минут.
Недостатком известного способа является необходимость использования специальных химикатов, ухудшающих экологическую обстановку, затраты на их последующую утилизацию, высокое рабочее напряжение. При этом в способе не обеспечивается получение покрытия с антибактериальным эффектом.
Наиболее близким к предложенному способу является способ нанесения покрытия из титана технической чистоты, который обладает высокой биоинертностью, на стальные спицы Киршнера методом электроискрового легирования. (В.В. Ворушенко, А.А. Погончинков «Применение имплантатов с наноструктурными титановыми покрытиями при чрескостном остеосинтезе». Сборник статей по материалам Международной 69-й научной итоговой студенческой конференции, посвященной 200-летию со дня рождения Н.И. Пирогова, г. Томск, 11-13 мая, 2010 год, с. 95-97).
Недостатком известного способа является то, что сформированные покрытия не обладают биоактивным и антибактериальным эффектом.
Технической задачей, на решение которой направлено изобретение, является создание биосовместимых, биоактивных покрытий с антибактериальным эффектом на металлах и их сплавах медицинского назначения.
Технический результат, достигаемый в предложенном способе, заключается в обеспечении получения на имплантатах, изготовленных из специальных сплавов медицинского назначения, сплошных биосовместимых, биоактивных покрытий с антибактериальным эффектом с высокой величиной адгезии (более 100 Н), высокой износостойкостью и с заданным рельефом.
Технический результат достигается следующим образом.
Способ получения биоактивного покрытия с антибактериальным эффектом включает электроискровую обработку поверхности токопроводящей подложки обрабатывающим электродом следующего состава (вес. %):
биоактивная добавка - 5-40,
антибактериальная металлическая добавка - 0,5-5,
биосовместимое тугоплавкое соединение - остальное.
В качестве биоактивной добавки используется гидроксилапатит, и/или трикальцийфосфат, и/или оксид кальция, и/или диоксид титана.
В качестве антибактериальной металлической добавки используется серебро и/или медь.
В качестве биосовместимого тугоплавкого соединения используется карбид, и/или карбонитрид, и/или оксикарбонитрид титана, и/или циркония, и/или гафния, и/или тантала.
Электроискровую обработку проводят при следующих режимах:
100≤Ni≤10000
10≤f≤100000
0,01≤v≤0,6,
где Ni - мощность единичного импульсного разряда, Вт,
f - частота импульсных разрядов, Гц,
v - линейная скорость перемещения обрабатывающего электрода, м/мин.
Токопроводящая подложка выполнена из сплавов медицинского назначения на основе Ti, Ni, Fe, Zr, Nb, Та.
Электроискровая обработка проводится в среде аргона, или гелия, или азота.
Электроискровая обработка проводится в жидкости, в качестве которой используют этиловый спирт, или дистиллированную воду, или физиологический раствор, или раствор Рингера.
Изобретение осуществляется следующим образом.
Нанесение покрытий осуществляется на оборудовании для электроискровой обработки, например Alier-Metal.
Имплантат, являющийся токопроводящей подложкой, устанавливают в специальном боксе, так чтобы он и рабочая часть обрабатывающего электрода находились в защитной среде.
Инструмент с закрепленным обрабатывающим электродом, в состав которого входят биоактивная добавка, антибактериальная металлическая добавка и биосовместимое тугоплавкое соединение в соотношении, указанном выше, и имплантат, подключают к генератору установки.
При сближении обрабатывающего электрода с имплантатом происходит электрический разряд с последующей электрической эрозией материала обрабатывающего электрода и полярным переносом продуктов эрозии на поверхность имплантата. Формирование биоактивного покрытия с антибактериальным эффектом происходит при перемещении обрабатывающего электрода по поверхности имплантата с заданной скоростью при установленной мощности и частоте импульсных разрядов.
Рельеф покрытия задается защитной средой, в которой проводят электроискровую обработку, например газовой или жидкой.
В качестве газовой среды при проведении электроискровой обработки используют аргон, или гелий, или азот.
В качестве жидкой среды при проведении электроискровой обработки используют этиловый спирт, или дистиллированную воду, или физиологический раствор H2O-NaCl, или раствор Рингера.
Для обеспечения биактивности покрытия в состав электродного материала вводят биоактивные добавки в виде неорганических соединений или их смесей, а именно гидроксилапатит Ca10(PO4)6(OH)2, и/или трикальцийфосфат Ca3(PO4)2, и/или оксид кальция CaO, и/или диоксид титана TiO2 в количестве 5-40 вес. %.
Введение биоактивной добавки в количестве меньше 5 вес.% не способствует повышению биоактивности сформированного покрытия.
Введение биоактивной добавки в количестве больше 40 вес.% может способствовать резкому увеличению неравномерности сформированного покрытия, снижению его сплошности, а также большому разбросу по величине шероховатости.
Для обеспечения антибактериальности биоактивного покрытия в электродный материал вводят антибактериальную металлическую добавку в количестве 0,5-5 вес. %, например в виде серебра и/или меди.
Введение антибактериальной металлической добавки в количестве меньше 0,5 вес. % не приводит к появлению антибактериального эффекта сформированного покрытия. Кроме этого, технически сложно обеспечить равномерность распределения добавки в таком количестве в объеме электродного материала.
Введение антибактериальной металлической добавки в количестве больше 5 вес.% может вызывать токсические явления, а в ряде случаев вероятен летальный исход.
В качестве основы электродного материала, используемого для получения биоактивного покрытия с антибактериальным эффектом, используют биосовместимое тугоплавкое соединение карбид, и/или карбонитрид, и/или оксикарбонитрид титана, и/или циркония, и/или гафния, и/или тантала.
Диапазон значений параметров режимов электроискровой обработки при проведении способа выбран из следующих предпосылок.
При мощности единичных импульсных разрядов меньше 100 Вт наблюдается неустойчивость проведения процесса электроискровой обработки. Сформированные покрытия характеризуются низкой сплошностью и минимальной шероховатостью. На данных режимах возможно неравномерное распределение биоактивных и антибактериальных добавок в поверхностном слое, что приводит к снижению биоактивности и антибактериального эффекта.
При проведении процесса электроискровой обработки с мощностью единичного импульсного разряда больше 10000 Вт происходит сильный нагрев электродного материала, что приводит к его эрозии в виде твердофазных частиц. Данные частицы не обладают достаточной возможностью закрепления на поверхности подложки. Сформированное покрытие имеет высокую шероховатость и недостаточную сплошность.
Существует вероятность, что слабо закрепленные между собой частицы покрытия при эксплуатации будут откалываться от покрытия и попадать в организм.
Кроме этого, интенсивный нагрев электрода может способствовать потере твердости и увеличению пластичности, приводящей к потере формы материала электрода, что делает невозможным его дальнейшее использование. Также происходит повышенный расход электродного материала.
Применение режима электроискровой обработки с частотой импульсных разрядов менее 10 Гц приводит к снижению производительности процесса. В этом случае для получения сплошных, равномерных покрытий необходимо увеличение времени обработки.
В то же время применение режимов обработки выше 100000 Гц приводит к формированию покрытий, характеризующихся минимальной шероховатостью и толщиной, не превышающей 10 мкм. Покрытие с минимальной шероховатостью не имеет разветвленной поверхности и не способствует повышению медико-биологических характеристик (биоактивности и антибактериального эффекта).
Проведение электроискровой обработки с линейной скоростью перемещения обрабатывающего электрода менее 0,01 м/мин снижает производительность процесса формирования биоактивных покрытий.
Линейная скорость перемещения обрабатывающего электрода более 0,6 м/мин способствует формированию несплошных покрытий и неравномерному распределению биоактивных и антибактериальных добавок на поверхности обрабатываемых имплантатов.
Физико-механические и биологические свойства биоактивных покрытий с антибактериальным эффектом определялись при использовании специализированных прецизионных приборов.
В качестве модельной системы в биологических исследованиях были использованы остеобласты линии МС3Т3-Е1, культивируемые на поверхности тестируемых материалов.
Адгезия клеток с последующим распластыванием на поверхности подложки является первой фазой взаимодействия клеток организма и имплантата, и поэтому качество этой первой фазы имеет решающее значение для биосовместимости материала.
Морфометрический анализ площади распластывания клеток на поверхности покрытий показал, что остеобласты хорошо распластывались на поверхности тестируемых образцов. Иммуноморфологическое исследование актинового цитоскелета показало, что разрушения актинового цитоскелета клеток не происходит.
С помощью количественного колориметрического метода с использованием в качестве маркера раннего маркера дифференцировки, щелочной фосфатазы также проводилась оценка способности покрытий влиять на дифференцировку остеобластов МС3Т3-Е1 при их росте в дифференцирующей среде. Проведенные исследования показали, что остеобласты, растущие на поверхности покрытий, способны дифференцироваться. После двух недель культивирования МС3Т3-Е1 остеобластов количественный колориметрический анализ показал более высокий уровень активности щелочной фосфатазы в клетках, растущих на поверхности покрытий по сравнению с контрольным образцом (образцом без покрытия из титанового сплава ВТ6).
В качестве тестовых культур микроорганизмов для исследования бактерицидной активности покрытий была использована кишечная палочка бактерия Е.coli. Оценивалось количество сохранившихся бактерий через 24 часа (в качестве параметра антибактериальной активности приведено процентное отношение сохранившихся бактерий по сравнению с контрольным образцом (образцом без антибактериальной добавки)).
Проведение электроискровой обработки при вышеперечисленных параметрах обеспечивает устойчивость (стабильность) проведения процесса формирования биоактивного покрытия с антибактериальным эффектом без дефектов в виде пор и трещин, с заданной шероховатостью и химическим составом, с высокой величиной адгезии, сплошностью и износостойкостью.
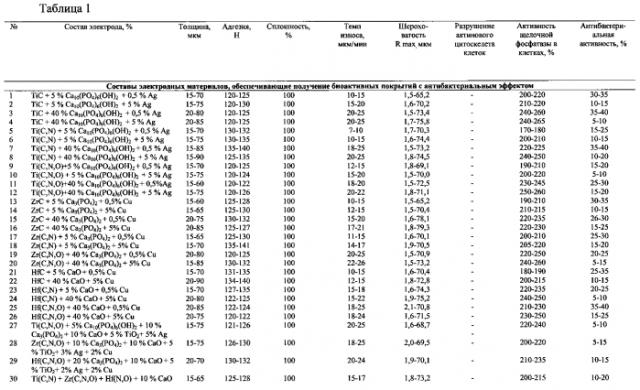
В таблице 1 приведены примеры осуществления способа и зависимость характеристик полученных биоактивных покрытий от заданного диапазона параметров электроискровой обработки для соответствующих составов электродных материалов.
Из таблицы 1 следует, что сформированные покрытия характеризуются высокой величиной адгезии более 100 Н, высокими эксплуатационными свойствами, а именно износостойкостью, заданным рельефом R max в диапазоне 1,5-79,3 мкм и толщиной 15-90 мкм. Медико-биологические характеристики, которыми являются биоактивность и антибактериальный эффект, подтверждаются:
- отсутствием разрушения актинового цитоскелета клеток на поверхности покрытий,
- увеличением уровня активности щелочной фосфатазы,
- снижением концентрации кишечной палочки.
1. Способ получения биоактивного покрытия с антибактериальным эффектом, включающий электроискровую обработку поверхности токопроводящей подложки обрабатывающим электродом, следующего состава (вес. %):биоактивная добавка - 5-40,антибактериальная металлическая добавка - 0,5-5,биосовместимое тугоплавкое соединение - остальное,при этом в качестве биоактивной добавки используют гидроксилапатит и/или трикальцийфосфат и/или оксид кальция и/или диоксид титана, в качестве антибактериальной металлической добавки используют серебро и/или медь, в качестве биосовместимого тугоплавкого соединения используют карбид и/или карбонитрид и/или оксикарбонитрид титана и/или циркония и/или гафния и/или тантала, а электроискровую обработку проводят при следующих условиях:100≤Ni≤1000010≤f≤1000000,01≤v≤0,6, где Ni - мощность единичного импульсного разряда, Вт,f - частота импульсных разрядов, Гц,v - линейная скорость перемещения обрабатывающего электрода, м/мин.
2. Способ по п. 1, в котором токопроводящая подложка выполнена из сплавов медицинского назначения на основе Ti, Ni, Fe, Zr, Nb, Та.
3. Способ по п. 1, в котором электроискровая обработка проводится в среде аргона, или гелия, или азота.
4. Способ по п. 1, в котором электроискровая обработка проводится в жидкости, в качестве которой используют этиловый спирт, или дистиллированную воду, или физиологический раствор, или раствор Рингера.