Способ и устройство для объединения хирургического лечения катаракты с хирургическим лечением глаукомы или астигматизма
Иллюстрации
Показать всеИзобретение относится к медицине. Универсальная офтальмологическая хирургическая система содержит: систему формирования изображений, сконфигурированную с возможностью поддержки определения целевой области при катаракте в хрусталике глаза; лазер, выполненный с возможностью подачи лазерных импульсов для лечения катаракты, чтобы выполнить фотодеструкцию участка определенной целевой области при катаракте. При этом система формирования изображений сконфигурирована также с возможностью поддержки определения целевой области при глаукоме в периферической области глаза; и лазер выполнен также с возможностью подачи лазерных импульсов для лечения глаукомы, чтобы создать один или более разрезов в целевой области при глаукоме посредством фотодеструкции. Причем лазерные импульсы для лечения катаракты и лазерные импульсы для лечения глаукомы подают при комплексной хирургической операции. 18 з.п. ф-лы, 26 ил.
Реферат
УРОВЕНЬ ТЕХНИКИ
Настоящий патентный документ относится к методам, устройствам и системам для объединения хирургического лечения катаракты с хирургическим лечением глаукомы или астигматизма.
Хирургическое лечение катаракты является одной из наиболее часто выполняемых офтальмологических операций. Основной целью хирургического лечения катаракты является удаление дефектного хрусталика и замена искусственным хрусталиком или интраокулярной линзой (IOL), который(ая) восстанавливает некоторые из оптических характеристик дефектного хрусталика. В общем, линза IOL способна улучшить пропускание света и уменьшить рассеяние, поглощение или и то и другое.
Широко применяемая форма хирургического лечения катаракты предусматривает факоэмульсификацию. В процессе хирургического вмешательства данного типа, в хрусталик глаза входят через разрез факоэмульсификационный зонд. Зонд генерирует ультразвук, который разбивает хрусталик на мелкие фракции, что приводит к его эмульсификации. Следует отметить, что данная операция оставалась, в основном, неизменной в течение последних двадцати лет. В процессе хирургического лечения катаракты, основанной на факоэмульсификации, выполняют последовательность отдельных хирургических манипуляций, содержащих (1) разрез роговицы и парацентез; (2) введение вискоэластика для сохранения общей структуры передней камеры и предотвращения ее разрушения; (3) разрез передней капсулы; (4) создание разрыва передней капсулы; (5) гидродиссекцию ядра хрусталика; (6) фрагментацию ядра хрусталика механическими и ультразвуковыми способами; (7) аспирацию ядра хрусталика; (8) введение вискоэластика в капсулу хрусталика; (9) аспирацию кортикальных масс хрусталика; (10) введение и позиционирование интраокулярной линзы; (11) удаление вискоэластика; и (12) исследование целостности роговичной раны, возможного места наложения шва. Некоторые из упомянутых этапов необходимы из-за того, что, во время хирургической операции глаза, глаз вскрыт, и в него физически вводят инструменты для дробления и удаления хрусталика.
Хирургическое лечение катаракты, выполняемое упомянутым способом, предусматривает высокую квалификацию хирурга и применение специализированного оборудования и расходных материалов, многие из которых требуют поддержки операционной сестры. Поскольку каждый этап является отдельным от остальных, то, возможно, было бы трудно оптимально координировать этапы между собой во время операции.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Вкратце и, в общем, осуществление настоящего изобретения содержит способ комплексной офтальмологической хирургии, содержащий следующие этапы: определяют целевую область при катаракте в хрусталике глаза; подают лазерные импульсы для лечения катаракты, чтобы выполнить фотодеструкцию участка определенной целевой области при катаракте; определяют целевую область при глаукоме в периферической области глаза; и подают лазерные импульсы для лечения глаукомы, чтобы создать, один или более разрезов в целевой области при глаукоме посредством фотодеструкции; при этом, этапы способа выполняют в рамках комплексной хирургической операции.
В некоторых вариантах осуществления этап подачи лазерных импульсов для лечения катаракты выполняют перед этапом подачи лазерных импульсов для лечения глаукомы.
В некоторых вариантах осуществления этап подачи лазерных импульсов для лечения катаракты выполняют после этапа подачи лазерных импульсов для лечения глаукомы.
В некоторых вариантах осуществления этап подачи лазерных импульсов для лечения катаракты выполняют, по меньшей мере, частично, одновременно с этапом подачи лазерных импульсов для лечения глаукомы.
В некоторых вариантах осуществления этап подачи лазерных импульсов для лечения глаукомы может содержать подачу лазерных импульсов в, по меньшей мере, что-то одно из склеры, лимбальной области, участка угла глаза или корня радужной оболочки.
В некоторых вариантах осуществления этап подачи лазерных импульсов для лечения глаукомы может содержать подачу лазерных импульсов в соответствии с картиной, связанной с, по меньшей мере, чем-то одним из трабекулопластики, иридотомии или иридэктомии.
В некоторых вариантах осуществления этап подачи лазерных импульсов для лечения глаукомы может содержать подачу лазерных импульсов для формирования, по меньшей мере, чего-то одного из дренажного канала и отверстия для оттока внутриглазной жидкости.
В некоторых вариантах осуществления способ содержит этап введения имплантируемого устройства во что-то одно из дренажного канала или отверстия для оттока внутриглазной жидкости.
В некоторых вариантах осуществления дренажный канал и отверстие для оттока внутриглазной жидкости формируют с возможностью соединения передней камеры оперируемого глаза с поверхностью оперируемого глаза, что допускает снижение внутриглазного давления внутриглазной жидкости в оперируемом глазу.
Некоторые варианты осуществления могут содержать использование одного лазера для подачи как лазерных импульсов для лечения катаракты, так и лазерных импульсов для лечения глаукомы.
В некоторых вариантах осуществления этап подачи лазерных импульсов для лечения глаукомы содержит: подачу лазерных импульсов для лечения глаукомы в оптимизированную целевую область при глаукоме, при этом, местоположение оптимизированной целевой области при глаукоме выбирают для меньшего рассеивания лазерных импульсов для лечения глаукомы, чем в склере глаза, и меньшего нарушения оптического пути глаза сформированным дренажным каналом, чем центрально сформированным дренажным каналом.
В некоторых вариантах осуществления целевая область при глаукоме является какой-то одной из граничной области между лимбом и склерой или области пересечения лимба и роговицы.
В некоторых вариантах осуществления этап подачи лазерных импульсов для лечения глаукомы содержит: подачу лазерных импульсов для лечения глаукомы для формирования дренажного канала в направлении, выбранном для оптимизации конкурирующих требований меньшего рассеивания лазерных импульсов для лечения глаукомы, чем в склере глаза, и меньшего нарушения оптического пути глаза сформированным дренажным каналом, чем центрально сформированным дренажным каналом.
В некоторых вариантах осуществления определение места подачи лазерных импульсов для лечения катаракты и место подачи лазерных импульсов для лечения глаукомы можно выполнять скоординированным способом.
В некоторых вариантах осуществления способ может содержать формирование изображений фотодеструкции, выполняемой лазерными импульсами для лечения катаракты; и определение, по меньшей мере, участков целевой области при глаукоме по отображаемой фотодеструкции.
В некоторых вариантах осуществления способ может содержать формирование изображений фотодеструкции, выполняемой лазерными импульсами для лечения глаукомы; и определение, по меньшей мере, участков целевой области при катаракте по отображаемой фотодеструкции.
В некоторых вариантах осуществления лазерные импульсы для лечения катаракты подают с длиной волны λ-c лазера для лечения катаракты; и лазерные импульсы для лечения глаукомы подают с длиной волны λ-g лазера для лечения глаукомы.
В некоторых вариантах осуществления лазерные импульсы для лечения катаракты подают посредством интерфейса пациента с катарактой; и лазерные импульсы для лечения глаукомы подаются посредством интерфейса пациента с глаукомой.
В некоторых вариантах осуществления универсальная (многоцелевая) офтальмологическая хирургическая система может содержать универсальный лазер, выполненный с возможностью подачи лазерных импульсов для лечения катаракты в целевую область при катаракте и подачи лазерных импульсов для лечения глаукомы в целевую область при глаукоме; и систему формирования изображений, выполненную с возможностью формирования изображений фотодеструкции, создаваемой, по меньшей мере, какими-то одними из лазерных импульсов для лечения катаракты и лазерных импульсов для лечения глаукомы.
В некоторых вариантах осуществления универсальная офтальмологическая хирургическая система выполнена с возможностью подачи лазерных импульсов для лечения катаракты с длиной волны λ-c лазера для лечения катаракты и подачи лазерных импульсов для лечения глаукомы с длиной волны λ-g лазера для лечения глаукомы.
В некоторых вариантах осуществления универсальный лазер выполнен с возможностью подачи лазерных импульсов для лечения катаракты посредством интерфейса пациента с катарактой и подачи лазерных импульсов для лечения глаукомы посредством интерфейса пациента с глаукомой.
В некоторых вариантах осуществления универсальная офтальмологическая хирургическая система выполнена с возможностью подачи лазерных импульсов для лечения катаракты и лазерных импульсов для лечения глаукомы одним лазером.
В некоторых вариантах осуществления способ комплексной офтальмологической хирургии может содержать следующие этапы: определяют целевую область при катаракте в хрусталике глаза; подают лазерные импульсы для лечения катаракты, чтобы выполнить фотодеструкцию участка определенной целевой области при катаракте; определяют целевую область при астигматизме в центральной, средней или периферической области глаза; и подают лазерные импульсы для коррекции астигматизма, чтобы создать, по меньшей мере, один разрез в целевой области при астигматизме посредством фотодеструкции; при этом, этапы способа выполняют в течение комплексной хирургической операции.
В некоторых вариантах осуществления способ может содержать формирование изображений фотодеструкции, выполняемой лазерными импульсами для лечения катаракты; и определяют, по меньшей мере, участки целевой области при астигматизме по отображенной фотодеструкции.
В некоторых вариантах осуществления универсальная офтальмологическая хирургическая система может содержать универсальный лазер, выполненный с возможностью подачи лазерных импульсов для лечения катаракты в целевую область при катаракте и подачи лазерных импульсов для коррекции астигматизма в целевую область при астигматизме; и систему формирования изображений, выполненную с возможностью формирования изображений фотодеструкции, создаваемой, по меньшей мере, какими-то одними из лазерных импульсов для лечения катаракты и лазерных импульсов для коррекции астигматизма.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
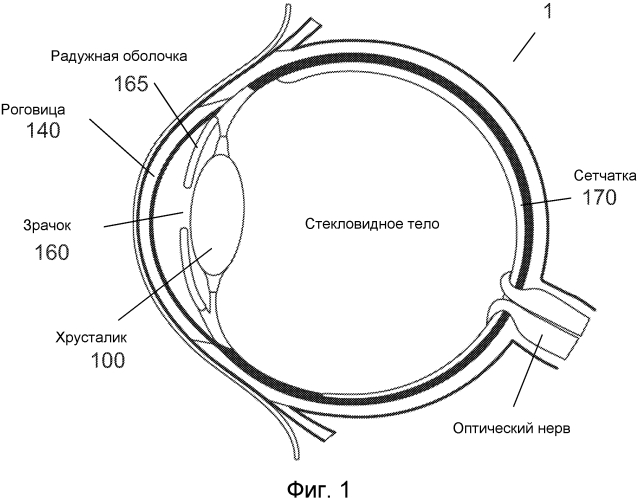
Фиг.1 - изображение глаза.
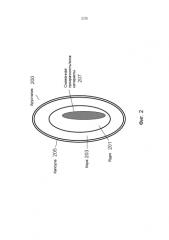
Фиг.2 - изображение ядра глаза.
Фиг.3 - пояснение способа фотодеструкции.
Фиг.4 - пояснение применения хирургического лазера на этапе 320a-b.
Фиг.5A-G - пояснение создания разрезов роговицы и капсулы и введения линзы IOL.
Фиг.6A-G - пояснение различных осуществлений хирургического лечения катаракты, объединенной с хирургическим лечением глаукомы или астигматизма.
Фиг.7 - пример лазерной хирургической системы с управлением по изображениям, в которой обеспечен модуль формирования изображений для обеспечения формирования изображений целевого объекта для устройства управления лазером.
Фиг.8-16 - примеры лазерной хирургической системы с управлением по изображениям, с изменением степеней интегрирования лазерной хирургической системы и системы формирования изображений.
Фиг.17 - пример способа выполнения лазерной хирургической операции с использованием лазерной хирургической системы с управлением по изображениям.
Фиг.18 - пример изображения глаза, полученного модулем формирования изображений методом оптической когерентной томографии (ОКТ).
Фиг.19A-D - два примера калибровочных образцов для калибровки лазерной хирургической системы с управлением по изображениям.
Фиг.20 - пример закрепления материала калибровочного образца к интерфейсу пациента в лазерной хирургической системе с управлением по изображениям, для калибровки системы.
Фиг.21 - пример реперных отметок, созданных хирургическим лазерным пучком на стеклянной поверхности.
Фиг.22 - пример способа калибровки и хирургической операции после калибровки лазерной хирургической системы с управлением по изображениям.
Фиг.23A-B - два режима работы примерной лазерной хирургической системы с управлением по изображениям, которая захватывает изображения побочного продукта лазерной фотодеструкции и целевой ткани для управления настройкой лазера.
Фиг.24-25 - примеры операций настройки лазера в лазерных хирургических системах с управлением по изображениям.
Фиг.26 - примерная лазерная хирургическая система с настройкой лазера с использованием изображения побочного продукта фотодеструкции.
ПОДРОБНОЕ ОПИСАНИЕ
На Фиг.1 представлено общее строение глаза 1. Падающий свет распространяется по оптическому пути, который содержит роговицу 140, зрачок 160, ограниченный радужной оболочкой 165, хрусталик 100 и стекловидное тело. Данные оптические элементы направляют свет на сетчатку 170.
На Фиг.2 приведено более подробное изображение хрусталика 200. Хрусталик 200 иногда называют кристаллическим из-за α, β и γ кристаллических белков, которые составляют, приблизительно, 90% хрусталика. Кристаллический хрусталик обеспечивает несколько оптических функций в глазу, в том числе, его динамическую фокусирующую способность. Хрусталик является особой тканью человеческого организма, в котором хрусталик продолжает увеличиваться в размере в период беременности, после рождения и в течение всей жизни. Хрусталик растет путем образования новых волокнистых клеток хрусталика, с началом от зародышевого ядра, находящегося на экваториальной периферии хрусталика. Волокна хрусталика являются длинными тонкими прозрачными клетками с диаметрами, обычно, в диапазоне 4-7 микрометров и длинами до 12 мм. Самые старые волокна хрусталика расположены по центру внутри хрусталика, с формированием ядра. Ядро 201 можно дополнительно подразделить на эмбриональную, фетальную и зрелую зоны ядра. Новообразование вокруг ядра 201, называемое корой 203, развивается концентрическими эллипсоидальными слоями, областями или зонами. Поскольку ядро 201 и кора 203 формируются на разных стадиях развития человека, то их оптические характеристики различаются. Хотя диаметр хрусталика увеличивается со временем, хрусталик может также уплотняться, и поэтому свойства ядра 201 и окружающей коры 203 могут различаться еще значительнее (Freel et al BMC Ophthalmology 2003, vol. 3, p. 1).
В результате вышеописанного сложного процесса роста, типичный хрусталик 200 содержит более твердое ядро 201, аксиально продолжающееся, приблизительно, на 2 мм, окруженное более мягкой корой 203 с аксиальной шириной 1-2 мм, заключенное в намного более тонкую капсульную сумку 205 с типичной шириной, приблизительно, 20 микрометров. Приведенные значения могут значительно различаться от человека к человеку.
Волокнистые клетки хрусталика постепенно теряют эндоплазматические элементы с течением времени. Поскольку никакие кровеносные или лимфатические сосуды не достигают хрусталика для питания его внутренней зоны, то с приближением старости иногда ухудшаются оптическая прозрачность, гибкость и другие функциональные свойства хрусталика.
На Фиг.2 показано, что, в некоторых обстоятельствах, включая долговременное облучение ультрафиолетовым излучением, воздействие излучения вообще, денатурирование белков хрусталика, вторичные эффекты заболеваний типа диабета, гипертензии и старения, область ядра 201 может становиться областью 207 с пониженной прозрачностью. Область 207 с пониженной прозрачностью является, обычно, центрально расположенной областью хрусталика (Sweeney et al Exp Eye res, 1998, vol. 67, p. 587-95). Упомянутая потеря прозрачности часто коррелируется с развитием катаракты наиболее распространенного типа в той же области, а также с повышением жесткости хрусталика. Данный процесс может происходить с приближением старости постепенно от периферического к центральному участку линзы (Heys et al Molecular Vision 2004, vol. 10, p. 956-63). Одним результатом данных изменений является развитие старческой дальнозоркости и катаракты, которая усиливается по тяжести и широте распространения с возрастом.
Целью хирургического лечения катаракты является удаление данной непрозрачной области с пониженной прозрачностью, области катаракты. Во многих случаях, при этом необходимо удалить всю внутреннюю область хрусталика, с оставлением только капсулы хрусталика.
Как упоминалось в разделе уровня техники, хирургическому лечению катаракты на основе факоэмульсификации могут быть свойственны различные ограничения. Например, упомянутая ультразвуковая хирургия может создавать в роговице разрезы, которые не легко контролировать по размеру, форме и местоположению, что приводит к недостаточной самогерметизации раны. Работа с неконтролируемыми разрезами может потребовать наложения швов. Метод факоэмульсификации требует также выполнения большого разреза на капсуле, иногда, до 7 мм. Операция может сопровождаться обширными непреднамеренными модификациями: оперированный глаз может проявлять большой астигматизм и остаточную или вторичную погрешность рефракции или другую погрешность. Данная погрешность часто требует последующей рефракционной или другой хирургической операции или устройства. Кроме того, ткань радужной оболочки может быть разорвана зондом, или операция может вызвать пролапс ткани радужной оболочки в ране. Доступ к раздробленному материалу хрусталика может быть сложным, и имплантация линзы IOL может представлять трудную задачу. Ультразвуковая хирургическая операция может также приводить к нежелательному повышению глазного давления вследствие остаточных виксоэластичных препаратов, которые блокируют дренажные каналы глаза. Кроме того, данные операции могут приводить к неоптимальным центрированию, формам или размерам отверстий в капсуле, что может осложнять удаление материала хрусталика и/или ограничивать точность позиционирования и размещение линзы IOL в глазу.
Две причины вышеупомянутых затруднений и осложнений состоят в том, что дробление хрусталика выполняют (i) посредством вскрытия глаза, и (ii) за большое число отдельных этапов, каждый из которых требует введения или извлечения инструментов, с оставлением глаза вскрытым между данными этапами.
Приведенные и другие ограничения и сопутствующие риски в процессе хирургического лечения катаракты с использованием факоэмульсификации привели к разработке операций для лечения катаракты без выполнения разреза в глазу. Например, в патенте США 6726679 предложен способ устранения помутнения хрусталика посредством направления ультракоротких лазерных импульсов на местоположения помутнений в глазу. Однако упомянутый, ранее предложенный способ не принимает во внимание некоторые сложности управления хирургическим процессом. Кроме того, полезность данного способа ограничена для случаев, когда состояние глаза вызвано проблемами, отличающимися от непрозрачности хрусталика. Например, в случае сопутствующей погрешности рефракции, требовались отдельные процедуры.
Осуществления настоящего изобретения характеризуют способы и устройства для выполнения хирургического лечения катаракты, которые справляются с двумя вышеописанными проблемами. Данные осуществления выполняют разрушение хрусталика (i) без вскрытия глаза, и (ii) за одну комплексную процедуру. Кроме того, данные осуществления обеспечивают надежное управление хирургической процедурой, сокращают возможность ошибки, минимизируют необходимость дополнительной технической поддержки и повышают эффективность хирургии. Способы и устройства для хирургического лечения катаракты, описанные в настоящей заявке, можно осуществлять для удаления хрусталика глаза и объединения удаления хрусталика с другими хирургическими этапами, и выполнения всей процедуры скоординированным и эффективным способом.
Физический вход в глаз можно исключить посредством применения фотодеструкции с использованием, например, коротких лазерных импульсов. Операторы лазеров для офтальмологической хирургии могут подавать лазерный пучок в область хрусталика, намеченную для фрагментации, с высокой точностью. Фрагментацию хрусталика, основанную на фотодеструкции, можно осуществлять в различных конфигурациях, например, в конфигурациях, описанных в патентах США №№: 4538608, 5246435 и 5439462. Способы и устройства, описанные в настоящей заявке, можно применять с обеспечением выполнения данных и других способов фрагментации хрусталика, основанных на фотодеструкции, вместе комплексно с другими хирургическими этапами, необходимыми в процессе хирургического лечения катаракты, включая этап вскрытия глаза и/или капсулы, этап удаления фрагментированного материала хрусталика и этап введения искусственного хрусталика в свободное пространство, оставленное удаленным фрагментированным материалом.
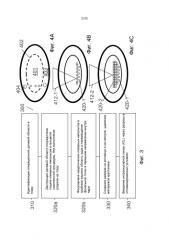
На Фиг.3-4 показано, что, в варианте осуществления 300 настоящих способов, хирургические этапы для удаления катаракты могут содержать следующее.
Этап 310 может содержать определение операционной целевой области в глазу. В нескольких из описанных вариантов осуществления, целевая область может быть ядром или областью, имеющей отношению к ядру, в которой развилась катаракта. В других вариантах осуществления возможно планирование других целевых областей.
На Фиг.4A показано, что, в соответствии с некоторыми особенностями этапа 310, определение операционной целевой области содержит определение границ целевой области, например, границы 402 ядра. Данное определение может содержать создание группы пробных пузырьков 404 внутри хрусталика лазерными импульсами и наблюдение их роста или динамику. Пробные пузырьки увеличиваются быстрее в области коры, которая мягче, а в ядре пробные пузырьки увеличиваются медленнее, так как ядро тверже. Возможно также применение других способов для оценки границы 402 ядра на основании наблюдения пробных пузырьков 404, например, ультразвукового возбуждения и измерения реакции на данное возбуждение. По наблюдаемым росту или динамике пробных пузырьков 404 можно оценить твердость окружающего материала: данный способ эффективен при разделении более жесткого ядра с более мягкой корой, для идентификации, тем самым, границы ядра.
Этап 320a может содержать деструкцию целевой области, без выполнения разреза на глазу. Деструкцию выполняют подачей лазерных импульсов в процессе комплексной процедуры в целевую область.
Одна из особенностей, в связи с которой этап 320a называют комплексной процедурой, состоит в том, что этап 320a обеспечивает результат, эквивалентный пяти этапам вышеописанной ультразвуковой хирургической операции:
(1) Разрез роговицы и парацентез; (3) разрез передней капсулы; (4) создание разрыва передней капсулы; (5) гидродиссекция ядра хрусталика; (6) фрагментация ядра хрусталика механическим и ультразвуковым способами.
Особенности этапа 320a содержат следующее. (i) Поскольку глаз не вскрывают для деструкции хрусталика, то оптический путь не нарушается, и лазерным пучком можно управлять с высокой точностью для поражения предполагаемой целевой области с высокой точностью, (ii) кроме того, поскольку в разрезы глаза не вводят физических объектов, то разрезы не разрываются дополнительно трудноконтролируемым образом, при введении и извлечении физического объекта, (iii) поскольку глаз не вскрывают в процессе деструкции, то хирург не должен работать с жидкостями во вскрытом глазу, которая, в ином случае, истекала бы и нуждалась бы в восполнении, например, введением вязких текучих сред, как на этапе (2) ультразвуковой хирургической операции.
В процессе лазерной фрагментации хрусталика, лазерные импульсы ионизируют участок молекул в целевой области. Ионизация может вызвать лавину вторичных процессов ионизации выше «порога образования плазмы». В процессе многих хирургических процедур, в целевую область передается большое количество энергии короткими импульсами. Данные импульсы концентрированной энергии могут превращать ионизированную область в газ, что приводит к образованию кавитационных пузырьков. Данные пузырьки могут формировать диаметр несколько микрометров и расширяться со сверхзвуковой скоростью до 50-100 микрометров. Когда расширение пузырьков замедляется до субсветовых скоростей, данные пузырьки могут возбуждать в окружающей ткани ударные волны, вызывающие вторичную деструкцию.
Как сами пузырьки, так и возбужденные ударные волны выполняют одну из задач этапа 320a: деструкцию, дефрагментацию или эмульсификацию ядра 201, без выполнения разреза на капсуле 205.
Как отмечено выше, фотодеструкция снижает прозрачность облучаемой области. Если подача лазерных импульсов начинается с фокусировки импульсов во фронтальной или передней области хрусталика, и затем фокус перемещают глубже к задней области, то кавитационные пузырьки и сопутствующая ткань со сниженной прозрачностью может находиться на оптическом пути последующих лазерных импульсов и блокировать, ослаблять или рассеивать данные импульсы. Данное действие может снижать точность и управляемость подачи последующих лазерных импульсов, а также ослаблять импульс энергии, фактически доставляемый в более глубокие задние области хрусталика. Поэтому эффективность процедур лазерной офтальмологической хирургии можно повысить с использованием способов, при которых пузырьки, сформированные прежними лазерными импульсами, не блокировали оптического пути последующих лазерных импульсов.
Один из возможных способов предотвращать загораживание ранее сформированными пузырьками оптического пути подаваемых впоследствии лазерных импульсов заключается в том, чтобы сначала подавать импульсы в крайнюю заднюю область хрусталика и затем перемещать фокальную точку к передним областям хрусталика.
Метод, предложенный в патенте США № 5246435, не принимал во внимание различные проблемы, связанные с сопутствующими процессами. Упомянутые проблемы включают в себя то, что пузырьки, сформированные в коре, часто неконтролируемо распространяются из-за низкой твердости и большей вязкости коры. Следовательно, если лазер направляют на заднюю сторону хрусталика, где находится задний участок коры, то хирург будет создавать пузырьки, которые быстро и неконтролируемо распространяются по большой площади, с высокой вероятностью загораживания оптического пути.
Этап 320b является пояснением усовершенствованного выполнения этапа 320a: посредством фокусировки хирургических лазерных импульсов в крайнюю заднюю область ядра 401 и перемещения фокальной точки в переднем направлении внутри ядра 401.
На Фиг.4B показано, что варианты осуществления настоящего способа используют апроксимированные данные о границах 402 ядра 401, которые получены на этапе 310. Этап 320b предотвращает загораживание ранее сформированными пузырьками оптического пути подаваемых впоследствии лазерных импульсов (например, путем распространения в кору 403) посредством сначала подачи импульсов 412-1 в крайнюю заднюю область 420-1 ядра 401. Затем подают последующие лазерные импульсы 412-2 в область 420-2 в ядре 401, которая является передней относительно области 420-1, в которую первоначально подавали лазерные импульсы 412-1.
Иначе говоря: фокальную точку лазерных импульсов 412 перемещают из задней области к передней области ядра 401.
Особенность этапов 320a и 320b состоит в том, что лазерные импульсы подают с мощностью, которая является достаточно большой для обеспечения требуемой фотодеструкции хрусталика, но не достаточной для вызова деструкции или другого разрушения в других областях, например, в сетчатке. Кроме того, пузырьки размещают достаточно тесно, чтобы вызывать фотодеструкцию, но не настолько тесно, чтобы созданные пузырьки сливались и формировали большой пузырек, который может неконтролируемо разрастаться и распространяться. Пороговую мощность для достижения деструкции можно назвать «порогом деструкции», и пороговую мощность для вызова нежелательного распространения газовых пузырьков можно назвать «порогом распространения».
Вышеописанные верхний и нижний пороги налагают ограничения на параметры лазерных импульсов, например, их мощность и интервал между импульсами. Длительность лазерных импульсов также может иметь аналогичные пороги деструкции и распространения. В некоторых вариантах осуществления длительность может изменяться в диапазоне от 0,01 пикосекунд до 50 пикосекунд. Для некоторых пациентов, определенные результаты получали в диапазоне длительностей импульсов от 100 фемтосекунд до 2 пикосекунд. В некоторых вариантах осуществления энергия лазера на один импульс может изменяться между порогами 1 мкДж и 25 мкДж. Частота повторения лазерных импульсов может изменяться между порогами 10 кГц и 100 МГц.
Энергию, разделение целевых объектов, длительность и частоту повторения лазерных импульсов можно также выбирать на основании предоперационного измерения оптических или структурных характеристик. В альтернативном варианте, выбор энергии лазера и разделения целевых объектов может быть основан на предоперационном измерении общих размеров хрусталика и применении возрастного алгоритма, вычислений, измерениях на препарированном анатомическом материале или базах данных.
Следует отметить, что методы лазерной деструкции, разработанные для других областей глаза, например, роговицы, нельзя применять на хрусталике без значительной модификации. Одна из причин данного условия состоит с том, что роговицы является очень многослойной структурой, очень эффективно сдерживающей распространение и перемещение пузырьков. Таким образом, распространение пузырьков создает качественно меньше проблем в роговице, чем в более мягких слоях хрусталика, содержащих само ядро.
На Фиг.5A также поясняются этапы 320a-b. При использовании сходной нумерации, лазерный пучок 512 может вызывать деструкцию ядра 501 внутри хрусталика 500 посредством формирования пузырьков 520, при этом, подаваемый лазерный пучок 512 имеет параметры в диапазоне между порогами деструкции и распространения, с перемещением его фокальной точки в направлении с задней стороны вперед.
Этап 330 может содержать выполнение разрезов на роговице и на капсуле. Данные разрезы выполняют с, по меньшей мере, двумя целями: вскрытие пути для удаления деструктированного ядра и другого материала хрусталика и для последующего введения линзы IOL.
На Фиг.5B-C поясняется создание разреза на капсуле 505 хрусталика 500, иногда называемого капсулотомией. На этапе 330, лазерный пучок 512 можно сфокусировать на поверхности капсулы таким образом, чтобы число созданных «капсулотомических пузырьков» 550 был достаточно для деструкции капсулы 505, в сущности, перфорировали ее. На Фиг.5B представлен вид сбоку глаза, и на Фиг.5C представлен вид спереди хрусталика 500 после того, как создано кольцо из «капсулотомических пузырьков» 550, ограничивающих разрез 555 капсулы. В некоторых вариантах осуществления из данных пузырьков 550 формируют полную окружность, и дисковидную, так называемую, крышку капсулы, т.е. разрез 555 капсулы, просто снимают. В других вариантах осуществления на капсуле 505 формируют неполную окружность, крышка остается закрепленной на капсуле, и, в конце процедуры, крышку можно восстановить в ее исходное положение.
Затем, дисковидный разрез 555 капсулы, ограничиваемый перфорацией посредством капсулотомических пузырьков 550, можно поднять и удалить хирургическим инструментом на более позднем этапе, с преодолением минимального сопротивления перфорированной ткани капсулы 505.
На Фиг.5D-E показано создание разреза на роговице 540. Лазерный пучок 512 можно направлять для создания цепочки пузырьков, которые создают разрез через роговицу 540. Данный разрез может быть не полной окружностью, а крышкой или только лоскутом, который можно снова закрыть в конце процедуры.
И вновь, подаваемый пучок для лазерной хирургии, по существу, перфорирует роговицу, с ограничением крышки роговице таким образом, что, на последующем этапе, крышку роговицы можно легко отделить от остальной части роговицы и поднять, чтобы представить возможность физического проникновения в глаз.
В некоторых вариантах осуществления разрез роговицы может быть многоплоскостным или «клапанным» разрезом, как показано на виде сбоку на Фиг.5E (не в масштабе). Данный разрез может быть самогерметизирующимся и намного лучше заключает текучую среду внутри глаза после того, как хирургическая процедура заканчивается. Кроме того, данные разрезы лучше и эффективнее заживляются, обеспечивают более широкое перекрытие тканей роговицы, при этом, заживление не испытывает помех из-за сложностей с разрывом.
На данных Фиг.5A-E хорошо заметны различия между разрезами при выполнении ультразвуковых хирургических операций и фотодеструктивных хирургических операций, описанных в настоящей заявке.
В процессе ультразвуковых хирургических операций разрезы выполняют механическим разрывом целевой ткани, например, роговицы и капсулы, посредством пинцета: данный метод называется криволинейным разрывом капсулы. Кроме того, в процессе ультразвуковых хирургических операций, стороны разрезов испытывают многократные воздействия, оказываемые различными механическими устройствами, перемещаемыми внутрь и наружу. По данным причинам, контуры разрезов нельзя достаточно точно контролировать, и разрезы нельзя выполнить вышеописанным самогерметизирующимся образом. Следовательно, ультразвуковой способ характеризуется менее точным контролем размеров и отсутствием способности к самогерметизации многоплоскостных разрезов, которые возможны при фотодеструктивных процедурах.
Приведенные положения подтверждены во время процедур тестирования, когда в процессе обеих процедур пробовали создавать номинально 5-мм отверстия. Разрез, созданный механическим разрывом, имел диаметр 5,88 мм, при среднем отклонении 0,73 мм. Напротив, при фотодеструктивном способе, описанном в настоящей заявке, отверстие с диаметром 5,02 мм получали со средним отклонением 0,04 мм.
Приведенные результаты испытаний показывают качественно более высокую точность фотодеструктивного способа. Важность приведенного различия можно оценить, например, с учетом того, что, если разрез роговицы для коррекции астигматизма отклоняется только на 10-20%, то тем самым подавляется или даже нейтрализуется большая часть запланированного воздействия данного разреза, что, возможно, потребует повторной хирургической операции.
Кроме того, в момент, когда роговицу вскрывают разрезом во время осуществления ультразвукового способа, «внутриглазная жидкость передней камеры», т.е. текучая среда, содержащаяся в глазу, начинает вытекать, фактически, текучая среда начинает капать из глаза.
Данная потеря текучей среды имеет негативные последствия, так как внутриглазная жидкость выполняет жизненно важную функцию в поддержании структурной целостности глаза посредством его поддерживания, в какой-то степени подобно воде в водонаполненном баллоне.
Следовательно, значительные усилия требуется затрачивать на непрерывное восполнение текучей среды, вытекающей из глаза. Во время ультразвуковых хирургических операций, комплексная система с компьютерным управлением контролирует и наблюдает за упомянутым управлением операциями с текучей средой. Однако данная задача требует высокой квалификации от самого хирурга.
Напротив, осуществления настоящего способа не предусматривают вскрытия глаза для обеспечения фотодеструкции. По данной причине, при фотодеструкции хрусталика отсутствует задача управления операциями с текучей средой, и, следовательно, снижаются требования к квалификации хирурга и сложности оборудования.
Как видно из Фиг.3, этап 330 содержит также удаление фрагментированного, деструктированного, эмульсифицированного или иначе модифицированного ядра и другого материала хрусталика, например, более текучей коры. Данное удаление обычно выполняют введением аспирационного зонда через разрезы роговицы и капсулы и аспирацией материала.
На Фиг.5F показано, что этап 340 может содержать введение интраокулярной линзы (IOL) 530 в капсулу 505 хрусталика для замены деструктированного в