Модифицированный кремнийорганическими фрагментами фталонитрильный мономер, способ его получения, связующее на его основе и препрег
Иллюстрации
Показать всеИзобретение относится к способам получения модифицированных фталонитрилов, содержащих кремнийорганические фрагменты, и связующих на их основе. Предложен модифицированный кремнийорганическими фрагментами фталонитрильный мономер общей формулы I, где X - двухвалентный ароматический радикал, выбранный из группы, включающей и ; Y - кремнийорганический фрагмент, выбранный из группы, включающей -SiR1R2 и SiR1R2-O-SiR1R2, где R1 и R2 - радикалы, выбранные из группы, включающей СН3, С6Н5, и НС=СН2. Предложен также способ получения заявленного фталонитрильного мономера, связующее на его основе и препрег. Технический результат - предложенный фталонитрил сочетает свойства традиционных типов фталонитрилов - высокую термостойкость - с преимуществами кремнийорганических полимеров, демонстрирующих хорошую растворимость, сохранение термостойкости, низкой температуры стеклования, обеспечивающей агрегатное состояние при комнатной температуре в виде вязкой жидкости или полутвердых веществ. 4 н. и 7 з.п. ф-лы, 1 табл., 9 пр.
I
Реферат
Область техники
Изобретение относится к области органической химии, в частности к способу получения модифицированных фталонитрилов, содержащих кремнийорганические фрагменты и связующих на их основе и может быть использовано в различных областях техники, в частности, в авиастроении и автомобилестроении, для производства полимерных композиционных материалов.
Предшествующий уровень техники
Большинство методик получения фталонтрильных мономеров и производных на их основе проводят в апротонных растворителях, таких как диметилсульфоксид (ДМСО), ди-метилформамид (ДМФА) в смеси с бензолом или толуолом для удаления воды при протекании реакции нуклеофильного замещения. Данные методики описаны ниже.
Известен способ получения мономера на основе 4,4′- дигидроксибензофенона, который был получен в соответствии со схемой, приведенной ниже.
Получение 4,4′-((карбонилбис(4,1-фенилен))бис(окси)) дифталонитрила проводили в смеси ДМСО, бензола, воды и гидроксида натрия. При кипячении с насадкой Дина-Старка удаляли воду, при комнатной температуре добавляли 4-нитрофталонитрил, перемешивали в течение 12 ч, затем разбавляли водой, фильтровали, промывали водой и горячим этанолом. Выход продукта составил 94%. Температура плавления синтезированного фталонитрильного соединения составила 216-218°С.
В работе [Sastri S.B., Keller Т.М. Phthalonitrile Polymers: Cure Behavior and Properties. // Journal of Polymer Science: Part A: Polymer Chemistry. 1999. V. 37. P. 2105-2111] авторами были исследованы фталонитрильные мономеры: 2,2-бис[4-(3,4-дицианофенок-си)фенил]гексафторпропан (а) и 2,2-бис[4-(3,4-дицианофенокси)фенил]пропан (б).
2,2-бис[4-(3,4-дицианофенокси)фенил]гексафторпропан был получен при взаимодействии 4,4′-(1,1,1,3,3,3-гексафторпропан-2,2-диил)дифенола, 4-нитрофталонитрила и карбоната калия, в качестве растворителя использовался диметилформамид. Реакционную смесь авторы перемешивали при комнатной температуре в течение суток и затем вылили ее в воду. Осадок отфильтровали и промыли водой, метанолом и ацетонитрилом. Полученный осадок перекристаллизовали из ацетонитрила. Выход составил 74% [Yang С. - P., Su Y. - Y., Hsu M. - Y. Organo-soluble and Lightly-colored Fluorinated Polyimides Based on 2,2-Bis[4-(3,4-dicarboxyphenoxy)phenyl]hexafluoropropane Dianhydride and Aromatic Bis(ether amine)s Bearing Pendent Trifluoromethyl Groups. // Polymer Journal. 2006. V. 38. №2. P. 132-144].
Наиболее близким модифицированным фталонитрилом к предложенному является фталонитрил, раскрытый в заявке на изобретение US 2004181029, состав которого отвечает формуле:
где Ar представляет собой, независимо выбранный двухвалентный ароматический радикал, полученный взаимодействием ароматическим соединением, содержащим два гидроксила с ароматическим соединением, содержащим два хлора; и в котором реакцию проводят в присутствии соединения меди и карбоната цезия, a n - число от 2 до 100.
Получают данный модифицированный фталонитрил путем взаимодействия 3 или 4 нитрофталонитрила с олигомером ароматического эфира с концевыми гидроксильными группами.
Полученный модифицированный фталонитрил обладает следующими характеристиками: Тст мономера 42°С, температура отверждения 375°С, температура стеклования отвержденного продукта - более 550°С, агрегатное состояние полученного модифицированного фталонитрила твердое.
Для всех других вышеописанных олигомеров-аналогов, даже для которых пытались максимально понизить температуру стеклования, ее значение лежало не ниже 40°С и, как правило, составляло более 60-80°С.
Технической задачей изобретения является получение фталонитрилов, содержащих кремнийорганические фрагменты, сочетающих свойства традиционных типов фталонитрилов - высокую термостойкость с преимуществами кремнийорганических полимеров, демонстрирующих хорошую растворимость при сохранении термостойкости, низкую температуру стеклования, обеспечивающую агрегатное состояние при комнатной температуре в виде вязкой жидкости или полутвердых веществ.
Задачей изобретения также является получение фталонитрильных мономеров с приемлемыми технологическими свойствами для получения на их основе связующего за счет снижения температуры плавления и уменьшения вязкости для производства препрегов, а также композиционных материалов в том числе, и по инжекционным технологиям.
Поставленная задача решается модифицированным кремний органическими фрагментами фталонитрильным мономером, характеризующимся общей формулой
где X - двухвалентный ароматический радикал;
выбранный из группы, включающей и
Y - кремний органический фрагмент, выбранный из группы, включающей -SiR1R2 и SiR1R2-O-SiR1R2, где R1 и R2 - радикалы, выбранные из группы, включающей СН3, C6H5, и НС=СН2.
Поставленная задача также решается способом получения модифицированного кремний органическими фрагментами фталонитрильного мономера, в соответствии с которым сначала получают гидроксилсодержащий фталонитрил, а затем упомянутый гидроксилсодержащий фталонитрил в безводном апротонном растворителе подвергают взаимодействию с замещенным дихлорсиланом в присутствии основания с последующим извлечением из продуктов взаимодействия целевого продукта в виде модифицированного кремний органическим фрагментом мономерного фталонитрила.
В частных воплощениях изобретения поставленная задача также решается тем, что гидроксилсодержащий фталонитрил получают путем взаимодействия 4-нитрофталонитрила с дигидроксилсодержащим ароматическим соединением в апротонном растворителе в инертной атмосфере в присутствии неорганического основания.
Целесообразно извлечение целевого продукта осуществлять путем последовательно проводимых фильтрации продуктов взаимодействия с получением фильтрата и осадка, последующего упаривания фильтрата, растворения продукта упаривания и выделения из него целевого продукта.
В качестве безводного апротонного растворителя может быть использован тетрагидрофуран, а в качестве основания - третичные амины.
Поставленная задача решается также связующим, которое включает модифицированный кремний органическими фрагментами раскрытый выше фталонитрильный мономер и ароматический диамин в качестве инициатора полимеризации.
Связующее может содержать ароматический диамин в количестве до 10 масс. %.
Связующее может быть использовано в качестве связующего для получения полимерных композиционных материалов по инфузионным технологиям.
Поставленная задача также решается препрегом, который выполнен из данного связующего и армирующего элемента.
В частных воплощениях изобретения препрег в качестве армирующего элемента может содержать элемент, выбранный из группы, включающей углеродные однонаправленные ленты, углеродные ткани, стеклоткани, стеклянные однонаправленные ленты, углеродные рубленые волокна, стеклянные рубленые волокна.
Сущность изобретения состоит в следующем.
Новым подходом к уменьшению температуры плавления фталонитрильных мономеров является введение силоксановой -O-SiR2-O- группы. Введение такого гибкого фрагмента существенно увеличивает подвижность фрагментов молекулы. Силоксановые группы являются, как правило, термически стабильными. Связь С-O-Si, до настоящего момента не использовалась широко при получении новых полимеров, что, как полагают, связано с ее низкой гидролитической стабильностью.
Описанные данные обусловили выбор силоксановой группы, в качестве фрагмента, обеспечивающего понижение температуры плавления фталонитрильного связующего.
Введение кремнийорганических фрагментов приводит к снижению температуры стеклования целевых продуктов за счет гибкости силоксанового фрагмента без потери термостабильности, присущей описанным выше отвержденным фталонитрильным мономерам.
В заявленном техническом решении предлагается осуществлять синтез фталонитрилов, содержащих кремнийорганические фрагменты в среде безводного апротонного растворителя при проведении реакции между двумя эквивалентами безводного гидроксилсодержащего фталонитрила, в присутствии основания, например третичного амина, с одним эквивалентом замещенного дихлорсилана различной химической структуры.
В качестве гидроксилсодержащих фталонитрилов могут быть использованы любые гидроксилсодержащие фталонитрилы, например, такие, как 4-гидроксифталонитрил; 4-(2-гидроксифенокси)фталонитрил; 4-(3-гидроксифенокси)фталонитрил; 4-(4-гидроксифенокси)фталонитрил; 4-((6-гидроксинафталин-2-ил)окси)фталонитрил; 4-((5-гидроксинафталин-1-ил)окси)фталонитрил; 4-(4-(1,1,1,3,3,3-гесафтор-2-(4-гидроксифенил)пропан-2-ил)фенокси)фталонитрил; 4-(4-(гидроксиметил)фенокси)фталонитрил; 4-(3-(гидроксиметил)фенокси)фталонитрил; 4-(2-(гидроксиметил)фенокси)фталонитрил. Данный список не является исчерпывающим.
Так, в одном из конкретных воплощений изобретения для получения гидроксил- содержащего фталонитрила проводили реакцию 4-нитрофталонитрила с дигидроксилсодержащим ароматическим соединением в апротонном растворителе в инертной атмосфере в присутствии основания (карбоната калия) с получением гидроксилсодержащего фталониторила. При этом в качестве дигидроксилсодержащего ароматического соединения может быть использовано любое подходящее для этих целей соединение, множество из которых раскрыто в предшествующем уровне техники, например, 4-гидроксибензиловый спирт (4-гидроксиметилфенол); 3-гидроксибензиловый спирт; 2-гидроксибензиловый спирт; резорцин; пирокатехин; гидрохинон; 1,8-дигидроксинафталин; бисфенол А; бисфенол Ф; бисфенол М и т.п.
Применение безводных апротонных растворителей как на стадии получения гидроксилсодержащего фталонитрила, так и на стадии синтеза модифицированного фталонитрила, позволяет обеспечить синтез фталонитрилов с высоким выходом.
В качестве безводных апротонных растворителей могут быть использованы любые безводные апротонные растворители, однако целесообразно для некоторых воплощений изобретения использовать такие растворители как безводные тетрагидрофуран (ТГФ), диэтиловый эфир, диметилформамид, диметилацетамид, N-метил-2-пирролидон, широко применяемые в уровне техники для получения растворов фталонитрилов (см. например, RU2281952).
Они позволяют получать продукт с высоким выходом.
При введении кремнийорганических фрагментов выделение фталонитрильных целевых продуктов из апротонных растворителей может быть затруднено из-за их высокой растворимости в растворителе.
Известно, что хлорзамещенные силаны например диметилдихлорсилан, являются основным исходным сырьем для получения разнообразных кремнийорганических продуктов. При получении алкоксисиланов образуются значительные количества побочных продуктов: простые эфиры, хлоралканы, полисилоксаны. Их образование требует применения избытка спирта для завершения реакции. Реакция алкоксисиланов с хлористым водородом является обратимой, поэтому быстрое и эффективное удаление хлористого водорода из зоны реакции позволяет существенно интенсифицировать процесс и увеличить выход целевого продукта.
На практике часто используют связывание хлористого водорода основаниями, например третичными аминами, такими как пиридин или триэтиламин, а также неорганическими основаниями, такими, например, как карбонаты или фосфаты щелочных металлов, которые связывают хлористый водород.
При этом в качестве дихлорсиланов могут быть использованы любые дихлорсиланы, например, такие как диметилдихлорсилан; метилфенилдихлорсилан; дифенилдихлорсилан; 1,1,3,3-тетраметил-1,3-дихлордисилоксан; 1,3-диметил-1,3-дихлор-1,3-дифенилдисилоксан; 1,3 -дихлор-1,1,3,3 -тетрафенилдисилоксан
Схема синтеза по предложенному способу приведена ниже.
Полученный модифицированный кремнийорганическими фрагментами мономер фталонитрила при комнатной температуре представляет собой вязкую жидкость или полутвердое вещество.
Модифицированный кремнийорганическими фрагментами мономер фталонитрила может быть использован для изготовления связующего, которое можно применить как для получения препрегов, так и для производства композиционных материалов, в частности, особенно он подходит для производства композитов методом инжекции.
Связующее кроме модифицированного кремнийорганическими фрагментами фталонитрила дополнительно содержит ароматический диамин в качестве инициатора полимеризации. В наилучших воплощениях изобретения, количество ароматического диамина не превышает по массе 10%.
В качестве ароматических диаминов, инициирующих полимеризацию, могут быть использованы такие диамины как 4,4′-диаминодифенилметан, 4,4′-диаминодифенилсульфон, 4,4′-(1,3-фениленбис(окси))дианилин, 4,4′-(1,4-фениленбис(окси))дианилин, 4,4′-((сульфонилбис(4,1-фенилен))бис(окси))дианилин, 3,3′-((сульфонилбис(4,1-фенил ен))бис(окси)) дианилин.
Препрег получают путем пропитки полученным связующим армирующего наполнителя, в качестве которого может быть использован широкий спектр материалов - начиная от армирующих волокон до тканей из этих волокон.
Способ поясняется примерами его осуществления.
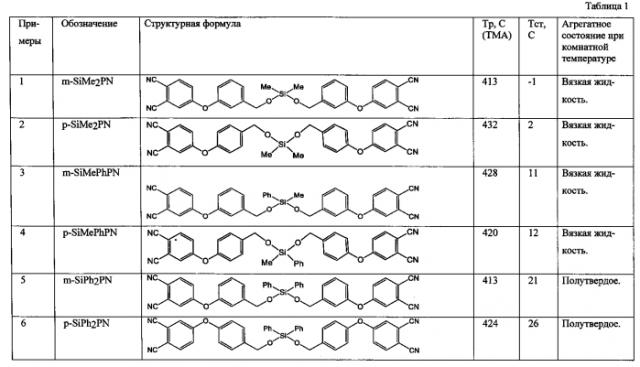
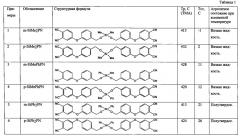
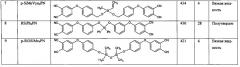
Структура и свойства синтезированных в соответствии с примерами фталонитрилов приведены в табл.1.
Пример 1.
Получили модифицированный кремнийорганическими соединениями фталонитрил 4-[4-(гидроксиметил)фенокси]бензол-1,2-дикарбонитрил.
1. На первой стадии осуществления изобретения получали гидроксилсодержащий фталонитрил в соответствии со следующим.
В трехгорлую колбу на 250 мл, снабженную обратным холодильником с кран-пробкой, добавляли 5 г 4-гидроксиметилфенола, 5,56 г карбоната калия и 30 мл диметил-формамида при перемешивании на магнитной мешалке. Реакционную смесь охлаждали до 0°С, добавляли 6,97 г 4-нитрофталонитрила и оставили перемешиваться на сутки. На следующий день реакционную смесь нагревали при 70°С в течение 6 часов, затем охлаждали до комнатной температуры и вылили в 500 мл холодной воды. Выпавший осадок коричневого цвета отфильтровали, растворяли в хлористом метилене и трижды проэкстрагировали водой. Нижнюю фракцию слили в стакан и упарили хлористый метилен на роторном испарителе.
Получили 4-[4-(гидроксиметил)фенокси]бензол-1,2-дикарбонитрил. Выход составил 5,32 г (49,63%).
2. На второй стадии получали 4,4′-(((((метил(фенил)силандиил)бис(окси)) бис(метилен))бис(4,1-фенилен))бис(окси))дифталонитрил (см. таблицу 1, № п/п 4).
В трехгорлую колбу на 250 мл, снабженную обратным холодильником и кран-пробкой, помещали 5 г (20 ммоль) 4-[4-(гидроксиметил)фенокси]бензол-1,2-дикарбонитрила, затем подсоединяли прибор, содержащий ТГФ (абсолютный). Из прибора, содержащего ТГФ, добавляли 100 мл растворителя и перемешивали на магнитной мешалке до полного растворения. Затем сменили стеклянную пробку на резиновую и добавляли 5,57 мл (40 ммоль) триэтиламина. Далее добавляли 1,908 г (10 ммоль) фенилметилдихлорсилана и оставили перемешиваться на ночь. Реакционную смесь профильтровали, осадок промывали 100 мл ТГФ, упаривали раствор на масляном насосе при 100°С и растворяли полученное вещество в хлористом метилене. С помощью колоночной хроматографии выделяли продукт в растворе, в качестве элюента использовали смесь гексан-хлористый метилен. Раствор упаривали на роторном испарителе, выход составил 4,17 г (67,42%).
Пример 2.
Получали модифицированный кремнийорганическими соединениями фталонитрил 4,4′-(((((диметилсиландиил)бис(окси))бис(метилен))бис(4,1-фенилен))бис(окси)) дифталонитрил (см. таблицу 1, № п/п 2).
1. Для этого сначала получали 4-[4-(гидроксиметил)фенокси] бензол-1,2-дикарбонитрил в соответствии с первой стадией примера 1.
2. Затем в трехгорлую колбу на 250 мл, снабженную обратным холодильником и кран-пробкой, помещали 5 г (20 ммоль) полученного 4-[4-(гидроксиметил)фенокси]бензол-1,2-дикарбонитрила, затем подсоединяли прибор, содержащий ТГФ (абсолютный). Из прибора, содержащего ТГФ, добавляли 50 мл растворителя и перемешивали на магнитной мешалке до полного растворения. Затем меняли стеклянную пробку на резиновую и добавляли 5,57 мл (40 ммоль) триэтиламина. Далее добавляли 1,29 г (10 ммоль) диметилди-хлорсилана и оставляли перемешиваться на ночь. Реакционную смесь профильтровали, осадок промывали 100 мл ТГФ, упаривали раствор на масляном насосе при 100°С и растворяли полученное вещество в хлористом метилене. С помощью колоночной хроматографии выделяли продукт в растворе, в качестве элюента использовали смесь гексан-хлористый метилен. Раствор упаривали на роторном испарителе, выход составил 3,503 г (62,98%).
Пример 3.
Получали 4,4′-(((((дифенилсиландиил)бис(окси))бис(метилен))бис(4,1-фенилен))бис(окси))дифталонитрил (таблицу 1, № п/п 6).
1. На первой стадии получали 4-[4-(гидроксиметил)фенокси]бензол-1,2-дикарбонитрил в соответствии с первой стадией примера 1.
2. В трехгорлую колбу на 250 мл, снабженную обратным холодильником и кран-пробкой, помещали 3,62 г (14 ммоль) полученного 4-[4-(гидроксиметил)фенокси]бензол-1,2-дикарбонитрила, затем подсоединили прибор, содержащий ТГФ (абсолютный). Из прибора, содержащего ТГФ, добавляли 35 мл растворителя и перемешивали на магнитной мешалке до полного растворения. Затем меняли стеклянную пробку на резиновую и добавляли 4,04 мл (29 ммоль) триэтиламина. Далее прибор охлаждали до 0°С, добавляли 1,83 г (7 ммоль) дифенилдихлорсилана и оставили перемешиваться на ночь. Реакционную смесь профильтровали, осадок промыли 100 мл ТГФ, упарили раствор на масляном насосе при 100°С и растворяли полученное вещество в хлористом метилене. С помощью колоночной хроматографии выделили продукт в растворе, в качестве элюента использовали смесь гексан-хлористый метилен. Раствор упарили на роторном испарителе, выход составил 4,46 г (90,65%).
Пример 4.
Получали 4,4′-(((((метил(фенил)силандиил)бис(окси))бис(метилен))бис(3,1 -фенилен))бис(окси))дифталонитрил (см. таблица 1, строка № п/п 3).
1. На первой стадии осуществления изобретения получали гидроксилсодержащий фталонитрил состава: 4-[3-(гидроксиметил)фенокси]бензол-1,2-дикарбонитрил в соответствии со следующим.
В трехгорлую колбу на 250 мл, снабженную обратным холодильником с кран-пробкой, добавляли 7 г (56 ммлоь) 3-гидроксиметилфенола, 7,78 г (56 ммоль) карбоната калия и 40 мл диметилформамида при перемешивании на магнитной мешалке. Реакционную смесь охлаждали до 0°С, добавляли 9,69 г (56 ммоль) 4-нитрофталонитрила и оставили перемешиваться на сутки. На следующий день реакционную смесь нагревали при 70°С в течение 6 часов, затем охлаждали до комнатной температуры и выливали в 500 мл холодной воды. Выпавший осадок коричневого цвета отфильтровали, растворяли в хлористом метилене и трижды проэкстрагировали водой. Нижнюю фракцию слили в стакан и упарили хлористый метилен на роторном испарителе.
2. В трехгорлую колбу, снабженную обратным холодильником помещали 10г (40 ммоль) 4-[3-(гидроксиметил)фенокси]бензол-1,2-дикарбонитрила и 100 мл растворителя тетрагидрофурана (ТФГ) и перемешивали до полного растворения. Затем добавляли 9,107 мл триэтиламина. Далее в колбу вводили 3,82 г (20 ммоль) фенилметилдихлорсилана и оставили перемешиваться на ночь. Реакционную смесь профильтровали, осадок промыли 100 мл ТГФ, упарили раствор на масляном насосе при 100°С и растворяли полученное вещество в хлористом метилене. С помощью колоночной хроматографии выделили продукт в растворе, в качестве элюента использовали смесь гексан-хлористый метилен. Раствор упарили на роторном испарителе, выход составил 7,42 г (59,79%).
Пример 5.
Получали 4,4′-(((((диметилсиландиил)бис(окси))бис(метилен))бис (3,1-фенилен))бис(окси))дифталонитрил (см. таблица 1, строка № п/п 1).
1. На первой стадии осуществления изобретения получали гидроксилсодержащий фталонитрил состава 4-[3-(гидроксиметил)фенокси]бензол-1,2-дикарбонитрил в соответствии со стадией 1 примера 4.
2. В трехгорлую колбу на 250 мл, снабженную обратным холодильником и кран-пробкой, помещали 5 г (20 ммоль) 4-[3-(гидроксиметил)фенокси]бензол-1,2-дикарбонитрила, затем подсоединяли прибор, содержащий ТГФ(абсолютный). Из прибора, содержащего ТГФ, добавляли 50 мл растворителя и перемешивали на магнитной мешалке до полного растворения. Затем сменили стеклянную пробку на резиновую и добавляли 5,57 (40 ммоль) мл триэтиламина. Далее в колбу добавляли 1,29 г (10 ммоль) диметилдихлорсиланаи оставляли перемешиваться на ночь.. Реакционную смесь профильтровывали, осадок промывали 100 мл ТГФ, упаривали раствор на масляном насосе при 100°С и растворяли полученное вещество в хлористом метилене. С помощью колоночной хроматографии выделяли продукт в растворе, в качестве элюента использовали смесь гексан-хлористый метилен.
Раствор упаривали на роторном испарителе, выход составил 2,41 г (43,30%).
Пример 6.
Получали 4,4′-(((((дифенилсиландиил)бис(окси))бис(метилен))бис(3,1-фенилен))бис(окси))дифталонитрил (5).
1. На первой стадии осуществления изобретения получали гидроксилсодержащий фталонитрил состава 4-[3-(гидроксиметил)фенокси]бензол-1,2-дикарбонитрил в соответствии со стадией 1 примера 4.
2. В трехгорлую колбу на 250 мл, снабженную обратным холодильником и кран-пробкой, помещали 5 г (20 ммоль) 4-[3-(гидроксиметил)фенокси]бензол-1,2-дикарбонитрила, затем подсоединили прибор, содержащий ТГФ(абсолютный). Из прибора, содержащего ТГФ, добавляли 50 мл растворителя и перемешивали на магнитной мешалке до полного растворения. Затем сменили стеклянную пробку на резиновую и добавляли 5,57 мл (40 ммоль) триэтиламина. Далее прибор охлаждали до 0°С, добавляли 2,532 г (10 ммоль) ди-фенилдихлорсилана и оставляли перемешиваться на ночь. Реакционную смесь профильтровали, осадок промывали 100 мл ТГФ, упаривали раствор на масляном насосе при 100°С и растворяли полученное вещество в хлористом метилене. С помощью колоночной хроматографии выделяли продукт в растворе, в качестве элюента использовали смесь гексан-хлористый метилен. Раствор упаривали на роторном испарителе,
Выход составил 2,89 г (42,46%).
Далее из данного связующего готовили препрег.
Для этого на валки подавали связующее из модифицированных фталонитрилов по примерам 1 и 3. В качестве ароматического диамина использовали - (1,3-фениленбис(окси))дианилин в количестве 1 масс. % (для фталонитрила по примеру 2) и -(1,3-фениленбис(окси))дианилин в количестве 3 масс. % (для фталонитрила по примеру 4). Пленка связующего заданной толщины, из расчета 40% массовых от поверхностной плотности конечного препрега, посредством валков переносилась на силиконизированную бумагу. Затем происходило совмещение углеродной ткани или однонаправленной ленты с пленкой связующего на бумаге и каландрирование разогретыми до 100°С каландрами между двумя силиконизированными бумагами, обеспечивающими равномерное распределение и пропитку углеродных волокон связующим.
Полученный препрег наматывали в рулоны.
Препрег обладает липкостью при комнатной температуре.
Связующее из модифицированных фталонитрилов в соответствии с примерами 2 и 4 протестировали в качестве связующего для инфузионной технологии. В качестве инициатора полимеризации использовали следующие диамины 4,4′-Диаминодифенилсульфон в количестве 3%.
В формы для вакуумной инжекции укладывали 8 слоев углеродной однонаправленной ленты плотностью 200 г/м2, затем откачивали воздух и подавали разогретое до 100°С связующее при 110°С внутри формы. Затем ступенчато отверждали при 200°С, 250°С, 300°С, 350°С, 375°С.
Пример 7.
Получали модифицированный кремнийорганическими соединениями фталонитрил 4,4′-(((((винил(метил)силандиил)бис(окси))бис(метилен))бис(4,1-фенилен))бис(окси))дифталонитрил (см. таблицу 1, № п/п 7).
1. Для этого сначала получали 4-[4-(гидроксиметил)фенокси]бензол-1,2-дикарбонитрил в соответствии с первой стадией примера 1.
2. Затем в трехгорлую колбу на 250 мл, снабженную обратным холодильником и кран-пробкой, помещали 5 г (20 ммоль) полученного 4-[4-(гидроксиметил)фенокси]бензол-1Д-дикарбонитрила, затем подсоединяли прибор, содержащий ТГФ (абсолютный). Из прибора, содержащего ТГФ, добавляли 50 мл растворителя и перемешивали на магнитной мешалке до полного растворения. Затем меняли стеклянную пробку на резиновую и добавляли 5,57 мл (40 ммоль) триэтиламина. Далее добавляли 1,41 г (10 ммоль) винилметилдихлорсилана и оставляли перемешиваться на ночь. Реакционную смесь профильтровавали, осадок промывали 100 мл ТГФ, упаривали раствор на масляном насосе при 100°С и растворяли полученное вещество в хлористом метилене. С помощью колоночной хроматографии выделяли продукт в растворе, в качестве элюента использовали смесь гексан-хлористый метилен. Раствор упаривали на роторном испарителе, выход составил 3,98 г (69,95%).
Пример 8.
Получали модифицированный кремнийорганическими соединениями фталонитрил 4,4′(((((дифенилсиландиил)бис(окси)))бис(3,1-фенилен))бис(окси)) дифталонитрил (см. таблицу 1, № п/п 8).
1. Для этого сначала получали 4-[3-(гидрокси)фенокси]бензол-1,2-дикарбонитрил в соответствии с первой стадией примера 1, но вместо 4-гидроксиметилфенола брали 3-гидроксифенол (резорцин).
2. Затем в трехгорлую колбу на 250 мл, снабженную обратным холодильником и кран-пробкой, помещали 4.72 г (20 ммоль) полученного 4-[3-(гидрокси)фенокси]бензол-1,2-дикарбонитрила, затем подсоединяли прибор, содержащий ТГФ (абсолютный). Из прибора, содержащего ТГФ, добавляли 50 мл растворителя и перемешивали на магнитной мешалке до полного растворения. Затем меняли стеклянную пробку на резиновую и добавляли 5,57 мл (40 ммоль) триэтиламина. Далее добавляли 2,53 г (10 ммоль)винилметилдихлорсилана и оставляли перемешиваться на ночь. Реакционную смесь профильтровавали, осадок промывали 100 мл ТГФ, упаривали раствор на масляном насосе при 100°С и растворяли полученное вещество в хлористом метилене. С помощью колоночной хроматографии выделяли продукт в растворе, в качестве элюента использовали смесь гексан-хлористый метилен. Раствор упаривали на роторном испарителе, выход составил 5,81 г (88,97%).
Пример 9.
Получали модифицированный кремнийорганическими соединениями фталонитрил 1,3-бис(4-(3,4-динитрилфенилокси)фенилокси)-1,1,3,3-тетраметилдисилоксана (см. таблицу 1, № п/п 9).
1. Для этого сначала получали 4-[4-(гидрокси)фенокси]бензол-1,2-дикарбонитрил в соответствии с первой стадией примера 1, но вместо 4-гидроксиметилфенола брали 4-гидроксифенол (гидрохинон).
2. Затем в трехгорлую колбу на 250 мл, снабженную обратным холодильником и кран-пробкой, помещали 4.72 г (20 ммоль) полученного 4-[4-(гидрокси)фенокси]бензол-1,2-дикарбонитрила, затем подсоединяли прибор, содержащий ТГФ (абсолютный). Из прибора, содержащего ТГФ, добавляли 50 мл растворителя и перемешивали на магнитной мешалке до полного растворения. Затем меняли стеклянную пробку на резиновую и добавляли 5,57 мл (40 ммоль) триэтиламина. Далее добавляли 2,03 г (10 ммоль) 1,3-дихлор-1,1,3,3-тетраметилдисилоксана и оставляли перемешиваться на ночь. Реакционную смесь профильтровавали, осадок промывали 100 мл ТГФ, упаривали раствор на масляном насосе при 100°С и растворяли полученное вещество в хлористом метилене. С помощью колоночной хроматографии выделяли продукт в растворе, в качестве элюента использовали смесь гексан-хлористый метилен. Раствор упаривали на роторном испарителе, выход составил 4,47 г (74,33%).
Как следует из представленных таблице 1 данных, предложенный фталонитрильный модифицированный мономер обладает низкой температурой стеклования Тс, обеспечивающей агрегатное состояние фталонитрильного мономера при комнатной температуре в виде вязкой жидкости или полутвердого (стеклообразного) вещества, что позволяет использовать его, в частности, для изготовления препрегов и композитов по инфузионным технологиям. Получаемые при этом препреги обладают улучшенной живучестью, что обусловлено низкой температурой стеклования.
Кроме того, полученный мономер обладает высокой температурой размягчения, что свидетельствует о его высокой термостойкости и, соответственно, высокой термостойкости получаемых композитов.
1. Модифицированный кремнийорганическими фрагментами фталонитрильный мономер, характеризующийся общей формулой где X - двухвалентный ароматический радикал, выбранный из группы, включающей и ;Y - кремнийорганический фрагмент, выбранный из группы, включающей -SiR1R2 и SiR1R2-O-SiR1R2, где R1 и R2 - радикалы, выбранные из группы, включающей СН3, С6Н5, и НС=СН2.
2. Способ получения модифицированного кремнийорганическими фрагментами фталонитрильного мономера по п.1, характеризующийся тем, что сначала получают гидроксилсодержащий фталонитрил, а затем упомянутый гидроксилсодержащий фталонитрил в безводном апротонном растворителе подвергают взаимодействию с дихлорсиланом в присутствии основания с последующим извлечением из продуктов взаимодействия целевого продукта в виде модифицированного кремнийорганическими фрагментами мономерного фталонитрила.
3. Способ по п.2, характеризующийся тем, что гидроксилсодержащий фталонитрил получают путем взаимодействия 4-нитрофталонитрила с дигидроксилсодержащим ароматическим соединением в апротонном растворителе в инертной атмосфере в присутствии неорганического основания.
4. Способ по п.2, характеризующийся тем, что извлечение целевого продукта осуществляют путем последовательно проводимых фильтрации продуктов взаимодействия с получением фильтрата и осадка, последующего упаривания фильтрата, растворения продукта упаривания и выделения из него целевого продукта.
5. Способ по п.2, характеризующийся тем, что в качестве безводного апротонного растворителя используют тетрагидрофуран.
6. Способ по п.2, характеризующийся тем, что в качестве основания используют третичные амины.
7. Связующее, характеризующееся тем, что включает модифицированный кремнийорганическими фрагментами мономер фталонитрила в соответствии с любым из предшествующих пунктов формулы и ароматический диамин в качестве инициатора полимеризации.
8. Связующее по п.7, характеризующееся тем, что содержит ароматический диамин в количестве до 10 мас.%.
9. Связующее по п.7, характеризующееся тем, что его используют в качестве связующего для получения полимерных композиционных материалов по инфузионным технологиям.
10. Препрег, характеризующийся тем, что выполнен из связующего в соответствии с любым из пп. 7-9 формулы и армирующего элемента.
11. Препрег по п.10, характеризующийся тем, что в качестве армирующего элемента содержит элемент, выбранный из группы, включающей углеродные направленные ленты, углеродные ткани, стеклоткани, стеклянные однонаправленные ленты, углеродные рубленые волокна, стеклянные рубленые волокна.