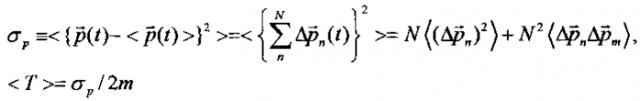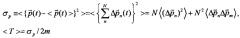Способ очистки воды от радионуклидов
Иллюстрации
Показать всеИзобретение относится к способу очистки воды от радионуклидов. В заявленном способе приготавливают питательную среду для роста микробиологических культур, дефицитную по химическому элементу, соответствующему изотопу, получаемому в результате трансмутации, и содержащую необходимые для трансмутации исходные изотопные компоненты; выращивают в этой питательной среде микробиологические культуры. При этом процесс трансмутации осуществляют в три стадии, в течение первой из которых стимулируют эффект мутагенной адаптации содержащихся в биомассе микроорганизмов к конкретным типам радионуклидов. Затем постепенно добавляют порции подлежащего очистке водного раствора с радионуклидами, которые не приводят к гибели биомассы за счет радиоактивного облучения, вплоть до достижения концентрации подлежащего очистке раствора. Далее производят оптимизацию биологической части процесса трансмутации в полученном растворе. После осуществления трансмутации биомасса удаляется из очищаемой воды. Техническим результатом является создание в очищаемом водном растворе условий для ядерной трансмутации радиоактивных изотопов одних химических элементов в нерадиоактивные изотопы других химических элементов в синтрофных ассоциациях микробиологических культур. 6 з.п. ф-лы, 4 ил.
Реферат
Изобретение относится к области переработки жидких радиоактивных отходов, в частности к способам очистки воды от радионуклидов.
Проблема очистки воды, загрязненной радионуклидами, является одной из наиболее актуальных задач экологии. Появление такой воды связано как с плановыми технологическими операциями, обусловленными спецификой деятельности ядерно-ориентированного производства, так и с нештатными ситуациями, вызванными, в частности, авариями на ядерно-ориентированных объектах.
В процессе ядерной реакции деления в атомных реакторах образуется большое количество радиоактивных изотопов и изомеров (высокоактивных отходов) со средним или большим временем жизни:
H3, Be7, C14, F18, Na22, 24, Si31, P32, 33, S35, Cl36, 38, K42, 43, Ca45, 47, Sc46, 47, 48, V48, Cr51, Mn51, 52, 52m, 53, 54, 56, Fe52, 55, 59, Co55, 56, 57, 58, 58m, 60, 60m, 61, 62m, Ni59, 63, 65, Cu64, Zn65, 69, 69m, Ga67, Ge67, As73, 74, 76, 77m, Se75, Br82, Rb86, Sr85, 85m, 87m, 89, 90, 91, 92, Y90, 91, 91m, 92, 93, Zr93, 95, 97, Nb93m, 94, 95, 97, 98, Mo90, 93, 99, 101, Tc96, 96m, 97, 97m, 99, 99m, Rh97, 103, 105, 106Ru, 103m, 105, Pd103, 109, Ag105, 110m, 111, Cd109, 115, 115m, In111, 113m, 114m, 115m, Sn113, 125, Sb122, 124, 125, Te123m, 125m, 127, 127m, 129, 129m, 131, 131m, 132, 133, 133m, 134, I123, 125, 126, 129, 130, 131, 132, 133, 134, 135, Cs129, 131, 132, 134, 134m, 135, 136, 137, 138, Ba131, 140, La140, Ce139, 141, 143, 144, Pr142, 143, Nd147, 149, Pm147, 149, Eu151, 153Sm, 152, 152m, 154, 155, Gd153, 159, Tb160, Dy165, 166, Ho166, Er169, 171, Tm170, 171, Yb175, Lu177, Hf181, Ta182, W181, 185, 187, Re186, 188, Os185, 191, 191m, 193, Ir190, 192, 194, Pt191, 193m, 197, 197m, Au198, 199, Hg198, 199, Pb200, 201, 202, 204Tl, 203, Bi206, 207, Po203, 205, 207, At211, Ra225, 227, Th226, 229, Pa230, 233, U230, 231, 232, 233, 236, 237, 239, 240, Np237, 239, 240, Pu234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, Am241, 242, 242m, 243, Cm242, 243, 244, 245, 246, 247, 248, Bk249, Cf246, 248, 249, 250, 251, 252, 253, 254, Es253, 254, 254m, Fm254, 255.
Из этих радионуклидов наиболее опасными для биологических объектов являются изотопы Sr90, Tc99, 99m, Cs137, Np237, 239, Pu238, 239, 240, 241, Am241, Cm242.
Известен способ биологической очистки воды от техногенных радионуклидов (патент RU 2255906, опубликован 10.07.2005), основанный на явлении высоких поглотительных свойств некоторых водорослей (в частности, Phillophonia elongata, Ulwa regida, Thalassiosira и др.), рассаду которых помещают в биоконтейнеры, установленные в объеме подлежащей очистке загрязненной воды. При выращивании этих водорослей в течение 20-40 суток в процессе метаболизма происходит активная абсорбция на основе метаболических и биохимических процессов и накопление некоторых типов радионуклидов, что ведет к очищению воды. После заполнения растущими водорослями биоконтейнер извлекают из воды, а затем водоросли сушат и сжигают, а радиоактивный зольный остаток подлежит захоронению. Максимальный коэффициент накопления радионуклидов этими водорослями (по отношению к аналогичной массе воды) равен 30 (для Cs137) и 40 (для Sr90).
Недостатком этого способа является то, что он не решает проблемы деактивации радионуклидов, поскольку опасные радионуклиды не уничтожаются, а переводятся в другое состояние (озоляются).
Известен способ утилизации радиоактивных отходов путем облучения их тепловыми нейтронами (патент US 4721596 А, опубликован 26.01.1988). При таком облучении происходит захват нейтронов ядрами долгоживущих изотопов с последующим каскадом ядерных превращений и образованием других изотопов, которые, в частности, могут быть более короткоживущими, что уменьшает длительность естественной деактивации путем спонтанного распада.
Недостатком этого способа является то, что реакции деления под действием медленных нейтронов могут протекать только в некоторых тяжелых радиоактивных изотопах (в частности в U235 и Pu239) и, кроме того, поглощение таких нейтронов многими стабильными ядрами средних по массе элементов может приводить к формированию радиоактивных изотопов этих ядер.
Техническим результатом, на получение которого направлено изобретение, является создание способа очистки водных растворов, содержащих радионуклиды, за счет явления трансмутации (ядерного преобразования) ионов радиоактивных изотопов (радионуклидов) в другие стабильные изотопы в растущих микробиологических культурах.
Технический результат достигается в изобретении за счет создания в очищаемом водном растворе условий для ядерной трансмутации радиоактивных изотопов одних химических элементов в нерадиоактивные изотопы других химических элементов в растущих микробиологических культурах, для чего приготавливают питательную среду для роста микробиологических культур, дефицитную по химическому элементу, соответствующему изотопу, получаемому в результате трансмутации (Изотоп 1), и содержащую необходимые для трансмутации исходные изотопные компоненты (Изотоп 2); выращивают в этой питательной среде микробиологические культуры, требующие Изотопы 1 для своего роста и развития, для чего добавляют биомассу микроорганизмов, например, в виде гранул, включающую микробные синтрофные ассоциации в жизнеспособном состоянии в указанную питательную среду, причем процесс трансмутации осуществляют в три стадии, в течение первой из которых стимулируют эффект мутагенной адаптации содержащихся в биомассе микроорганизмов к конкретным типам радионуклидов (Изотопы 3), содержащимся в подлежащем очистке водном растворе путем поэтапного выдерживания биомассы микроорганизмов при оптимальной (повышенной до 30-40°C) температуре, ускоряющей процесс мутагенеза, в течение времени в интервале от 10 часов для аэробных микроорганизмов до 24 часов для анаэробных микроорганизмов, в жидкости, состав которой включает воду в количестве, достаточном для покрытия объема биомассы с питательной средой и поэтапно увеличивающемся путем добавления порций подлежащего очистке водного раствора с радионуклидами, которые не приводят к гибели биомассы за счет радиоактивного облучения, вплоть до достижения концентрации подлежащего очистке раствора, после чего в течение второй стадии производят оптимизацию биологической части процесса трансмутации в полученном растворе путем раздельного добавления в разные небольшие части полученного водного раствора основных необходимых микроэлементов и/или комбинаций этих микроэлементов и, после выдержки в этих частях в течение определенного времени одинакового количества прошедшей мутагенную адаптацию биомассы, выбора тех микроэлементов и/или комбинаций этих микроэлементов, которые максимально ускоряют процесс трансмутации, а затем на третьей стадии добавляют в очищаемый водный раствор выбранные микроэлементы и/или выбранные комбинации микроэлементов в необходимом количестве, обеспечивающем максимальную скорость трансмутации радиоактивных изотопов во всем объеме подлежащего очистке водного раствора, после чего биомасса удаляется из очищаемой воды. Длительность третьего этапа определяется временем достижения требуемой величины остаточной радиоактивности очищаемого раствора. При этом в изобретении для блокировки прямого поглощения радионуклидов биомассой микроорганизмов без их трансмутации в подлежащую очистке воду или в биомассу вводится достаточное для роста биомассы количество тех микроэлементов, которые необходимы для этого роста и являются стабильными аналогами (стабильными изотопами) тех радионуклидов, которые необходимо утилизировать.
В одном из вариантов изобретения после соединения биомассы микроорганизмов с питательной средой проводят ее гранулирование в присутствии соединений, образующих стабильные неразмокаемые в воде гранулы, структура которых не препятствует свободному движению воды и растворенных в ней солей и радионуклидов по всему объему гранул.
В одном из вариантов изобретения биомассу микроорганизмов формируют с использованием синтрофных ассоциаций аэробных и анаэробных микроорганизмов.
Предпочтительно с целью очистки от радионуклидов растворов, содержащих морскую воду (не пресную) или основанных на такой воде, используют биомассу микроорганизмов, включающую микробные синтрофные ассоциации в жизнеспособном состоянии, адаптированные к морской воде, например, на основе жизнеспособных илов, для которых морская вода является естественной средой обитания.
Предпочтительно в течение третьей стадии процесса трансмутации проведение непрерывного перемешивания водного раствора с биомассой и/или продувание воздуха (барботирование) сквозь водный раствор с биомассой.
Предпочтительно при очистке водных растворов от радионуклидов Cs137 и Sr90 путем их трансмутации в стабильные изотопы других элементов из состава питательной среды исключение (или снижение концентрации) элементов Mg и K.
Указанные отличительные признаки позволяют реализовать способ очистки водных растворов, содержащих радионуклиды одних химических элементов, за счет их трансмутации в стабильные изотопы других химических элементов.
На фиг. 1. представлен спектр относительной интенсивности гамма-излучения реакторных изотопов, содержащихся в очищаемой воде, на 10 день после извлечения из активной зоны водо-водяного ядерного реактора.
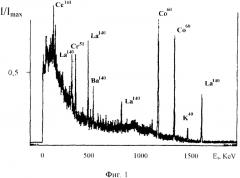
На фиг. 2 представлена зависимость активности Q(t) реакторного изотопа La140 в пробах реакторной воды в эксперименте по трансмутации (активность Qcultures в кюветах в присутствии гранул, содержащих синтрофные ассоциации метаболически активных микроорганизмов), и в контрольных кюветах без микроорганизмов (активность Qcontrol).
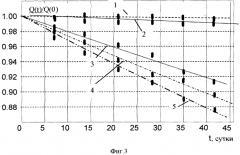
На фиг. 3. показана ускоренная утилизация (деактивация) изотопа Cs137 в «биологических ячейках» в присутствии микробиологических гранул и различных химических элементов. 1 - Cs137 (контроль), τ*≈30 лет; 2 - Cs137 + гранулы + KCl, τ*≈10 лет; 3 - Cs137 + гранулы + NaCl, τ*≈480 дней; 4 - Cs137 + гранулы, τ*≈380 дней; 5 - Cs137 + гранулы + CaCO3, τ*≈310 дней.
На фиг. 4. проиллюстрирован принцип формирования гигантских флуктуаций импульса и кинетической энергии в когерентном коррелированном состоянии (справа).
Процесс трансмутации изотопов в растущей микробиологической культуре и синтрофной ассоциации таких культур связан с двумя факторами.
Первый из них относится к собственно биологическим процессам использования и усвоения химических элементов в метаболических процессах, а второй - к физическим процессам ядерного превращения, стимулированным биологическими процессами.
Процесс роста любого конкретного биологического объекта требует строго определенного набора химических микро- и макроэлементов. Отсутствие хотя бы одного из этих элементов полностью тормозит этот рост.
К числу жизненно необходимых элементов относятся
O (типичная концентрация в живой культуре около 24%), H (около 64%), C (около 9%), N (около 0,13%)).
В число необходимых для роста различных биологических культур микроэлементов входят
Na (7.10-3%), K (4,5.10-2%), Ca (7,5.10-2%), Mg (2.10-2%), Fe (8.10-4%), P (1,3.10-2%), Si (3,5.10-2%), Cl (7.10-3%), Al (6.10-3%), B (6.10-4%), Ti (10-4%), Zn (3.10-5%), Li (10-4%), Cu (10-5%), Sr (10-5%), Ba (5.10-6%), F (3.10-5%), Br (6.10-6%), Rb (4.10-6%), Sn (10-6%), Ni (5.10-6%), Mo (10-6%), Со (10-6%).
Указанные концентрации являются типичными, но могут отличаться в несколько раз для различных культур.
Для некоторых их микробиологических культур необходимыми являются также микроэлементы S, Mn, J, Hg и другие.
В отсутствие какого-либо из необходимых химического элемента возможна его замена на биохимический (стереохимический) аналог, который имеет близкий ионный радиус и такую же (или близкую) валентность. В частности, если атомы необходимого химического элемента отсутствуют в составе питательной среды, но они могут формироваться в процессе ядерного синтеза из подходящих нуклидов, то после процесса синтеза вновь образованное ядро необходимого элемента вместе с электронным окружением сразу встраивается в растущую культуру. Аналогичная ситуация соответствует тому случаю, когда в отсутствие атомов необходимого химического элемента процесс синтеза приводит к формированию его стереохимического аналога.
Процесс "встраивания" синтезируемого элемента (изотопа 1) в растущую биологическую систему является фактически процессом фиксации и необратимости этого синтеза. Процесс ядерного синтеза происходит с участием исходных ядер за счет, например, кратковременной флуктуации энергии δE за время δt. Если эта флуктуация достаточна для преодоления кулоновского барьера реакции и при этом в результате реакции за время δt выделяется энергия ΔE>δE, то процесс синтеза становится необратимым. В противоположном случае, когда ΔE<δE, реакция является обратимой и не приводит к формированию необходимого изотопа.
Еще одной особенностью заявляемого способа является использование не чистых микробиологических культур, а синтрофных микробиологических ассоциаций, включающих много тысяч различных типов микроорганизмов, принадлежащих к разным физиологическим группам, которые представляют разные группы микробного метаболизма и характеризуются различными механизмами микробной аккумуляции.
Эти микроорганизмы не находятся в форме простой механической смеси. Они сосуществуют в синтрофной ассоциации в таком состоянии совместного симбиоза, когда фактически образуют единый макроорганизм (хотя и с раздельными системами внутреннего метаболизма). В его объеме каждый член и каждая физиологическая группа сообщества максимально адаптированы к совместной жизнедеятельности и находятся в состоянии коллективной взаимопомощи и взаимозащиты. Эта система обладает высокой приспосабливаемостью к разным вариациям и "агрессивным" проявлениям внешней среды (в частности, к высокому уровню радиоактивного облучения, наличию токсинов или малым значениям водородного показателя pH).
При каждом типе конкретного биохимического окружения максимально благоприятные условия для развития имеют микроорганизмы, принадлежащие к конкретной физиологической группе. Все остальные группы синтрофной ассоциации "играют" вспомогательную роль, работая на лидера, который максимально эффективно развивается. При изменении внешних условий (изменение температуры, изменение состава питательной среды, действие токсинов и ионизирующей радиации, дополнительное действие свободных радикалов и др.) роль лидера может перейти к другой физиологической группе, максимально адаптированной к изменившимся условиям. Бывшие лидеры становятся участниками коллективной помощи, способствуя развитию лидирующей группы и ассоциации в целом.
Такая система оказывается максимально адаптированной к изменяющимся агрессивным условиям, что соответствует их росту, в том числе в условиях действия радиации. Эффективность такой "коллективной защиты" исключительно высока. Известно, например, что в кислой среде с pH 2 (концентрированная соляная кислота) никакие "чистые" штаммы микроорганизмов не могут развиваться. В то же время синтрофная ассоциация после некоторого переходного периода адаптации успешно растет и развивается в такой среде. Временной интервал полной адаптации соответствует смене 5-10 поколений, что позволяет оценить этот интервал периодом от 10 часов до 10 суток.
В эксперименте исследуемая вода имела активность около 10-4 Кюри/л и содержала ряд высокоактивных нестабильных изотопов (в частности, Na24, K40, Co60, Sr90, 91, I131, Xe135, Ba140, La140, Ce141, Np239), см. Фиг. 1.
Одинаковые по объему пробы воды (около 5 мл) помещались в одинаковые стеклянные тонкостенные закрываемые кюветы объемом около 10 мл. В часть кювет с радиоактивной водой помещалось одинаковое по массе количество гранулированной биомассы микроорганизмов. Остальные кюветы с аналогичной радиоактивной водой но без присутствия гранулированной биомассы были контрольными.
Исследования проводились на основе анализа изменения амплитуды спектральных линий, энергия которых превосходит 500 КэВ. Это сделано для повышения точности, поскольку для более мягкого излучения существенно влияние комптоновского фона и поглощение в объеме воды в кювете.
На фиг. 2 представлены усредненные результаты зависимости активности изотопа La140 в экспериментальных кюветах (Qcultures) и в контрольных кюветах (Qcontrol) от времени после начала экспериментов. Этот изотоп имеет сравнительно небольшое время жизни (τLa=40.3 часа), образуется при бета-распаде и является дочерним нестабильным изотопом более долгоживущего изотопа Ba140, у которого время жизни равно τBa=12.7 дня.
Начальные удельные активности изотопов Ba140 и La140 (на 10-й день после отбора пробы воды из активной зоны реактора) для каждой из кювет составляли соответственно и . Поскольку (τLa<<τBa), то наблюдаемое уменьшение активности La140 отображало уменьшение активности Ba140.
Было обнаружено, что уменьшение активности La140 в контрольных кюветах примерно соответствовало закону "стандартного" распада изотопа Ba140 с "табличным" значением времени жизни. Такой же закон уменьшения активности La140 наблюдался в кюветах с гранулами до 10 дня эксперимента. После этого начального периода адаптации периодические измерения показали, что скорость уменьшения активности La140 (а значит и активности Ba140) соответствует (эквивалентна по закону изменения активности) более ускоренному распаду. Экстраполяция показала, что эффективное время жизни этого изотопа уменьшилось примерно в 2 раза по отношению к времени жизни Ba140.
Эти результаты могут быть объяснены на основе предположения о том, что радиоактивный изотоп Ba140 преобразуется в экспериментальных кюветах в нерадиоактивный изотоп другого химического элемента. При этом наличие начального, неизменного участка в законе распада может быть объяснено обсуждаемыми выше процессами адаптации микробиологической ассоциации к действию радиоактивного облучения в кювете с активной водой. Это время (около 10 дней) хорошо коррелирует с ожидаемым временем смены 5-10 поколений микробиологических культур.
Анализ возможных преобразований изотопов показал, что в данном случае возможна следующая реакция трансмутации радиоактивного изотопа Ba140 к стабильному ядру другого типа
Ba140+Cl2→Sm152
Эта реакция является энерговыгодной и характеризуется положительной энергией реакции. Необходимый для этой реакции углерод в избытке содержится в объеме микробиологических гранул.
В силу закона постоянства химического состава биологических объектов, который является одним из фундаментальных свойств живой материи, реакция трансмутации изотопов в биологической системе будет возможной в том случае, когда результатом реакции является изотоп, соответствующий химическому элементу, который либо сам входит в число необходимых химических элементов, либо является биохимическим аналогом такого элемента. В последнем случае он должен иметь примерно тот же ионный радиус и, желательно, ту же валентность. При этом эффективность реакции будет большой только тогда, когда необходимый химический элемент или его биохимический аналог не содержится в питательной среде или содержится в малом количестве.
Сопоставление ионов Sm2+ и Ca2+ показывает, что они являются биохимическими аналогами и имеют близкий ионный радиус в двухвалентном состоянии (RSm≈1.2 A, RCa≈1.06 А). Кальций входит в число необходимых элементов, и если его концентрация в объеме микробиологических гранул была небольшой, можно утверждать, что нехватку кальция растущая микробиологическая ассоциация могла восполнять синтезом ее биохимического аналога (самария).
Необходимо также учесть, что состав гранулированной биомассы, которая формируется на основе природных синтрофных ассоциаций, получаемых, например, на основе сброженных продуктов жизнедеятельности животных или природных илов, может иметь разный химический состав. Для оптимизации роста этой биомассы необходим сбалансированный комплекс основных макро- и микроэлементов. Состав последних может быть определен только опытным путем независимого добавления основных микроэлементов и анализом связанных с этим изменений эффективности процесса трансмутации.
В исследованиях использовались одинаковые закрытые стеклянные кюветы, каждая из которых содержала по 10 мл дистиллированной воды, в которой находился раствор Cs137 с удельной активностью .
Одинаковое количество гранул помещалось в 7 кюветах. В 6 кюветах к активной воде были дополнительно добавлены очищенные соли K, Ca, Na, Fe, Mg и P соответственно. Эти химические элементы входят в число необходимых для развития любой биологической системы. Две дополнительные кюветы были использованы для контроля: одна содержала радиоактивную воду и гранулы (но не содержала дополнительных солей), а другая - только радиоактивную воду.
Все кюветы были закрыты и содержались при температуре 20°C. Амплитудный спектр гамма-излучения кювет измерялся каждые 7 дней на одном и том же детекторе. Особое внимание уделялось ослаблению влияния погрешностей, связанных с процессом измерений. Для этой цели использовались кюветы с малой высотой, а детектор - с большим размером (диаметром) кристалла Ge. Кюветы при каждом измерении устанавливались в одинаковое положение в центре кристалла детектора.
Результаты изменения активности изотопа Cs137 представлены на фиг. 3.
В контрольной кювете, содержащей только радиоактивную воду, изменение активности изотопа Cs137 соответствовало стандартному спонтанному распаду с временим жизни около 30 лет.
Самое быстрое уменьшение активности (оно было эквивалентно уменьшению времени жизни в 35 раз до величины τ*≈310 дней) наблюдалось в кювете, содержащей соль кальция. В кювете, содержащей дополнительную соль калия, уменьшение активности Cs137 соответствовало времени жизни 10 лет. Это уменьшение активности не было связано с ускоренным распадом, а являлось результатом реакции утилизации радиоактивного изотопа Cs137 в стабильный изотоп другого элемента.
Предположительная утилизация радионуклида Cs137 связана с реакцией
Csl37+p→Bal38,
протекающей с участием протонов воды. Результатом реакции является стабильный изотоп Ba138.
Ионы Ba2+ and K+ являются биохимическими аналогами, они имеют примерно одинаковые ионные радиусы в двухвалентном состоянии (RBa≈1-4 A, RK≈1.33 А). Поскольку заменяемый элемент (калий) входит в число необходимых микроэлементов, то вероятность такой замены представляется достаточно большой и ионы синтезируемого бария могут замещать ионы калия в метаболических процессах при росте культур. Такая замена представляется более эффективной, чем "прямая" замена калия на цезий в случае дефицита калия (это видно из большой разницы ионных радиусов цезия RCs≈1.65-1.69 А и калия RK≈133 А). Следует отметить, что подобная замена ионов ранее наблюдалась и анализировалась в экспериментах с микробиологической культурой Blastocladiella emersonii [Van Brunt J., Caldwell J.H., Harold F.M. Circulation of potassium across the plasma embrane of Blastocladiella emersonii. K-chanel // J. Bacteriol., 1982, v. 150, N 3, pp. 1449-1561]. В этих экспериментах регистрировалась замена ионов K+ на ионы Rb+ и Ba2+. Эти ионы могут заменять друг друга в процессах, связанных с ионным транспортом сквозь мембрану в клетку.
Еще одним очень опасным радионуклидом, образуемым в процессе деления и содержащимся в отработанном реакторном топливе, является изотоп Sr90. Этот изотоп может быть утилизирован путем преобразования в разные стабильные изотопы других элементов в одной из реакций
38Sr90+6C12=44Ru102,
38Sr90+8O16=46Pd106,
38Sr90+11Na32=49In113.
В этих реакциях образуются стабильные изотопы Ru, Pd и In, которые являются биохимическими аналогами таких необходимых микроэлементов, как соответственно Fe и Mg, Ca и Mg, Fe и Mg. Такое соответствие определяется примерным равенством ионных радиусов этих элементов
В отсутствие этих необходимых химических элементов возможна их замена на вновь синтезируемые стабильные изотопы элементов Ru, Pd и In. Видно, что все эти элементы являются, в частности, биохимическими аналогами Mg и Fe. Следовательно, при отсутствии Mg и Fe в очищаемой воде и активной среде они могут заменяться продуктами всех трех возможных реакций утилизации радиоактивного стронция.
Причиной увеличения эффективности утилизации при использовании дополнительной соли кальция является общая закономерность метаболизма микробиологических культур: оптимальный рост культуры соответствует необходимому балансу всех микро- и макроэлементов. Предположительно именно дефицит кальция был тем "узким местом", которое тормозило процесс роста и сопутствующую трансмутацию в конкретной растущей микробиологической системе. Очевидно, что при использовании гранул, приготовленных на основе других природных синтрофных ассоциаций, влияние разных солей может быть другим и должно определяться опытным путем.
Для обеспечения ядерного взаимодействия двух ядер необходимо обеспечить условия преодоления кулоновского барьера, который препятствует сближению этих ядер. Высота этого барьера очень большая, а его прозрачность (в модельном случае отсутствия атомных электронов) может быть определена с помощью зависимости
следующей из формулы Гамова
которая зависит от полной E=µν2/2 и потенциальной (кулоновской) энергии V(r)=Z1Z2e2/r взаимного отталкивания ядер с зарядами Z1e и Z2e. Здесь µ=m1m2/(m1+m2) - "приведенная" масса взаимодействующих ядер, зависящая от массы каждого ядра. Для частиц, находящихся в состоянии теплового равновесия, .
Учет экранирующего влияния атомных электронов приводит к уменьшению ширины этого барьера и, соответственно, возрастанию коэффициента прозрачности, что может быть учтено введением дополнительной эффективной энергии, что соответствует замене E=kT+Eeff. При взаимодействии атомов водорода Eeff≈27eV. В случае биологической системы E=Eeff, а прозрачность барьера равна очень малой величине D≈10-100.
При взаимодействии более тяжелых ядер эта вероятность будет намного меньше. Например, при взаимодействии ядер цезия и водорода Eeff≈300eV, а прозрачность барьера при температуре kT<<Eeff равна D≈10-1000. Приблизительно такая же пренебрежимо малая вероятность соответствует случаю, когда одна или обе взаимодействующие частицы (взаимодействующих ядра с электронным окружением) находятся в стационарной потенциальной яме.
Эти оценки показывают, что при той температуре, которая характерна для процесса роста микробиологических культур, "обычные" ядерные реакции в живых организмах невозможны. Такой вывод соответствует случаю, когда рассматривается парное взаимодействие ядер в свободном пространстве или в стационарной потенциальной яме.
В работах авторов (V.I. Vysotskii, M.V. Vysotskyy. "Coherent correlated states and low-energy nuclear reactions in non stationary systems". European Physical Journal. A, 2013, v. 49, issue 8: 99; и V.I. Vysotskii, S.V. Adamenko, M.V. Vysotskyy. 2013. "Acceleration of low energy nuclear reactions by formation of correlated states of interacting particles in dynamical systems", Annals of Nuclear Energy, 2013, v. 62, 618-625) было показано, что в случае определенной нестационарной деформации потенциальной ямы, в которой находится хотя бы одна из взаимодействующих частиц, происходит значительное увеличение прозрачности ядерного барьера. Такой эффект связан с формированием когерентных коррелированных состояний частицы, для которых имеет место эффект синхронизации и эффективного сложения (интерференции) флуктуаций разных компонент ее импульса в нестационарном суперпозиционном состоянии. При таком сложении образуются большие итоговые флуктуации полного импульса и флуктуации кинетической энергии частицы, что способствует значительному увеличению коэффициента прозрачности потенциального барьера и, естественно, аналогичному увеличению вероятности ядерной реакции синтеза. Простая интерпретация этого квантово-механического явления состоит в следующем.
В состоянии суперпозиции частица может находиться с разной вероятностью на разных уровнях энергии En потенциальной ямы (см. фиг. 4).
В такой системе дисперсия полного импульса частицы и среднее значение кинетической энергии определяются формулами
В случае "обычного" (т.е. некогерентного и некоррелированного) состояния флуктуации импульса на разных состояниях взаимно независимы и . В этом случае среднее значение кинетической энергии частицы определяется величиной .
Это соотношение соответствует стандартным представлениям: средняя кинетическая энергия частицы в системе квантовых уровней в потенциальной яме равна сумме средних энергий на этих уровнях.
В случае когерентного коррелированного состояния и средняя кинетическая энергия равна
В этом случае происходит значительное возрастание средней кинетической энергии частицы в многоуровневой системе.
В частности, если
то в случае некогерентного некоррелированного) состояния <Tnoncorr>=N<Tn>, а для когерентного коррелированного состояния <Tcorr>=(N+1)<Tnoncorr>.
Видно, что в этом случае имеет место возрастание средней кинетической энергии в N+1>>1 раз. Наличие или отсутствие таких гигантских флуктуаций импульса схематически изображено большим вектором под правым рисунком на фиг. 4 и очень малым вектором под левым рисунком. В реальной ситуации соотношение между этими флуктуациями на много порядков больше.
Формально наличие такого состояния характеризуется коэффициентом корреляции, определяемым формулой
а также видоизмененным соотношением неопределенностей (соотношением неопределенностей Шредингера-Робертсона)
Величина |r| изменяется в интервале 0≤|r|≤1. В отсутствие корреляции между координатой q и импульсом p частицы имеем r=0, а последняя формула принимает вид соотношения неопределенностей Гейзенберга .
В предельном случае полностью коррелированного состояния |r|→1 дисперсия импульса частицы становится неограниченно большой, а коэффициент прозрачности D любого потенциального барьера возрастает до максимальной величины D→1 при произвольной малой энергии частицы.
В работах, в частности, показано, что при быстром монотонном сжатии потенциальной ямы, в которой находится одна из взаимодействующих частиц, коэффициент корреляции возрастает до величины |r|≥1-106, что приводит к увеличению коэффициента прозрачности на много порядков от предельно малых величин Dnoncorr≈10-100…10-1000 для "обычных" (некоррелированных) состояний частицы до величины Dcorr→1.
Подобные потенциальные ямы из-за локальной неоднородности процесса роста и динамического характера биофизических явлений (деление клеток, репликация ДНК и др.) с неизбежностью возникают в зоне роста любого биологического объекта, существуют определенное время, а затем исчезают из-за влияния случайных соударений атомов и молекул.
В каждой из таких изменяющихся потенциальных ям возможно на короткое время формирование когерентных коррелированных частиц, находящихся в этом месте. Если при этом в данном месте будут присутствовать оба потенциально пригодных для необходимого синтеза ядра (например, атомы стронция и водорода), то вероятность реакции утилизации радионуклида Cs137+p=Ba138 будет очень большой. При этом в быстрорастущих биологических объектах происхъодит непрерывное самовоспроизводство большого количества таких сжимающихся потенциальных ям, каждая из которых при наличии всех требуемых условий является одноразовым ядерным микрореактором. В статических системах такой эффект невозможен.
1. Способ очистки воды от радионуклидов, заключающийся в создании в очищаемом водном растворе условий для ядерной трансмутации в растущих микробиологических культурах радиоактивных изотопов одних химических элементов (Изотоп 3) в нерадиоактивные изотопы других химических элементов (Изотоп 1), для чего сначала приготавливают питательную среду для роста микробиологических культур, дефицитную по химическому элементу, соответствующему Изотопу 1, и содержащую необходимые для трансмутации исходные изотопные компоненты (Изотоп 2), после чего в указанную питательную среду добавляют биомассу микроорганизмов, затем осуществляют в три стадии процесс трансмутации, в течение первой стадии стимулируют эффект мутагенной адаптации содержащихся в биомассе микроорганизмов к Изотопам 3 путем поэтапного выдерживания биомассы микроорганизмов в течение времени в интервале от 10 часов для аэробных микроорганизмов до 24 часов для анаэробных микроорганизмов в жидкости, состав которой включает воду в количестве, достаточном для покрытия объема биомассы с питательной средой и поэтапно увеличивающемся путем добавления порций подлежащего очистке водного раствора с радионуклидами, которые не приводят к гибели биомассы за счет радиоактивного облучения, вплоть до достижения концентрации подлежащего очистке раствора, после чего в течение второй стадии производят оптимизацию биологической части процесса трансмутации в полученном растворе путем раздельного добавления в разные небольшие части полученного водного раствора основных необходимых микроэлементов и/или комбинаций этих микроэлементов и, после выдержки в этих частях в течение определенного времени одинакового количества прошедшей мутагенную адаптацию биомассы, выбора тех микроэлементов и/или комбинаций этих микроэлементов, которые максимально ускоряют процесс трансмутации, затем на третьей стадии добавляют в очищаемый водный раствор выбранные микроэлементы и/или выбранные комбинации микроэлементов в необходимом количестве, обеспечивающем максимальную скорость трансмутации Изотопов 3 во всем объеме подлежащего очистке водного раствора, и выдерживают в течение времени, необходимого для достижения требуемой величины остаточной радиоактивности очищаемого раствора, после чего биомасса микроорганизмов удаляется из очищаемой воды.
2. Способ по п. 1, отличающийся тем, что выдерживание на первой стадии процесса осуществляется при температуре в интервале 30-40ºС.
3. Способ по п. 1, отличающийся тем, что после добавления биомассы микроорганизмов в питательную среду проводят гранулирование полученной субстанции в присутствии соединений, образующих стабильные неразмокаемые в воде гранулы, структура которых не препятствует свободному движению воды и растворенных в ней солей и радионуклидов по всему объему гранул.
4. Способ по п. 1, отличающийся тем, что биомассу микроорганизмов формируют с использованием синтрофных ассоциаций аэробных и анаэробных микроорганизмов.
5. Способ по п. 1, отличающийся тем, что при очистке от радионуклидов растворов, содержащих морскую воду, используют биомассу микроорганизмов, включающую микробные синтрофные ассоциации в жизнеспособном состоянии, адаптированные к морской воде, например, на основе природных жизнеспособных ило