Способ получения жидкой микроэлементной смеси "комплекс"
Иллюстрации
Показать всеИзобретение относится к сельскому хозяйству. Способ получения смеси микроэлементной на основе лимонной и оксиэтилидендифосфоновой кислот, содержащей композицию микроэлементов в виде органоминеральных комплексов марганца, железа, цинка, кобальта, молибдена, меди и неорганических соединений магния и бора, причем исходные компоненты вводятся в раствор лимонной кислоты в строго определенной последовательности, а именно: сульфат марганца, сульфат железа, окись цинка, нитрат кобальта, молибденовокислый аммоний, сульфат меди, окись магния или окись цинка, борная кислота - затем оксиэтилидендифосфоновая кислота с целью обеспечения pH среды в интервале 1,2÷2,2 в течение всего производственного цикла. Изобретение позволяет стабилизировать качество продукта при одновременном повышении концентрации микроэлементов и упрощении процесса. 1 з.п. ф-лы, 1 табл., 3 пр.
Реферат
Изобретение относится к способам получения жидких микроэлементных смесей, предназначенных для предпосевной обработки семян, внекорневой и корневой подкормки в парниках, теплицах и открытом грунте зерновых, овощных, плодово-ягодных и цветочно-декоративных культур, а также деревьев и кустарников, обеспечивающих ускорение процесса роста растений, повышение урожайности культур и улучшение качества производимой сельскохозяйственной продукции.
Известен способ получения комплексного удобрения на основе оксиэтилидендифосфоновой кислоты, содержащего кроме макроэлементов N, P, K микроэлементы Mn, Cu, Mo, Zn, Co, B [1]. При непрерывном перемешивании смешивают в воде, г/л: Mn·C2H7O7P2·2H2O - 1,71; Cu·2C2H7O7P2·4H2O - 0,64; Mo·C4H11O16P4·3NH4·6,75H2O - 0,27; Zn·2C2H7O7P2·4H2O - 0,71; Co·C4H18O16P4C4H14N2 - 1,65; H3BO3 - 0,50; K2PO4 - 0,78. Суммарное содержание микроэлементов в удобрении при этом составляет 0,93 г/л. Изобретение позволяет повысить энергию прорастания и всхожесть семян, повысить урожайность пшеницы, расширить ассортимент удобрений, применяемых в растениеводстве.
Известен способ получения средства для некорневой обработки культурных растений, которое содержит композицию микроэлементов в виде меди, цинка, бора, железа, молибдена, кобальта, селена и марганца и композицию макроэлементов в виде азота, магния и серы. Приготовление средства осуществляют следующим образом: в горячей воде (при температуре 60°C) растворяют следующие химические реактивы, (г/л) - медь сернокислая - 10, цинковый купорос - 10, магний сернокислый - 40, кобальт сернокислый - 0,5, железо (II) сернокислое - 5, марганец сернокислый - 5, Na2 ЭДТА - 30 (для частичной хелатизации цинка, меди, железа, марганца и кобальта), аммоний молибденовокислый - 1, борная кислота - 5, натрий селенит - 0,2, мочевина - 200, аммиачная селитра - 100 [2]. Суммарная концентрация микроэлементов в удобрении составляет 9,45 г/л. Изобретение позволяет активировать и стабилизировать внутренние биохимические процессы на ранней стадии развития растений, повысить эффективность дальнейших агротехнических мероприятий.
Известен способ получения питательной смеси для обработки вегетативных органов растений сельскохозяйственных культур для получения урожая высокого качества [3]. Средство для некорневой подкормки сельскохозяйственных культур содержит композицию микроэлементов в виде меди, цинка, бора, железа, молибдена, кобальта, хрома, селена, никеля, лития и марганца и композицию макроэлементов в виде азота, калия, магния и серы. Микроэлементы цинк, медь, никель, железо и кобальт представлены в хелатированной форме. Суммарное содержание микроэлементов в удобрении при этом составляет примерно 4,5%. Средство для некорневой подкормки сельскохозяйственных культур обеспечивает повышение их урожайности, ускорение процесса роста растений и улучшение качества продукции.
Недостатком всех перечисленных способов является низкая концентрация микроэлементов в готовом продукте, что приводит к использованию больших объемов удобрения при перевозке потребителям и повышению конечной цены на продукцию.
Наиболее близким к заявляемому по технической сущности и достигаемому результату является способ получения питательных растворов, содержащих микроэлементы (Микровит) [4]. Способ включает введение кислого компонента в горячую воду и добавление в полученный кислый раствор последовательно солей микроэлементов, при этом в качестве кислого компонента вводят лимонную кислоту, добавляют в нее раствор натриевой соли оксиэтилидендифосфоновой кислоты при соотношении 1:(0,4-0,7) соответственно, в смесь при pH 1,5-2,3 вводят при перемешивании сульфаты железа и марганца до полного растворения солей и в полученный раствор добавляют аммоний или калийсодержащий компонент до доведения pH раствора до 2,4-3,5, после чего добавляют неорганические соли цинка, кобальта и молибдена, перемешивание ведут до полного их растворения и затем вводят сульфаты меди и магния, а затем борную кислоту, при этом микроэлементы вводят в количествах, регламентируемых марками питательных растворов, и температуру поддерживают на уровне 75-90°C. В качестве аммонийсодержащего компонента берут либо цитрат аммония, либо раствор аммиака, в качестве калийсодержащего компонента - карбонат калия или гидроксид калия, а в качестве неорганических солей цинка используют сульфат цинка, в качестве неорганических солей кобальта - сульфат или нитрат кобальта, в качестве солей молибдена - молибдат аммония. Суммарная концентрация микроэлементов в питательной смеси составляет 94,0-125,5 г/л.
Одним из недостатков способа является использование в процессе получения питательной смеси в качестве подщелачивающих реагентов таких химических соединений, как аммиак и цитрат аммония. Аммиак обладает резко выраженным раздражающим действием. Даже при малых концентрациях вызывает слезотечение и резкий удушливый кашель, при больших концентрациях вызывает острое раздражение глаз, ожоги слизистых оболочек, удушье, головокружение [5]. Работу с аммиаком следует проводить в хорошо вентилируемом помещении в герметичном оборудовании с использованием специальных индивидуальных средств защиты обслуживающего персонала. Использование в производстве растворов аммиака существенно усложняет процесс и повышает его опасность.
Применение в качестве подщелачивающего реагента цитрата аммония экономически нецелесообразно в связи с его высокой стоимостью.
Кроме того, в заявленном изобретении для приготовления питательной смеси в качестве исходных неорганических соединений практически всех микроэлементов, за исключением молибдена и бора, используются сернокислотные соли. Высокое содержание в системе «балластных» сульфат-ионов, не участвующих в процессах комплексообразования, провоцирует образование побочных продуктов путем смещения равновесия химической реакции. Согласно кинетике процессов комплекообразования, «простые» анионы или катионы реагируют с ионной скоростью, т.е быстро, тогда как химические реакции, при которых претерпевает изменение комплексно построенная часть молекулы, протекают замедленно [6, 7]. По этой причине высокое содержание в растворе сульфат-ионов в сочетании с ионами железа и аммония создают благоприятные условия для образования в растворе двойной соли аммонийного сульфата железа (NH4)2SO4·FeSO4·6H2O, растворимость которой меньше, чем сульфата железа. В случае неполноты протекания реакции комплексообразования или снижения ее скорости по каким-либо причинам, возникает вероятность того, что при охлаждении продукта или в процессе длительного хранения может выпасть кристаллический осадок.
Из литературных данных известно, что взаимодействие комплексонов с катионами металлов приводит к формированию высокоустойчивых и необычайно разнообразных по форме циклических структур. В общем виде состав продукта взаимодействия катиона с комплексоном может быть выражен следующей формулой [8]:
{[M′(H2O)x(OH)y]i [M′′(H2O)z(OH)p]j…[L′(H)n]k[L′′(H)m]l},
где индексы x, y, i … z принимают значения 0; 1; 2; 3; и т.д.; М и L - обозначают соответственно катион и лиганд - полностью депротонированный анион комплексона; знаки зарядов здесь и в дальнейшем опущены.
Учитывая, что питательные микроэлементные смеси являются системами с несколькими лигандами, анионами и катионами, в этих водных растворах за счет одновременного формирования целого ряда комплексов устанавливаются довольно сложные химические равновесия.
Увеличение концентрации катиона М по сравнению с содержанием в растворе лиганда L может приводить к образованию биядерных M2L и полиядерных MxL комплексонатов. При близости свойств катионов М′ и М′′ в растворе могут присутствовать комплексы типа M′M′′L. Введение в раствор нескольких лигандов приводит к образовыванию разнолигандных, или смешаннолигандных, комплексонатов типа ML′L′′.
Можно предположить, что в растворе могут существовать следующие соединения:
[ML], [ML2], [MLn], [M2L], [MxL], [M′M′′L], [ML′L′′], [M′M′′ … L′L′′] и др.,
где М - ион металла (Fe, Mn, Zn, Cu, Co и др.);
L - лиганд (лимонная кислота, ОЭДФК и др.).
Необходимо отметить, что используемая в производстве микроэлементных смесей в качестве комплексона оксиэтилидендифосфоновая кислота (ОЭДФК) обладает уникальной способностью субстехиометрического действия, т.е. способностью связывать огромное число ионов металла малым количеством реагента [9].
Кроме того, в питательном растворе присутствуют ионы, не участвующие в реакциях комплексообразования: сульфат-ион, аммоний-ион, борат-ион. Система равновесий, описывающих состояние ионов в микроэлементной смеси, очень сложна за счет одновременного формирования целого ряда комплексов. Эмпирически определить факторы, влияющие на устойчивость комплексонатов в данной системе, сложно.
Таким образом только точное определение условий ведения процесса (температуры, pH, концентрации комплексона, соотношения металл:лиганд и некоторых других) дает необходимый результат.
Нами поставлена задача создать способ получения жидкой микроэлементной смеси, позволяющий стабилизировать качество продукта, при одновременном повышении концентрации микроэлементов и упрощении процесса.
Поставленная задача решена в способе, включающем приготовление раствора лимонной кислоты с последующим введением в него неорганических соединений микроэлементов в строго определенной последовательности, а именно: сульфата марганца, сульфата железа, цинксодержащего компонента, нитрата кобальта, молибденовокислого аммония, сульфата меди, магнийсодержащего или цинксодержащего компонента, борной кислоты - затем оксиэтилидендифосфоновой кислоты (ОЭДФК). Строго определенная последовательность введения реагентов обеспечивает необходимую величину pH среды в интервале 1,2÷2,2 в течение всего цикла приготовления смеси. Процесс ведут при температуре 65-70°C и непрерывном перемешивании. Каждый последующий компонент вводится в раствор после полного растворения предыдущего. В качестве неорганических соединений цинка и магния используют оксид цинка и оксид магния, выполняющих также функцию подщелачивающих реагентов. Способ позволяет стабилизировать качество продукта за счет исключения из технологического процесса растворов аммиака и снижения содержания сульфат-ионов, при одновременном повышении концентрации микроэлементов и упрощении процесса.
Сущность способа заключается в подборе условий получения микроэлементной смеси. Стабильное качество продукта зависит от создания и поддержания оптимального интервала pH в пределах 1,2÷2,2. В этих условиях микроэлементы находятся в виде комплексонатов на протяжении всего цикла приготовления продукта, а также в процессе длительного хранения.
Технический результат настоящего изобретения достигается тем, что компоненты смеси вводятся в раствор в строго определенной последовательности. Это позволяет выдерживать pH среды на протяжении всего цикла приготовления микроэлементной смеси в интервале 1,2÷2,2. Для поддержания оптимального интервала pH в качестве подщелачивающих реагентов используют оксиды цинка и магния.
Использование предлагаемого способа получения микроэлементной смеси позволяет стабилизировать качество продукта, существенно упростить технологический процесс и повысить его безопасность в результате применения в качестве подщелачивающих реагентов оксидов цинка и магния.
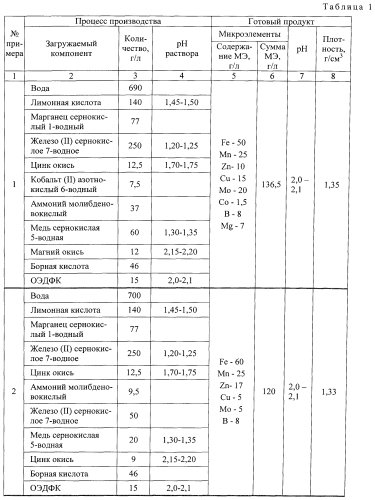
Пример 1.
Для получения 1 л микроэлементной смеси в 690 мл воды, нагретой до температуры 65-70°C, растворяют 140 г лимонной кислоты, при этом pH раствора составляет 1,45÷1,50. Затем в раствор лимонной кислоты вводят 77 г сульфата марганца и 250 г сульфата железа. В результате pH раствора снижается до величины 1,20÷1,25. Далее вводят 12,5 г оксида цинка, pH раствора возрастает до 1,70÷1,75. После оксида цинка добавляют 7,5 г нитрата кобальта и 37 г молибденовокислого аммония. Эти компоненты не оказывают существенного влияния на pH раствора. Далее в раствор вводят 60 г сульфата меди, снижающего pH до 1,30÷1,35, после чего добавляют 12 г оксида магния, pH раствора повышается до 2,15÷2,2. Последними компонентами, добавляемыми в раствор, являются 46 г борной кислоты и 16 г оксиэтилидендифосфоновой кислоты. В течение всего процесса поддерживают температуру раствора в интервале 65-70°C. После окончания загрузки всех компонентов перемешивание продолжают в течение трех-четырех часов. В результате получают микроэлементную смесь с суммарным содержанием микроэлементов 136,5 г/л, в том числе: Fe - 50; Mn - 25; Zn - 10; Cu - 15; Мо - 20; Со - 1,5; Mg - 7; В - 8. Готовый продукт имеет pH=2,0÷2,1 и плотность 1,35 г/л.
Пример 2.
Условия проведения процесса аналогичны примеру 1. В отличие от примера 1 в данном случае применяется только один подщелачивающий реагент - оксид цинка, содержание которого увеличено до 21,5 г, но введение его в раствор происходит в два этапа с целью поддержания определенного значения pH раствора. В результате получают микроэлементную смесь с суммарным содержанием микроэлементов 120 г/л, в том числе: Fe - 60; Mn - 25; Zn - 17; Cu - 5; Mo - 5; В - 8. Готовый продукт имеет pH=2,0÷2,1 и плотность 1,33 г/л.
Примеры 1-3 приведены в таблице 1. Манипуляции с сырьевыми компонентами позволяют выдерживать pH среды на протяжении всего цикла приготовления микроэлементной смеси в интервале 1,2÷2,2 и получать широкий ассортимент микроудобрений. Составы микроэлементных смесей в примерах подобраны исходя из агрохимического анализа питания растений. Пропорции между микроэлементами максимально приближены к потребностям зернобобовых культур (пример 1), тепличных культур (пример 2), а также универсального назначения (пример 3).
Источники информации
1. Патент РФ №2417969 С1, опубл. 10.05.2011.
2. Патент РФ №2484073 С2, опубл. 10.06.2013.
3. Патент РФ №2377227 С1, опубл. 27.12.2009.
4. Патент РФ №2179162 С1, опубл. 10.02.2002.
5. ГОСТ 9-92. Аммиак водный технический. Технические условия.
6. Н.М. Дятлова, В.Я. Темкина, И.Д. Колпакова. Комплексоны. Изд-во «Химия», М., 1970, с. 32-35.
7. Н.Н. Желиговская, И.И. Черняев. Химия комплексных соединений. Изд-во «Высшая школа», М., 1966, с. 13.
8. Н.М. Дятлова, В.Я. Темкина, К.И. Попов. Комплексоны и комплексонаты металлов М.: Химия, 1988. с. 99.
9. Н.М. Дятлова. Ж.ВХО им. Д.И. Менделеева, том XXIX, №3, 1984, с. 13.
1. Способ получения смеси микроэлементной на основе лимонной и оксиэтилидендифосфоновой кислот, содержащей композицию микроэлементов в виде органоминеральных комплексов марганца, железа, цинка, кобальта, молибдена, меди и неорганических соединений магния и бора, отличающийся тем, что исходные компоненты вводятся в раствор лимонной кислоты в строго определенной последовательности, а именно: сульфат марганца, сульфат железа, окись цинка, нитрат кобальта, молибденовокислый аммоний, сульфат меди, окись магния или окись цинка, борная кислота - затем оксиэтилидендифосфоновая кислота с целью обеспечения pH среды в интервале 1,2÷2,2 в течение всего производственного цикла.
2. Способ по п. 1, отличающийся тем, что сохранение последовательности введения исходных компонентов при получении смеси микроэлементной без магния для тепличных культур обеспечивает замена окиси магния окисью цинка для поддержания необходимого pH среды.