Противоопухолевые фармацевтические композиции и способ лечения рака молочной железы
Иллюстрации
Показать всеГруппа изобретений относится к сфере лекарственных препаратов, в частности к новому способу лечения рака молочной железы, предусматривающему парентеральное введение пациенту терапевтически эффективного количества (R)-4,11-дигидрокси-3-[(пирролидин-3-иламино)метил]-1H-нафто[2,3-f]индол-5,10-диона формулы I или его фармацевтически приемлемой соли.
Кроме того, группа изобретений относится к противоопухолевым фармацевтическим композициям для парентерального применения соединения формулы I, содержащим соединение I, фармакологически приемлемый носитель и один или несколько эксципиентов, выбранных из сорастворителей, солюбилизаторов, наполнителей, эмульгаторов, консервантов, антиоксидантов, буферных соединений, веществ для поддержания изотоничности. Данные композиции обеспечивают эффективное применение соединения I, поскольку хорошо растворимы в водных фармакологически приемлемых средах, обладают высокой стабильностью при хранении как в форме лиофилизата, так и в форме водных растворов. 3 н. и 2 з.п. ф-лы, 6 табл., 4 пр.
Реферат
Изобретение относится к медицине, а именно к онкологии, и может быть использовано для лечения рака молочной железы, включая поздние стадии заболевания и случаи, характеризующиеся низкой восприимчивостью к традиционным химиотерапевтическим препаратам. Сущность заявляемого способа заключается в том, что нуждающемуся в лечении пациенту парентерально при однократном или многократном режиме применения вводят терапевтически эффективное количество (R)-4,11-дигидрокси-3-[(пирролидин-3-иламино)метил]-1H-нафто[2,3-f]индол-5,10-диона (соединение формулы I) или его фармацевтически приемлемой соли. Способ лечения основан на способности соединения I ингибировать в опухолевых клетках топоизомеразы 1 и 2, ферменты, нарушающие репликацию ДНК путем индукции одноцепочечных и двуцепочечных разрывов, что приводит к индукции апоптоза. Соединение формулы I может быть использовано самостоятельно или в качестве активного компонента противоопухолевых фармацевтических композиций.
Известны способы лечения рака молочной железы с помощью химиотерапевтических средств, однако эффективность таких средств в монорежиме, особенно на поздних стадиях развития болезни, по-прежнему невысока, что требует, как правило, использования комбинаций, например, с таксотером или гемцитабином [Руководство по химиотерапии опухолевых заболеваний. Переводчикова Н.И. (ред.). 3-е изд. - М.: изд. Практическая медицина, 2011, 512; Семиглазов В.Ф. Неоадъювантное и адъювантное лечение рака молочной железы. - М.: изд. МИА, 2008, 288; С.А. Тюляндин. Практическая онкология, 2000, №2, 3; Н.И. Переводчикова, М.Б. Стенина. Лекарственная терапия рака молочной железы, изд. Практика, 2014, 284]. Наиболее близким к заявляемому является способ лечения рака молочной железы с помощью парентерального применения доксорубицина с известной лимитирующей кардиотоксичностью, который выбран в качестве прототипа. В соответствии с этим способом доксорубицин в дозе 6 мг/кг, близкой к максимально переносимой, вводили внутрибрюшинно мышам с ксенографтами гормонозависимого (аутокринный тип) эпителиального протокового рака молочной железы человека T47D (АТСС® НТВ-133™). Недостатком данного способа лечения является низкий недостоверный противоопухолевый эффект на фоне высокой токсичности.
Задачей изобретения является разработка более эффективного способа лечения рака молочной железы с помощью менее токсичного агента, который можно применять в схемах традиционного лечения этой патологии. Поставленная задача решается тем, что в заявляемом способе для лечения применяется нафтоиндолдион формулы I. Указанный агент способен индуцировать апоптоз в опухолевых клетках, включая ряд линий с активированными механизмами множественной лекарственной устойчивости. Ранее было показано, что производные нафто[2,3-f]индол-5,10-диона, содержащие в боковой цепи циклические диамины (например, соединение I), способны блокировать пролиферацию различных типов опухолевых клеток in vitro [RU 2412166; А.Е. Shchekotikhin etal, Eur. J. Med. Chem., 2014, 30 (86), 797]. Кроме того, в скрининговых опытах на мышином перевитом внутрибрюшинно лейкозе Р388 было показано, что нафтоиндолдион I эффективен при парентеральном введении [RU 2412166].
Таким образом, описанные ранее свойства нафтоиндолдиона формулы I характеризуют его цитотоксические свойства и не имеют прогностической значимости для его применения при различных злокачественных новообразованиях человека, т.к. не релевантны для корреляции его биоэквивалентности у пациентов [Wagner J.G. Rate of dissolution in vitro and in vivo. Part VI. Correlation of in vivo with in vitro data - theoretical and practical consideration. // Drug Intell. Clin. Pharm. - 1970. - Vol. 4. - P. 60-63; FDA, Center for drug evaluation and research. Guidance for industry: Extended release oral dosage forms, development, evaluation and application of in vitro/in vivo correlations. September 1997; FDA, Electronic Orange Book. Approved Drug Products with Therapeutic Equivalence Evaluations, 23th Edition, 2003; Раменская Г.В., Шохин И.Е., Давыдова К.С., Савченко А.Ю. In vivo - in vitro корреляция (ivivc): современный инструмент для оценки поведения лекарственных форм в условиях in vivo // Медицинский альманах. - 2011. - №1(14). - Стр. 222-226]. Признанными в качестве прогностически значимых доклинических моделей являются подкожные ксенографты опухолей человека, трансплантированные иммунодефицитным мышам [Kerbel R.S1. Human tumor xenografts as predictive preclinical models for anticancer drug activity in humans: better than commonly perceived-but they can be improved // Cancer Biol Ther. 2003 Jul-Aug; 2(4 Suppl 1):S134-9].
В соответствии с еще одним аспектом настоящего изобретения нафтоиндолдион I может быть использован для приготовления противоопухолевых фармацевтических композиций, например, в виде жидкой или сухой парентеральных лекарственных форм.
Фармацевтические композиции для парентерального введения обычно являются водными или неводными стерильными изотоническими растворами для инъекций, которые, помимо терапевтически эффективного количества лекарственного средства, содержат фармакологически приемлемый носитель (растворитель), а также различные эксципиенты (вспомогательные вещества). Фармацевтические композиции могут являться как жидкими готовыми растворами для инъекций, так и концентратами, суспензиями, стерильными порошками или лиофилизированными композициями, для применения которых необходимо добавление стерильного растворителя (например, воды для инъекций) непосредственно перед использованием. Методики получения парентеральных лекарственных композиций хорошо известны из уровня техники.
В качестве носителя (растворителя) для приготовления жидких фармацевтических композиций в настоящем изобретении может быть использован «физиологический раствор», или «раствор глюкозы», или другие менее предпочтительные носители, включая водные изотонические солевые растворы, растворы электролитов, а также неводные фармацевтически приемлемые полярные растворители, такие как масла, спирты, амиды, сложные эфиры, простые эфиры, кетоны, углеводороды и их смеси.
Помимо лекарственного средства и носителя, фармацевтические композиции могут необязательно содержать один или несколько известных из уровня техники фармацевтически приемлемых эксципиентов (вспомогательных компонентов). В частности, в настоящем изобретении эксципиенты могут быть выбраны из сорастворителей, наполнителей, солюбилизаторов, соединений, способствующих поддержанию рН и/или изотоничности, эмульгаторов, консервантов, антиоксидантов и других веществ. Эти хорошо известные компоненты фармацевтических композиций способствуют улучшению их потребительских или полезных свойств за счет облегчения применения, повышения стабильности, регулирования значения рН, изменения времени удерживания лекарственного соединения в месте введения. Так, в соответствии с еще одним аспектом настоящего изобретения стабильность фармацевтических композиций нафтоиндолдиона I и их эффективность могут быть повышены за счет одного или нескольких эксципиентов, выбранных независимо из группы сорастворителей, солюбилизаторов, наполнителей, эмульгаторов, консервантов, антиоксидантов, буферных солей и веществ для поддержания изотоничности. Количество нафтоиндолдиона I или его фармацевтически приемлемой соли в фармацевтической композиции не ограничивается, но предпочтительно составляет от 0,1% до 10% (мас./об.), более предпочтительно от 0,1% до 5% (мас./об.). Количество растворителя (наполнителя или разбавителя) не ограничивается, но может достигать до 99 мас. % в расчете на общую массу композиции, как хорошо известно в технологии приготовления лекарственных форм. Количество сорастворителя в композиции не ограничивается и может варьироваться, например, от 1% до 60%. Количество солюбилизирующего агента в композиции не ограничивается и может варьироваться, например, от 0,1% до 20%. Количество стабилизатора и антиоксиданта в композиции не ограничивается, но может достигать, например, от 0,1 до 1%. Количество агента для поддержания изотоничности в композиции не ограничивается, но может достигать, например, от 0,5 до 10%. Количество консерванта не ограничивается и может составлять, например, от 0,001 до 5%.
В качестве сорастворителей фармацевтические композиции нафтоиндолдиона I могут содержать один или несколько фармакологически приемлемых растворителей, пригодных для приготовления жидких парентеральных форм. Такие сорастворители хорошо знакомы специалистам в области фармацевтики (без ограничения перечисленным): спирты или полиолы (например, этанол, 1,2-пропиленгликоль, глицерин, 1,3-бутиленгликоль), модифицированные полиоксиалкиленом алкиленоксиды или липиды (например, полиэтиленгликоль ПЭГ), сложные полиоксиэтиленсорбитановые эфиры жирных кислот, эфиры полиэтиленгликоля, сложные полиоксиэтиленовые эфиры жирных кислот, сополимеры этиленоксида и пропиленоксида (например, полоксамеры). Другие фармацевтически приемлемые сорастворители, которые могут быть использованы в настоящем изобретении, хорошо известны специалистам и описаны в литературе [например, в Modern Pharmaceutics (Fourth Edition). G. Banker et al. (eds.), 2002, 864; Remington′s Pharmaceutical Sciences (21th Edition) D B. Troy, P. Beringer (ed.), 2006, 2393, Spiegel A.J. et al. J. Pharm. Sci., 1963, 52 (10), 917-927]. Эти эксципиенты могут быть получены способами, хорошо известными в данной области техники, или от промышленных поставщиков.
В качестве эксципиентов, повышающих стабильность фармацевтических композиций нафтоиндолдиона I или обеспечивающих удобство их практического применения, в их состав могут входить один или несколько фармакологически приемлемых наполнителей или солюбилизирующих агентов, хорошо знакомых специалистам в области фармацевтики, такие как (без ограничения перечисленным) лактоза, декстран, поливинилпирролидон (ПВП), полисорбат 80 (твин 80), кремофор ЕН, гидроксиалкилированые β-циклодекстрины и γ-циклодекстрины и т.п. В предпочтительных вариантах осуществления настоящего изобретения для приготовления стабильных фармацевтических композиций для парентерального применения нафтоиндолдиона I, являющихся предметом настоящего изобретения, используются лактоза, ПВП, полоксамеры, твин 80, гидроксипропильные производные β- или γ-циклодекстринов.
В качестве консервантов, предохраняющих композицию от воздействия микроорганизмов, в настоящем изобретении могут быть применены различные противомикробные вещества, хорошо знакомые специалистам в области фармацевтики, такие как (без ограничения перечисленным) сульфиты, бензиловый спирт, хлорбутанол, сорбит, ксилит, сорбиновая кислота, бензойная кислота, тимеросал, парабены и их различные соли.
В качестве вспомогательных буферных компонентов в фармацевтических композициях настоящего изобретения могут быть предпочтительно использованы кислоты (например, лимонная, уксусная, фосфорная и др.), или их соли с щелочными металлами (например, цитрат, ацетат или дигидрофосфат натрия и др.), или их сочетания (например, лимонная кислота и цитрат натрия). Ионная сила буферного раствора, используемого как компонент жидкой композиции в настоящем изобретении, не ограничивается и может быть, например, на уровне 0,01-0,6.
В качестве антиоксидантов могут быть использованы, например, глюкоза, аскорбиновая кислота, метабисульфит натрия, бисульфит натрия, сульфит натрия, фенолы и тиофенолы.
В одном из вариантов приготовления жидких фармацевтических композиций фармацевтически приемлемую соль нафтоиндолдиона I и необходимые эксципиенты (например, наполнители, солюбилизирующие или стабилизирующие агенты, буферы, антиоксиданты и т.п.) растворяют или суспендируют в подходящем фармакологически приемлемом носителе (например, в «воде для инъекций», или в «растворе глюкозы», или ПЭГ) с выдерживанием смеси до полного растворения всех ингредиентов при температуре от 20 до 100°С, предпочтительно при температуре от 20 до 25°С. При необходимости раствор разбавляют водой для инъекций для получения желаемой концентрации нафтоиндолдиона I (предпочтительно 0,1% до 5%). Полученная таким образом композиция может быть применена непосредственно после приготовления. В другом варианте полученной композицией заполняют герметизируемый стеклянный сосуд (ампулу или флакон), после чего стерилизуют, укупоривают и хранят в защищенном от света месте.
Таким образом, настоящее изобретение описывает готовые жидкие фармацевтические композиции для парентерального применения, содержащие нафтоиндолдион I. Кроме того, в некоторых вариантах осуществления композиция является сухой (как, например, лиофилизированной), которая может быть восстановлена, ресуспендирована или регидратирована для получения стабильной жидкой композиции фармацевтического вещества. Так, авторы настоящего изобретения путем лиофилизации жидких композиций получили ряд лиофилизированных препаратов, обладающих превосходной лекарственной стабильностью в процессе приготовления и хранения и легко восстанавливающихся в жидкую композицию при добавлении водного растворителя. Соответственно, настоящее изобретение также включает лиофилизированные композиции нафтоиндолдиона I. В некоторых вариантах осуществления композиция может быть промежуточной жидкой (как, например, водной) композицией, которую можно высушить (как, например, лиофилизировать), или жидкой (как, например, водной) композицией, полученной посредством восстановления или ресуспендирования сухой композиции.
Для получения лиофилизированных композиций, являющихся предметом настоящего изобретения, жидкую композицию нафтоиндолдиона I, полученную, как описано выше, заливают в жесткий сосуд, такой как стерильная ампула, флакон или пузырек, и подвергают лиофилизации традиционным способом. Количество жидкого препарата, которым заполняют сосуд, составляет, например, от 5 до 50% (об./об.) от объема сосуда, особенно предпочтительно 10-25% (об./об.). Внешнюю температуру при лиофилизации предпочтительно поддерживают от -70 до 0°С, особенно предпочтительно от -60 до -40°С, и применяемое давление для сублимации растворителя предпочтительно составляет от 0,01 до 0,2 мм рт. ст., более предпочтительно от 0,01 до 0,1 мм рт. ст. Предпочтительно скорость лиофилизации регулируется таким образом, чтобы растворитель (в расчете на раствор) сублимировался со скоростью от 10 мкл до 100 мкл на 1 см2 площади поверхности, с которой сублимируется растворитель в течение 1 часа.
В случае лиофилизации жидкой композиции, особенно содержащей декстран, маннит и/или карбонат натрия и др., защита от разрушения сосуда, содержащего лиофилизируемый раствор, может быть обеспечена введением добавок, например сульфатов щелочных металлов (например, сульфата натрия, сульфата калия и др.) в указанный жидкий препарат. Кроме того, лиофилизируемые композиции могут содержать дополнительные криозащитные компоненты, предотвращающие осаждение лекарственного соединения, такие как поверхностно-активные вещества, смачивающие или эмульгирующие агенты (как, например, лецитин, полисорбат 80, полиоксиэтиленстеарат).
Содержание указанных эксципиентов может составлять 0,01-10% от веса лекарственного препарата.
Лиофилизированные композиции, являющиеся предметом настоящего изобретения, приготовленные, как указано выше, обладают отличными свойствами в отношении стабильности действующего вещества (нафтоиндолдиона I) в процессе приготовления или хранения. Вышеописанные лиофилизированные формы, как и жидкие композиции для парентерального применения нафтоиндолдиона I, могут быть упакованы в стерильные флаконы, ампулы или пакеты, пузырьки для однократного или многократного применения. Фармацевтические композиции в сухой (лиофилизированной) или жидкой концентрированной форме, как известно из уровня техники, перед использованием могут быть восстановлены или разбавлены посредством добавления стерильного фармацевтически приемлемого растворителя с получением необходимой концентрации терапевтического агента. Это дает возможность, при необходимости, легко приготовить стерильную жидкую композицию для парентерального применения нафтоиндолдиона I, которая может быть непосредственно введена пациенту.
Нафтоиндолдион I и жидкие фармацевтические композиции, содержащие от 0,1 до 5% соединения формулы I или его соли, могут быть применены парентерально (например, внутривенно, внутриартериально, внутримышечно, подкожно, ректально, интраспинально, интраперитонеально, внутриполостно) для лечения рака молочной железы или других онкологических заболеваний, включая формы болезни, характеризующиеся резистентностью к другим лекарственным средствам.
Термин "фармацевтическая композиция", использованный в настоящем описании, означает, например, смесь, содержащую определенное количество терапевтического агента, например, терапевтически эффективное количество лекарственного соединения, по меньшей мере, с одним фармацевтически приемлемым носителем, предназначенную для введения человеку.
Термин "фармацевтически приемлемый", использованный в настоящем описании, относится к соединениям, композициям и/или лекарственным формам, которые при контакте с тканями млекопитающих, прежде всего тканями человека, не вызывают аллергических реакций, раздражения, осложнений или других токсических проявлений, и указанные соединения характеризуются достаточно высоким соотношением польза/риск.
"Фармацевтически приемлемая соль" в настоящем изобретении означает обычные соли, получаемые прибавлением кислоты к основанию, которые сохраняют биологическую эффективность и свойства нафтоиндолдиона I и образуются из его свободного основания и подходящих органических или неорганических кислот. Примеры солей, образующихся при прибавлении кислоты, включают соли, полученные из органических кислот, например метансульфоновой, этансульфоновой, 2-гидроксиэтансульфоновой, п-толуолсульфоновой, или неорганических кислот, например хлористоводородной, бромистоводородной, йодистоводородной, серной, сульфаминовой и т.п. Кроме того, термин "фармацевтически приемлемая соль" также включает фармацевтически приемлемые сольваты, предпочтительно гидраты. Химическое превращение нафтоиндолдиона I в соль осуществляется способом, хорошо известным химикам-фармацевтам, обеспечивающим улучшенную физическую и химическую стабильность, гигроскопичность, сыпучесть и растворимость соединений [см., например, Pharmaceutical Dosage Forms and Drug Delivery Systems (6th Edition). Rowe R.C. (Ed.), 1995, 1456-1457]. Для демонстрации эффективности заявляемого способа лечения даны примеры использования дигидрохлорида (R)-4,11-дигидрокси-3-[(пирролидин-3-иламино)метил]-1H-нафто[2,3-f]индол-5,10-диона (I), синтезированного ранее описанным методом [А.Е. Shchekotikhin etal, Eur. J. Med. Chem., 2014, 30 (86), 797].
Термин "фармакологически приемлемый носитель" в настоящем изобретении означает один или несколько совместимых жидких или твердых разбавителей или наполнителей, которые подходят для введения млекопитающему, предпочтительно человеку. Предпочтительно в качестве фармацевтически приемлемого носителя в композициях по изобретению используются протонсодержащие среды, более предпочтительно водные среды.
Концентрация терапевтического агента в фармацевтической композиции составляет определенное значение, обеспечивающее введение терапевтически эффективного количества лекарственного средства, которое зависит от скорости абсорбции, инактивации и выведения из организма препарата, а также от тяжести состояния пациента или от других факторов, известных специалистам в данной области техники.
"Эффективное количество" или "терапевтически эффективное количество" соединения в настоящем изобретении означает количество нафтоиндолдиона I или его фармацевтически приемлемой соли, которое значительно подавляет пролиферацию опухолевых клеток и эффективно для предупреждения, ослабления или смягчения симптомов заболевания или увеличения продолжительности жизни субъекта, подвергающегося лечению. Определение терапевтически эффективного количества вещества относится к компетенции специалиста в данной области техники. Терапевтически эффективное количество или дозировка соединения, предлагаемого в настоящем изобретении, может меняться в широких пределах и может определяться способом, известным в данной области техники.
Для конкретного реципиента соответствующий курс лечения подбирается с учетом индивидуальной потребности и мнения врача, который вводит фармацевтические композиции пациенту или назначает введение фармацевтических композиций. Суточную дозу терапевтического агента можно вводить однократно в виде разовой дозы или многократно в виде разделенных доз, которые вводят через определенные периоды времени, или при парентеральном введении ее можно вводить путем непрерывного вливания. Таким образом, необходимое количество терапевтического агента, например необходимое терапевтически эффективное количество, определяет специалист в данной области медицины. Например, доза терапевтического агента может варьироваться в зависимости от возраста, веса тела или условий в интервале от приблизительно 1 мг до приблизительно 100 мг в расчете на нафтоиндолдион I или его фармацевтически приемлемую соль на килограмм массы тела реципиента в сутки.
Подтверждение эффективности заявляемого способа лечения получено на иммунодефицитных мышах-самках Balb/c nude с подкожными (п/к) ксенографтами перевиваемого рака молочной железы человека, которым однократно или многократно парентерально вводят фармацевтические композиции, содержащие нафтоиндолдион I. Для трансплантации был взята адаптированная к росту in vivo культура клеток рака молочной железы человека T47D из АТСС (номенклатурный номер № НТВ 133b-у). Опухоль представляет собой протоковый рак («ductal carcinoma»), клетки которого получены из плеврального выпота больной раком молочной железы с метастатическим плевритом. Клетки опухоли характеризуются положительной экспрессией рецепторов кальцитонина, андрогенов, эстрогенов, прогестеронов, глюкокортикоидов, пролактина. Методика трансплантации опухолей стандартная [Anticancer Drug Development Guide. Preclinical screening, clinical trials, and approval, edt. by Teicher B.A., Andrews P.A., Humana Press (Totowa-New Jersey), 2004, 450; Трещалина E.M., Жукова О.С., Герасимова Г.К., Андронова Н.В., Гарин A.M. Методические рекомендации по доклиническому изучению противоопухолевой активности лекарственных средств // В кн. «Руководство по проведению доклинических исследований лекарственных средств. Часть первая». - М.: изд. Гриф и К. - 2012. - Гл. 39. Стр. 642-657; Трещалина Е.М., Андронова Н.В., Гарин A.M. Доклиническое изучение противоопухолевых препаратов» // Глава в кн.: "Рациональная фармакотерапия в онкологии». - М., 2015. - Гл. 5. - Стр. 70-75]. В опыте использовали 10-18 пассажи опухоли in vivo. Имплантация 1-го пассажа выполнена 3,0×106 клеток на мышь.
Популяция жизнеспособных клеток составила 98% при окраске трипановым синим. Последующее многократное подкожное пассирование выполнено взвесью опухолевой ткани из предшествующих пассажей по 50 мг на мышь в среде 199.
Мышам фармацевтические композиции, содержащие 0,2% нафтоиндолдиона I, вводили в брюшную полость однократно в разовой дозе 80 мг/кг или 5-кратным курсом ежедневно в разовой дозе 30 мг/кг (суммарная доза 150 мг/кг) с началом лечения на 4 или 6 сутки после трансплантации ксенографтов. В качестве препарата сравнения использовали доксорубицин во флаконах по 10 мг (Эбеве, Австрия), который вводили мышам в разведении физиологическим раствором в 0,03%-ной концентрации внутрибрюшинно 5-дневным курсом в эффективной разовой дозе 3,0 мг/кг (суммарная доза 15 мг/кг). Мыши группы контроля получали в/б инъекции физиологического раствора (0,9% раствор натрия хлорида) в адекватном объеме в аналогичных схемах.
Эффективность лечения оценивали по стандартным критериям: по торможению роста опухоли (ТРО) и скорости роста опухоли. Торможение роста опухоли (Т/С, «treatment/control»), определенное по формуле T/C=(Vо/Vк)×100%, где Vo - средний объем опухоли в опытной группе животных, Vк - средний объем опухоли в контрольной группе. В контроле Т/С принимается за 100%. Минимальный критерий эффективности для п/к ксенографтов опухолей человека Т/С≤42% [Anticancer Drug Development Guide. Preclinical screening, clinical trials, and approval, edt. by Teicher B.A., Andrews P.A., Humana Press (Totowa-New Jersey), 2004, 450; Трещалина E.M., Жукова O.C., Герасимова Г.К., Андронова Н.В., Гарин A.M. Методические рекомендации по доклиническому изучению противоопухолевой активности лекарственных средств // В кн. «Руководство по проведению доклинических исследований лекарственных средств. Часть первая». - М.: изд. Гриф и К. - 2012. - Гл. 39. Стр. 642-657; Трещалина Е.М., Андронова Н.В., Гарин A.M. Доклиническое изучение противоопухолевых препаратов» // Глава в кн.: "Рациональная фармакотерапия в онкологии». - М., 2015. - Гл. 5. - Стр. 70-75]. Скорость роста опухоли вычисляли по формуле: Vt/V0, где V0 - средний объем опухоли до лечения, Vt - средний объем опухоли на сроки после лечения.
О переносимости лечения судили по поведению и состоянию мышей во время проведения опыта, а также по результатам аутопсии умерщвленных после окончания наблюдения мышей.
Начальные объемы опухолей на 4 сутки после трансплантации составили 32-57 мм3, что удовлетворяет условиям «раннего лечения». Для тестирования эффективности препарата на модели «позднего лечения» проведен эксперимент с однократным применением на опухолях больших размеров (Vcp~240 мм3), что достигнуто смещением начала лечения с 4 на 6 сутки после трансплантации опухоли в период экспоненциальной фазы роста.
Измерение объема опухолей проводили многократно, начиная от образования пальпируемых опухолей в контроле. Объем опухоли вычисляли по произведению 3-х взаимно перпендикулярных диаметров. Статистическая обработка результатов экспериментов проведена стандартным методом Фишера-Стьюдента в модификации Р.Б. Стрелкова, различия считали статистически достоверными при р≤0,05.
Следующие ниже неограничивающие примеры даны для демонстрации предпочтительных вариантов осуществления настоящего изобретения.
Пример 1
Получение лиофилизированных фармацевтических композиций для парентерального применения нафтоиндолдиона I
Растворы нафтоиндолдиона I для получения лиофилизированных фармацевтических композиций готовят в дистиллированной воде в стерильной посуде. В мерный сосуд наливают 3/4 от требуемого объема воды и растворяют в ней отвешенное количество дигидрохлорида нафтоиндолдиона I [А.Е. Shchekotikhin etal, Eur. J. Med. Chem., 2014, 30 (86), 797] при помешивании смеси. Полученные растворы нафтоиндолдиона I стерилизуют, удаляя бактериальную контаминацию и механические примеси фильтрованием раствора через микропористый фильтр в асептических условиях. Полученный раствор переносят в мерный сосуд и доводят стерильной водой до требуемого объема. После проверки содержания нафтоиндолдиона I методом ВЭЖХ (требуемая концентрация 10±0,05 мг/мл) растворы дозируют по 2 мл в стерильные флаконы из нейтрального стекла. Флаконы с растворами закрывают стерильными марлевыми тампонами и выдерживают при -70°С 12 ч. Флаконы с замороженным раствором вносят в установку для лиофильной сушки и выдерживают 12 ч при давлении 0,01 мм рт. ст. После извлечения из установки флаконы укупоривают стерильными резиновыми пробками и обкатывают алюминиевыми колпачками.
Иллюстративные рецептуры лиофилизированных фармацевтических композиций для приготовления растворов для парентерального применения нафтоиндолдиона I приведены ниже (представлен состав композиций нафтоиндолдиона I из расчета на один флакон объемом 10 мл).
Состав 1: 20 мг дигидрохлорида нафтоиндолдиона I; 50 мг лактозы; 4 мг полоксамера 188, 1 мг сорбита.
Состав 2: 20 мг дигидрохлорида нафтоиндолдиона I; 60 мг маннита; 14 мг поливинилпирролидона, 2 мг полисорбата 80, 1 мг аскорбиновой кислоты.
Состав 3: 20 мг дигидрохлорида нафтоиндолдиона I; 100 мг 3-гидроксипропил-β-циклодекстрина (степень замещения 5), 3 мг полоксамера 188, 1 мг цитрата натрия.
Приготовленные составы стабильны при хранении как в естественных условиях (1 год, 25°С, в затемненном месте), так и в условиях ускоренного старения (64 дня при 60°С): снижение содержания нафтоиндолдиона I в композициях не превышает 2%. Лиофилизированные композиции составов 1-3 легко восстанавливаются в гомогенный раствор при комнатной температуре менее чем через 1 мин при добавлении 1-10 мл стерильной воды, «физиологического раствора» или «изотонического раствора глюкозы (5%) для внутривенных инъекций». Для приготовления 10 мл 0,2% раствора нафтоиндолдиона I к содержимому флакона прибавляют 10 мл «физиологического раствора» или «изотонического раствора глюкозы (5%) для внутривенных инъекций», периодически помешивая содержимое флакона до полного растворения композиции.
Пример 2
Противоопухолевая активность нафтоиндолдиона I при однократном применении на модели «раннее лечение»
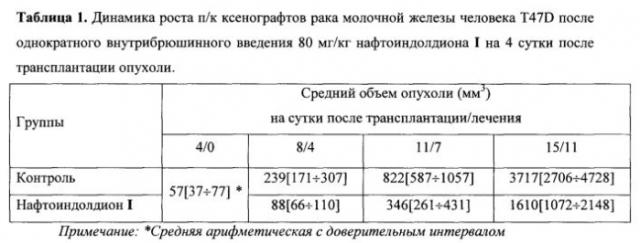
В группе контроля у животных без лечения на 4 сутки после трансплантации средний объем опухоли составил V0=57[37÷77] мм3 (таблица 1). На 8 сутки средний объем опухоли составил Vt=239[171÷307] мм3. На 11 сутки средний объем Vt=822[587÷1057] мм3, на 15 сутки Vt=3717[2706÷4728] мм3. Видно, что без лечения ксенографт T47D растет достаточно быстро - латентный период 3-4 дня. Кривая роста в течение 15 дней после трансплантации имеет экспоненциальную зависимость, о чем свидетельствует достижение опухолью среднего объема ~4 см3 к этому сроку. Скорость роста к 15 дню после трансплантации опухоли описывается соотношением Vt/V0=3717/57=65 (таблица 2). Гибель мышей от опухоли без лечения начиналась на 17 сутки после трансплантации опухоли и продолжалась в течение последующих 10 дней.
В группе животных, получавших лечение нафтоиндолдионом в дозе 80 мг/кг, на 4 сутки после введения I средний объем опухоли (Vt) составил 88[66÷110] мм3, на 7 сутки - Vt=346[261÷431] мм3, на 11 сутки - Vt=1610[1072÷2148] мм3 (таблица 1). Скорость роста к последнему изменению описывается соотношением Vt/V0=1610/57=28,2 (таблица 2). Анализ роста опухоли после введения нафтоиндолдиона I показывает, что скорость роста опухоли в экспоненциальной фазе в 2,3 раза меньше, чем в контроле: Vt/V0=28,2 против Vt/V0=65 (таблица 2).
Таким образом, при «раннем» лечении мышей с T47D нафтоиндолдионом I в однократной дозе 80 мг/кг достигнут значимый достоверный противоопухолевый эффект на уровне Т/С=37-42-43% (р<0,05), который в течение 8 дней удовлетворяет критерию эффективности, а на 10 сутки после лечения близок к нему (таблица 2).
Пример 3
Противоопухолевая активность нафтоиндолдиона I при однократном применении на модели «позднее лечение»
В группе контроля без лечения на 6-е сутки после трансплантации средний объем опухоли у животных составил V0=242[92÷392] мм3, на 10 сутки - Vt=890[522÷1258] мм3, на 14 сутки - Vt=2671[1497÷3845] мм3, на 17 сутки - Vt=4764[2080÷7448] мм3 (таблица 3). Видно, что без лечения ксенографт T47D растет быстро - латентный период 3-4 дня, экспоненциальная фаза роста прослеживается до 17 суток, о чем свидетельствует достижение объема более чем 4 см3. Скорость роста описывается соотношением Vt/V0=4764/242=19,6 (таблица 3). Гибель мышей от опухоли без лечения начиналась на 18 сутки после трансплантации опухоли и продолжалась в течение последующих 12 дней.
В группе животных, получавших лечение, на 4 сутки после введения нафтоиндолдиона I в дозе 80 мг/кг объем опухоли Vt составил 495[339÷651] мм3, на 8 сутки - Vt=1085[791÷1397] мм3, на 11 сутки - Vt=1910[1486÷2334] мм3 (таблица 3). Анализ роста опухоли после введения нафтоиндолдиона I показывает, что скорость роста опухоли в экспоненциальной фазе в 2,5 раза меньше, чем в контроле: Vt/V0=7,8 против Vt/V0=19,6 (таблица 4).
Таким образом, при «позднем» лечении мышей с T47D нафтоиндолдионом I в однократной дозе 80 мг/кг показан значимый достоверный противоопухолевый эффект на уровне Т/С=55-41-43% (таблица 4), который удовлетворяет критерию эффективности и близок к результатам, полученным при раннем лечении опухоли. Достоверные отличия от контроля выявлены для Т/С на 11 сутки после лечения (р<0,05). Наблюдаемый отдаленный достоверный результат Т/С=43% подтверждает противоопухолевый эффект препарата.
Пример 4
Противоопухолевая активность нафтоиндолдиона I при многократном применении на модели «раннее лечение»
В группе контроля у животных без лечения на 4-е сутки после трансплантации средний объем опухоли составил V0=32[18÷46] мм3, на 9 сутки - Vt=189[136÷242] мм3, на 12 сутки - Vt=489[348÷630] мм3, на 17 сутки - Vt=1261[869÷1653] мм3 (таблица 5). Экспоненциальная фаза роста прослеживается до 12 суток. Скорость роста описывается соотношением Vt/V0=1261/32=39,4. Гибель мышей от опухоли без лечения начиналась на 21 сутки после трансплантации опухоли и продолжалась в течение последующих 10 дней.
В группе животных, получавших лечение пятидневным курсом в разовой дозе нафтоиндолдиона I 30 мг/кг, на 1-е сутки после окончания введения препарата средний объем опухоли составил 68[50÷86] мм3, на 4 сутки - Vt=222[149÷295] мм3, на 9 сутки - Vt=593[391÷795] мм3 (таблица 6).
Таким образом, при лечении мышей с T47D пятидневным курсом в разовой дозе 30 мг/кг нафтоиндолдиона I достигнут значимый достоверный противоопухолевый эффект на уровне Т/С=36-45-47% (р<0,05) (таблица 6), который удовлетворяет критерию эффективности и воспроизводит результаты, полученные при однократном режиме применения. Скорость роста опухоли после лечения нафтоиндолдионом I описывается соотношением Vt/V0=593/32=18.5. Анализ роста опухоли после пятидневного курса лечения нафтоиндолдионом I показывает, что скорость роста опухоли в экспоненциальной фазе в 2.1 раза меньше, чем в контроле: Vt/V0=18,5 против Vt/V0=39,4 (таблица 6). Для препарата сравнения доксорубицина на 1 и 4 сутки после проведения лечения достоверных отличий от контроля по размерам опухолевых узлов не выявлено, ингибирование роста слабое и недостоверное, Т/С=67-68% (р>0,05). Более того, на 5-7 сутки доксорубицин вызвал гибель мышей от токсичности (таблица 6).
1. Способ лечения рака молочной железы нуждающегося в этом пациента, предусматривающий парентеральное введение указанному пациенту терапевтически эффективного количества (R)-4,11-дигидрокси-3-[(пирролидин-3-иламино)метил]-1H-нафто[2,3-f]индол-5,10-диона формулы I или его фармацевтически приемлемой соли или фармацевтической композиции, содержащей соединение формулы I или его фармацевтически приемлемую соль.
2. Фармацевтическая композиция для лечения рака молочной железы, включающая терапевтически эффективное количество соединения формулы I или его фармакологически приемлемой соли и фармакологически приемлемый носитель.
3. Фармацевтическая композиция по п. 2, в которой фармакологически приемлемый носитель содержит воду.
4. Фармацевтическая композиция по пп. 2-3, содержащая один или несколько эксципиентов, выбранных из β-циклодекстрина или его производного, γ-циклодекстрина или его производного, поливинилпирролидона, глюкозы, лактозы, полисорбата, полоксамера.
5. Лиофилизированная композиция, полученная путем лиофилизации композиции для лечения рака молочной железы по пп. 2-4.