Способ получения лабораторной модели артифициального флегмонозного воспаления мягких тканей у крыс на фоне искусственной иммуносупрессии
Иллюстрации
Показать всеИзобретение относится к экспериментальной медицине, а именно к моделированию артифициального флегмонозного воспаления мягких тканей. Для этого лабораторному животному (крысе) в одном шприце однократно вводят смесь, состоящую из человеческой слюны в количестве 0,3 мл, раствора дексаметазона 0,5 мг, суспензии гидрокортизона ацетата 2,5% в дозировке 20 мг на 100 г массы тела. Смесь вводят в мышцы бедра тазовой конечности крысы. Способ позволяет в 86% случаев моделировать воспаление в мягких тканях, приближенное по клиническому течению к артифициальному гнойно-воспалительному заболеванию мягких тканей у человека при простоте, доступности, экономичности методики, достижении результата в течение 3-х суток. 1 ил., 1 табл., 4 пр.
Реферат
Способ получения лабораторной модели артифициального флегмонозного воспаления мягких тканей у крыс на фоне искусственной иммуносупрессии.
Изобретение относится к области экспериментальной медицины и может быть использовано для моделирования артифициального гнойно-воспалительного заболевания мягких тканей у крыс.
Актуальность. Гнойная инфекция в хирургии занимает особое место среди наиболее важных проблем клинической медицины и с течением времени ее актуальность приобретает все большую значимость в практической деятельности любого хирурга (Ерюхин Р.Б., 2003). Особое место среди гнойно-воспалительных заболеваний занимают артифициальные заболевания. Экономические затраты на обследование и консервативное лечение одного пациента с артифициальным заболеванием составляют около 32 тыс.долларов США в месяц, а при выполнении операции могут достигать 168 тыс.долларов США (Baktari J.В. at al., 1994). В России сводные данные на финансовые затраты по лечению данной категории больных отсутствуют.
Актуальным остается изучение клинико-микробиологических и морфологических характеристик артифициального гнойно-воспалительного заболевания мягких тканей, вызванного введением наиболее часто используемых инфицированных, нестерильных биологических жидкостей человека или нефтепродуктов.
Известны модели ран у лабораторных животных, где авторы используют изоляты штаммов либо микстинфекцию наиболее часто встречающихся патогенов внутригоспитальной антибиотикорезистентной флоры, вызывающих флегмоны на фоне иммуносупрессии. Данные способы имеют существенные недостатки, так как при инфицировании человеческой слюной вирулентный симбиоз микроорганизмов полости, а не одного или нескольких изолятов, приводит к образованию флегмоны с быстропрогрессирующим течением, как правило, анаэробной в более короткие сроки. Известен способ моделирования околочелюстной флегмоны у белых лабораторных крыс породы Wistar путем введения 2-кратно 2,5% эмульсии гидрокортизона ацетата в дозе 20 мг на 100 г массы тела животного. Затем двукратно вводят культуру золотистого стафилококка в дозе по 400 млн микробных тел под надкостницу нижней челюсти (Патент №2442224 РФ Маликова С.Г., 2012). Существенным недостатком в указанных методиках является использование открытых ран для инфицирования. При инъекции слюны в мягкие ткани наличие бескислородной среды способствует росту анаэробной флоры, содержащейся в полости рта. Все вышеуказанные способы формирования флегмоны не учитывали особенности повреждения мягких тканей при артифициальных гнойно-воспалительных заболеваниях мягких тканей, вызванных путем введения бактериально загрязненных жидкостей, например человеческая слюна, моча, кал. Для создания модели артифициальной флегмоны и достоверности сопоставления результатов с наиболее часто встречающимися клиническими наблюдениями целесообразно выполнять инфицирование мягких тканей путем инъекции человеческой слюны.
Для создания эффективной модели необходим фон иммунологической недостаточности, который, как известно, характерен для лиц призывного возраста, вызывающих артифициальные заболевания (Новоженов В.Г. и соавт., 1997; Покровский В.И., 1994). Нами предложена инъекция человеческой слюны в объеме 0,3 мл с глюкокортикоидами короткого и длительного действия в мышцы области бедра тазовой конечности лабораторной крысы, что позволяет эффективно снизить как местный, так и общий иммунный ответ и пролонгировать глюкортикоидный эффект без многократного повторного введения. Сила глюкокортикоидной активности дексаметазона превышает таковую гидрокортизона ацетата в 7 раз, а его максимальное действие наступает через 12 часов, за счет более медленного метаболизирования в организме и сохраняется на протяжении 3 суток ("Регистр лекарственных средств России" 2000-2014 гг.). Использовали гидрокортизона ацетата 20 мг на 100 г массы тела животного, дозировка которого намного превышает терапевтическую, (Патент №2442224 РФ Маликова С.Г., 2012) в местной инъекции в сочетании со слюной в количестве 0,3 мл и дексаметазоном 0,5 мг - терапевтическая концентрация.
В эксперименте использовали крыс породы Wistar, самцов массой 180-220 грамм. Выбор крыс-самцов диктуется необходимостью получения стабильных результатов, исключая влияние циклических изменений, характерных для организма самок. Это позволяет стандартизировать условия проведения экспериментальных исследований. На основании данных ряда исследователей для создания модели артифициального гнойно-воспалительного заболевания мягких тканей на лабораторных животных решили использовать инъекцию человеческой слюны. Все вмешательства проводили в стерильных условиях под общим обезболиванием. На момент инъекции инфицирующего агента крыса на несколько секунд помещалась в фиксатор, в роли фиксатора использовали прозрачную пластиковую бутылку, «устройство для фиксации мелких лабораторных животных» (патент РФ №2461368).
Задача изобретения состоит в том, чтобы разработать способ получения лабораторной модели артифициального флегмонозного воспаления мягких тканей у крыс на фоне искусственной иммуносупрессии, вызванного путем введения нестерильной биологической жидкости - человеческой слюны.
Технический результат состоит в том, чтобы в короткие сроки, на 3-е сутки, добиться возникновения быстро прогрессирующей флегмоны мягких тканей у крыс путем введения нестерильной биологической жидкости - человеческой слюны на фоне искусственной иммуносупрессии.
Технический результат достигается тем, что в одном шприце животному - крысе - в мышечный массив области бедра тазовой конечности, что изображено на Фиг. 1, через предварительно деэпелированный и обработанный антисептиком участок кожи вводят смесь двух препаратов: 2,5% эмульсии гидрокортизона ацетата в дозе 20 мг на 100 г массы тела животного, раствор дексаметазона 0,5 мг и человеческой слюны в количестве 0,3 мл. На Фиг. 1 схематически представлена инъекция инфицирующей смеси с глюкокортикоидами в мышцы области бедра тазовой конечности крысы, на которой отмечены: 1 - инсулиновый шприц, содержащий инфицирующую смесь и глюкокортикоиды, 2 - тазовая конечность, 3 - область бедра, 4 - область голени. Слюна получена у студентов-добровольцев ГБОУ ВПО «Дальневосточного государственного медицинского университета» г. Хабаровск, призывного возраста. С целью увеличения титра микробных сообществ, специальной частью на тыльной стороне головки зубной щетки, вначале подметающими движениями - от корня к кончику - счищали налет, слизь на одной половине языка, затем другой и, очистив язык слюной, сплевывали в стерильную пробирку.
В течение всего времени с момента введения контролировалось состояние крыс. На 3-е сутки после введения слюны отмечали снижение двигательной активности, аппетита, появление обширной инфильтрации тканей бедра у места инъекции. На 5-е сутки снижение массы тела на 10%, загрязнение наружных покровов. На 6-е сутки сформировалась флегмона с распространением гнойного воспаления на соседние анатомические области. На 12-е сутки эксперимента 60% животных умерли, что детально продемонстрировано в примере 1, на 14-е сутки еще 20% умерли и у 20% воспалительный процесс привел к абсцессу.
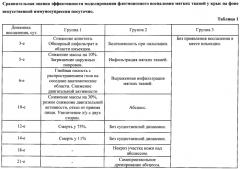
По предлагаемому способу получена модель артифициального гнойно-воспалительного заболевания мягких тканей у 30 из 35 крыс, использовавшихся в эксперименте. Эксперимент проведен нами на белых крысах самцах массой 180-220 граммов, которые методом случайных чисел разделены на группы, по 35 крыс в каждой: опытная 1-я группа, группа сравнения 2-я группа и контрольная 3-я группа. В 1-й группе, как показано в примере 1, создан системный иммунодефицит и местное противовоспалительное действие одномоментным введением человеческой слюны 0,3 мл в мышечный массив тазовой конечности и смеси гидрокортизона ацетата 2,5% в дозе 20 мг на 100 г массы тела крысы и дексаметазона в дозе 0,5 мг. Во 2-й группе вводили только человеческую слюну в количестве 0,3 мл в мышечный массив тазовой конечности без индуцирования иммуносупрессии, что показано в примере 2. В 3-й группе крысам вводили физиологический раствор 0,9% NaCl в количестве 0,3 мл в мышечный массив тазовой конечности, что наглядно показано в примере 2. Данные исследования включены в таблицу 1.
В 1-й группе на 3-е сутки отмечались клинические проявления воспаления, наличие обширного инфильтрата мягких тканей в месте инъекции триггерной смеси. На 5-е сутки снижение массы тела на 10%, снижение двигательной активности, наружные покровы становились грязные, распространение гнойного воспаления на спинку. На 10-е сутки потеря в массе до 30%, резкое снижение двигательной активности, отказ от приема пищи. На 12-е сутки 26 крыс умерли на фоне разлитого гнойного воспаления мягких тканей тазовой конечности, на 14-е сутки умерли еще 4 крыс и у 5 оставшихся крыс сформировался абсцесс. При вскрытии умерших животных установлено, что флегмона распространялась на мягкие ткани всей тазовой конечности и прилежащие области. При разрезе из раны под давлением истекал жидкий коричневый гной с пузырьками газа и зловонным запахом. Пораженные серо-коричневые пропитанные гноем ткани имели дряблую консистенцию. Кроме того, на стороне поражения имелись признаки регионарного лимфаденита - увеличение и уплотнение лимфатических узлов.
Во 2-й группе клинические проявления местного воспаления начали проявляться на 6-е сутки, формирование абсцесса на 10-е сутки. Животные 2-й группы забиты, выведены из эксперимента на 12-е сутки, при вскрытии обнаружены скудные изменения в виде абсцесса с гнилостным запахом, инфильтрация прилежащих тканей, гиперплазия лимфатических узлов на стороне поражения. При посеве материала на питательную среду в 1-й и 2-й группах получен рост: Candida spp., Enterococcus faecalis, E. coli, S. aureus, что соответствует резидентной флоре полости рта и результатам посевов, полученных при клинических наблюдениях.
В 3-й группе клинических проявлений местного воспаления не наблюдали. При вскрытии: тазовая конечность - вариант нормы. В микробиологических посевах стерильно.
Преимущества способа моделирования артифициального флегмонозного воспаления мягких тканей у крыс на фоне искусственной иммуносупрессии состоят в следующем:
1. Инфицирующий биологический материал не требует долгого и технически сложного процесса приготовления и титрования, затрат на текущий материал.
2. Инъекция человеческой слюны на фоне иммуносупрессии позволяет в эксперименте смоделировать воспалительный процесс, приближенный по клиническому течению к артифициальному гнойно-воспалительному заболеванию мягких тканей у человека.
3. Получение флегмонозного воспаления мягких тканей у крыс в короткие сроки, до 3 суток, что приближено к клинической картине течения артифициальной флегмоны.
4. Предложенный способ позволяет воспроизвести флегмонозное воспаления мягких тканей у крыс в 86% случаев, что в отличие от аналогов более эффективно.
Для иллюстрации положений предлагаются следующие примеры.
Пример 1
Самцу белой крысы, массой 186 г для индукции артифициального флегмонозного воспаления мягких тканей через предварительно деэпелированный и обработанный антисептиком участок кожи тазовой конечности в одном шприце было введено: 0,3 мл человеческой слюны, гидрокортизона ацетата в дозе 20 мг на 100 г веса (38 мг), дексаметазона 0,5 мг. На 3-е сутки после введения инфекта отмечали выраженную инфильтрацию тканей. На 6-е сутки распространение гнойного воспаления на спинку. На 12-е сутки - смертельный исход. Проведено гистологическое исследование тазовой конечности. При исследовании гистологических образцов: поперечнополосатая мышечная ткань с наличием очага некротической ткани в виде эозинофильных масс с базофильными включениями, вокруг которых скопления нейтрофильных лейкоцитов распадающихся и неизмененных с фагоцитированными кокками, палочками, за которыми следует слой грануляционной ткани с большим количеством эозинофильных лейкоцитов и новообразованных капилляров. Заключение: гнойно-некротическое воспаление мышечной ткани.
Пример 2
Самцу белой крысы, массой 200 г для индукции артифициального гнойно-воспалительного заболевания мягких тканей было введено через предварительно деэпелированный и обработанный антисептиком участок кожи тазовой конечности: 0,3 мл слюны. На 3-е сутки после введения инфекта отмечали невыраженную инфильтрацию тканей. На 6-е сутки формирование абсцесса в месте инъекции. На 12-е сутки без существенной динамики. На 18-е сутки некроз участка кожи над абсцессом. На 21-е сутки дренирование абсцесса наружу. Животное было умерщвлено под эфирным наркозом путем перерезки спинного мозга с соблюдением правил эвтаназии. Проведено гистологическое исследование тазовой конечности. При исследовании гистологических образцов: в пяти срезах поперечнополосатая мышечная ткань с наличием хронического гранулирующего воспаления с большим количеством лимфоцитов, плазматических клеток, макрофагов, с примесью гранулоцитов, пролиферацией сосудов, с очаговыми скоплениями гемосидерофагов, наличие очага некротической ткани. Заключение: хроническое воспаление, гнойно-некротическое воспаление мышечной ткани.
Пример 3
Самцу белой крысы массой 190 г деэпелировали и обработали антисептиком участок кожи задней конечности и ввели 0,3 мл 0,9% NaCl. За время наблюдения 21 день - без признаков воспаления. Животное было умерщвлено под эфирным наркозом путем перерезки спинного мозга с соблюдением правил эвтаназии. Проведено гистологическое исследование задней конечности. При исследовании гистологических образцов: в пяти срезах поперечнополосатая мышечная. Заключение: вариант нормы.
Пример 4
Самцу белой крысы, массой 210 г для индукции артифициального флегмонозного воспаления мягких тканей введено в одном шприце через предварительно деэпелированный и обработанный антисептиком участок кожи задней конечности: 0,3 мл человеческой слюны, гидрокортизона ацетата в дозе 20 мг на 100 г веса (40 мг), дексаметазона 0,5 мг. На 3-е сутки отмечали при контакте болезненность в месте инъекции. На 5-е сутки плотный инфильтрат. На 8-е сутки формирование абсцесса в месте инъекции. На 12-е сутки без существенной динамики. На 18-е сутки некроз участка кожи над абсцессом. На 20-е сутки дренирование абсцесса наружу. Животное было умерщвлено под эфирным наркозом путем перерезки спинного мозга с соблюдением правил эвтаназии. Проведено гистологическое исследование тазовой конечности. При исследовании гистологических образцов: в пяти срезах поперечнополосатая мышечная ткань с наличием хронического гранулирующего воспаления с большим количеством лимфоцитов, макрофагов, с примесью гранулоцитов, пролиферацией сосудов наличие очага некротической ткани. Заключение: хроническое воспаление, гнойно-некротическое воспаление мышечной ткани.
Способ получения лабораторной модели артифициального флегмонозного воспаления мягких тканей у крыс на фоне искусственной иммуносупрессии, включающий инъекцию гидрокортизона ацетата 2,5% в дозе 20 мг на 100 г массы тела, отличающийся тем, что гидрокортизона ацетат одновременно набирают в шприц с дексаметазоном в дозе 0,5 мг и в этот же шприц добирают человеческую слюну в количестве 0,3 мл, предварительно забранную в стерильную пробирку, затем вводят в мышцы бедра тазовой конечности крысы.