Способ получения 9-арил-6,8-диокса-13,20-диазапентацикло [11.8.0.01,10.02,7014,19генэйкоза-9, 14, 16, 18-тетраен-11, 12, 21-трионов
Иллюстрации
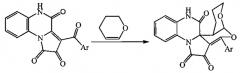
Показать всеИзобретение относится к способу получения новых 9-арил-6,8-диокса-13,20-диазапентацикло[11.8.0.01,10.02,7.014,19]генэйкоза-9,14,16,18-тетраен-11,12,21-трионов формулы I взаимодействием 3-ароилпиррола [1,2-а]хиноксалин-1,2,4(5Н)-трионов с 3,4-дигидропираном в среде инертного апротонного растворителя, например абсолютного 1,4-диоксана. Эти соединения могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем и в фармакологии. 1 з.п. ф-лы, 1 табл., 3 пр.
Реферат
Изобретение относится к области органической химии, а именно к способу получения новых индивидуальных соединений класса 6,8-диокса-13,20-диазапентацикло[11.8.0.01,10.02,7.014,19]генэйкозана, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем и в фармакологии.
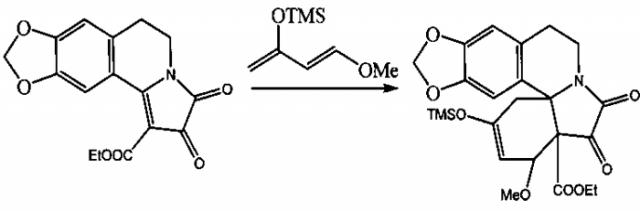
Известен структурный аналог заявленных соединений - этил 19-(триметилсилокси)-17-метокси-14,15-диоксо-5,7-диокса-13-азапентацикло-[11.7.0.1,16.02,10.04,8]эйкоза-2,4(8),9,18-тетраен-16-карбоксилат, получаемый при взаимодействии этил 2,3-диоксо-2,3,5,6-тетрагидроазоло[1,2-а]-[1,3]диоксоло[4′,5′:4,5]бензо[с]азин-1-карбоксилата с 1-метокси-3-(триметилсилокси)-1,3-бутадиеном, проводимым путем выдерживания реагентов при температуре 130°C в течение 3 часов (T. Sano, J. Toda, N. Kashiwaba et al., Heterocycles, 1981, v. 16, №7, p. 1151-1156).
К недостаткам данного способа относится невозможность получения 9-арил-6,8-диокса-13,20-диазапентацикло[11.8.0.01,10.02,7.014,19]генэйкоза-9,14,16,18-тетраен-11,12,21-трионов.
Задачей изобретения является разработка простого способа синтеза неописанных в литературе 9-арил-6,8-диокса-13,20-диазапентацикло[11.8.0.01,10.02,7.014,19]генэйкоза-9,14,16,18-тетраен-11,12,21-трионов.
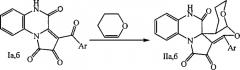
Поставленная задача осуществляется путем кипячения 3-ароилпирроло[1,2-a]хиноксалин-1,2,4(5H)-трионов (Iа,б) с 3,4-дигидро-2H-пираном в среде инертных апротонных растворителей по следующей схеме:
I и II: Ar=Ph (a), C6H4OMe-4 (б).
Процесс ведут при температуре 100°C, а в качестве растворителя используют абсолютный 1,4-диоксан.
Из патентной и технической литературы не были выявлены способы получения 9-арил-6,8-диокса-13,20-диазапентацикло[11.8.0.01,10.02,7.014,19]-генэйкоза-9,14,16,18-тетраен-11,12,21-трионов, имеющие сходные признаки с заявленным способом, а именно не использовались исходные продукты, растворитель, в котором проходит реакция, на основании чего можно сделать вывод о соответствии заявленного технического решения критерию «новизна» и «изобретательский уровень».
Изобретение иллюстрируется следующими примерами.
Пример 1. 9-Фенил-6,8-диокса-13,20-диазапентацикло[11.8.0.01,10.02,7.014,19]генэйкоза-9,14,16,18-тетраен-11,12,21-трион (IIa)
К раствору 3.0 ммоль 3-бензоилпирроло[1,2-а]хиноксалин-1,2,4(5H)-триона (Iа) в 20 мл абсолютного 1,4-диоксана добавляли раствор 12.0 ммоль 3,4-дигидро-2H-пирана в 5 мл абсолютного 1,4-диоксана, кипятили 90 мин, охлаждали, выпавший осадок отфильтровывали, промывали 10 мл ацетона.
Выход 36%, т.пл. 278-280°C (разл., 1,4-диоксан). Соединение (IIа) C23H18N2O5.
Найдено, %: С 68.71; H 4.41; N 7.09.
Вычислено, %: С 68.65; H 4.51; N 6.96.
Соединение (IIа) - бледно-желтое кристаллическое вещество, труднорастворимое в ДМСО, ДМФА и в обычных органических растворителях, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях.
В ИК-спектре соединения (IIа), снятого в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний группы NH в области 3184 см-1, лактамной карбонильной группы С21=O в области 1722 см-1, лактамной карбонильной группы С12=O и кетонной карбонильной группы С11=O в области 1700 см-1.
В спектре ЯМР 1H соединения (IIa), снятом в растворе ДМСО-d6, кроме сигналов протонов алифатических заместителей, ароматических колец и связанных с ними групп, присутствуют синглет протона ΝΗ группы при 11.16 м.д., дублет метановой группы С7Н при 5.76 м.д., мультиплет метановой группы С2Н при 2.24 м.д.
Пример 2. 9-(4-Метоксифенил)-6,8-диокса-13,20-диазапентацикло[11.8.0.01,10.02,7.014,19]генэйкоза-9,14,16,18-тетраен-11,12,21-трион (IIб)
К раствору 3.0 ммоль 3-(4-метоксибензоил)пирроло[1,2-а]хиноксалин-1,2,4(5H)-триона (Iб) в 20 мл абсолютного 1,4-диоксана добавляли раствор 12.0 ммоль 3,4-дигидро-2H-пирана в 5 мл абсолютного 1,4-диоксана, кипятили 90 мин, охлаждали, выпавший осадок отфильтровывали, промывали 10 мл ацетона. Выход 35%, т.пл. 282-284°C (разд., 1,4-диоксан). Соединение (IIб) C24H20N2O5.
Найдено, %: С 66.59; Η 4.65; N 6.51.
Вычислено, %: С 66.66; Η 4.66; N 6.48.
Соединение (IIб) - бледно-желтое кристаллическое вещество, труднорастворимое в ДМСО, ДМФА и в обычных органических растворителях, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях.
В ИК-спектре соединения (IIб), снятого в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний группы NH в области 3187 см-1, лактамной карбонильной группы С21=O в области 1729 см-1, лактамной карбонильной группы С12=O и кетонной карбонильной группы C11=O в области 1697 см-1.
В спектре ЯМР 1Н соединения (IIб), снятом в растворе ДМСО-d6, кроме сигналов протонов алифатических заместителей, ароматических колец и связанных с ними групп, присутствуют синглет протона NH группы при 11.15 м.д., дублет метановой группы С7Н при 5.73 м.д., мультиплет метановой группы С2Н при 2.22 м.д.
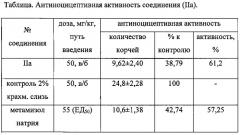
Пример 3. Фармакологическое исследование 9-арил-6,8-диокса-13,20-диазапентацикло[11.8.0.01,10.02,7.014,19]генэйкоза-9,14,16,18-тетраен-11,12,21-триона (IIа) на наличие антиноцицептивной активности
Антиноцицептивную активность соединения (IIa) по отношению к метамизолу натрия определяли методом «уксусные корчи» на беспородных мышах массой 18-22 грамм. Статическую обработку экспериментального материала проводили с использованием t критерия Стьюдента (М.Л. Беленький, Элементы количественной оценки фармакологического эффекта. - 2-е изд. - Л., 1963, - с. 152). Эффект считали достоверным при p<0,05.
Проведенные исследования показали (см. табл.), что соединение (IIа) обладает антиноцицептивной активностью. Данные о фармакологической активности аналогов заявляемых соединений в доступной литературе отсутствуют.
1. Способ получения 9-арил-6,8-диокса-13,20-диазапентацикло[11.8.0.01,10.02,7.014,19]генэйкоза-9,14,16,18-тетраен-11,12,21-трионов, отличающийся тем, что 3-ароилпирроло[1,2-а]хиноксалин-1,2,4(5H)-трионы подвергают взаимодействию с 3,4-дигидро-2H-пираном в среде инертного апротонного растворителя с последующим выделением целевых продуктов по следующей схеме:
2. Способ по п. 1, отличающийся тем, что в качестве растворителя используют абсолютный 1,4-диоксан.