Соединения для лечения рака
Иллюстрации
Показать всеИзобретение относится к соединению, представленному структурой формулы (II), где В представляет собой имидазол, замещенный (R10)l и R11; R1 представляет собой О-алкил, ОН, F, Cl, Br, I или С1-С5 линейный или разветвленный алкил; R2 и R3 каждый независимо представляет собой атом водорода, О-алкил, ОН, F, С1, Br, I, С1-С5 линейный или разветвленный алкил или -OCH2Ph; R5 представляет собой F, Cl, I, -СН3, галоалкил, CF3, -(CH2)iN(CH3)2 или -OCH2Ph; R4 и R6 каждый независимо представляет собой атом водорода, F, Cl, I, галоалкил, CF3, -(CH2)iN(CH3)2 или -OCH2Ph; R10 представляет собой атом водорода; R11 представляет собой атом водорода, С1-С5 линейный или разветвленный алкил, SO2Ph, SO2PhOCH3 или CH2Ph; X представляет собой связь; Y представляет собой -С=O; i равно 0; l равно 1; n представляет собой целое число от 1 до 3; и m представляет собой целое число от 1 до 3; или его оптическому изомеру, фармацевтически приемлемой соли или таутомеру. Изобретение также относится к соединению, представленному структурой формулы (XVI), где R4 представляет собой Н, О-алкил, I, Cl, F, алкил, галогеналкил, -(CH2)iN(CH3)2, OCH2Ph или ОН; R5 представляет собой I, Cl, F, алкил, галогеналкил, -(CH2)iN(CH3)2 или OCH2Ph; R3 представляет собой I, Br, С1 или F; i равно 0; и n равно 1-4. Изобретение относится к конкретным соединениям. Соединения предназначены для изготовления противораковой фармацевтической композиции и для лечения рака, лекарственно-устойчивой опухоли или опухолей, разрушения раковой клетки, где указанные рак, опухоль или раковая клетка представляют собой рак, опухоль или раковую клетку меланомы, метастатической меланомы или предстательной железы. Технический результат - соединения, обладающие противораковой активностью, для применения в противораковой терапии. 7 н. и 11 з.п. ф-лы, 21 табл., 52 ил., 28 пр.
, (имидазол),
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение касается новых соединений, обладающих противораковой активностью, способов получения таких соединений и их применения для лечения рака, лечения лекарственно-устойчивых опухолей, лекарственно-устойчивого рака, метастатического рака, метастатической меланомы, лекарственно-устойчивой меланомы, рака предстательной железы и лекарственно-устойчивого рака предстательной железы.
Уровень техники
Рак является второй по частоте причиной смерти в Соединенных Штатах, уступая только сердечным заболеваниям. В Соединенных Штатах рак является причиной каждой четвертой смерти. Уровень относительной пятилетней выживаемости для всех пациентов, у которых был диагностирован рак, в 1996-2003 годах составлял 66%, повысившись со значения 50%, зафиксированного в 1975-1977 годах (Cancer Facts & Figures American Cancer Society: Atlanta, GA (2008)). Такое повышение выживаемости отражает прогресс в диагностике на ранних стадиях и улучшение в методиках лечения. Разработка высокоэффективных противораковых средств, имеющих низкую токсичность, является приоритетной задачей в исследовании рака.
Микротрубочки представляют собой цитоскелетные волокна, состоящие из гетеродимеров α,β-тубулина, и участвуют в широком наборе клеточных функций, включая поддержание формы, везикулярный транспорт, моторику клеток и деление. Тубулин представляет собой главный структурный компонент микротрубочек и хорошо известную мишень для многих высокоуспешных противораковых лекарственных средств. Соединения, способные нарушать равновесие между микротрубочками и тубулином в клетках эффективны в лечении рака. Противораковые лекарства, способные нарушать равновесие между микротрубочками и тубулином в клетках, такие как таксол и винбластин, широко применяются в химиотерапии рака. Существует три основных класса противоопухолевых средств. Средства, стабилизирующие микротрубочки, которые связываются с полностью сформированными микротрубочками и предотвращают деполимеризацию субъединиц тубулина, представлены таксанами и эпотилонами. Двумя другими классами средств являются средства, дестабилизирующие микротрубочки, которые связываются с димерами тубулина и ингибируют их полимеризацию в микротрубочки. Алкалоиды барвинка, такие как винбластин, связываются с сайтом барвинка и являются представителями одного из таких классов. Колхицин и вещества, связывающиеся с сайтом колхицина, взаимодействуют с другим сайтом тубулина и представляют собой третий класс антимитотических средств.
И таксаны, и алкалоиды барвинка широко применяются для лечения раковых заболеваний у человека, в то время как ни одно из веществ, связывающихся с сайтом колхицина, к настоящему моменту не было одобрено для применения в химиотерапии рака. Однако, средства, связывающиеся с сайтом колхицина, такие как комбретастатин А-4 (СА-4) и АВТ-751 (фиг.19), находятся на стадии клинических испытаний в качестве потенциальных новых средств для химиотерапии (Luo, Y.; Hradil, V.Р.; Frost, D.J.; Rosenberg, S.H.; Gordon, G.В.; Morgan, S.J.; Gagne, G.D.; Cox, B.F.; Tahir, S.K.; Fox, G.В., АВТ-751, "a novel tubulin-binding agent, decreases tumor perfusion и disrupts tumor vasculature". Anticancer Drugs 2009, 20, (6), 483-92.; Mauer, A.M.; Cohen, E.E.; Ma, P.C; Kozloff, M.F.; Schwartzberg, L.; Coates, A.I.; Qian, J.; Hagey, A.E.; Gordon, G.В., "A phase II study of АВТ-751 in patients with advanced non-small cell lung cancer". J Thorac Oncol 2008, 3, (6), 631-6.; Rustin, G.J.; Shreeves, G.; Nathan, P.D.; Gaya, A.; Ganesan, T.S.; Wang, D.; Boxall, J.; Poupard, L.; Chaplin, D.J.; Stratford, M.R.; Balkissoon, J.; Zweifel, M., "A Phase Ib trial of CA4P (combretastatin A-4 phosphate), carboplatin, and paclitaxel in patients with advanced cancer". Br J Cancer 2010, 102, (9), 1355-60.).
К сожалению, противораковые лекарственные средства, взаимодействующие с микротрубочками, при клиническом применении имеют две главные проблемы: резистентность и нейротоксичность. Их эффективность ограничивается обычным механизмом множественной лекарственной резистентности (MDR), а именно выведением лекарства посредством белков-транспортеров АТФ-связывающей кассеты (АВС) (Green, H.; Rosenberg, P.; Soderkvist, P.; Horvath, G.; Peterson, C, "beta-Tubulin mutations in ovarian cancer using single strand conformation analysis-risk of false positive results from paraffin embedded tissues". Cancer letters 2006, 236, (1), 148-54.; Wang, Y.; Cabral, F., "Paclitaxel resistance in cells with reduced beta-tubulin". Biochimica et Biophysica Acta, Molecular Cell Research 2005, 1744, (2), 245-255.; Leslie, E.M.; Deeley, R.G.; Cole, S.P.C, "Multidrug resistance proteins: role of P-glycoprotein, MRP1, MRP2, and BCRP (ABCG2) in tissue defense". Toxicology and Applied Pharmacology 2005, 204, (3), 216-237.).
Р-гликопротеины (Р-gp, кодируются геном MDR1) являются важными представителями суперсемейства АВС. P-gp предотвращают внутриклеточное накопление многих противораковых лекарств путем усиления их выведения из раковых клеток, а также участвуя в их выведении через печень, почки или кишечник. Успех попыток одновременного введения еще и P-gp модуляторов или ингибиторов для усиления клеточной доступности посредством блокировки действия P-gp был очень ограничен (Gottesman, M.M.; Pastan, I., "The multidrug transporter, a double-edged sword". J Biol Chew 1988, 263, (25), 12163-6.; Fisher, G.A.; Sikic, B.I., "Clinical studies with modulators of multidrug resistance". Hematology/oncology clinics of North America 1995, 9, (2), 363-82).
Другой важной проблемой для таксанов, так же как для многих биологически активных природных продуктов, является их липофильность и нерастворимость в водных системах. Это приводит к применению в клинических препаратах эмульгаторов, таких как Cremophor EL и Tween 80. Был описан ряд биологических эффектов, вызываемых применением этих носителей в лекарственных препаратах, включая острые аллергические реакции и периферические нейропатии (Hennenfent, К.L.; Govindan, R., "Novel formulations of taxanes: a review. Old wine in a new bottle?" Ann Oncol 2006, 17, (5), 735-49.; ten Tije, A.J.; Verweij, J.; Loos, W.J.; Sparreboom, A., "Pharmacological effects of formulation vehicles: implications for cancer chemotherapy". Clin Pharmacokinet 2003, 42, (7), 665-85.).
По сравнению с соединениями, связывающимися с сайтами паклитаксела или алкалоидов барвинка, колхицин-связывающиеся средства обычно имеют относительно простую структуру. Тем самым они дают больше возможностей для достижения пероральной биодоступности посредством оптимизации структуры для улучшения растворимости и фармакокинетических параметров. Кроме того, как оказалось, эффективность многих из этих лекарственных средств не страдает от множественной лекарственной резистентности, обеспечиваемой P-gp. По этой причине такие новые соединения, нацеленные на колхицин-связывающие сайты, имеют большой потенциал в качестве терапевтических средств, в особенности благодаря более высокой растворимости в воде и способности избегать множественной лекарственной резистентности, обеспечиваемой P-gp.
Рак предстательной железы является одним из наиболее часто диагностируемых некожных видов рака среди мужчин в США и является второй по частоте причиной смерти от рака. Ожидаемая в этом году заболеваемость составляет свыше 180000, а смертность - почти 29000. Пациенты с поздними стадиями рака предстательной железы проходят антиандрогенную терапию (ADT), обычно с применением агонистов гормона, высвобождающего лютеинизирующий гормон (LHRH), или двусторонней орхиэктомии. Антиандрогенная терапия не только снижает уровень тестостерона, но также понижает уровень эстрогена, поскольку эстроген получается при ароматизации тестостерона, уровень которого снижается при ADT. Дефицит эстрогена, вызванный антиандрогенной терапией, вызывает заметные побочные эффекты, которые включают приливы, гинекомастию и масталгию, разрежение костей, снижение качества и прочности костной ткани, остеопороз и угрожающие жизни трещины, неблагоприятные изменения липидов, повышенный риск сердечно-сосудистых заболеваний и инфаркта миокарда, депрессию и другие изменения настроения. Считается, что многие из побочных эффектов от дефицита эстрогена при ADT вызываются ERα.
Лейпролид ацетат (Lupron®) представляет собой синтетический нонапептидный аналог природного гонадотропин-рилизинг гормона (GnRH или LH-RH). Лейпролид ацетат представляет собой суперагонист LH-RH, который в конечном счете подавляет выработку LH в гипофизе. Лейпролид ацетат работает как мощный ингибитор секреции гонадотропина, подавляя стероидогенез в яичниках и яичках. У человека введение лейпролида ацетата приводит к повышению уровня в крови лютеинизирующего гормона (LH) и фолликулостимулирующего гормона (FSH), в результате временно повышается уровень гонадных стероидов (тестостерона и дигидротестостерона у мужчин, и эстрона и эстрадиола у женщин предклимактерического возраста). Однако продолжительный прием лейпролида ацетата приводит к понижению уровня LH и FSH. У мужчин уровень тестостерона понижается до уровня кастратов (ниже 50 нг/дл). У женщин предклимактерического возраста уровень эстрогена понижается до уровня, характерного для постклимактерического возраста. Тестостерон является известным стимулом для раковых клеток в предстательной железе. Подавление секреции тестостерона или ингибирование действия тестостерона является, таким образом, необходимым компонентом терапии рака предстательной железы. Лейпролид ацетат может применяться для подавления LH, и, как следствие, снижения уровня тестостерона в плазме крови до уровня кастратов с целью лечения рака предстательной железы.
Злокачественная меланома представляет собой наиболее опасную форму рака кожи, на долю которой приходится около 75% смертей от рака кожи. Заболеваемость меланомой в Западной популяции постепенно повышается. Число заболевших удвоилось за последние 20 лет. Около 160000 новых случаев меланомы диагностируется в мире ежегодно, и она чаще встречается у мужчин и представителей европеоидной расы. Согласно отчету ВОЗ, в год в мире фиксируется около 48000 смертей от меланомы.
В настоящее время не существует эффективного метода лечения метастатической меланомы. Она крайне устойчива к известным в настоящее время методам химиотерапии, радиотерапии и иммунотерапии. Метастатическая меланома характеризуется очень плохим прогнозом, при этом медиана выживаемости составляет 6 месяцев, а уровень выживаемости в течение 5 лет составляет менее 5%. За последние 30 лет единственным одобренным FDA средством лечения метастатической меланомы является дакарбазин (DTIC). Однако он обеспечивает полную ремиссию всего лишь для менее 5% пациентов. В последние годы предпринимались большие усилия для борьбы с метастатической меланомой. Ни комбинирование DTIC с другими средствами химиотерапии (например, цисплатином, винбластином и кармустином), ни добавление интерферона-α2b к DTIC не дали повышения выживаемости по сравнению с лечением только DTIC. Совсем недавние клинические испытания с использованием антител и вакцин для лечения метастатической меланомы также не показали удовлетворительной эффективности.
Клетки меланомы имеют низкий уровень спонтанного апоптоза in vivo no сравнению с опухолевыми клетками других типов, и они относительно устойчивы к индуцируемому лекарствами апоптозу in vitro. Природная роль меланоцитов состоит в защите внутренних органов от УФ-излучения, потенциально способного повредить ДНК. Поэтому неудивительно, что клетки меланомы могут иметь специальные системы починки повреждений ДНК и повышенные характеристики выживаемости. Кроме того, недавние исследования показали, что при развитии меланома приобретает комплексные генетические изменения, приводящие к гиперактивации выкачивающих насосов, ферментов детоксикации и мультифакторному изменению путей выживания и апоптоза. Предполагается, что все вышеперечисленное обуславливает множественный лекарственно-устойчивый фенотип меланомы. Принимая во внимание рост случаев заболевания данной болезнью и высокую устойчивость к существующим терапевтическим средствам, разработка более эффективных лекарств для лечения распространенной меланомы и других типов рака, способных преодолевать множественную лекарственную резистентность, обеспечит значительные преимущества пациентам, страдающим от рака.
Краткое описание изобретения
В одном варианте осуществления настоящее изобретение касается соединения, представленного структурой формулы (Ia):
,
где
А представляет собой замещенную или незамещенную моноциклическую, конденсированную или полициклическую арильную или (гетеро)циклическую систему; замещенный или незамещенный, насыщенный или ненасыщенный N-гетероцикл; замещенный или незамещенный, насыщенный или ненасыщенный S-гетероцикл; замещенный или незамещенный, насыщенный или ненасыщенный O-гетероцикл; замещенный или незамещенный, насыщенный или ненасыщенный циклический углеводород; или замещенный или незамещенный, насыщенный или ненасыщенный смешанный гетероцикл;
В представляет собой
(тиазол), (тиазол), (тиазолидин),
(оксазол), (оксазолин), (оксазолидин), (бензол),
(бензол), (пиримидин), (имидазол),
(пиридин), (фуран), (тиофен), (изоксазол),
, (пиперидин), (пиразол), (индол), или
(изохинолин);
R1, R2 и R3 независимо представляют собой атом водорода, O-алкил, O-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)iNHCH3, -(CH2)iNH2, -(СН2)iN(СН3)2, -ОС(O)CF3, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, C(O)O-алкил, С(O)Н, -C(O)NH2 или NO2;
R10 и R11 независимо представляют собой атом водорода, O-алкил, O-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)iNHCH3, -(CH2)iNH2, -(СН2)iN(СН3)2, -ОС(O)CF3, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или NO2;
Х представляет собой связь, NH, C1-C5 углеводород, О или S;
Y представляет собой связь, -С=O, -C=S, -C=N-NH2, -C=N-OH, -CH-OH, -C=CH-CN; -C=N-CN, -СН=СН-, -С=С(СН3)2, -C=N-OMe, -(C=O)-NH, -NH-(C=O), -(С=О)-О, -O-(С=O), -(CH2)1-5-(C=O), (C=O)-(CH2)1-5, -(SO2)-NH-, -NH-(SO2)-, SO2, SO или S;
где указанные циклы А и В необязательно замещены 1-5 заместителями, которые независимо представляют собой O-алкил, O-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)iNHCH3, -(CH2)iNH2, -(СН2)iN(СН3)2, -ОС(O)CF3, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или NO2;
i представляет собой целое число от 0 до 5;
l представляет собой целое число от 1 до 2;
m представляет собой целое число от 1 до 3; и
где если В представляет собой бензольное кольцо, тиофеновый цикл, фурановый цикл или индольный цикл, то Х не является связью или СН2, и А не является индолом;
если В представляет собой индол, то Х не является О; и
если В представляет собой тиазольный цикл, то Х не является связью;
или его фармацевтически приемлемая соль, гидрат, полиморф, метаболит, таутомер или изомер.
В одном варианте осуществления настоящее изобретение касается соединения, представленного структурой формулы II:
,
где
В представляет собой
(тиазол), (тиазол), (тиазолидин),
(оксазол), (оксазолин), (оксазолидин), (бензол),
(бензол), (пиримидин), (имидазол),
(пиридин), (фуран), (тиофен), (изоксазол),
, (пиперидин), (пиразол), (индол), или
(изохинолин);
R1, R2, R3, R4, R5 и R6 независимо представляют собой атом водорода, O-алкил, O-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(СН2)iNHCH3, -(CH2)iNH2, -(СН2)iN(СН3)2, -ОС(O)CF3, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, C(O)O-алкил, С(O)Н, -C(O)NH2 или NO2;
R10 и R11 независимо представляют собой атом водорода, O-алкил, O-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)iNHCH3, -(CH2)iNH2, -(CH2)iN(CH3)2, -ОС(O)CF3, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или NO2;
Х представляет собой связь, NH, С1-С5 углеводород, О или S;
Y представляет собой связь, -С=O, -C=S, -C=N-NH2, -C=N-OH, -CH-OH, -C=CH-CN, -C=N-CN, -CH=CH-, С=СН(СН3)2, -C=N-OMe, -(C=O)-NH, -NH-(C=O), -(C=O)-O, -O-(C=O), -(CH2)1-5-(C=O), (C=O)-(CH2)1-5, -(SO2)-NH-, -NH-(SO2)-, SO2, SO или S;
i представляет собой целое число от 0 до 5;
l представляет собой целое число от 1 до 2;
n представляет собой целое число от 1 до 3; и
m представляет собой целое число от 1 до 3;
где если В представляет собой индол, то Х не является О; и
если В представляет собой тиазольный цикл, то Х не является связью;
или его фармацевтически приемлемая соль, гидрат, полиморф, метаболит, таутомер или изомер.
В одном варианте осуществления настоящее изобретение касается соединения, представленного структурой формулы (V):
где
В представляет собой
(тиазол), (тиазолидин), (оксазолидин),
(бензол), (бензол), (пиримидин), (пиридин),
(фуран), (тиофен), (изоксазол), ,
(пиперидин), (пиразол), (индол), или
(изохинолин);
R4, R5 и R6 независимо представляют собой атом водорода, O-алкил, O-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(СН2)iNHCH3, -(CH2)iNH2, -(CH2)iN(CH3)2, -ОС(O)CF3, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, C(O)O-алкил, С(O)Н, -C(O)NH2 или NO2;
R10 и R11 независимо представляют собой атом водорода, O-алкил, O-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)iNHCH3, -(CH2)iNH2, -(CH2)iN(CH3)2, -ОС(O)CF3, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или NO2;
i представляет собой целое число от 0 до 5;
l представляет собой целое число от 1 до 2; и
n представляет собой целое число от 1 до 3;
или его фармацевтически приемлемая соль, гидрат, полиморф, метаболит, таутомер или изомер.
В одном варианте осуществления настоящее изобретение касается соединения, представленного структурой формулы (XI):
,
где
Х представляет собой связь, NH или S;
Q представляет собой О, NH или S;
А представляет собой замещенную или незамещенную моноциклическую, конденсированную или полициклическую арильную или (гетеро)циклическую систему; замещенный или незамещенный, насыщенный или ненасыщенный N-гетероцикл; замещенный или незамещенный, насыщенный или ненасыщенный S-гетероцикл; замещенный или незамещенный, насыщенный или ненасыщенный O-гетероцикл; замещенный или незамещенный, насыщенный или ненасыщенный циклический углеводород; или замещенный или незамещенный, насыщенный или ненасыщенный смешанный гетероцикл; где указанный цикл А необязательно замещен 1-5 заместителями, которые независимо представляют собой O-алкил, O-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(СН2)iNHCH3, -(CH2)iNH2, -(CH2)iN(CH3)2, -ОС(O)CF3, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или NO2; и
i представляет собой целое число от 0 до 5;
где если Q представляет собой S, то Х не является связью;
или его фармацевтически приемлемая соль, гидрат, полиморф, метаболит, таутомер или изомер.
В одном варианте осуществления настоящее изобретение касается соединения, представленного структурой формулы (VIII):
,
где
R4, R5 и R6 независимо представляют собой атом водорода, O-алкил, O-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(СН2)iNHCH3, -(CH2)iNH2, -(CH2)iN(CH3)2, -ОС(O)CF3, С1-С5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, C(O)O-алкил, С(O)Н, -C(O)NH2 или NO2;
Q представляет собой S, О или NH;
i представляет собой целое число от 0 до 5; и
n представляет собой целое число от 1 до 3;
или его фармацевтически приемлемая соль, гидрат, полиморф, метаболит, таутомер или изомер.
В одном варианте осуществления настоящее изобретение касается соединения, представленного структурой формулы [XI(b)]:
,
где R4 и R5 независимо представляют собой атом водорода, O-алкил, O-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)iNHCH3, -(CH2)iNH2, -(CH2)iN(CH3)2, -ОС(O)CF3, С1-С5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, C(O)O-алкил, С(O)Н, -C(O)NH2 или NO2;
i представляет собой целое число от 0 до 5; и
n представляет собой целое число от 1 до 4;
или его фармацевтически приемлемая соль, гидрат, полиморф, метаболит, таутомер или изомер.
В одном варианте осуществления настоящее изобретение касается соединения, представленного структурой формулы [XI(с)]:
,
где R4 и R5 независимо представляют собой атом водорода, O-алкил, O-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)iNHCH3, -(CH2)iNH2, -(СН2)iN(СН3)2, -ОС(O)CF3, С1-С5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, C(O)O-алкил, С(O)Н, -C(O)NH2 или NO2;
i представляет собой целое число от 0 до 5; и
n представляет собой целое число от 1 до 4;
или его фармацевтически приемлемая соль, гидрат, полиморф, метаболит, таутомер или изомер.
В одном варианте осуществления настоящее изобретение касается соединения, представленного структурой формулы [XI(е)]:
,
где R4 и R5 независимо представляют собой атом водорода, O-алкил, O-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)iNHCH3, -(CH2)iNH2, -(СН2)iN(СН3)2, -ОС(O)CF3, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, C(O)O-алкил, С(O)Н, -C(O)NH2 или NO2;
i представляет собой целое число от 0 до 5; и
n представляет собой целое число от 1 до 4;
или его фармацевтически приемлемая соль, гидрат, полиморф, метаболит, таутомер или изомер.
В одном варианте осуществления настоящее изобретение касается соединения, представленного структурой формулы (XVI):
,
где R4 и R5 независимо представляют собой Н, O-алкил, I, Br, Cl, F, алкил, галогеналкил, аминоалкил, -(CH2)iNHCH3, -(CH2)iNH2, -(CH2)iN(CH3)2, OCH2Ph, OH, CN, NO2, -NHCO-алкил, COOH, С(O)O-алкил или С(O)Н;
R3 представляет собой I, Br, Cl, F;
i представляет собой целое число от 0 до 5; и
n равен 1-4;
или его фармацевтически приемлемая соль, гидрат, полиморф, метаболит, таутомер или изомер.
В одном варианте осуществления настоящее изобретение касается соединения, представленного структурой формулы IX:
,
R4 и R5 независимо выбраны из атома водорода, O-алкила, O-галогеналкила, F, Cl, Br, I, галогеналкила, CF3, CN, -CH2CN, NH2, гидроксила, -(CH2)iNHCH3, -(CH2)iNH2, -(CH2)iN(CH3)2, -ОС(O)CF3, C1-C5 линейного или разветвленного алкила, галогеналкила, алкиламино-группы, аминоалкила, -OCH2Ph, -NHCO-алкила, COOH, -C(O)Ph, C(O)O-алкила, С(O)Н, -(O)NH2 или NO2;
А' представляет собой замещенную или незамещенную моноциклическую, конденсированную или полициклическую арильную или (гетеро)циклическую систему, включая насыщенные и ненасыщенные N-гетероциклы, насыщенные и ненасыщенные S-гетероциклы, и насыщенные и ненасыщенные O-гетероциклы, насыщенный или ненасыщенный циклический углеводород, насыщенный или ненасыщенный смешанный гетероцикл или алифатический линейный или разветвленный C1-С30 углеводород; где указанный цикл А необязательно замещен 1-5 одинаковыми или разными заместителями, включая O-алкил, O-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(СН2)iNHCH3, -(CH2)iNH2, -(СН2)iN(СН3)2, -ОС(O)CF3, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или NO2;
i представляет собой целое число от 0 до 5; и
n представляет собой целое число от 1 до 3;
или его фармацевтически приемлемая соль, гидрат, полиморф, метаболит, таутомер или изомер.
В одном варианте осуществления настоящее изобретение касается соединения, представленного структурой соединения (55):
.
В одном варианте осуществления настоящее изобретение касается соединения, представленного структурой соединения (17ya):
.
В одном варианте осуществления настоящее изобретение касается соединения, представленного структурой соединения 12da:
.
В одном варианте осуществления настоящее изобретение касается соединения, представленного структурой соединения (12fa):
.
В одном варианте осуществления настоящее изобретение касается соединения, представленного структурой соединения (12cb):
.
В одном варианте осуществления настоящее изобретение касается соединения, представленного структурой соединения (12fb):
.
В одном варианте осуществления настоящее изобретение касается соединения, представленного структурой соединения (6b):
.
В одном варианте осуществления настоящее изобретение касается фармацевтической композиции, содержащей соединение по настоящему изобретению и фармацевтически приемлемый носитель.
В одном варианте осуществления настоящее изобретение касается способа (а) лечения, подавления, уменьшения тяжести, снижения риска, или ингибирования рака; (b) лечения лекарственно-устойчивой опухоли или опухолей; и (с) разрушения раковой клетки, включающего введение соединения по настоящему изобретению. В другом варианте осуществления рак выбран из группы, состоящей из рака предстательной железы, рака груди, рака яичника, рака кожи, меланомы, рака легких, рака толстой кишки, лейкемии, рака почки, рака ЦНС и их комбинаций.
Краткое описание чертежей
Объект настоящего изобретения предметно описан и однозначно сформулирован в завершающей части настоящего описания. Однако настоящее изобретение, в плане организации и способа осуществления, вместе с задачами, отличительными особенностями и преимуществами, наилучшим образом можно понять из приведенного далее подробного описания в совокупности с прилагающимися чертежами, в которых:
На фиг.1 изображен синтез различных В-циклических промежуточных соединений на основе оксазола. Реагенты и условия: (а) МеОН, CH3COCl, 83%; (b) Этиловый эфир бензимидной кислоты, CH2Cl2, Et3N, 96%; (с) LiOH, МеОН, H2O, 65%; (d) EDCI, HOBt, NMM, CH3OCH3NH·HCl, 61%; (e) бромид 3,4,5-триметоксифенилмагния, ТГФ, 48%-71%; (f) CBrCl3, DBU, CH2Cl2, 56%.
На фиг.2 изображен синтез различных В-циклических промежуточных соединений. Реагенты и условия: (a) EDCI, HOBt, NMM, CH3OCH3NH·HCl, CH2Cl2, 51-95%; (b) бромид 3,4,5-триметоксифенилмагния, ТГФ, 48-78%; (с) LAH, -78°С, ТГФ, 85%; (d) Реагент Десс-Мартина, CH2Cl2, 81%; (e) EDCI, HOBt, NMM, 3,4,5-триметоксибензойная кислота, CH2Cl2, 58%.
На фиг.3 изображена схема синтеза соединений по настоящему изобретению. Реагенты и условия: (а) МеОН/рН=6.4 фосфатный буфер, комнатная температура; (b) EDCI, HOBt, NMM, HNCH3OCH3; (с) CBrCl3, DBU, CH2Cl2; (d) бромид 3,4,5-триметоксифенилмагния, ТГФ; (е) иодид изопропилтрифенилфосфония, н-BuLi, ТГФ; (f) LAH, ТГФ; (g) Для 2е-цис и 2е-транс, NH2OH·HCl, C2H5OH, H2O, NaOH; Для 2g и 2h, NH2OMe-HCl, пиридин; (h) TsCl, NaH, основный Al2O3; (i) NH2NH2•xH2O, CH2Cl2, i-BuOH; (j) диэтил цианометилфосфонат, н-BuLi, ТГФ; (k) бис-триметилсилилкарбодиимид, TiCl4, CH2Cl2; (l) EDCI, HOBt, Et3N, 3,4,5-триметоксианилин, CH2Cl2.
На фиг.4 изображена схема синтеза соединений по настоящему изобретению. Реагенты и условия: (а) бром, EtOH; (b) бензотиоамид, EtOH, кипячение; (с) EDCI, HOBt, NMM, HNCH3OCH3, CH2Cl2; (d) CBrCl3, DBU, CH2Cl2; (е) LAH, ТГФ; (f) 5-(бромметил)-1,2,3-триметоксибензол, Ph3P, ТГФ; (g) н-BuLi, ТГФ; (h) (l) HCl, H2O; (2) NaNO2, H2O, 0°С; (i) ксантат этил калия; (j) KOH/EtOH; (k) H2O, HCl; (l) 5-иод-1,2,3-триметоксибензол, CuI, t-BuONa; (m) 2 экв или 1 экв м-СРВА, CH2Cl2; (n) 3,4,5-триметоксианилин, NEt3, ДМФА.
На фиг.5 изображена схема синтеза соединений по настоящему изобретению. Реагенты и условия: (а) L-цистеин, EtOH, 65°С; (b) EDCI, HOBt, NMM, HNCH3OCH3, CH2Cl2; (с) TBDMSCl, имидазол, ТГФ; (d) 3,4,5-триметоксифенилбромид, BuLi, ТГФ; (е) TBAF, ТГФ; (f) SOCl2, Et2O; (g) NH3, МеОН; (h) POCl3; (i) PhSO2Cl, Bu4NHSO4, толуол, 50% NaOH; (j) 1 н. NaOH, EtOH, кипячение; (k) Boc2O, 1 н. NaOH, 1,4-диоксан; (l) CBrCl3, DBU, CH2Cl2; (m) 4 н. HCl в 1,4-диоксане; (n) NaH, ДМФА, MeI; (о) НСНО, NaBH3CN, Et3N.
На фиг.6 изображена схема синтеза соединений по настоящему изобретению. Реагенты и условия: (а) EtOH, 65°С; (b) NaOH, C2H5OH, кипячение; (с) EDCI, HOBt, NMM, HNCH3OCH3, CH2Cl2; (d) 3,4,5-триметоксифенилбромид, BuLi, ТГФ; (е) 2 н. HCl в 1,4-диоксане.
На фиг.7 изображена схема синтеза Арил-Бензоил-Имидазольных (ABI) соединений по настоящему изобретению. Реагенты и условия: (a) t-BuOH, I2, этилендиамин, К2СО3, кипячение; (b) PhI(ОАс)2, К2СО3, ДМСО; (с) DBU, CBrCl3, ДМФА; (d) NaH, PhSO2Cl, ТГФ, 0°С - комнатная температура; (е) t-BuLi, замещенный бензоилхлорид, ТГФ, -78°С; (f) Bu4NF, ТГФ, комнатная температура.
На фиг.8 изображена схема синтеза Арил-Бензоил-Имидазольных (ABI) соединений по настоящему изобретению. Реагенты и условия: (a) NH4OH, щавелевый альдегид, этанол, комнатная температура; (b) NaH, PhSO2Cl, ТГФ, 0°С - комнатная температура; (с) t-BuLi, замещенный бензоилхлорид, ТГФ, -78°С; (d) Bu4NF, ТГФ, комнатная температура; (е) BBr3, CH2Cl2; (f) конц-HCl, АсОН, кипячение.
На фиг.9 изображена схема синтеза Арил-Бензоил-Имидазольных (ABI) соединений по настоящему изобретению. Реагенты и условия: (a) NaH, замещенный бензоилхлорид, ТГФ.
На фиг.10 изображена схема синтеза соединений 12dc, 12fc, 12daa, 12dab, 12cba. (а) AlCl3, ТГФ, кипячение; (b) NaH, CH3I для 12dab и 12cba и BnBr для 12daa, ТГФ, кипячение.
На фиг.11 изображена схема синтеза соединений 11gaa, 12la. (a) NH4OH, этанол, глиоксаль, комнатная температура; (b) NaH, замещенный PhSO2Cl, ТГФ, 0°С - комнатная температура; (с) t-BuLi (1.7 М в пентане), замещенный бензоилхлорид, ТГФ, -78°С; (d) Bu4NF, комнатная температура.
На фиг.12 изображена схема синтеза соединений 15хаа и 12ха. (а) 1. КОН, этанол; 2. PhSO2Cl, ацетон; (b) NH4OH, глиоксаль, этанол, комнатная температура; (с) NaH, PhSO2Cl, ТГФ, 0°С - комнатная температура; (d) t-BuLi (1.7 М в пентане), бензоилхлорид, ТГФ, -78°С; (е) NaOH, этанол, Н2О, кипячение.
На фиг.13 изображена схема синтеза соединения 17ya. (а) 1. КОН, этанол, 2. PhSO2Cl, ацетон, комнатная температура; (b) NH4OH, глиоксаль, этанол, комнатная температура; (с) NaH, PhSO2Cl, ТГФ, 0°С - комнатная температура; (d) t-BuLi (1.7 М в пентане), бензоилхлорид, ТГФ, -78°С; (е) NaOH, этанол, H2O, кипячение.
На фиг.14 изображена схема синтеза соединения 12fa. (a) NH4OH, щавелевый альдегид, этанол, комнатная температура; (b) NaH, PhSO2Cl, ТГФ, 0°С - комнатная температура; (с) t-BuLi, 3,4,5-триметоксибензоилхлорид, ТГФ, -78°С; (d) Bu4NF, ТГФ, комнатная температура.
На фиг.15 изображена схема синтеза соединения 55.
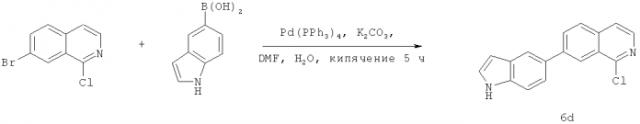
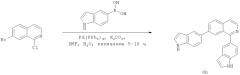
Фиг.16. Схема синтеза соединений на основе изохинолина и хинолина. На фиг.16А изображена схема синтеза производных изохинолина. Реагенты и условия: а) арилбороновая кислота (1 экв.), Pd(PPh3)4 (0.01 экв.), К2СО3, H2O, ДМФА, 5 ч; b) арилбороновая кислота (2.4 экв.), Pd(PPh3)4 (0.04 экв.), К2СО3, H2O, ДМФА, 16 ч; с) арилбороновая кислота (1.2 экв.), Pd(PPh3)4 (0.04 экв.), К2СО3, H2O, ДМФА, 16 ч. На фиг.16В изображена схема синтеза соединений 41 и 44. Реагенты и условия: а) п-фторбензолсульфонил хлорид, пиридин, пиридин, 80°С, 3 ч; b) 5-индолбороновая кислота (1.2 экв.), Pd(PPh3)4 (0.02 экв.), К2СО3, H2O, ДМФА, 16 ч. На фиг.16С изображена схема синтеза изохинолинового производного 6d. На фиг.16D изображена схема синтеза изохинолинового производного 6с. На фиг.16Е изображена схема синтеза изохинолинового производного 6b.
На фиг.17 изображена стандартная кривая растворимости для ABI соединения 12ga (растворено в ацетонитриле). По оси x приведено количество соединения, а по оси y площадь пика m/z.
На фиг.18 приведена измеренная раствори