Полипептиды
Иллюстрации
Показать всеГруппа изобретений относится к области биотехнологии. Предложен полипептид длиной менее 100 аминокислот. Полипептид содержит последовательность, выбранную из SEQ ID NO: 2, 3, 4, 7 или 8, или ее иммуногенный фрагмент, содержащий по меньшей мере 8 аминокислот. Предложена смесь полипептидов, содержащая по меньшей мере первый и второй полипептид, различные друг от друга. Также предложена фармацевтическая композиция, содержащая вышеуказанный полипептид или смесь полипептидов. Предложен способ лечения или профилактики злокачественного новообразования с использованием указанного полипептида, смеси полипептидов или фармацевтической композиции. Группа изобретений обладает повышенной иммуногенностью при вакцинации по сравнению с полноразмерным белком hTERT, а также позволяет индуцировать Т-клеточный иммунный ответ и увеличить длительность периода дожития. 7 н. и 13 з.п. ф-лы, 19 ил., 10 табл., 9 пр.
Реферат
Область техники
Настоящее изобретение относится к полипептиду и молекуле нуклеиновой кислоты, состоящей из нуклеотидной последовательности, кодирующей полипептиды. Изобретение также относится к смеси полипептидов и смеси молекул нуклеиновой кислоты. Изобретение дополнительно относится к фармацевтической композиции, содержащей такой полипептид, молекулу нуклеиновой кислоты или их смесь. Кроме того, настоящее изобретение относится к способам лечения или профилактики злокачественного новообразования у пациента, включающим введение пациенту полипептида, молекулы нуклеиновой кислоты или смеси.
Уровень техники
Злокачественным новообразованием является заболевание, отличающееся новым и аномальным ростом клеток индивидуума. Злокачественное новообразование развивается в результате многоступенчатого процесса, включающего несколько мутационных событий, позволяющих развиваться злокачественным клеткам, иначе говоря, клеткам, демонстрирующим свойства инвазии и метастазирования. Как правило, существуют два класса генов, в которых могут происходить мутации, приводящие к возникновению злокачественного новообразования: онкогены и гены опухолевых супрессоров. Активация онкогенов приводит к возникновению новых свойств клеток, таких как сверхактивный рост и деление, защита от программируемой гибели клеток, несоответствие нормальным границам тканей и способность адаптироваться к условиям в различных тканях. Можно инактивировать гены опухолевых супрессоров, делая возможной потерю нормальных функций клетки, таких как точная репликация ДНК, контроль клеточного цикла, ориентация и адгезия в тканях и взаимодействие с защитными клетками иммунной системы.
Предлагают различные подходы в лечении и профилактике злокачественного новообразования. Одним из подходов является использование антигенных пептидов, содержащих фрагменты опухолеспецифичных антигенов. При введении индивидууму такие антигенные пептиды вызывают ограниченный MHC класса I или класса II Т-клеточный ответ против клеток, экспрессирующих опухолеспецифичные антигены.
Следует отметить, что для возникновения такого Т-клеточного ответа антигенный полипептид должен быть представлен на молекуле MHC. Существует широкий диапазон вариабельности молекул MHC в популяциях человека. В частности, различные индивидуумы имеют различные аллели HLA, обладающие различной аффинностью связывания полипептидов в зависимости от аминокислотной последовательности полипептидов. Таким образом, индивидуум с одним конкретным аллелем HLA может иметь молекулы MHC, которые будут связывать полипептид с конкретной последовательностью, в то время как другие индивидуумы без этого аллеля HLA будут иметь молекулы MHC, не способные связывать и представлять полипептид (или по меньшей мере их молекулы MHC будут иметь очень низкую аффинность к полипептиду и, таким образом, представлять его на относительно низком уровне).
Кроме того, предлагают предоставлять вакцину, содержащую молекулу нуклеиновой кислоты, кодирующую такой антигенный пептид. Такая вакцина действует по схожему принципу, за исключением того, что после введения вакцины нуждающемуся в лечении индивидууму молекула нуклеиновой кислоты транскрибируется (если она является молекулой ДНК) и транслируется для синтеза пептида, который затем может связывать и представлять молекула MHC, как описано выше.
Теломераза является ферментом, обладающим функцией репликации 3'-конца теломерных областей линейных цепей ДНК в эукариотических клетках, т.к. в норме фермент ДНК-полимераза не может удлинять эти области. Фермент теломераза содержит субъединицу теломеразной обратной транскриптазы ("TERT" или "hTERT" у людей) и теломеразную РНК. Для удлинения 3'-конца цепи ДНК субъединица теломеразной обратной транскриптазы добавляет повторяющуюся последовательность на 3'-конец хромосом в эукариотических клетках посредством использования теломеразной РНК в качестве матрицы.
Наблюдали, что фермент теломераза активируется в подавляющем большинстве опухолей человека. Полагают, что это происходит по причине того, что без экспрессии фермента теломеразы теломеры клеток постепенно утрачиваются, и с каждым циклом деления целостность хромосом снижается, что в конечном итоге приводит к апоптозу клеток. Таким образом, экспрессия фермента теломеразы, как правило, является необходимой для развития злокачественных клеток, т.к. без такой экспрессии, как правило, программируемая гибель клеток будет происходить по умолчанию. В свете роли активации теломеразы в злокачественном новообразовании теломеразу расценивают как опухолеспецифичный антиген и, таким образом, как потенциальную мишень для терапии злокачественных новообразований.
В WO03/038047 описывают пептид, обозначаемый как T672, который, как сообщают, вызывает пролиферативный Т-клеточный ответ клеток здоровых доноров. Также описывают другие различные пептиды hTERT, но их не подвергали каким-либо экспериментальным тестам.
В WO00/02581 описывают полипептиды теломеразы, вызывающие ограниченный MHC класса I и/или класса II Т-клеточный ответ. В Великобритании один из описываемых полипептидов (имеющий аминокислотную последовательность EARPALLTSRLRFIPK, также известный как GV1001) подвергают клиническому испытанию фазы III (Telo Vac) в качестве вакцинотерапии на пациентах с раком поджелудочной железы.
В WO02/094312 описывают конкретные полипептиды, получаемые из hTERT.
В Liu JP et al., (2009 Telomerase in cancer immunotherapy Biochim Biophys Acta. Sep 12) проводят обзор 26 пептидов hTERT, которые, как показано, вызывают существенные иммунные ответы на hTERT-положительные опухолевые клетки.
Также для лечения пациентов с метастазирующим раком предстательной железы ранее использовали дендритные клетки, трансфицированные мРНК hTERT (Su et al., 2005, Telomerase mRNA-transfected dendritic cells stimulate antigen-specific CD8+ и CD4+ Т-cell responses in patients with metastatic prostate cancer. J Immunol. 174(6):3798-807). Su et al. демонстрировали успешное получение hTERT-специфичных Т-клеточных ответов, измеряемых по секретирующим ИФНγ CD8+ T-клеткам и CTL-опосредованной гибели мишеней hTERT. У четырех пациентов развивался частичный клинический ответ. Однако в этом исследовании не охарактеризовывали эпитопы hTERT.
Всегда существует потребность в дополнительных антигенных полипептидах (и молекулах нуклеиновой кислоты, кодирующих такие полипептиды) для лечения злокачественного новообразования, таких как полипептиды, вызывающие более эффективный иммунный ответ у индивидуумов, и/или полипептиды, представляемые аллелями HLA, присутствующими в большей части популяции.
Настоящее изобретение предназначено для решения одной или нескольких из указанных выше проблем.
Сущность изобретения
Первый аспект настоящего изобретения относится к полипептиду, содержащему последовательность, выбранную из:
i) SEQ ID NO: 2, 3, 4, 7, 8 или 9;
ii) последовательности иммуногенного фрагмента i), содержащей по меньшей мере восемь аминокислот, где иммуногенный фрагмент не является одним из SEQ ID NO: 6 или 11-16; или
iii) последовательности, обладающей по меньшей мере 80% идентичности последовательности с i) или ii),
где полипептид составляет менее 100 аминокислот в длину и где полипептид не содержит последовательность SEQ ID NO: 10 или 56.
Предпочтительно, полипептид не содержит последовательность любой SEQ ID NO: 46, 57 или 59-62 и не состоит из последовательности SEQ ID NO: 58.
Полипептид выделяют, иначе говоря, он не образует часть белка (hTERT), в котором находится в природе.
Полипептид способен вызывать Т-клеточный ответ у здорового пациента с аллелем HLA, подходящим для представления полипептида.
Условно, последовательность полипептида по первому аспекту настоящего изобретения определяют как последовательность, выбранную из:
i) SEQ ID NO: 1;
ii) последовательности иммуногенного фрагмента i), содержащего по меньшей мере восемь аминокислот, где иммуногенный фрагмент не является одним из SEQ ID NO: 6, 11-16 или 56; и
iii) последовательности, обладающей по меньшей мере 80% идентичности последовательности с i) или ii),
где полипептид составляет менее 100 аминокислот в длину.
Иначе говоря, полипептид может содержать последовательность SEQ ID NO: 1, которая включает последовательности SEQ ID NO: 2 и 3 и не должна являться дополнением к последовательностям SEQ ID NO: 2 и 3.
Предпочтительно, полипептид не состоит из последовательности SEQ ID NO: 58.
Предпочтительно, иммуногенный фрагмент имеет последовательность любой из SEQ ID NO: 17-40.
Предпочтительно, полипептид составляет 80, 50, 30, 20 или 11 или менее аминокислот в длину.
Второй аспект настоящего изобретения относится к молекуле нуклеиновой кислоты, состоящей из нуклеотидной последовательности, кодирующей полипептид по изобретению.
Молекулу нуклеиновой кислоты выделяют, иначе говоря, она не образует часть гена (гена теломеразы), в котором находится в природе.
Третий аспект настоящего изобретения относится к смеси полипептидов, содержащих по меньшей мере два различных полипептида, содержащих последовательности, выбранные из группы, состоящей из:
i) SEQ ID NO: 2-7;
ii) последовательности иммуногенного фрагмента i), содержащего по меньшей мере восемь аминокислот; и
iii) последовательности, обладающей по меньшей мере 80% идентичности последовательности с i) или ii),
где каждый полипептид составляет менее 100 аминокислот в длину. Предпочтительно по меньшей мере два указанных полипептида отличаются в том смысле, что определяемая в i) последовательность отличается для каждого полипептида.
Условно, последовательность по меньшей мере одного из полипептидов определяют как содержащую последовательность, выбранную из группы, состоящей из:
i) SEQ ID NO: 1, 7, 8, 9 или 10;
ii) последовательности иммуногенного фрагмента i), содержащей по меньшей мере восемь аминокислот; и
iii) последовательности, обладающей по меньшей мере 80% идентичности последовательности с i) или ii),
где полипептиды составляют менее 100 аминокислот в длину. Например, один из полипептидов может содержать последовательность SEQ ID NO: 1, которая включает SEQ ID NO: 2 и 3 и не должна являться дополнением к последовательности SEQ ID NO: 2 и 3.
Предпочтительно, по меньшей мере два различных полипептида включают смесь полипептидов, выбранную из группы, состоящей из:
i) смесь: полипептида, содержащего последовательность SEQ ID NO: 1 или последовательность, обладающую по меньшей мере 80% идентичности с этой последовательностью, или ее иммуногенный фрагмент, содержащий по меньшей мере восемь аминокислот; полипептида, содержащего последовательность SEQ ID NO: 7 или последовательность, обладающую по меньшей мере 80% идентичности с этой последовательностью, или ее иммуногенный фрагмент, содержащий по меньшей мере восемь аминокислот; и полипептида, содержащего последовательность SEQ ID NO: 9 или последовательность, обладающую по меньшей мере 80% идентичности с этой последовательностью, или ее иммуногенный фрагмент, содержащий по меньшей мере восемь аминокислот;
ii) смесь: полипептида, содержащего последовательность SEQ ID NO: 1 или последовательность, обладающую по меньшей мере 80% идентичности с этой последовательностью, или ее иммуногенный фрагмент, содержащий по меньшей мере восемь аминокислот; полипептида, содержащего последовательность SEQ ID NO: 8 или последовательность, обладающую по меньшей мере 80% идентичности с этой последовательностью, или ее иммуногенный фрагмент, содержащий по меньшей мере восемь аминокислот; и полипептида, содержащего последовательность SEQ ID NO: 9 или последовательность, обладающую по меньшей мере 80% идентичности с этой последовательностью, или ее иммуногенный фрагмент, содержащий по меньшей мере восемь аминокислот; и
iii) смесь: полипептида, содержащего последовательность SEQ ID NO: 1 или последовательность, обладающую по меньшей мере 80% идентичности с этой последовательностью, или ее иммуногенный фрагмент, содержащий по меньшей мере восемь аминокислот; полипептида, содержащего последовательность SEQ ID NO: 8 или последовательность, обладающую по меньшей мере 80% идентичности с этой последовательностью, или ее иммуногенный фрагмент, содержащий по меньшей мере восемь аминокислот; и полипептида, содержащего последовательность SEQ ID NO: 10 или последовательность, обладающую по меньшей мере 80% идентичности с этой последовательностью, или ее иммуногенный фрагмент, содержащий по меньшей мере восемь аминокислот,
где каждый полипептид составляет менее 100 аминокислот в длину.
Предпочтительно, упомянутый выше или каждый иммуногенный фрагмент имеет последовательность любой из SEQ ID NO: 17-40.
Четвертый аспект настоящего изобретения относится к смеси молекул нуклеиновой кислоты, содержащей по меньшей мере две различные молекулы нуклеиновой кислоты, состоящие из последовательности нуклеиновой кислоты, кодирующей полипептид, содержащий последовательность, выбранную из группы, состоящей из:
i) SEQ ID NO: 2-7;
ii) последовательности иммуногенного фрагмента i), содержащей по меньшей мере восемь аминокислот; и
iii) последовательности, обладающей по меньшей мере 80% идентичности последовательности с i) или ii),
где полипептид составляет менее 100 аминокислот в длину.
Предпочтительно, по меньшей мере две указанные молекулы нуклеиновой кислоты отличаются в том смысле, что определяемая в i) последовательность отличается для каждой молекулы нуклеиновой кислоты.
Предпочтительно, по меньшей мере одну молекулу нуклеиновой кислоты определяют как состоящую из последовательности нуклеиновой кислоты, кодирующей полипептид, содержащий последовательность, выбранную из группы, состоящей из:
i) SEQ ID NO: 1, 7, 8, 9 или 10;
ii) последовательности иммуногенного фрагмента i), содержащей по меньшей мере восемь аминокислот; и
iii) последовательности, обладающей по меньшей мере 80% идентичности последовательности с i) или ii),
где полипептиды составляют менее 100 аминокислот в длину. Например, молекула нуклеиновой кислоты может состоять из последовательности нуклеиновой кислоты, кодирующей полипептид, содержащий SEQ ID NO: 1, включающую SEQ ID NO: 2 и 3, и полипептид не должен дополнительно содержать последовательность SEQ ID NO: 2 и 3.
Предпочтительно, по меньшей мере две различные молекулы нуклеиновой кислоты включают смесь молекул нуклеиновой кислоты, выбранную из группы, состоящей из:
i) смеси: молекулы нуклеиновой кислоты, состоящей из последовательности нуклеиновой кислоты, кодирующей полипептид, содержащий первичную последовательность SEQ ID NO: 1, или вторичную последовательность, обладающую по меньшей мере 80% идентичности последовательности с первичной последовательностью, или иммуногенный фрагмент первичной последовательности, или вторичную последовательность, содержащую по меньшей мере восемь аминокислот; молекулы нуклеиновой кислоты, состоящей из последовательности нуклеиновой кислоты, кодирующей полипептид, содержащий первичную последовательность SEQ ID NO: 7, или вторичную последовательность, обладающую по меньшей мере 80% идентичности последовательности с первичной последовательностью, или иммуногенный фрагмент первичной последовательности, или вторичную последовательность, содержащую по меньшей мере восемь аминокислот; и молекулы нуклеиновой кислоты, состоящей из последовательности нуклеиновой кислоты, кодирующей полипептид, содержащий первичную последовательность SEQ ID NO: 9, или вторичную последовательность, обладающую по меньшей мере 80% идентичности последовательности с первичной последовательностью, или иммуногенный фрагмент первичной последовательности, или вторичную последовательность, содержащую по меньшей мере восемь аминокислот;
ii) смеси: молекулы нуклеиновой кислоты, состоящей из последовательности нуклеиновой кислоты, кодирующей полипептид, содержащий первичную последовательность SEQ ID NO: 1, или вторичную последовательность, обладающую по меньшей мере 80% идентичности последовательности с первичной последовательностью, или иммуногенный фрагмент первичной последовательности, или вторичную последовательность, содержащую по меньшей мере восемь аминокислот; молекулы нуклеиновой кислоты, состоящей из последовательности нуклеиновой кислоты, кодирующей полипептид, содержащий первичную последовательность SEQ ID NO: 8, или вторичную последовательность, обладающую по меньшей мере 80% идентичности последовательности с первичной последовательностью, или иммуногенный фрагмент первичной последовательности, или вторичную последовательность, содержащую по меньшей мере восемь аминокислот; и молекулы нуклеиновой кислоты, состоящей из последовательности нуклеиновой кислоты, кодирующей полипептид, содержащий первичную последовательность SEQ ID NO: 9, или вторичную последовательность, обладающую по меньшей мере 80% идентичности последовательности с первичной последовательностью, или иммуногенный фрагмент первичной последовательности, или вторичную последовательность, содержащую по меньшей мере восемь аминокислот; и
iii) смеси: молекулы нуклеиновой кислоты, состоящей из последовательности нуклеиновой кислоты, кодирующей полипептид, содержащий первичную последовательность SEQ ID NO: 1, или вторичную последовательность, обладающую по меньшей мере 80% идентичности последовательности с первичной последовательностью, или иммуногенный фрагмент первичной последовательности, или вторичную последовательность, содержащую по меньшей мере восемь аминокислот; молекулы нуклеиновой кислоты, состоящей из последовательности нуклеиновой кислоты, кодирующей полипептид, содержащий первичную последовательность SEQ ID NO: 8, или вторичную последовательность, обладающую по меньшей мере 80% идентичности последовательности с первичной последовательностью, или иммуногенный фрагмент первичной последовательности, или вторичную последовательность, содержащую по меньшей мере восемь аминокислот; и молекулы нуклеиновой кислоты, состоящей из последовательности нуклеиновой кислоты, кодирующей полипептид, содержащий первичную последовательность SEQ ID NO: 10, или вторичную последовательность, обладающую по меньшей мере 80% идентичности последовательности с первичной последовательностью, или иммуногенный фрагмент первичной последовательности, или вторичную последовательность, содержащую по меньшей мере восемь аминокислот, где каждый полипептид составляет менее 100 аминокислот в длину.
Условно, упомянутый выше или каждый иммуногенный фрагмент имеет последовательность любой из SEQ ID NO: 17-40.
Пятый аспект настоящего изобретения относится к фармацевтической композиции, содержащей полипептид по изобретению, молекулу нуклеиновой кислоты по изобретению, смесь полипептидов по изобретению или смесь молекул нуклеиновой кислоты по изобретению и фармацевтически приемлемый адъювант, дилюент или эксципиент и необязательно другой терапевтический ингредиент.
Предпочтительно, полипептид, молекула нуклеиновой кислоты, смесь полипептидов или смесь молекул нуклеиновой кислоты присутствуют в количестве от 50 до 200 мкг.
Шестой аспект настоящего изобретения относится к способу лечения или профилактики злокачественного новообразования у пациента, включающему введение пациенту полипептида по изобретению, молекулы нуклеиновой кислоты по изобретению, смеси полипептидов по изобретению, смеси молекул нуклеиновой кислоты по изобретению или фармацевтической композиции по изобретению.
Седьмой аспект настоящего изобретения относится к полипептиду по изобретению, молекуле нуклеиновой кислоты по изобретению, смеси полипептидов по изобретению, смеси молекул нуклеиновой кислоты по изобретению или фармацевтической композиции по изобретению для использования в медицине.
Предпочтительно, полипептид, молекула нуклеиновой кислоты, смесь полипептидов, смесь молекул нуклеиновой кислоты или фармацевтическая композиция предназначены для использования в лечении или профилактике злокачественного новообразования.
Восьмой аспект настоящего изобретения относится к использованию полипептида по изобретению, молекулы нуклеиновой кислоты по изобретению, смеси полипептидов по изобретению, смеси молекул нуклеиновой кислоты по изобретению или фармацевтической композиции по изобретению для производства лекарственного средства для лечения или профилактики злокачественного новообразования.
Термины "полипептид", "пептид" и "белок" в настоящем описании взаимозаменяемо используют в отношении полимера аминокислотных остатков. Термины применяют к аминокислотным полимерам, в которых один или несколько аминокислотных остатков являются модифицированными остатками или неприродными остатками, такими как искусственная химическая имитация соответствующей природной аминокислоты, а также к природным аминокислотным полимерам.
Как применяют в настоящем описании, термин "аминокислота" относится к природным и синтетическим аминокислотам, а также аналогам аминокислот и имитациям аминокислот, обладающим функцией, схожей с природными аминокислотами. Природные аминокислоты являются аминокислотами, кодируемыми генетическим кодом, а также модифицированными после трансляции в клетках (например, гидроксипролином, гамма-карбоксиглутаматом и O-фосфосерином). Фраза "аналог аминокислоты" относится к соединениям, имеющим ту же основную химическую структуру (альфа-углеродная связь с водородом, карбоксильная группа, аминогруппа и R-группа), что и природная аминокислота, но имеющим модифицированную R-группу или модифицированные основные цепи (например, гомосерин, норлейцин, метионин-сульфоксид, метилметионинсульфоний). Фраза "имитация аминокислоты" относится к химическим соединениям, имеющим отличающуюся от природных аминокислот структуру, но схожие с ними функции.
Как применяют в настоящем описании, термин "фрагмент" в отношении полипептида означает последовательную серию аминокислот, образующих часть полипептида. "Иммуногенный фрагмент" полипептида является фрагментом, как определено ранее, способным при введении индивидууму вызывать иммунный ответ, такой как Т-клеточный ответ.
В настоящем описании термины "ген", "полинуклеотиды" и "молекулы нуклеиновой кислоты" используют взаимозаменяемо в отношении полимера из множества нуклеотидов. Молекулы нуклеиновой кислоты могут содержать природные нуклеиновые кислоты или могут содержать искусственные нуклеиновые кислоты, такие как пептидно-нуклеиновые кислоты, морфолин и замкнутая нуклеиновая кислота, а также гликолевая нуклеиновая кислота и треозная нуклеиновая кислота.
Как применяют в настоящем описании, термин "нуклеотид" относится к природным нуклеотидам и синтетическим аналогам нуклеотидов, распознаваемым клеточными ферментами.
Как применяют в настоящем описании, термин "лечение" относится к любому частичному или полному лечению и включает: ингибирование заболевания или симптома, т.е. прекращение его развития; и ослабление заболевания или симптома, т.е. вызывание ремиссии заболевания или симптома.
В настоящем описании процентную долю "идентичности" между двумя последовательностями определяют с использованием алгоритма BLASTP версии 2.2.2 (Altschul, Stephen F., Thomas L Madden, Alejandro A. Schaffer, Jinghui Zhang, Zheng Zhang, Webb Miller, и David J. Lipman (1997), "Gapped BLAST и PSI-BLAST: a new generation of protein database search programs", Nucleic Acids Res. 25:3389-3402) с использованием параметров по умолчанию. В частности, алгоритм BLAST доступен в интернете с использованием URL http://www. ncbi. nlm. nih.gov/blast/.
Краткое описание чертежей
Фигура 1 представляет собой гистограмму, на которой представлены hTERT-Т-клеточные ответы, определяемые у пациента с раком поджелудочной железы, вакцинированного ДК, трансфицированными мРНК hTERT. В образцах из различных временных точек на всем протяжении режима вакцинации определяли Т-клеточные ответы на 24 перекрывающихся 15-мерных пептида hTERT. Пролиферацию в ответ на нагруженные пептидами PBMC измеряли введением 3H-тимидина. Индекс стимуляции >2 рассматривали как иммунный ответ.
Фигура 2 представляет собой серию диаграмм, на которой представлено определение hTERT-специфичных HLA-A2-ограниченных CD8+ T-клеток у вакцинированных пациентов со злокачественными новообразованиями посредством проточной цитометрии. PBMC окрашивали непосредственно после выделения без предварительной стимуляции антигеном. Показано окрашивание с использованием пентамера в клетках, делящих сигнал на CD8+ CD3+ клетки. Фоновое окрашивание показано на графике с неродственным пентамером (ВИЧ-пептидом), на графиках hTERT-пентамеров показано окрашивание для двух новых пептидов hTERT у пациента с раком поджелудочной железы (A) (пептид, обозначаемый как 720GLL, соответствует SEQ ID NO: 3; пептид, обозначаемый как 728RLT, соответствует SEQ ID NO: 6) и третьего hTERT-пептида, определяемого у пациента с раком легких (B) (пептид, обозначаемый как 613RPA, соответствует SEQ ID NO: 5), последний в двух различных временных точках с разницей в пять лет. Анализировали 45000 CD8+ T-клеток.
Фигура 3 представляет собой график, на котором представлена T-клеточная пролиферация в ответ на пептид GV1001 (SEQ ID NO: 10), 663-677 (15-мерный) (SEQ ID NO: 2) и 660-689 (30-мерный) (SEQ ID NO: 1). Индекс стимуляции является мерой того, во сколько раз пептидспецифичная пролиферация превышает фон.
Фигура 4 представляет собой график, на котором представлены результаты определения CD4+ T-клеточных клонов, демонстрирующих пептидспецифичную пролиферацию в ответ на повышение концентраций пептида. Значение выше 2 рассматривают как положительный ответ.
Фигура 5 представляет собой график, на котором представлены результаты определения CD8+ T-лимфоцитов, специфичных для 9- или 10-мерных пептидов SEQ ID NO: 3, 4 и 6, непосредственно в мононуклеарных клетках периферической крови (PBMC) из образцов крови пациентов. Пептид 615-624 (SEQ ID NO: 4) не тестировали на двух последних пациентах. Пациенты являлись HLA-A2-положительными. Фоновое окрашивание с использованием неродственного пентамера составляло <0,05%.
Фигура 6 представляет собой график, на котором представлены результаты определения CD8+ T-лимфоцитов, специфичных для 9-мерного пептида 613-621 (SEQ ID NO: 5), у пациента с раком легких, находящегося в полной ремиссии в течение нескольких лет после вакцинации GV1001 (SEQ ID NO: 10). Пациент является HLA-B7-положительным. Пациента последовательно вакцинировали каждые 6 месяцев, и через шесть лет после того, как пациент достиг полной ремиссии, все еще можно определять стабильную популяцию CD8+ T-клеток, специфичных для пептида hTERT 613-621. В некоторых временных точках определяли вторую минорную популяцию CTL, специфичную для другого эпитопа CTL, 672-681 (SEQ ID. NO. 25).
Фигура 7 представляет собой график, на котором представлен Т-клеточный ответ на библиотеку перекрывающихся пептидов hTERT у пациента с меланомой после вакцинации GV1001 (SEQ ID NO: 10).
Фигура 8 представляет собой график, на котором представлен Т-клеточный ответ на библиотеку перекрывающихся пептидов hTERT у пациента с раком легких после вакцинации GV1001 (SEQ ID NO: 10).
Фигура 9 представляет собой график, на котором представлен Т-клеточный ответ на библиотеку перекрывающихся пептидов hTERT у пациента с раком толстого кишечника после вакцинации GV1001 (SEQ ID NO: 10).
Фигура 10 представляет собой график, на котором представлен Т-клеточный ответ на библиотеку перекрывающихся пептидов hTERT у пациента с второй меланомой после вакцинации GV1001 (SEQ ID NO: 10).
Фигура 11 представляет собой график, на котором представлен Т-клеточный ответ на библиотеку перекрывающихся пептидов hTERT у пациента с раком поджелудочной железы после вакцинации ДК, трансфицированными мРНК hTERT. Представленные результаты являются результатами для того же пациента, что и на фигуре 1.
Фигура 12 представляет собой график, на котором представлен Т-клеточный ответ на библиотеку перекрывающихся пептидов hTERT у пациента с раком легких после вакцинации ДК, трансфицированными мРНК hTERT.
Фигура 13 представляет собой график, на котором представлен спонтанный Т-клеточный ответ на библиотеку перекрывающихся пептидов hTERT у невакцинированного третьего пациента с меланомой.
Фигура 14 представляет собой график, на котором представлена сумма результатов на фигурах 7-13 для выбранных пептидов hTERT.
Фигура 15 представляет собой график, на котором представлены Т-клеточные ответы на выбранные пептиды hTERT у четырех пациентов с раком легких.
Фигура 16 представляет собой график, на котором представлены Т-клеточные ответы на выбранные пептиды hTERT у шести пациентов с меланомой.
Фигура 17 является диаграммой рассеяния, на которой представлено количество месяцев периода дожития для каждого пациента по отношению к количеству пептидов, индуцирующих иммунный ответ.
Фигура 18 представляет собой график, на котором представлен период дожития для различных пациентов, тестируемых и разделенных на две группы в зависимости от их иммунных ответов на пептидные последовательности, по отношению к пептидам hTERT. Отвечающих на 0-1 пептид в дополнение к GV1001 помещали в одну группу, и отвечающих на 2 или более пептидов помещали в другую группу. Период дожития анализировали для двух групп с использованием t-критерия для независимых выборок. Предварительный тест на равенство периодов дожития свидетельствует о том, что период дожития в двух группах существенно отличается. Таким образом, использовали двухвыборочный t-критерий, не допускающий равного периода дожития. С использованием t-критерия с неодинаковой дисперсией получали t(6,1)=-3,22, p=0,018. Статистический анализ осуществляли с использованием программного обеспечения WINKS SDA (Texasoft, Cedar Hill, TX.). Статистические решения принимали при p=0,05. Для этих данных средний (SD) период дожития для группы отвечающих на 0-1 пептид составляет 10,7(3,9455), N=10, и средний (SD) период дожития для группы отвечающих на >2 пептида составляет 51,5714(33,3909), N=7.
Подробное описание изобретения
В общих чертах, изобретение относится к полипептиду белка теломеразы, содержащему последовательность, выбранную из SEQ ID NO: 2, 3, 4, 7, 8 и 9, где полипептид составляет менее 100 аминокислот в длину и не содержит последовательность полипептида GV1001 (т.е. SEQ ID NO: 10), SEQ ID NO: 56 (описываемую Schroers et al., 2002), любую из SEQ ID NO: 46, 57 или 59-61 (описываемые в WO03/038047) или SEQ ID NO: 62 (описываемую в WO00/02581). Полипептид также не состоит из последовательности SEQ ID NO: 58 (описываемой в WO03/038047).
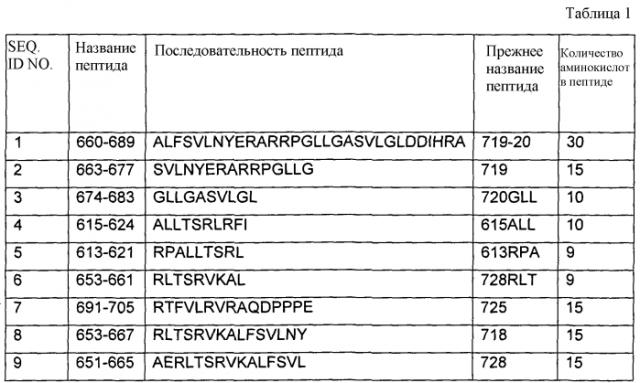
Особенно предпочтительные полипептиды содержат последовательность SEQ ID NO: 1 (включающую последовательности SEQ ID NO: 2 и 3), SEQ ID NO: 6 (включающую последовательности SEQ ID NO: 8 и 9) и SEQ ID NO: 7.
В некоторых вариантах осуществления полипептиды состоят из последовательностей, приведенных в одной из SEQ ID NO: 1-9. В других вариантах осуществления полипептиды содержат одну из последовательностей, приведенных в одной из SEQ ID NO: 1-9, и любые дополнительные аминокислоты на N- и/или C-конце отличаются от присутствующих в природном ферменте теломераза.
Другие варианты осуществления относятся к иммуногенным фрагментам указанного выше полипептида, содержащим по меньшей мере восемь аминокислот, и где фрагменты не являются ни любыми из полипептидов SEQ ID NO: 6 или 11-16, ни фрагментами полипептидов с последовательностью SEQ ID NO: 56. Примеры иммуногенных фрагментов включают приведенные в SEQ ID NO: 17-40, для которых прогнозируют, что они имеют аффинность связывания для молекул MHC конкретных аллелей HLA класса I. Следует отметить, что все полипептиды SEQ ID NO: 17-40 являются иммуногенными фрагментами полипептида SEQ ID NO: 1.
Последовательность фермента теломеразы человека (hTERT) приводят в GenBank под инвентарным номером AF015950. Следует отметить, что каждая из SEQ ID NO: 1-9 присутствует среди аминокислот в положениях 660-705 фермента теломераза. Это соответствует активному центру субъединицы теломеразной обратной транскриптазы человека. Полагают, что, если однажды возник иммунный ответ на эпитопы в этой области субъединицы обратной транскриптазы, любые клетки в опухоли, в которых мутировала часть гена теломеразы, кодирующая эту область, и которые, таким образом, могут избегать иммунного ответа, также будут иметь нарушенную ферментативную активность кодируемого белка теломеразы. Таким образом, при воздействии на эту область фермента теломераза будет менее вероятным то, что колонии злокачественных клеток будут выживать посредством мутации в гене теломеразы.
В некоторых вариантах осуществления множество полипептидов, как определено выше, ковалентно связывают друг с другом для образования большого полипептида или даже циклического полипептида.
Описываемые выше варианты осуществления изобретения относятся к полипептиду одной последовательности. Однако другие варианты осуществления относятся к смеси полипептидов, где смесь содержит по меньшей мере два различных полипептида, содержащих последовательности SEQ ID NO: 2-7. В некоторых вариантах осуществления смесь содержит иммуногенные фрагменты указанных полипептидов, где иммуногенные фрагменты содержат по меньшей мере восемь аминокислот. Полипептиды составляют менее 100 аминокислот в длину.
Особенно предпочтительно, полипептиды в смеси содержат последовательности SEQ ID NO: 1, 7, 8 или 9. Особенно предпочтительно, полипептиды в смеси содержат последовательности SEQ ID NO: 1, 7 и 9; SEQ ID NO: 1, 8 и 9; или SEQ ID NO: 1, 8 и 10. Таким образом, в объем изобретения входит то, что один из полипептидов в смеси содержит последовательность SEQ ID NO: 10 (т.е. последовательность пептида, обозначаемого как GV1001). Предпочтительно, иммуногенные фрагменты представляют собой SEQ ID NO: 17-40.
Предпочтительно, по меньшей мере два полипептида отличаются в том смысле, что они основаны на различных последовательностях, выбранных из SEQ ID NO: 1-10.
Особенно предпочтительно, в смеси полипептидов полипептиды в смеси способны быть связанными молекулами MHC нескольких аллелей HLA. Например, в одном из вариантов осуществления смесь содержит первый полипептид, способный быть связанным молекулами MHC аллеля HLA-A*0201, и второй полипептид, способный быть связанным молекулами MHC аллеля HLA-A-A*03. Также следует понимать, что в некоторых вариантах осуществления смесь содержит более двух полипептидов с различными последовательностями (например, 3, 4 или 5 полипептидов).
В дополнительных вариантах осуществления упомянутый выше или каждый предоставляемый полипептид не имеет точной идентичности последовательности с одним из указанных выше полипептидов. Вместо этого полипептид имеет по меньшей мере 80% идентичности последовательности с приведенным выше полипептидом. Особенно предпочтительно, последовательность имеет по меньшей мере 90%, 95% или 99% идентичности последовательности с приведенными выше. Также предпочтительно, любое добавление или замена в аминокислотной последовательности приводит к сохранению свойств исходной боковой цепи аминокислоты. Иначе говоря, замена или модификация является "консервативной".
Таблицы консервативных замен с указанием функционально схожих аминокислот хорошо известны в этой области. Примерами свойств боковых цепей аминокислот являются гидрофобные аминокислоты (A, I, L, M, F, P, W, Y, V), гидрофильные (R, D, N, C, E, Q, G, H, K, S, T) аминокислоты и боковые цепи со следующими функциональными группами или общими характеристиками: алифатические боковые цепи (G, A, V, L, I, P); боковая цепь, содержащая гидроксильную группу (S, T, Y); боковая цепь, содержащая атом серы (C, M); боковая цепь, содержащая карбоксильную или амидную группу (D, N, E, Q); боковая цепь, содержащая основание (R, K, H); и боковая цепь, содержащая ароматическую группу (H, F, Y, W). Кроме того, каждая из следующих восьми групп содержит аминокислоты, представляющие собой консервативные замены друг для друга (см., например, Creighton, Proteins (1984)):
1) Аланин (A), глицин (G);
2) Аспарагиновая кислота (D), глутаминовая кислота (E);
3) Аспарагин (N), глутамин (Q)
4) Аргинин (R), лизин (K)
5) Изолейцин (I), лейцин (L), метионин (M), валин (V);
6) Фенилаланин (F), тирозин (Y), триптофан (W);
7) Серин (S), треонин (T); и
8) Цистеин (C), метионин (M).
В некоторых вариантах осуществления изменяют последовательность упомянутого выше или каждого полипептида для изменения (например, повышения) аффинности связывания полипептида с молекулой MHC конкретного аллеля HLA. В других вариантах осуществления в дополнение к приведенным выше аминокислотам полипептид содержит дополнительные аминокислоты на своем N- и/или C-конце. Такие дополнительные аминокислоты также можно использовать для изменения (например, повышения) аффинности связывания полипептида с молекулой MHC.
Необходимо, чтобы упомянутый выше или каждый полипептид (в ч