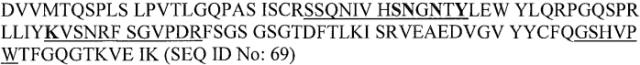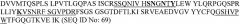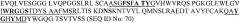Гуманизированные антитела против il-10 для лечения системной красной волчанки (sle)
Иллюстрации
Показать всеИзобретение относится к области биохимии. Представлены варианты гуманизированного или химерного антитела или его фрагмента, способные связываться с интерлейкином-10 (IL-10), где указанное антитело или его фрагмент можно вводить субъекту в отсутствие неприемлемого повышения уровня провоспалительных цитокинов. Антитела или их фрагменты применяются в способах лечения заболеваний и состояний, опосредованных повышенным уровнем или активностью IL-10, таких как системная красная волчанка. Изобретение позволяет вызывать меньшее повышение уровня провоспалительных цитокинов. 15 н. и 15 з. п. ф-лы, 21 ил., 10 табл., 8 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к интерлейкину-10 (IL-10) и специфичным к IL-10 средствам. В частности, настоящее изобретение включает гуманизированные антитела к IL-10 и их применение. Изобретение также относится к способу лечения системной красной волчанки (SLE).
Уровень техники
Системную красную волчанку (SLE) рассматривают как аутоиммунное заболевание, при котором ключевую роль играют аномальная гиперактивность Β-лимфоцитов и обширная аномальная продукция аутоантител к иммуноглобулину гамма (IgG). Данный патологический процесс приводит к секвестрации и разрушению покрытых Ig клеток, фиксации и расщеплению белков комплемента, и высвобождению хемотаксинов, вазоактивных пептидов и разрушающих ферментов в тканях (Hahn BH. Systemic Lupus Erythematosus. In: Kasper DL, Braunwald E, Fauci AS, Hauser SL, Longo DL, Jameson, JL, editors. In: Harrison's Principles of Internal Medicine (16th edition). New York (US): McGraw-Hill; 2005. pp. 1960-1967).
SLE отличается разнообразными проявлениями. В течение заболевания в общем 95% пациентов испытывают скелетно-мышечные нарушения, 80% демонстрируют кожные повреждения, 85% - гематологические нарушения, 60% - неврологические нарушения, 60% - сердечно-легочные нарушения, от 30% до 50% - почечные нарушения, 40% - желудочно-кишечные нарушения, 15% - тромбоз, и 15% - офтальмологические нарушения. Подавляющее большинство пациентов (95%) также страдает системными симптомами, такими как утомляемость, тревога, лихорадка, анорексия и потеря веса, присутствующими большую часть времени. Большинство пациентов испытывает периоды обострения заболевания, чередующиеся с ремиссиями. Постоянная ремиссия (отсутствие симптомов в отсутствие лечения) является очень редкой. Более чем 50 лет назад большинство пациентов с диагнозом SLE жили менее чем 5 лет. В настоящее время более 90% проживают 10 лет, в основном благодаря ранней диагностике, симптоматическому противовоспалительному и иммуносупрессивному лечению. Общей причиной смерти является инфекция в результате иммуносупрессии (Hahn 2005).
Общепринято в лечении SLE применять противомалярийные, противовоспалительные и иммуносупрессивные лекарственные средства. Нестероидные противовоспалительные средства дополняют кортикостероидами, если симптомы становится трудно контролировать. Кроме того, активная SLE с вовлечением основных органов требует агрессивной терапии циклофосфамидом.
До настоящего времени не существовало этиологического лечения, доступного для лечения SLE и/или улучшения качества жизни пациентов на долговременной основе. Однако последние достижения в связанных с антителами технологиях и дальнейшая идентификация факторов, лежащих в основе данного аутоиммунного заболевания, открыли возможность использования моноклональных антител в качестве способа лечения. В частности, удобным подходом для лечения SLE будет специфическое лечение, воздействующее на патологический иммунный ответ, приводящий к обширной гиперпродукции поликлональных аутоантител, или корректирующее его. Поскольку патогенез SLE, главным образом, включает Β-клетки с нарушенной регуляцией, особый интерес представляют моноклональные антитела, способные воздействовать на B-клетки. Как отмечают Robak и Robak (Current Drug Targets, 2009, No, 10, pages 26-37), потенциальными мишенями среди B-клеточных поверхностных антигенов являются CD19, CD20, CD21 и CD22. Кроме того, IL-10, IL-1ra, IL-12 (Capper et al., Clin. Exp. Immunol. 2004 Nov; 138(2)':348-56) и IL-6 (Chun et al., J. Clin. Immunol, 2007 Sep; 27(5):461-6) представляют собой важные цитокины в регуляции иммунного ответа, и их уровень значительно повышается при обострениях у пациентов с SLE. Уровни IL-10 и аутоантител против двухцепочечной ДНК (дцДНК) в плазме часто отражают активность заболевания у пациентов с SLE. Повышенные уровни IL-10 коррелируют с активностью заболевания у пациентов с SLE (Park et al., Clin. Exp, Rheumatol, 1998 мая-Jun; 16(3):283-8). Однако IL-10 представляет собой цитокин с плейотропными эффектами относительно иммунной системы, а также известно, что он вовлечен в снижение провоспалительных ответов.
На пациентах с SLE проводили клинические испытания с применением моноклональных антител. В частности, несколько испытаний включали антитело ритуксимаб, химерное моноклональное антитело мыши против CD20, применяемое при лечении неходжкинской лимфомы. Как отмечают Robak и Robak (2009), результаты данных испытаний демонстрируют высокую активность этого антитела у пациентов с SLE, и разработано несколько новых антител, нацеленных на CD20: офатумумаб, IMMU-106 и GA-101. Дальнейшие клинические испытания, в которых сообщали об активности моноклональных антител при SLE, проводили с антителом против CD22, эпратузумабом, антителом против TNF-α, инфликсимабом, антителом против IL-10 B-N10 (Llorente et al., Arthritis Rheum. 2000 Aug; 43(8): 1790-800), антителами против CD40L, IDEC 131 и BG 9588, ингибитором BLYS, белимумабом, антителом против рецептора IL-6, токлимумабом, и антителом против C5, экулизумабом.
Задачей настоящего изобретения является предоставление дополнительных средств и, в частности, антител, обладающих применимостью в данной области.
Таким образом, настоящее изобретение относится к гуманизированному или химерному антителу или его фрагменту, способному связываться с интерлейкином-10 (IL-10), где указанное антитело или его фрагмент можно вводить субъекту в отсутствие неприемлемого повышения уровня провоспалительных цитокинов.
Поскольку IL-10 представляет собой противовоспалительный цитокин, после блокирования можно ожидать значительного повышения уровня цитокинов. В случае антитела мыши против IL-10 B-N10 на нестимулированных культурах клеток (что отражает ситуацию in vivo у здоровых индивидуумов) можно наблюдать повышение уровня провоспалительных цитокинов, таких как IL-6 или TNF-α. Однако авторы изобретения неожиданно обнаружили, что, если антитело по настоящему изобретению наносят на клетки in vitro и вводят in vivo, высвобождение цитокина гораздо ниже. Это более низкое высвобождение цитокинов является предпочтительным, т.к. в результате индивидуумы, которым вводят антитело по настоящему изобретению, лучше его переносят.
Изобретение проиллюстрировано исключительно в качестве примеров следующими фигурами, среди которых:
На фиг.1A показана аминокислотная последовательность вариабельной области легкой цепи антитела B-N10 мыши (SEQ ID NO:2). Подчеркнуты гипервариабельные определяющие комплементарность области (CDR) (где LCDR1 является SEQ ID NO:4; LCDR2 является SEQ ID NO:5; и LCDR3 является SEQ ID NO:6).
На фиг.1B показана аминокислотная последовательность вариабельной области тяжелой цепи антитела B-N10 мыши (SEQ ID NO:3). Подчеркнуты гипервариабельные определяющие комплементарность области (CDR) (где HCDR1 является SEQ ID NO:7; HCDR2 является SEQ ID NO:8; и HCDR3 является SEQ ID NO:9).
На фиг.2A показана нуклеотидная последовательность, кодирующая вариабельную область легкой цепи антитела B-N10 мыши (SEQ ID NO:10).
На фиг.2B показана нуклеотидная последовательность, кодирующая вариабельную область тяжелой цепи антитела B-N10 мыши (SEQ ID NO:11).
На фиг.3 показана аминокислотная последовательность вариабельной области легкой и тяжелой цепей антитела B-N10 мыши (SEQ ID NO:12 и 13 соответственно) вместе с последовательностями, взятыми из A17 (SEQ ID NO:14), JK1 (SEQ ID NO:15), 3-66+04 (SEQ ID NO:16) и JH4 (SEQ ID NO:17), и вариабельных областей hVL1-hVL12 (SEQ ID NO:18-29), и вариабельных областей hVH1-hVH29 (SEQ ID NO:30-58), полученных при гуманизации антитела B-N10 мыши.
На фиг.4 показано сравнение антигенсвязывающих свойств вариантов гуманизированного антитела и химерного антитела cB-N10 с применением ELISA с фиксированным антигеном hIL-10.
На фиг.5 показан результат определения антигенсвязывающих свойств трех гуманизированных вариантов, hVH20/hVL7, hVH20/hVL8 и hVH26/hVL7, по сравнению с химерным антителом B-N10 с использованием очищенных препаратов антитела.
На фиг.6A показан уровень высвобождения TNF-α из культур клеток цельной крови от здоровых добровольцев после инкубации с B-N10 по сравнению с BT-063 (при 50 мкг/мл).
На фиг.6B показан уровень высвобождения TNF-α из культур клеток цельной крови от пациентов с SLE после инкубации с B-N10 по сравнению с BT-063 (при 50 мкг/мл).
На фиг.7A показан уровень высвобождения IL-6 из культур клеток цельной крови от здоровых добровольцев после инкубации с B-N10 по сравнению с BT-063 (при 50 мкг/мл).
На фиг.7B показан уровень высвобождения IL-6 из культур клеток цельной крови от пациентов с SLE после инкубации с B-N10 по сравнению с BT-063 (при 50 мкг/мл).
На фиг.8A показан уровень высвобождения IL-1β из культур клеток цельной крови от здоровых добровольцев после инкубации с B-N10 по сравнению с BT-063 (при 50 мкг/мл).
На фиг.8B показан уровень высвобождения IL-1 β из культур клеток цельной крови от пациентов с SLE после инкубации с B-N10 по сравнению с BT-063 (при 50 мкг/мл).
На фиг.9A показан уровень высвобождения INF-γ из культур клеток цельной крови от здоровых добровольцев после инкубации с B-N10 по сравнению с BT-063 (при 50 мкг/мл).
На фиг.9B показан уровень высвобождения INF-γ из культур клеток цельной крови от пациентов с SLE после инкубации с B-N10 по сравнению с BT-063 (при 50 мкг/мл).
На фиг.10 показана общая структура Fab-фрагмента BT-063, связывающего IL-10. IL-10 и Fab-фрагмент представлены в виде ленточной модели.
На фиг.11 показан Fab-фрагмент BT-063, относящийся к тому же участку связывания на IL-10, что и рецептор IL-10. IL-10, IL-10R1 и Fab-фрагмент представлены в виде ленточной модели.
На фиг.12 показан график средней концентрации Cmax цитокинов в плазме после введения BT-063 здоровым добровольцам относительно дозы.
На фиг.13 показан график средней концентрации IL-10 в плазме с течением времени после введения BT-063 in vivo здоровым добровольцам.
Подробное описание изобретения
Настоящее изобретение относится к гуманизированному или химерному антителу или его фрагменту, способному связываться с интерлейкином-10 (IL-10), и применению данного антитела или его фрагмента в лечении медицинских состояний, опосредуемых повышенным уровнем или активностью IL-10.
IL-10 человека представляет собой гомодимер с молекулярной массой 37 кДа. Каждый мономер состоит из 160 аминокислот и имеет молекулярную массу 18,5 кДа. Димер IL-10 взаимодействует с α-рецептором IL-10 (IL-10Rα или IL-10R1) и соответственно вовлекает β-рецептор IL-10 (IL-10Rβ или IL-10R2) в комплекс. Рецептор экспрессируется на множестве клеток, в частности иммунных клетках (Asadullah et al., Pharmacol. Rev. 2003 Jun; 55(2):241-69), включая большинство гематопоэтических клеток, таких как моноциты, макрофаги, и T- и B-лимфоциты, а также экспрессируется и на негематопоэтических клетках, таких как клетки эпидермиса или кератиноциты. Связывание IL-10 с α-рецептором IL-10 и вовлечение β-рецептора IL-10 приводит к передаче сигнала через тирозиновые киназы Jak1 и Tyk2 и затем к активации факторов транскрипции семейства STAT. Известны различные клеточные источники IL-10, такие как Τ-хелперные клетки, регуляторные Τ-клетки, моноциты, макрофаги, Β-клетки, эозинофилы, тучные клетки, кератиноциты, дендритные клетки и даже злокачественные клетки. Действие IL-10 на Β-клетки находится в диапазоне предотвращения апоптоза, усиления пролиферации, переключения класса иммуноглобулинов и дифференцировки в плазматические клетки (Asadullah et al., Pharmacol, Rev. 2003 Jun; 55(2):241-69).
Настоящее изобретение относится к гуманизированному или химерному антителу или его фрагменту, способному связываться с интерлейкином-10 (IL-10), где указанное антитело или его фрагмент можно вводить субъекту в отсутствие неприемлемого повышения уровня провоспалительных цитокинов.
В частности, известно, что введение терапевтических антител может приводить к неприемлемому повышению уровней провоспалительных цитокинов, приводящему к побочным эффектам у субъекта. В частности, неприемлемое повышение может вызывать покраснение кожи и лихорадку или гриппоподобные симптомы, включая повышение температуры тела. Таким образом, в предпочтительном аспекте изобретения антитело или фрагмент антитела является таким, которое можно вводить субъекту в отсутствие повышения температуры тела более чем на 2°C.
Кроме того, антитело или его фрагмент не вызывает существенного повышения количества провоспалительных цитокинов в плазме крови субъекта после введения. Уровни данных цитокинов, являющиеся неприемлемыми, как правило, в несколько раз больше, чем верхний предел цитокинов в норме (ULN), где ULN определяют как средний уровень цитокина (цитокинов), измеряемый в когорте индивидуумов+2 стандартных отклонения.
Таким образом, в предпочтительном аспекте изобретения антитело или его фрагмент можно вводить субъекту в отсутствие повышения провоспалительного цитокина, составляющего более чем 500%, более предпочтительно более чем 300% от верхнего предела в норме (ULN). Другими словами, антитело или его фрагмент вызывает повышение уровня провоспалительных цитокинов, составляющее менее чем 500%, более предпочтительно менее чем 300% от ULN для данного цитокина. Предпочтительно, чтобы провоспалительный цитокин представлял собой, по меньшей мере, один и, предпочтительно, все из TNF-α, INF-γ и IL-1β. Альтернативно, провоспалительный цитокин не является IL-6 или IL-8.
Кроме того, особенно предпочтительно, чтобы антитело или его фрагмент по настоящему изобретению могли стимулировать антагонист рецептора IL-1 (IL-1ra) у субъекта, приводя к противовоспалительному ответу.
В предпочтительном аспекте настоящего изобретения гуманизированное антитело или его фрагмент не вызывает более чем 500% повышение уровня провоспалительных цитокинов, особенно, TNF-α, IL-1β, IL-6, высвобождающихся из PBMC, более конкретно из иммунной клетки, при контакте с указанной клеткой in vitro.
Авторы настоящего изобретения неожиданно обнаружили, что гуманизированное антитело или его фрагмент по изобретению вызывают меньшее повышение уровня провоспалительных цитокинов в анализах in vitro, чем антитело B-N10 мыши.
Уровень высвобождения провоспалительного цитокина можно определить в исследованиях in vitro с использованием культур клеток цельной крови человека, таких как исследования, описанные ниже в примере 5, или выделенных иммунных клетках. В частности, способы включают стадии: (a) инкубации культуры клеток с антителом или его фрагментом; и (b) определение уровня, по меньшей мере, одного провоспалительного цитокина.
Культуры клеток цельной крови человека можно получать от здоровых добровольцев или пациентов с заболеванием, таких как пациенты, страдающие SLE. Мононуклеарные клетки периферической крови (PBMC) могут представлять собой иммунные клетки и, в частности, выбранные из макрофагов, моноцитов, дендритных клеток, Τ-хелперных клеток и Β-клеток.
По меньшей мере, один провоспалительный цитокин может быть выбиран из интерлейкина-1β (IL-1β), IL-1α, IL-6 или фактора некроза опухоли (TNF-α) или Τ-хелперных цитокинов (интерферона гамма, INF-гамма, IL-4), макрофагальных цитокинов (IL-12), хемокинов (IL-8, MCP-1) соответственно. Уровни таких высвобождаемых цитокинов могут быть измерены в супернатанте культуры клеток с применением способов, как правило, известных в данной области.
Более конкретно, данный способ in vitro может включать стадии:
a) приведения 50 мкг/мл антитела или фрагмента в контакт с культурой клеток цельной крови человека;
b) инкубации указанного антитела или фрагмента с указанной культурой клеток цельной крови при 37°C в течение 48 часов;
c) определения количества одного или нескольких провоспалительных цитокинов в культуре.
В частности, способ параллельно осуществляют на культуре клеток цельной крови человека, не контактировавшей с антителом. Предпочтительно, при сравнении с данным контролем антитело или фрагмент антитела по настоящему изобретению вызывает менее чем 500% повышение уровня цитокина, более предпочтительно менее чем 300% повышение уровня цитокина. Предпочтительно, чтобы цитокин в данном способе не являлся IL-6 или IL-8.
Цитокины можно определить в культуре с помощью мультиплексных иммуноферментных анализов с применением бус (твердофазных анализов белков, проводимых на 96-луночных фильтрующих планшетах). Способ основан на применении бус, связанных, во-первых, с конкретным антителом конкретного цитокина и, во-вторых, проявляющих определенные спектральные характеристики. Это позволяет специфически определять бусы и, таким образом, относить их к известному связанному антителу. Связанный с бусами цитокин можно количественно определить посредством дополнительного связывания цитокинов антителом определения. Это позволяет определять одновременно до 10 цитокинов человека, включая GM-CSF, IL-1β, IL-2, IL-4, IL-5, IL-6, IL-8, IL-10, INF-γ и TNF-α. Для этой цели используют фильтрующие планшеты, в увлажненные лунки которых пипеткой наносят образцы, стандарты и раствор бус. После инкубации жидкость отсасывают вакуумным насосом, оставшиеся бусы промывают и добавляют смесь биотинилированных антител определения. Не связавшиеся антитела определения удаляют посредством отсасывания жидкости и промыванием оставшихся в лунке бус и затем добавляют конъюгированный со стрептавидином R-фикоэритрин (стрептавидин-RPE). Это позволяет распознавать биотинилированные антитела определения при инкубации, и после повторного промывания образовавшиеся иммунные комплексы можно анализировать с использованием системы Bio-Plex 200. В иммунологическом анализе используют устройство Bio-Plex 200. В нем используются две системы лазеров, во-первых, определяющие бусы на основе их спектральных характеристик и, во-вторых, определяющие количество связавшихся цитокинов посредством определения с применением вторичного антитела. Количественный анализ связавшегося антитела осуществляют посредством анализируемых параллельно стандартов с известными количествами цитокинов.
Настоящее изобретение также относится к гуманизированному или химерному антителу или его фрагменту, способному связываться с интерлейкином-10 (IL-10), где указанное антитело или его фрагмент способны повышать уровни IL-10 в плазме при введении субъекту.
Как показано в примере 8 ниже, в то время как антитело по настоящему изобретению можно вводить в отсутствие неприемлемого повышения уровня провоспалительных цитокинов, введение дозо-зависимым образом повышает количество IL-10, определяемого в образцах плазмы. Обнаружение того, что уровни IL-10 будут повышаться при введении нейтрализующего антитела, является неожиданным. Можно было бы ожидать, что введение нейтрализатора цитокина будет снижать уровень свободного цитокина (Strand et al., Nature Reviews Drug Discovery, 2007, Vol, 6, pages 75-92). Не желая быть связанными теорией, полагают, что связывание IL-10 антителом предотвращает связывание IL-10 с рецептором IL-10 и запускает отрицательную обратную связь, заставляющую B-клетки продуцировать больше IL-10. Однако положительная регуляция не препятствует терапевтической применимости антитела по настоящему изобретению, т.к. антитело безопасно для введения на уровнях, достаточно высоких для нейтрализации всего IL-10, что также показано в примере 8.
В настоящем описании термин "химерное антитело" относится к антителам, в которых часть тяжелой и/или легкой цепи идентична последовательностям антител, полученным из конкретных видов или принадлежащим конкретному классу или подклассу антител, в то время как остальная часть антитела идентична последовательностям антител, полученным из других видов, класса или подкласса антител. Особенно предпочтительно, чтобы CDR химерного антитела имели одно происхождение, в то время как остальная часть антитела имела другое происхождение. В частности, в настоящем изобретении химерное антитело может являться гуманизированным антителом, в котором антигенсвязывающие последовательности/вариабельные домены не принадлежащего человеку антитела пересаживают на каркасные области антитела человека.
В настоящем описании термин "фрагмент" относится к фрагменту или производному антитела, сохраняющему желаемую биологическую активность. Как правило, фрагмент будет содержать антигенсвязывающую область антитела, в частности Fab, Fab', F(ab)'2, Fv и scFv фрагменты, а также производные поливалентных антител, в частности диател или тандемных диател. Предпочтительно, фрагмент содержит, по меньшей мере, 25, более предпочтительно 50 и еще более предпочтительно 200-500 аминокислот. Альтернативно, фрагменты могут быть определены как имеющие размер от 30 кДа до 150 кДа. Кроме того, фрагменты антител могут включать две или более пептидные/полипептидные цепи. Например, Fab фрагмент, содержащий две цепи от 200 до 300 аминокислот в каждой, или TandAbs® (форматы тетравалентного биспецифического антитела), содержащий две цепи от 400 до 500 аминокислот в каждой.
Предпочтительным признаком изобретения является то, что антитело или его фрагмент получают из антитела B-N10 мыши или гуманизированного антитела BT-063 (вариант hVH26/hVL7), описанного в настоящем описании. В частности, такое антитело или его фрагмент будет содержать CDR, по меньшей мере, на 80% идентичные CDR из CDR1, CDR2 и CDR3 вариабельной области легкой цепи B-N10/BT-063, и/или содержать аминокислотные последовательности, по меньшей мере, на 80% идентичные последовательностям CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи B-N10/BT-063. Аминокислотная последовательность CDR мыши показана на фиг.1. Аминокислотная последовательность CDR BT-063 показана в примере 6. Более предпочтительно, последовательности будут, по меньшей мере, на 90% или, по меньшей мере, на 95% идентичны последовательностям CDR антитела B-N10/BT-063. Рентгено-кристаллографические исследования, описанные в примере 6 в настоящем описании, указывают на то, какие остатки в CDR важны для связывания IL-10.
Альтернативно, антитело или фрагмент по изобретению, все еще являясь производным антитела B-N10/BT-063, может содержать аминокислотную последовательность CDR1, CDR2 и CDR3 вариабельной области легкой цепи B-N10/BT-063 и/или аминокислотную последовательность CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи B-N10/BT-063, необязательно, с вариацией в данных последовательностях, которая по существу не изменяет аффинности и/или специфичности антитела или его фрагмента. В частности, вариации в последовательности не снижают аффинности или специфичности антитела или фрагмента в отношении IL-10, по сравнению с аффинностью или специфичностью антитела или фрагмента, содержащих CDR антитела B-N10 мыши или антитела BT-063 (вариант hVH26/hVL7).
В конкретном варианте осуществления изобретение относится к гуманизированному или химерному антителу или его фрагменту, содержащему аминокислотные последовательности CDR1, CDR2 и CDR3 вариабельной области легкой и/или тяжелой цепей B-N10/BT-063. Более предпочтительно, настоящее изобретение относится к гуманизированному или химерному антителу или его фрагменту, содержащему аминокислотные последовательности вариабельных доменов антитела B-N10 мыши, как показано на фиг.1. Наиболее предпочтительно, антитело или фрагмент содержит одну или обе аминокислотные последовательности вариабельных доменов BT-063 (SEQ ID NO:69 и SEQ ID NO:70).
Как правило, антитело по изобретению дополнительно содержит константную область (Fc) человека. Она может быть выбрана среди константных доменов любого класса иммуноглобулинов, включая IgM, IgG, IgD, IgA и IgE, и любых изотипов, включая IgG1, IgG2, IgG3 и IgG4. Предпочтительные константные области выбирают среди константных доменов IgG, в частности IgG1.
Другие продукты
Настоящее изобретение дополнительно относится к последовательностям нуклеиновой кислоты, кодирующим описанное выше антитело или фрагменты антител. Последовательности нуклеиновой кислоты могут представлять собой ДНК или РНК, но предпочтительно ДНК. Последовательности можно использовать в экспрессирующих кассетах или векторах и практически применять в производстве описываемых в настоящем описании антител и их фрагментов.
Изобретение дополнительно относится к клеткам-хозяевам, трансформированным данными полинуклеотидами, экспрессирующими кассетами или векторами. Подходящие клетки-хозяева могут являться прокариотическими и эукариотическими.
Альтернативно, клетка-хозяин может представлять собой гибридому, полученную слиянием клетки, продуцирующей антитело по настоящему изобретению, с миеломной клеткой.
Описанные выше клетки-хозяева можно применять в способе получения антитела или его фрагмента. В частности, такой способ может включать стадию культивирования клетки-хозяина в подходящей среде для культивирования в условиях, делающих возможной экспрессию антитела или его фрагмента и отделение антитела или фрагмента от среды для культивирования. Способы данного типа хорошо известны и описаны в данной области.
Медицинское применение
Описанные в настоящем описании антитела и их фрагменты обладают применимостью в лечении заболеваний или медицинских состояний, опосредуемых повышенным уровнем или активностью IL-10. В результате предоставлен способ лечения или предотвращения медицинского состояния у субъекта, где медицинское состояние опосредовано повышенным уровнем или активностью IL-10, включающий введение терапевтически эффективного количества описанного в настоящем описании антитела или его фрагмента.
В частности, медицинское состояние, опосредованное повышенным уровнем или активностью IL-10, представляет собой SLE. Таким образом, настоящее изобретение также относится к антителу или его фрагменту, как описано в настоящем описании, для применения в лечении SLE.
Дополнительные примеры представляют собой тромбоцитопеническую пурпуру, люпус-нефрит, ВИЧ, ЦМВ и гепатит C. Другой пример представляет собой лечение опухолевых клеток в зависимости от IL-10 посредством прямой поддержки пролиферации или супрессии иммунного ответа.
Дополнительным вариантом осуществления изобретения является фармацевтическая композиция, содержащая описанное выше антитело или его фрагмент, фармацевтически приемлемый носитель или разбавитель. В одном из вариантов осуществления композиция содержит липосомы, с которыми соединяют антитело или его фрагмент.
Такие композиции можно вводить пациенту парентерально, внутривенно или подкожно. Предпочтительно при лечении SLE антитело или его фрагмент вводят внутривенно или подкожно.
Антитела и их фрагменты практически применяют в лечении медицинского состояния, поскольку они не вызывают значимого повышения уровней провоспалительных цитокинов, они не требуют совместного введения с кортикостероидом для предотвращения "цитокиновой бури", неприемлемой для пациента.
Таким образом, конкретный аспект настоящего изобретения относится к способу лечения или предотвращения медицинского состояния у субъекта, где медицинское состояние опосредованно повышенным уровнем или активностью IL-10, включающему введение указанному субъекту терапевтически эффективного количества антитела или его фрагмента, как описано в настоящем описании, где субъекта не лечат одновременно или раздельно кортикостероидом, т.е. пациентом является пациент, которого не лечат одновременно кортикостероидом. В варианте осуществления данного предпочтительного аспекта медицинским состоянием, опосредованным повышенным уровнем или активностью IL-10, является SLE.
В настоящее время кортикостероиды применяют в лечении SLE у многих пациентов. Однако данный аспект изобретения обладает конкретной применимостью в лечении пациентов, когда дальнейшее введение кортикостероидов нежелательно.
Немедицинское применение
Кроме того, предоставлено меченое гуманизированное или химерное антитело или его фрагмент, включающее описанное в настоящем описании антитело или его фрагмент и метку. Метка может быть любого подходящего типа, известного в данной области для определения присутствия антитела в образце. В частности, метка может представлять собой флуоресцентную метку.
Меченое или немеченое антитело, в частности меченое антитело, обладает конкретной применимостью в способе определения наличия IL-10 in vitro в образце. Способ может включать стадию приведения немеченого или меченого антитела или его фрагмента в контакт с образцом, промывания образца для удаления антитела и его фрагментов, не связавшихся с образцом (т.е. не связавшегося антитела или фрагментов антител), и определение наличия антитела (или фрагмента) в образце, например, посредством метки.
Альтернативно, немеченое антитело или фрагмент может быть использовано в способе нейтрализации IL-10 in vitro в образце. Такой способ включает стадии приведения образца в контакт с антителом или его фрагментом для связывания антитела или его фрагмента с IL-10.
Теперь изобретение будет описано далее в отношении следующих конкретных вариантов осуществления.
ПРИМЕРЫ
ПРИМЕР 1 - Характеристика антитела B-N10 мыши против IL-10
1.1. Выделение ДНК, кодирующей вариабельные домены антитела B-N10
Для идентификации вариабельных последовательностей B-N10 мыши применяли клеточные массы. Образцы (3×B-N10, пассаж 3, 1×107 клеток) хранили при -80°C до выделения мРНК из клеток, и после синтеза кДНК вариабельные последовательности B-N10 амплифицировали посредством ПЦР и затем клонировали.
Секвенировали в общем 14 клонов (SEQ Laboratories, Gottingen) и анализировали вариабельные области легкой цепи и вариабельные области тяжелой цепи. Однозначно определяли вариабельные последовательности B-N10. Отклонения присутствовали только в N-концевых областях праймеров (см. таблицу 1). В случае вариабельной области тяжелой цепи вариант последовательности QVQLKQ (SEQ ID NO:59) присутствовал в области праймеров девять раз, но другие варианты присутствовали только один или два раза. Данный вариант выбирали для субклонирования. В случае вариабельной области легкой цепи в равных пропорциях присутствовали два варианта. После сравнения последовательностей с последовательностями зародышевой линии мыши значительную гомологию с идентифицированной последовательностью VL проявляла последовательность cr1 только с 3 мутациями. Это означает, что последовательность DVLMTQ (SEQ ID NO:60) является наиболее вероятной правильной последовательностью. Последовательность DIVMTQ (SEQ ID NO:61) представляет собой типичную последовательность другого класса последовательностей зародышевой линии, и поэтому ее исключали.
| Таблица 1 Встречаемость секвенированных вариантов N-концевой последовательности вариабельной области легкой и тяжелой цепи B-N10 Выбранные последовательности выделены жирным шрифтом. | ||
| Последовательность | Число раз | |
| Вариабельная область легкой цепи | DIVMTQ (SEQ ID No:61) | 5 |
| DVLMTQ (SEQ ID No:60) | 5 | |
| DVLMTR (SEQ ID No:62) | 1 | |
| DIVITQ (SEQ ID No:63) | 1 | |
| DIVLTQ (SEQ ID No:64) | 2 | |
| Вариабельная область тяжелой цепи | QVQLKQ (SEQ ID No:59) | 9 |
| QVQLKE (SEQ ID No:65) | 2 | |
| EVQLQQ (SEQ ID No:66) | 1 | |
| QVQLNQ (SEQ ID No:67) | 1 | |
| QVQLTQ (SEQ ID No:68) | 1 |
Белковые последовательности вариабельной области легкой цепи VL и вариабельной области тяжелой цепи VH представлены на фиг.1A и 1B соответственно. Подчеркнуты гипервариабельные определяющие комплементарность области (CDR). Соответствующие последовательности ДНК представлены на фиг.2A и 2B соответственно.
ПРИМЕР 2 - Получение химерного антитела B-N10
Идентифицированные вариабельные последовательности тяжелой и легкой цепей антитела примера 1 клонировали в векторную систему для экспрессии рекомбинантных антител. Первой стадией являлось клонирование последовательностей в лидерную последовательность BS; с Ν-конца добавляли секреторный сигнал и с C-конца добавляли последовательность донорного сайта сплайсинга. Второй стадией являлось клонирование данных последовательностей в экспрессирующие векторы, содержащие константные области каппа-цепи человека и константные области гамма-1-цепи человека соответственно. Получали вектор для легкой цепи и вектор для тяжелой цепи и затем транзиторно котрансфицировали в клетки COS-7 осаждением фосфатом кальция или липофекцией. Супернатант культуры клеток собирали через 2 дня. После экспрессии химерного B-N10 в клетках COS-7 и определения титра антител в супернатанте (сэндвич-вариант ELISA) тестировали их связывающую способность на интерлейкине-10 человека (R&D Systems, кат. № 217-IL/CF, лот ET114021, хранящийся при -20°C) с применением ELISA.
Для сэндвич-варианта ELISA антитело мыши против каппа-цепи человека (Becton Dickinson) связывали с поверхностью планшета в качестве фиксирующего антитела, затем инкубировали с супернатантом культуры клеток и определяли присутствие химерного антитела с применением POD-конъюгированного антитела кролика против IgG человека (H+L) (Dianova). В качестве положительного контроля использовали химерное контрольное антитело в определенной концентрации (0,125-12 мкг/мл).
Для ELISA с фиксированным антигеном IL-10 человека связывали с поверхностью планшета в концентрации 0,5 и 5 мкг/мл. После инкубации с супернатантом культуры клеток (неразведенным и разведенным 1:5) определяли связывание химерного B-N10 с POD-конъюгированным антителом кролика против IgG человека (H+L) (Dianova). В качестве положительного контроля использовали B-N10 мыши. Антитело использовали в концентрациях 0,5 и 5 мкг/мл и определяли связывание с POD-конъюгированным антителом кролика против IgG/IgM мыши (Dako).
Результаты ELISA обсуждены в примере 3.
ПРИМЕР 3 - Гуманизация антител против IL-10
Исходные попытки снижать иммуногенность антител грызунов у людей включали получение химерных антител заменой константных доменов антитела грызунов доменами человека. Т.к. каркасные области грызунов в вариабельных доменах все равно могут индуцировать иммунный ответ, разработали усовершенствованный способ ремоделирования CDR, подразумевающий перенос антигенсвязывающих последовательностей (определяющих комплементарность областей, CDR) на каркасы антитела полностью человека (гуманизация). Как правило, для повышения возможности сохранения исходной антиген-специфичности и аффинности при гуманизации выбирают акцепторные каркасы человека, наиболее напоминающие донорное антитело мыши. Для улучшения способа можно применять или сочетать различные подходы с использованием последовательностей зародышевой линии антител человека, консенсусных последовательностей экспрессируемых антител, анализ структур петель CDR и рентгеновских структур комплексов антитело/антиген. Как правило, таким способом получали несколько вариантов гуманизированных антител и затем анализировали их биологические эффекты, которые могут отличаться у разных антител и у исходного антитела. В конечном итоге в соответствии с желаемой функцией антитела может быть выбрана подходящая константная область человека.
3.1. Сравнение вариабельных последовательностей B-N10 мыши и последовательностей человека и дизайн набора гуманизированных последовательностей VL (hVL) и VH (hVH)
Выбирали антитело мыши против IL-10 B-N10 (Llorente et al., Eur. Cytokine Netw. 1993 Nov-Dec; 4(6): 421-7; и Llorente et al., Arthritis Rheum, 2000 Aug; 43(8): 1790-80). Способ получения гуманизированных антител основан на способе ремоделирования CDR, где определяющие комплементарность области (CDR) объединяют с акцепторными областями человека.
Выбор акцепторных каркасов человека основан на комбинированном анализе трех наборов данных:
1) гомология последовательностей мыши с последовательностями зародышевой линии человека для минимизации риска соматических мутаций;
2) сравнение последовательностей мыши с консенсусными последовательностями человека для идентификации необычных аминокислотных остатков и
3) идентификация канонических классов структур последовательностей CDR для получения информации о важных структурных аминокислотных остатках каркаса.
Вариабельные области легкой цепи B-N10 мыши демонстрируют наибольшую гомологию с вариабельным сегментом 2-30*01 зародышевой линии человека (A17 (SEQ ID NO:14)) и соединительным пептидом JK1 (SEQ ID NO:15). Консенсусной последовательностью человека с наибольшей гомологией с B-N10 является HuKII. Определяющие комплементарность области (CDR) вариабельной области легкой цепи в случае L1 можно отнести к классу 4 и в случае L2 и L3 - к классу 1. Идентифицировали критические аминокислотные остатки.
При сравнении последовательностей генов CDR мыши и VL зародышевой линии человека с канонической структурой класса 4-1-1 выявляли наибольшую гомологию с 2-30*01 (наименьшее количество несовпадающих аминокислот).
Вариабельные области тяжелой цепи B-N10 мыши демонстрируют наибольшую гомологию с вариабельным сегментом VH3-33 зародышевой линии человека и с соединительным пептидом JH4 (SEQ ID NO:17). Консенсусной последовательностью человека