Новое пиперидиновое соединение или его соль
Иллюстрации
Показать всеНастоящее изобретение относится к новому пиперидиновому соединению, представленному общей формулой (I), или к его фармацевтически приемлемой соли. Данное соединение обладает превосходным селективным ингибирующим aurora A действием и является пригодным в качестве перорально вводимого противоракового лекарственного средства. Кроме того, настоящее изобретение относится к новому средству для усиления противоопухолевого эффекта агонистов микротрубочек, которые включают таксановое противораковое средство для комбинированной терапии. В соединении формулы (I) R1 представляет собой карбоксильную группу -C(=O)NR5R6 или оксадиазолильную группу, необязательно содержащую C1-C6алкильную группу или трифторметильную группу в качестве заместителя; R2 представляет собой атом галогена или C1-C6алкоксигруппу; R3 представляет собой фенильную группу, необязательно содержащую 1-3 одинаковые или различные группы, выбранные из атома галогена, C1-C6алкильной группы, C1-C6алкоксигруппы и трифторметильной группы в качестве заместителя; R4 представляет собой атом водорода или C1-C6алкильную группу; и R5 и R6 являются одинаковыми или различными, и каждый представляет собой атом водорода, C1-C6алкильную группу или C3-C6циклоалкильную группу, или R5 и R6 необязательно образуют 3-6-членную содержащую азот насыщенную гетероциклическую группу вместе с атомом азота, с которым связаны R5 и R6. 10 н. и 14 з.п. ф-лы, 23 табл., 28 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новому пиперидиновому соединению, обладающему ингибирующей киназу aurora A активностью, или его соли, и применению соединения или его соли.
Предпосылки создания изобретения
Aurora A является членом серин-треониновых киназ, и она в значительной степени связана, например, с образованием и созреванием центросом, динамикой веретена и выравниванием хромосом в митотической фазе (M фаза) клеточного цикла, посредством этого, регулируя протекание митоза (непатентный документ 1). К настоящему времени, сверхэкспрессия и/или амплификация aurora A подтверждена при большом разнообразии карцином (непатентный документ 2). Кроме того, поскольку ингибирование киназы aurora A в опухолевых клетках вызывает не только остановку митоза, но также и апоптоз, aurora A является одной из важных молекул-мишеней в терапии рака.
Между тем, средства, воздействующие на микротрубочки, как представлено таксаном и алкалоидом барвинка, широко применяются в качестве ключевого лекарственного средства в химиотерапии рака. Однако устойчивые и достаточные терапевтические эффекты не всегда получают из-за потери восприимчивости к лекарственным средствам или возникновения устойчивости к лекарственным средствам. Следовательно, есть клиническая необходимость в разработке лекарственного средства, способного усиливать противоопухолевый эффект таксановых лекарственных средств, поскольку данное лекарственное средство обещает обеспечить более эффективными терапевтическими возможностями. Разрушающий клетки эффект таксановых противораковых средств требует активации контрольной точки сборки веретена в клеточном цикле, при этом сообщают, что опухолевые клетки, имеющие пониженную активность контрольной точки сборки веретена, обладают пониженной чувствительностью к таксановым противораковым лекарственным средствам (непатентный документ 3). Кроме того, известно, что клеточная линия, сверхэкспрессирующая aurora A, становится устойчивой к паклитакселу (непатентный документ 4), и ингибирование aurora A усиливает активность паклитаксела или доцетаксела (непатентный документ 5). Между тем, сообщалось, что хотя aurora B, которая представляет собой ее подтип, обладает активностью на митотической фазе (M фаза) клеточного цикла с aurora A, при этом ингибирование aurora B снижает активность контрольной точки сборки веретена (непатентный документ 6). Следовательно, предполагается, что ингибирование aurora B сможет смягчить эффект таксановых лекарственных средств. Кроме того, aurora C сильно экспрессируется, например, в семеннике или сперматозоидах, и результаты анализа генома человека показали, что aurora C является важной в сперматогенезе (непатентный документ 7). Известно, что aurora C функционирует в качестве дополнения к функционированию aurora B при делении клеток (непатентный документ 8). Аналогично ингибированию aurora B, ингибирование aurora C вызывает анеуплоидию в клетках, приводящую к проявлению фенотипа, который сильно отличается от проявляемого при ингибировании aurora A и, вероятно, можно ожидать усиления эффекта таксановых лекарственных средств. Более того, нельзя не обратить внимания на влияние на репродуктивную систему и, следовательно, желательно, чтобы лекарственное средство не обладало ингибирующей aurora C активностью.
Согласно указанному выше, ожидают, что при введении лекарственного средства, которое селективно ингибирует киназу aurora A, в комбинации с таксановым противораковым средством лекарственное средство будет эффективно усиливать противоопухолевую активность таксанового противоракового средства, обеспечивая посредством этого больший терапевтический эффект.
Кроме того, сообщалось, что активность, прекращающая клеточный цикл, вызванная паклитакселом, поддерживается в течение нескольких дней на модели опухоли мышей, которым трансплантирована клеточная линия рака человека (непатентный документ 9). Следовательно, средство для перорального введения считают подходящим, когда одновременно вводят ингибитор aurora A, поскольку обеспечивается непрерывное воздействие.
К настоящему времени, сообщалось, что аминопиридиновое производное, обладающее ингибирующей aurora A активностью, можно вводить перорально (патентный документ 1). Однако хотя в патентном документе 1 описана ингибирующая активность aurora A и активность клеточной пролиферации in vitro, не было обнаружено какого-либо описания, относящегося к оценке перорального введения указанного выше соединения.
[Список цитируемых документов]
[Патентный документ]:
[патентный документ 1] WO2009/104802
[Непатентный документ]:
[непатентный документ 1] Nat. Rev. Drug Discov., 8, стр. 547-566 (2009)
[непатентный документ 2] Cancer Treat. Rev., 34, стр. 175-182 (2008)
[непатентный документ 3] Mol. Cancer Ther., 5, стр. 2963-2969 (2006)
[непатентный документ 4] Cancer Cell, 3, стр. 51-62 (2003)
[непатентный документ 5] Cancer Res., 65, стр. 2899-2905 (2005)
[непатентный документ 6] Mol. Cancer Ther., 8, стр. 2046-2056 (2009)
[непатентный документ 7] Nature Genet. 39: стр. 661-665, 2007
[непатентный документ 8] Genes Клетки 10: стр. 617-626, 2005
[непатентный документ 9] Cancer Res., 71, стр. 4608-4616 (2011)
Сущность изобретения
Задача настоящего изобретения
Соответственно, задача настоящего изобретения состоит в предоставлении нового соединения, которое обладает превосходной селективной ингибирующей aurora A активностью и является пригодным в качестве перорально вводимого противоракового лекарственного средства. Кроме того, другая задача настоящего изобретения состоит в предоставлении нового средства для усиления противоопухолевого эффекта лекарственных средств, воздействующих на микротрубочки, включающих таксановое противораковое средство, и комбинированной терапии.
Способы решения задачи
Авторы настоящего изобретения провели тщательное исследование для того, чтобы решить указанные выше задачи. Вследствие этого, было обнаружено, что пиперидиновое соединение, имеющее конкретный заместитель в пиридиновом кольце, обладает превосходной селективной ингибирующей aurora A активностью и активностью, ингибирующей пролиферацию раковых клеток, и является вводимым перорально. Кроме того, было обнаружено, что данное пиперидиновое соединение заметно усиливает противоопухолевые эффекты лекарственных средств, воздействующих на микротрубочки, включающих таксановое противораковое средство, что составило настоящее изобретение.
Конкретно, настоящее изобретение относится к пиперидиновому соединению, представленному общей формулой (I), или его соли:
где R1 представляет собой карбоксильную группу, -C(=O)NR5R6 или оксадиазолильную группу, необязательно содержащую C1-C6алкильную группу или трифторметильную группу в качестве заместителя;
R2 представляет собой атом галогена или C1-C6алкоксигруппу;
R3 представляет собой фенильную группу, необязательно содержащую 1-3 одинаковые или различные группы, выбранные из атома галогена, C1-C6алкильной группы, C1-C6алкоксигруппы и трифторметильной группы в качестве заместителя;
R4 представляет собой атом водорода или C1-C6алкильную группу; и
R5 и R6 представляют собой одинаковые или различные группы, и каждый представляет собой атом водорода, C1-C6алкильную группу или C3-C6циклоалкильную группу, или R5 и R6 необязательно образуют 3-6-членную содержащую азот насыщенную гетероциклическую группу вместе с атомом азота, с которым связаны R5 и R6.
Настоящее изобретение также относится к лекарственному средству, содержащему пиперидиновое соединение, представленное приведенной выше общей формулой (I), или его соли в качестве активного ингредиента.
Настоящее изобретение также относится к селективному ингибитору aurora A, противоопухолевому средству или средству для усиления противоопухолевого эффекта лекарственного средства, воздействующего на микротрубочки, содержащему пиперидиновое соединение, представленное приведенной выше общей формулой (I), или его соль в качестве активного ингредиента.
Настоящее изобретение также относится к применению пиперидинового соединения, представленного приведенной выше общей формулой (I), или его соли для получения селективного ингибитора aurora A, противоопухолевого средства или средства для усиления противоопухолевого эффекта лекарственного средства, воздействующего на микротрубочки.
Настоящее изобретение также относится к пиперидиновому соединению, представленному приведенной выше общая формула (I), или его соли для селективного ингибирования aurora A, лечения рака или усиления противоопухолевого эффекта лекарственного средства, воздействующего на микротрубочки.
Настоящее изобретение также относится к способу селективного ингибирования aurora A, лечения рака или усиления противоопухолевого эффекта лекарственного средства, воздействующего на микротрубочки, включающему введение эффективной дозы пиперидинового соединения, представленного приведенной выше общей формулой (I), или его соли.
Настоящее изобретение также относится к терапевтическому средству для лечения рака, содержащему пиперидиновое соединение, представленное приведенной выше общей формулой (I), или его соль и лекарственное средство, воздействующее на микротрубочки; композиции, содержащей пиперидиновое соединение, представленное приведенной выше общей формулой (I), или его соль и лекарственное средство, воздействующее на микротрубочки, для лечения рака; применению композиции, содержащей пиперидиновое соединение, представленное приведенной выше общей формулой (I), или его соль и средство, воздействующее на микротрубочки, для получения лекарственного средства для лечения рака; и способу лечения рака, включающему введение эффективной дозы пиперидинового соединения, представленного приведенной выше общей формулой (I), или его соли одновременно с эффективной дозой лекарственного средства, воздействующего на микротрубочки.
Кроме того, настоящее изобретение относится к приведенному выше лекарственному средству, селективному ингибитору aurora A, противоопухолевому средству или средству для усиления противоопухолевого эффекта агониста микротрубочек для перорального введения; применению приведенного выше селективного ингибитора aurora A, противоопухолевого средства или средства, воздействующего на микротрубочки, для перорального введения для получения усилителя противоопухолевого эффекта; приведенному выше соединению или его соли для приведенного выше селективного ингибирования aurora A, лечения рака или усиления противоопухолевого эффекта лекарственного средства, воздействующего на микротрубочки, пероральным введением; и способу приведенного выше селективного ингибирования aurora A, лечения рака или усиления противоопухолевого эффекта лекарственного средства, воздействующего на микротрубочки, где введение осуществляют посредством перорального введения.
Эффекты изобретения
Соединение (I) настоящего изобретения или его соль обладает превосходной селективной ингибирующей aurora A активностью и ингибирующей пролиферацию раковых клеток активностью, и является перорально вводимым. Соединение (I) настоящего изобретения или его соль является пригодной не только в качестве противоопухолевого средства, но также и для введения в комбинации со средством, воздействующим на микротрубочки, включающим таксановое противораковое средство.
Подробное описание изобретения
В соединении (I) настоящего изобретения выбор R2 является важным с точки зрения селективной ингибирующей aurora A активности, перорального поглощения, противоопухолевой активности пероральным введением и усиления противоопухолевого эффекта лекарственных средств, воздействующих на микротрубочки, включающих таксановое противораковое средство. Соединение настоящего изобретения характеризуется тем, что R2 представляет собой атом галогена или C1-C6алкоксигруппу.
В описании настоящего изобретения "C1-C6алкильная группа" представляет собой линейную или разветвленную алкильную группу, содержащую 1-6 атомов углерода, и ее конкретные примеры включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, пентильную группу и гексильную группу. C1-C6алкильная группа предпочтительно представляет собой линейную или разветвленную алкильную группу, содержащую 1-4 атома углерода (C1-C4алкильная группа).
В описании настоящего изобретения "оксадиазолильная группа" относится к 1,2,4-оксадиазолильной группе или 1,3,4-оксадиазолильной группе. Оксадиазолильное кольцо является предпочтительно незамещенным или замещено C1-C4алкильной группой или трифторметильной группой, и оксадиазолильное кольцо является более предпочтительно незамещенным или замещено метильной группой или трифторметильной группой.
В описании настоящего изобретения примеры "атома галогена" включают атом фтора, атом хлора, атом брома и атом йода.
В описании настоящего изобретения "C1-C6алкоксигруппа" представляет собой линейную или разветвленную алкоксигруппу, содержащую 1-6 атомов углерода, и ее конкретные примеры включают метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу, трет-бутоксигруппу, пентоксигруппу и гексоксигруппу. C1-C6алкоксигруппа предпочтительно представляет собой линейную или разветвленную алкоксигруппу, содержащую 1-4 атома углерода (C1-C4алкоксигруппа).
В описании настоящего изобретения "C3-C6циклоалкильная группа" относится к моноциклической циклоалкильной группе, содержащей 3-6 атомов углерода, и ее конкретные примеры включают циклопропильную группу, циклобутильную группу, циклопентильную группу и циклогексильную группу. C3-C6циклоалкильная группа предпочтительно представляет собой циклопропильную группу или циклобутильную группу.
В описании настоящего изобретения фраза "R5 и R6 необязательно образуют 3-6-членную, содержащую азот насыщенную гетероциклическую группу вместе с атомом азота, с котором соединены R5 и R6" означает, что R5 и R6 необязательно образуют, вместе с атомом азота, с которым связаны R5 и R6 (то есть как -NR5R6), 3-6-членную насыщенную гетероциклическую группу, дополнительно содержащую 0-2 атома азота и/или атома кислорода в кольце. Конкретные примеры 3-6-членной, содержащей азот насыщенной гетероциклической группы, которая необязательно образуется, включают азетидинильную группу, пирролидинильную группу, пиперидинильную группу, пиперазинильную группу, морфолинильную группу и изоксазолидинильную группу.
В общей формуле (I) R1 предпочтительно представляет собой карбоксильную группу, -C(=O)NR5R6 (где R5 и R6 являются одинаковыми или различными, и каждый представляет собой атом водорода, C1-C6алкильную группу или C3-C6циклоалкильную группу, или R5 и R6 необязательно образуют азетидинильную группу, пирролидинильную группу или изоксазолидинильную группу вместе с атомом азота, с которым связаны R5 и R6) или оксадиазолильную группу, необязательно содержащую C1-C6алкильную группу или трифторметильную группу в качестве заместителя.
В общей формуле (I) R1 более предпочтительно представляет собой карбоксильную группу, -C(=O)NR5R6 (где R5 и R6 являются одинаковыми или различными, и каждый представляет собой атом водорода, метильную группу, циклопропильную группу или циклобутильную группу, или R5 и R6 представляют собой азетидинильную группу, пирролидинильную группу или изоксазолидинильную группу вместе с атомом азота, с которым связаны R5 и R6) или оксадиазолильную группу, необязательно содержащую метильную группу или трифторметильную группу в качестве заместителя.
Как показано в примерах ниже, является важным, чтобы R2 в общей формуле (I) представлял собой атом галогена или C1-C6алкоксигруппу с точки зрения селективной ингибирующей aurora A активности, перорального поглощения, противоопухолевой активности пероральным введением и усиления противоопухолевого эффекта лекарственных средств, воздействующих на микротрубочки, включающих таксановое противораковое средство. R2 предпочтительно представляет собой атом фтора, атом хлора или C1-C4алкоксигруппу, более предпочтительно атом фтора, атом хлора или метоксигруппу.
В общей формуле (I) R3 предпочтительно представляет собой фенильную группу, необязательно содержащую 1-3 одинаковые или различные группы, выбранные из атома галогена, C1-C4алкильной группы, C1-C4алкоксигруппы и трифторметильной группы в качестве заместителя, более предпочтительно фенильную группу, содержащую 1-2 одинаковые или различные группы, выбранные из приведенных выше заместителей. R3 даже более предпочтительно представляет собой фенильную группу, содержащую 1-2 одинаковые или различные группы, выбранные из атома фтора, атома хлора, метильной группы, метоксигруппы и трифторметильной группы в качестве заместителя.
В общей формуле (I) R4 предпочтительно представляет собой атом водорода или C1-C4алкильную группу, и более предпочтительно атом водорода или метильную группу.
В соединении настоящего изобретения предпочтительно, чтобы R1 представлял собой карбоксильную группу, -C(=O)NR5R6 (где R5 и R6 являются одинаковыми или различными, и каждый представляет собой атом водорода, C1-C4алкильную группу или C3-C6циклоалкильную группу, или R5 и R6 необязательно образуют азетидинильную группу, пирролидинильную группу или изоксазолидинильную группу вместе с атомом азота, с которым связаны R5 и R6) или оксадиазолильную группу, необязательно содержащую C1-C4алкильную группу или трифторметильную группу в качестве заместителя; R2 представлял собой атом фтора, атом хлора или C1-C4алкоксигруппу; R3 представлял собой фенильную группу, необязательно содержащую 1-2 одинаковые или различные группы, выбранные из атома галогена, C1-C4алкильной группы, C1-C4алкоксигруппы и трифторметильной группы в качестве заместителя; и R4 представлял собой атом водорода или C1-C4алкильную группу.
Кроме того, в качестве соединения настоящего изобретения, соединение, где в общей формуле (I) R1 представляет собой карбоксильную группу, -C(=O)NR5R6 (где R5 и R6 являются одинаковыми или различными, и каждый представляет собой атом водорода, метильную группу, циклопропильную группу или циклобутильную группу, или R5 и R6 представляют собой азетидинильную группу, пирролидинильную группу или изоксазолидинильную группу вместе с атомом азота, с которым связаны R5 и R6) или оксадиазолильную группу, необязательно содержащую метильную группу или трифторметильную группу в качестве заместителя; R2 представляет собой атом фтора, атом хлора или метоксигруппу; R3 представляет собой фенильную группу, необязательно содержащую 1-2 одинаковые или различные группы, выбранные из атома фтора, атома хлора, метильной группы, метоксигруппы и трифторметильной группы в качестве заместителя; и R4 представляет собой атом водорода или метильную группу, является предпочтительным.
Кроме того, соединение, где R1 представляет собой карбоксильную группу, -C(=O)NR5R6 (где R5 и R6 являются одинаковыми или различными, и каждый представляет собой атом водорода или метильную группу, или R5 и R6 представляют собой изоксазолидинильную группу вместе с атомом азота, с которым связаны R5 и R6) или 1,2,4-оксадиазолильную группу или 1,3,4-оксадиазолильную группу, необязательно содержащую метильную группу в качестве заместителя; R2 представляет собой атом фтора, атом хлора или метоксигруппу; R3 представляет собой фенильную группу, содержащую 1-2 одинаковые или различные группы, выбранные из атома фтора, атома хлора, метильной группы, метоксигруппы и трифторметильной группы в качестве заместителя; и R4 представляет собой атом водорода или метильную группу, является более предпочтительным.
Кроме того, соединение, где R1 представляет собой карбоксильную группу или 1,2,4-оксадиазолильную группу, необязательно содержащую метильную группу в качестве заместителя; R2 представляет собой атом фтора; R3 представляет собой фенильную группу, содержащую 1-2 одинаковые или различные группы, выбранные из атома фтора и атома хлора в качестве заместителя; и R4 представляет собой метильную группу, является особенно предпочтительным.
Следующие соединения могут быть приведены в качестве примеров особенно предпочтительных соединений настоящего изобретения.
1-(2,3-дихлорбензоил)-4-((5-фтор-6-(5-метил-1H-пиразол-3-иламино)пиридин-2-ил)метил)пиперидин-4-карбоновая кислота (соединение 1),
1-(2-фтор-3-трифторметилбензоил)-4-((5-фтор-6-(5-метил-1H-пиразол-3-иламино)пиридин-2-ил)метил)пиперидин-4-карбоновая кислота (соединение 2),
1-(3-хлор-2-фторбензоил)-4-((5-фтор-6-(1H-пиразол-3-иламино)пиридин-2-ил)метил)пиперидин-4-карбоновая кислота (соединение 10),
1-(3-хлор-2-фторбензоил)-4-((5-метокси-6-(5-метил-1H-пиразол-3-иламино)пиридин-2-ил)метил)пиперидин-4-карбоновая кислота (соединение 11),
1-(3-хлор-2-фторбензоил)-4-((5-хлор-6-(5-метил-1H-пиразол-3-иламино)пиридин-2-ил)метил)пиперидин-4-карбоновая кислота (соединение 12),
1-(3-хлор-2-фторбензоил)-4-((5-фтор-6-(5-метил-1H-пиразол-3-иламино)пиридин-2-ил)метил)пиперидин-4-карбоновая кислота (соединение 13),
1-(3-хлор-2-фторбензоил)-4-((5-фтор-6-(5-метил-1H-пиразол-3-иламино)пиридин-2-ил)метил)-N-метилпиперидин-4-карбоксамид (соединение 14),
1-(3-хлор-2-фторбензоил)-4-((5-фтор-6-(5-метил-1H-пиразол-3-иламино)пиридин-2-ил)метил)-N,N-диметилпиперидин-4-карбоксамид (соединение 16),
азетидин-1-ил(1-(3-хлор-2-фторбензоил)-4-((5-фтор-6-(5-метил-1H-пиразол-3-иламино)пиридин-2-ил)метил)пиперидин-4-ил)метанон (соединение 19),
(1-(3-хлор-2-фторбензоил)-4-((5-фтор-6-(5-метил-1H-пиразол-3-иламино)пиридин-2-ил)метил)пиперидин-4-ил)(изоксазолидин-2-ил)метанон (соединение 21),
(3-хлор-2-фторфенил)(4-((5-фтор-6-(5-метил-1H-пиразол-3-иламино)пиридин-2-ил)метил)-4-(5-метил-1,2,4-оксадиазол-3-ил)пиперидин-1-ил)метанон (соединение 22),
(2,3-дихлорфенил)(4-((5-фтор-6-(5-метил-1H-пиразол-3-иламино)пиридин-2-ил)метил)-4-(5-метил-1,2,4-оксадиазол-3-ил)пиперидин-1-ил)метанон (соединение 23),
(3-хлор-2-фторфенил)(4-((5-фтор-6-(5-метил-1H-пиразол-3-иламино)пиридин-2-ил)метил)-4-(1,2,4-оксадиазол-3-ил)пиперидин-1-ил)метанон (соединение 24),
(3-хлор-2-фторфенил)(4-((5-фтор-6-(5-метил-1H-пиразол-3-иламино)пиридин-2-ил)метил)-4-(5-метил-1,3,4-оксадиазол-2-ил)пиперидин-1-ил)метанон (соединение 28),
(3-хлор-2-фторфенил)(4-((5-фтор-6-(5-метил-1H-пиразол-3-иламино)пиридин-2-ил)метил)-4-(3-метил-1,2,4-оксадиазол-5-ил)пиперидин-1-ил)метанон (соединение 29).
Далее, репрезентативный способ получения соединения (I) настоящего изобретения показан в настоящем описании ниже.
Соединение (I) настоящего изобретения можно получить, например, следующим способом получения, показанным в примерах. Однако способ получения соединения (I) настоящего изобретения не ограничивается данными примерами реакций. Исходные соединения, необходимые для получения соединения настоящего изобретения, можно получить в виде коммерческих продуктов или легко получить способом получения, описанным, например, в документах предшествующего уровня техники.
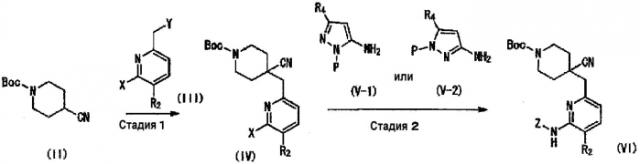
Среди соединений (I) настоящего изобретения, соединение (I-1), где R1 представляет собой карбоксильную группу, можно получить, например, следующим способом получения 1.
Способ получения 1
где X и Y, каждый представляет собой уходящую группу; P представляет собой атом водорода или защитную группу; и Z представляет собой общую формулу (a) или (b):
,
и R2, R3 и R4 являются такими, как определено выше.
В приведенном выше способе получения 1 примеры уходящей группы, представленной X или Y, включают атом галогена, и она предпочтительно является атомом брома. Примеры защитной группы, представленной P, включают трет-бутильную группу, метоксиметильную группу, [(2-триметилсилил)этокси]метильную группу и бензильную группу, и предпочтительно трет-бутильную группу.
(Стадия 1)
Данная стадия представляет собой способ получения соединения (IV) взаимодействием соединения (II) с основанием, и затем с соединением (III). Примеры соединения (III), которые будут использовать на данной стадии, включают 6-бром-2-бромметил-5-фторпиридин, 6-бром-2-хлорметил-5-фторпиридин, 2-бромметил-6-хлор-5-фторпиридин, 2-бромметил-5,6-дихлорпиридин и 6-бром-2-бромметил-5-метоксипиридин, и предпочтительно 6-бром-2-бромметил-5-фторпиридин. Соединение (III) можно получить в виде коммерческого продукта или получить согласно общеизвестному способу.
Количество соединения (III), которое будут использовать на данной стадии, составляет 0,1-10 эквивалентов, предпочтительно 0,8-2 эквивалентов на один эквивалент соединения (II). Температура реакции составляет от -90 до 100°C, предпочтительно от -78 до 0°C. Продолжительность реакции составляет 0,1-100 часов, предпочтительно 0,5-10 часов. Примеры основания включают диизопропиламин лития и гексаметилдисилазид лития, и основание можно использовать в количестве 0,5-10 эквивалентов, предпочтительно 1-1,5 эквивалентов. Растворитель, который будут использовать в данной реакции, конкретно не ограничен, при условии, что он не мешает протеканию реакции, и его примеры включают тетрагидрофуран, 2-метилтетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан и толуол. Данные растворители можно использовать отдельно или в виде смеси.
Соединение (IV), полученное, как описано выше, может быть подвергнуто последующей стадии с или без выделения и очистки общеизвестными способами выделения и очистки, такими как концентрирование, концентрирование при пониженном давлении, кристаллизация, экстракция растворителем, переосаждение и хроматография.
(Стадия 2)
Данная стадия представляет собой способ получения соединения (VI) реакцией сочетания соединения (IV) и соединения (V). Примеры соединения (V) для использования на данной стадии (соединение (V-1) или соединение (V-2)) включают 1-трет-бутил-3-метил-1H-пиразол-5-амин, 1-трет-бутил-1H-пиразол-5-амин, 1-{[2-(триметилсилил)этокси]метил}-1H-пиразол-3-амин и 5-метил-1-{[2-(триметилсилил)этокси]метил}-1H-пиразол-3-амин. Соединение (V) можно получить в виде коммерческого продукта или получить согласно общеизвестному способу.
Количество соединения (V) для использования на данной стадии составляет 0,5-10 эквивалентов, предпочтительно 0,8-2 эквивалента на один эквивалент соединения (IV). Примеры катализатора для использования на данной стадии включают металлический катализатор, такой как трис(бензилиденацетон)дипалладий и ацетат палладия, и катализатор можно использовать в количестве 0,001-5 эквивалентов, предпочтительно 0,005-0,1 эквивалента на один эквивалент соединения (IV). Примеры лиганда приведенного выше металлического катализатора включают 4,5-бис(дифенилфосфино)-9,9-диметилксантен и 2,2'-бисдифенилфосфино-1,1'-бинафтил, и данные лиганды можно использовать в количестве 0,001-5 эквивалентов, предпочтительно 0,005-0,2 эквивалента на один эквивалент соединения (IV). Температура реакции составляет 0-200°C, предпочтительно от комнатной температуры до 130°C. Продолжительность реакции составляет 0,1-100 часов, предпочтительно 0,5-20 часов. Примеры основания включают неорганическое основание, такое как фосфат калия, карбонат натрия, карбонат калия, карбонат цезия и трет-бутоксид натрия, и органические амины, такие как триметиламин, диизопропилэтиламин и пиридин, и данные основания можно использовать в количестве 0,5-10 эквивалентов, предпочтительно 1-3 эквивалента. Растворитель для использования в данной реакции конкретно не ограничен, при условии, что он не препятствует протеканию реакции, и его примеры включают толуол, тетрагидрофуран, диоксан, N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидин-2-он, трет-бутанол и трет-амиловый спирт. Данные растворители можно использовать отдельно или в виде смеси.
Соединение (VI), полученное, как описано выше, может быть подвергнуто последующей стадии с или без выделения и очистки общеизвестными способами выделения и очистки, такими как концентрирование, концентрирование при пониженном давлении, кристаллизация, экстракция растворителем, переосаждение и хроматография.
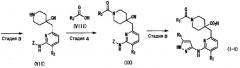
(Стадия 3)
Данная стадия представляет собой способ получения соединения (VII) удалением трет-бутоксикарбонильной группы, которая представляет собой защитную группу соединения (VI), в присутствии кислоты. Что касается условий реакции, применяемых на данной стадии, данную стадию можно осуществлять согласно способу, описанному в документе (Protective Groups in Organic Synthesis, written by T. W. Greene, John Wiley & Sons, Inc. (1981)), или способу, эквивалентному приведенному выше способу. Примеры кислоты для использования включают трифторуксусную кислоту, хлористоводородную кислоту, серную кислоту, метансульфоновую кислоту и толуолсульфоновую кислоту, и кислоту можно использовать в количестве 0,1-100 эквивалентов, предпочтительно 1-10 эквивалентов. Температура реакции составляет 0-200°C, предпочтительно от комнатной температуры до 100°C. Продолжительность реакции составляет 0,1-100 часов, предпочтительно 0,5-20 часов. Растворитель для использования в данной реакции конкретно не ограничен, при условии, что он не препятствует протеканию реакции, и его примеры включают хлороформ, ацетонитрил, толуол, тетрагидрофуран, диоксан, воду и уксусную кислоту. Данные растворители можно использовать отдельно или в виде смеси.
Соединение (VII), полученное, как описано выше, может быть подвергнуто последующей стадии с или без выделения и очистки общеизвестными способами выделения и очистки, такими как концентрирование, концентрирование при пониженном давлении, кристаллизация, экстракция растворителем, переосаждение и хроматография.
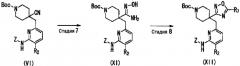
(Стадия 4)
Данная стадия представляет собой реакцию получения соединения (IX) реакцией конденсации с дегидратацией между соединением (VII) и соединением (VIII). Примеры соединения (VIII) для использования на данной стадии включают 2-фтор-3-хлорбензойную кислоту и 2,3-дихлорбензойную кислоту. Соединение (VIII) может быть получено в виде коммерческого продукта или получено согласно общеизвестному способу. На данной стадии, используя широко применяемый конденсирующий агент, соединение (IX) может быть получено согласно общеизвестному способу. Примеры конденсирующего агента включают N,N'-дициклогексилкарбодиимид (DCC), N,N'-диизопропилкарбодиимид (DIC), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (WSC), дифенилфосфорилазид (DPPA), гексафторфосфат (бензотриазол-1-илокси)трисдиметиламинофосфония (BOP), гексафторфосфат (бензотриазол-1-илокси)трипирролидинфосфония (PyBOP), фосфат (7-азабензотриазол-1-илокси)триспирролидинфосфония (PyAOP), гексафторфосфат бромтриспирролидинфосфония (BroP), гексафторфосфат хлортрис(пирролидин-1-ил)фосфония (PyCroP), 3-(диэтоксифосфорилокси)-1,2,3-бензотриазин-4(3H)-он (DEPBT), гексафторфосфат O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU) и гидрохлорид 4-(5,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолина (DMTMM). Примеры добавки для использования на данной стадии включают 1-гидроксибензотриазол (HOBt), 1-гидрокси-7-азабензотриазол (HOAt) и N-гидроксисукцинимид (HOSu). Данные добавки можно использовать в количестве 0,1-100 эквивалентов, предпочтительно 1-10 эквивалентов. При желании, основание, такое как триметиламин, триэтиламин, трипропиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 4-(N,N-диметиламино)пиридин, лутидин и коллидин, можно использовать в количестве 0,1-100 эквивалентов, предпочтительно 1-10 эквивалентов. Растворитель конкретно не ограничен и можно использовать, например, воду, метанол, этанол, 2-пропанол, тетрагидрофуран, 1,4-диоксан, толуол, метиленхлорид, хлороформ, ацетонитрил, N,N-диметилформамид и N,N-диметилацетамид, диметилсульфоксид. Температура реакции составляет от -30 до 200°C, предпочтительно 0-50°C. Продолжительность реакции составляет 0,1-100 часов, предпочтительно 0,5-24 часов.
Соединение (IX), полученное, как описано выше, может быть подвергнуто последующей стадии с или без выделения и очистки общеизвестными способами выделения и очистки, такой как концентрирование, концентрирование при пониженном давлении, кристаллизация, экстракция растворителем, переосаждение и хроматография.
(Стадия 5)
Данная стадия представляет собой способ получения соединения (I-1) одновременным проведением гидролиза цианогруппы соединения (IX) и удалением защитной группы (P) заместителя Z в кислых условиях. Примеры кислоты для использования включают хлористоводородную кислоту, серную кислоту, метансульфоновую кислоту, толуолсульфоновую кислоту и трифторуксусную кислоту. Данные кислоты можно использовать в количестве 0,1-100 эквивалентов, предпочтительно 1-10 эквивалентов. Температура реакции составляет от комнатной температуры до 200°C, предпочтительно 60-130°C. Продолжительность реакции составляет 0,1-100 часов, предпочтительно 0,5-20 часов. Растворитель для использования в данной реакции конкретно не ограничен, при условии, что он не препятствует протеканию реакции, и его примеры включают диоксан, воду, уксусную кислоту, толуол, тетрагидрофуран и 2-пропанол. Данные растворители можно использовать отдельно или в виде смеси. Соединение (I-1), полученное, как описано выше, можно выделить и очистить общеизвестными способами выделения и очистки, такими как концентрирование, концентрирование при пониженном давлении, кристаллизация, экстракция растворителем, переосаждение и хроматография.
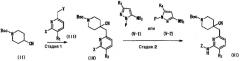
Среди соединений общей формулы (I), соединение (I-2), в котором R1 представляет собой -C(=O)NR5R6, может быть получено, например, следующим способом получения 2.
Способ получения 2
где R2, R3, R4, R5 и R6 являются такими, как указано выше.
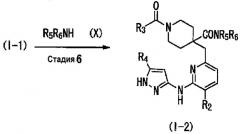
(Стадия 6)
Данная стадия представляет собой способ получения соединения (I-2) реакцией конденсации с дегидратацией между соединением (I-1), полученным способом получения 1, и соединением (X). Примеры соединения (X) для использования на данной стадии включают амин, такой как метиламин, диметиламин, хлорид аммония, циклопропиламин и пирролидин, а также их соли. Соединение (X) может быть получено в виде коммерческого продукта или получено согласно общеизвестному способу. На данной стадии, используя широко применяемый конденсирующий агент, соединение (I-2) может быть получено согласно общеизвестному способу. Примеры конденсирующего агента включают N,N'-дициклогексилкарбодиимид (DCC), N,N'-диизопропилкарбодиимид (DIC), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (WSC), дифенилфосфорилазид (DPPA), гексафторфосфат (бензотриазол-1-илокси)трисдиметиламинофосфония (BOP), гексафторфосфат (бензотриазол-1-илокси)трипирролидинфосфония (PyBOP), фосфат (7-азабензотриазол-1-илокси)триспирролидинфосфония (PyAOP), гексафторфосфат бромтриспирролидинфосфония (BroP), гексафторфосфат хлортрис(пирролидин-1-ил)фосфония (PyCroP), 3-(диэтоксифосфорилокси)-1,2,3-бензотриазин-4(3H)-он (DEPBT), гексафторфосфат O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU) и гидрохлорид 4-(5,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолина (DMTMM). Примеры добавки для использования на данной стадии включают 1-гидроксибензотриазол (HOBt), 1-гидрокси-7-азабензотриазол (HOAt), и N-гидроксисукцинимид (HOSu). Данные добавки можно использовать в количестве 0,1-100 эквивалентов, предпочтительно 1-10 эквивалентов. При желании, можно использовать основание, такое как триметиламин, триэтиламин, трипропиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 4-(N,N-диметиламино)пиридин, лутидин и коллидин, в количестве 0,1-100 эквивалентов, предпочтительно 1-10 эквивалентов. Рас