Терапевтическое применение новых фармацевтических препаратов, содержащих противоопухолевые лекарственные средства, связанные с гиалуроновой кислотой, в лечении неоплазий
Иллюстрации
Показать всеГруппа изобретений относится к химико-фармацевтической промышленности, а именно к биоконъюгатам для изготовления агента для лечения опухолевых патологий, состоящим из гиалуроновой кислоты, имеющей молекулярную массу в диапазоне от 30000 до 0,5×106 Да, ковалентно связанной через спейсер, выбранный из бромбутанола или бромпропанола и который образует сложноэфирную связь с гиалуроновой кислотой, с противоопухолевым лекарственным средством, которое представляет собой доксорубицин, со степенью замещения доксорубицина по карбоксильной группе гиалуроновой кислоты от 3 до 20%, и к фармацевтическим композициям, содержащим указанные биоконъюгаты. Группа изобретений обеспечивает повышение цитотоксической активности против опухолевых клеток. 4 н. и 10 з.п. ф-лы, 15 пр., 15 ил.
Реферат
Задача изобретения
В настоящем изобретении описано новое применение в области онкологии биоконъюгатов, полученных путем конъюгации между гиалуроновой кислотой (НА) и химиотерапевтическим продуктом (идентифицируемым далее под товарным знаком ONCOFID®), среди которых, в частности, можно привести иринотекан, доксорубицин, паклитаксел, цис-платин и 5-фторурацил (5-FU), в качестве агентов дифференцировки для лечения первичных опухолей и метастаза. В частности, биологическое поведение описано в отношении механизма действия, эффективности и устойчивости фармацевтических препаратов производного ONCOFID®, растворимого в воде.
Более конкретно, изобретение относится к неожиданному биологическому и фармакологическому действию, продемонстрированному препаратами, основанными на ONCOFID-S (конъюгаты HA-SN38) и ONCOFID-D (конъюгаты НА-Доксорубицин), способствующему дифференцировке опухолевых клеток в направлении нетрансформированного фенотипа, по сравнению с референсным лекарственным средством иринотеканом (или СРТ11, активная форма которого представлена SN38) и доксорубицином.
Область изобретения
В течение нескольких последних лет все более растущее понимание жизненных процессов, которые определяют начало, развитие, распространение и имплантацию опухоли и ее метастазов, не только обеспечило исследователей возможностью изучения, синтеза и/или тестирования новых химических молекул в качестве новых противоопухолевых агентов, но также облегчило исследование и совершенствование новых способов терапии, которые позволяют преодолеть проблемы, связанные с токсичностью противоопухолевых лекарственных средств. Многочисленные лекарственные средства, обладающие противоопухолевой активностью, фактически, как правило, имеют ряд отрицательных свойств, таких как:
- низкая растворимость в воде, поскольку множество молекул представляют собой гидрофобные вещества, которые трудно вводить;
- низкая селективность в отношении опухолевых клеток и, как следствие, токсичность в отношении неканцерогенных клеток;
- множество нежелательных эффектов на системном уровне;
- малый период полувыведения из плазмы крови с сопутствующей необходимостью повторных введений;
- индукция резистентности к химиотерапевтическому лечению опухоли.
В дополнение к поиску все более эффективных новых активных действующих компонентов в терапии опухоли наука параллельно пытается использовать все возможные молекулы, антибластическая активность которых уже известна, улучшая их эффективность и пытаясь уменьшить отрицательные свойства, описанные выше.
Одна из наиболее широко используемых стратегий уменьшения собственной токсичности противоопухолевых лекарственных средств связана с возможностью направления активного действующего начала непосредственно и избирательно в отношении опухолевой клетки.
Предложен многообещающий подход путем химической конъюгации противоопухолевого лекарственного средства с группами, обеспечивающими активное нацеливание, которое путем специфического взаимодействия с рецепторными областями опухолевой клетки гарантирует высокую селективность лекарственного средства в опухолевых тканях. Отличающийся подход представляет собой связывание с макромолекулами (т.е. полимерами), которые путем обеспечения высокой молекулярной массы обеспечивают большую аккумуляцию активного действующего начала в новообразованиях благодаря эффекту EPR (увеличенная проницаемость и задержка), т.е. аккумуляцию, связанную с проникновением через имеющий нарушение целостности эпителий сосудов, которые питают опухоль (пассивное нацеливание) с неадекватным отведением лимфатической системой.
По прошествии многих лет множество противоопухолевых лекарственных средств, используемых в области онкологии, были химически модифицированы с получением пролекарств, терапевтически неактивные производные которых обладают активностью только in vivo благодаря процессам спонтанного гидролиза и/или ферментативных разрушений, которые приводят к высвобождению активного действующего начала, таким образом увеличивая его терапевтическую эффективность.
Растворимость химиотерапевтических лекарственных средств в системе кровообращения представляет собой существенное условие для их фармакологического действия. Фактически, некоторые лекарственные средства, которые, как оказалось, являются чрезвычайно активными в различных типах опухолей, такие как, например камптотецины, паклитаксел и алкалоиды, являющиеся производными барвинка, ввиду их низкой растворимости создают проблемы при их внутривенном введении (а для гормонов и антигормонов также при внутримышечном), которые могут лимитировать и ограничить их клиническое применение.
Ввиду вышеприведенных причин синтезировали новые химиотерапевтические лекарственные средства, которые созданы путем химического связывания (прямого или опосредованного при помощи вставки) между классическим лекарственным средством и так называемыми терапевтическими полимерами, которые, кроме того, что придают важные физико-химические свойства активному действующему началу (такие как большая растворимость), способны обеспечить ему активное и/или пассивное нацеливание, увеличивая его эффективность. Эти терапевтические полимеры фактически могут действовать в качестве носителя лекарственного средства или они также могут демонстрировать собственную биологическую активность.
Среди этих полимеров, как оказалось, весьма многообещающим является применение гиалуроновой кислоты (НА), чьи благоприятные свойства делают ее подходящим носителем для введения противоопухолевых агентов.
Новые биоконъюгаты НА и противоопухолевых лекарственных средств, идентифицированные под товарным знаком ONCOFID, известные в области техники (WO 2004/035629 и WO 2007/014784), обладают следующими свойствами:
- позволяют преодолеть проблему, связанную с собственной токсичностью лекарственного средства, поскольку непосредственно нацелены на опухолевую,клетку, так как множество опухолевых фенотипов сверхэкспрессируют на своей поверхности рецептор CD-44, специфический для НА;
- увеличивают растворимость, поскольку продемонстрировано, что связывание липорастворимых лекарственных средств с сильногидрофильными молекулами, такими как НА, значительно увеличивает растворимость самого лекарственного средства в кровеносной системе;
- позволяют преодолеть проблему резистентности, вызванной классическими противоопухолевыми лекарственного средствами;
- обладают новыми физико-химическими свойствами (такими как, например, увеличение стабильности лекарственного средства и, таким образом, увеличение его пребывания в области опухоли).
SN-38 представляет собой активный метаболит иринотекана, являющегося фармакологическим производным камптотецина, применение которого относится к лечению различных типов опухолей, таких как меланомы, рак молочной железы, опухоли яичников, желудка, легкого, головного мозга, поджелудочной железы и колоректальный рак. Это лекарственное средство обладает высокой противоопухолевой активностью, но не может быть введено самостоятельно, так как оно нерастворимо в воде и по этой причине химически конъюгировано с НА.
Колоректальные опухоли представляют собой одни из наиболее агрессивных форм опухоли и представляют собой одну из наиболее частых причин смерти вследствие новообразования в западных странах.
Формирование рака в толстой и прямой кишке обусловлено неконтролируемым делением клеток слизистой оболочки, которая выстилает этот орган, причем его этиология до сих пор не известна даже в том случае, если эпидемиологические исследования идентифицировали возможные факторы риска, такие как:
- особенности питания,
- генетические факторы,
- опухолевые полипы,
- интестинальные воспалительные заболевания.
Известно, что один из прогностических биологических факторов карциномы и аденомы толстой и прямой кишки представляет собой ген АРС (аденоматозный полипоз толстой кишки). Будучи ответственными за семейный полипоз толстой кишки, соматические мутации этого гена представляют первый случай в естественной истории аденом и карцином в толстой кишке.
В нормальных условиях (в отсутствие опухолей) ген АРС локализован на хромосоме 5 и кодирует цитоплазматический белок (АРС белок), который играет ключевую роль в регуляции апоптоза в клеточном цикле, межклеточном взаимодействии и адгезии, процессах миграции дополнительно к метастазированию опухолей. Наиболее хорошо известная функция белка АРС представляет собой его ассоциацию с белком GSK-3β (белок гликоген-синтетазы киназы 3β) для регуляции, количества свободного β-катенина, представленного в цитоплазме, и следовательно, в ядре: фактически, вышеупомянутые белки путем фосфорилирования свободного β-катенина на цитоплазматическом уровне способствуют его деградации. β-Катенин представляет собой белок, способный связываться с цитоплазматическим доменом мембранного белка Е-кадгерина, вовлеченного в процесс клеточной адгезии. Деструкция внутриклеточного комплекса Е-кадгерин-β-катенин (явление, связанное с превращением неопухолевой клетки в опухолевую клетку) приводит к утрате способности к межклеточной адгезии и таким образом способствует образованию метастазов. Имеется множество научных свидетельств, указывающих на то, как происходит этот процесс на первых стадиях и при развитии различных новообразований, например при раке молочной железы, раке кожи (в частности, меланомах), раке кости, раке головного мозга и щитовидной железы и при опухолях головы и шеи, опухолях лимфатической системы, раке легкого и раке мезотелия, пищевода, желудка, толстой кишки, толстой и прямой кишки, поджелудочной железы, печени, почек, мочеточников и мочевого пузыря, предстательной железы, эндометрия и яичников (со всеми другими органами брюшной полости). В соответствии с этим утверждением эксперименты, направленные на восстановление нормального синтеза/уровня Е-кадгерина в опухолевых клеточных линиях, продемонстрировали реверсию злокачественной опухолевой формы по сравнению с нетрансформированным фенотипом, таким образом больше не являющейся опухолевой (Birchmeier W. et al., Biochim Biophys Acta, 1994, 1198 (1); 11-26; De Vita V. et al., CANCER, 6th Edition, 2001, Chapters).
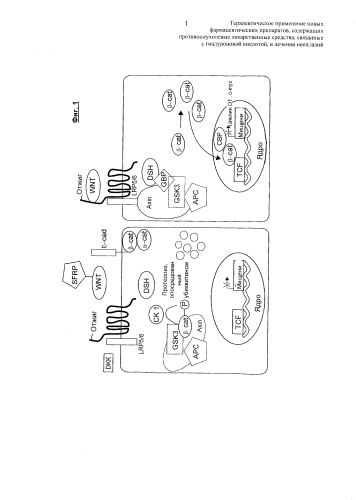
При множестве карцином мутация гена АРС приводит к образованию аномального неактивного белка АРС, не способного связываться с белком GSK-3β и таким образом регулировать β-катенин, который таким образом мигрирует из цитоплазмы в ядро, где он аккумулирует и образует комплексы с транскрипционными факторами (такими как Tcf-4), действуя в качестве коактиватора онкогенов активаторов роста и клеточной пролиферации (с-МУС, циклин 01) дополнительно к внеклеточным протеазам (ММР7), которые облегчают процессы инвазии и метастазы (см. фиг.1). На фиг.1 продемонстрирована схема β-катениновой регуляции в нормальной клетке (справа) и в опухолевой клетке (слева).
Таким образом, β-катенин обладает всем свойствами онкобелка, тогда как комплекс APC/GSK-3β благодаря его способности регулировать активность β-катенина определяют как онкосупрессор (Kollings F. et al, Digestion, 2002, 66: 131-144). Быстрая понижающая регуляция β-катенина, аккумулированного в ядре, фактически достигается благодаря действию белков АРС (немутированного) и GSK-3β, которые при движении в ядро связываются с онкобелком, разрушая его, и/или вновь транспортируют его в цитоплазму, где он фосфорилируется, а затем разрушается (Neufeld К. et al., EMBO reports, 2000, 1, 6: 519-523). Этот процесс отсутствует в опухолевых клетках, где комплекс APC/GSK-3β не активен, таким образом, отсутствие регуляции количества β-катенина в ядре и его активности представляют собой явления, имеющие первоочередную важность в развитии и метастазировании злокачественных новообразований.
Химиотерапия имеет фундаментальную роль в лечении опухолей. При лечении пациентов, пораженных карциномами толстой и прямой кишки, в фазе метастазирования общепринятыми являются различные терапевтические процедуры: системная химиотерапия, местно-регионарная химиотерапия, аблативные виды терапии и хирургическое вмешательство.
Химиотерапевтическое лечение представляет собой основу терапевтических возможностей, доступных для этой группы пациентов. Объективная процентная доля ответа, полученная с использованием химиотерапии, составляет 20% для ответа краткосрочного действия и низкая процентная доза полных ответов (только 5%); стабилизации заболевания составляют приблизительно 30-40%.
На протяжении 40 лет 5-фторурацил (5-FU) представлял собой единственное терапевтическое оружие, доступное при карциномах толстой и прямой кишки в прогрессирующей фазе.
В последние годы исследованы новые лекарственного средства, связанные с 5-FU или без него, в попытке улучшить выживание пациентов, пораженных метастазирующими аденомами и карциномами толстой и прямой кишки. Среди них иринотекан и оксалиплатин играют фундаментальную роль. Недавно продемонстрировано, что иринотекан, связанный с 5-FU, обладает большей процентной долей объективного ответа и временем прогресса у пациентов по сравнению с пациентами, которых лечат только 5-FU, с общим выживанием приблизительно 17 месяцев.
Иринотекан, также известный как СРТ-11, имеется в форме гидрохлорида и действует путем образования трехкомпонентного комплекса лекарственное средство-ДНК-топоизомераза I, представляющего собой фермент, который превращает суперспирализованную молекулу ДНК в молекулу без напряжения кручения в процессах транскрипции или репликации ДНК. Образование трехкомпонентного комплекса с вышеуказанным камптотецином создает стабилизацию в системе в фазе развертывания ДНК и приводит к тому, что клетка больше не способна делиться, что вызывает смерть путем апоптоза.
Иринотекан сам является неактивным, но гидролиз in vivo карбаминовой связи приводит к высвобождению активного метаболита SN38 (фиг.2), который представляет собой настоящее лекарственное средство, ответственное за цитотоксическое действие, но которое, будучи нерастворимым в воде, требует конкретных дополнительных средств для его введения. На фиг.2 продемонстрирована химическая структура Irinotecan® и SN38 соответственно.
В настоящем изобретении заявитель описывает новое биологическое и фармакологическое поведение конъюгатов - НА-противоопухолевые лекарственные средства, идентифицированных под товарным знаком ONCOFID®, описанных в WO 2004/035629 и WO 2007/014784, поскольку оно значительно отличается от действия, продемонстрированного неконъюгированными референсными лекарственными средствами в том, что включает новые терапевтические и фармакодинамические свойства.
Таким образом, в настоящем изобретении описано и заявлено удивительное и неожиданное биологическое и фармакологическое действие, полученное для препаратов, основанных на ONCOFID®, способствующее антипролиферативному терапевтическому действию (таким образом противоопухолевому) благодаря дифференцировке/реверсированию опухолевых клеток в направлении нетрансформированного фенотипа, а не в направлении индукции апоптоза.
Подробное описание изобретения
Известно, что производные ONCOFID®, как указано ранее, придают противоопухолевым лекарственным средствам благоприятные свойства, такие как растворимость в воде, стабильность, селективность в отношении опухолевых тканей, уменьшение резистентности к химиотерапии и усиление фармакологической эффективности.
Известно, что одна из наиболее широко распространенных смертельных опухолей представлена карциномами или аденомами толстой и прямой кишки, и что один из наиболее эффективных способов терапии при лечении этого новообразования представляет собой способ, основанный на внутрибрюшинном введении СРТ-11. Как указано выше, известно, что при этом типе опухоли мутация/инактивация гена АРС приводит к серии событий, которые ведут к ядерной аккумуляции β-катенина и, следовательно, активации транскрипционных факторов, которые облегчают клеточную инвазию и метастазы.
В настоящем изобретении описано и заявлено новое терапевтическое применение в области онкологии новых композиций, основанных на ONCOFID®, в частности ONCOFID-S, представленных биоконъюгатом HA-SN38, и ONCOFID-D, представленных биоконъюгатом НА-доксорубицин.
Композиции, основанные на ONCOFID-S и ONCOFID-D, содержащие определенные концентрации вышеприведенных биоконъюгатов, фактически приводят к удивительным и совершенно неожиданным результатам в лечении опухолей толстой и прямой кишки и меланом in vitro и in vivo, обладая отличным механизмом действия, чем у неконъюгированного лекарственного средства, таким образом, обеспечивая возможность для отличающегося применения биоконъюгата, поскольку он особенно эффективен в дозах, отличающихся от доз, которые в настоящее время рассматриваются как терапевтически активные.
Оценка эффектов в отношении клеточной пролиферации, указанная в Примере 10, неожиданно выявила, как ONCOFID® вызывает механизм блокировки клеточной пролиферации, приписываемый к дифференцирующему эффекту опухолевой клетки, которая, таким образом, претерпевает процесс реверсирования фенотипа злокачественной опухолевой клетки в направлении нетрансформированного фенотипа, т.е. неопухолевого, при помощи: активации белкового комплекса APC/GSK-3β для уменьшения ядерной аккумуляции β-катенина; и для регуляции процессов, связанных с действием β-катенина и Е-кадгерина, таким образом повторного установления способности к клеточной адгезии и контактного ингибирования, особенно нетрансформированной дифференцированной клетки, следовательно, не вызывая смерть опухолевой клетки путем апоптоза (как известно, в противоположность для SN38). В конце своего клеточного цикла вышеприведенные клетки погибают, не вызывая образование новых метастазов и не внося вклад в рост первичной опухоли.
Кроме того, в последующих экспериментах заявитель продемонстрировал, как конъюгаты ONCOFID способны радикально модифицировать различные жизненные фазы опухолевой клетки путем того, что вызывают резкую остановку фазы 1 (определенную как разрыв 1) и фазы S, увеличивая фазу 2 (определенную как разрыв 2), в которой клетка "остается блокированной". Этот результат доказывает, что конъюгаты ONCOFID способны модулировать все жизненные фазы опухолевых клеток (где фаза S синтеза ДНК клеточного цикла значительно увеличена), приводя их к дифференцировке и блокированию фаз синтеза новых ДНК, таким образом активной клеточной пролиферации. Затем достигается блокирование процесса роста первичной опухоли и процесса метастазирования.
В конце экспериментальных тестов, Пример 13, ясно продемонстрирована наибольшая противоопухолевая эффективность in vivo конъюгатов ONCOFID-S по сравнению с неконъюгированным лекарственным средством, вводимым в той же самой дозе.
Как представлено в результатах, применение данного лекарственного средства в качестве новой фармакологической терапии новообразований является возможным, поскольку конъюгат HA-SN38 вызывает значительное уменьшение системной токсичности SN38, таким образом увеличивая терапевтический индекс самого лекарственного средства, поскольку оно растворимо в воде и более эффективно при гораздо меньших дозах по сравнению с обычно используемыми в клинических протоколах.
В настоящем изобретении раскрыто и заявлено применение биоконъюгатов, состоящих из гиалуроновой кислоты, связанной с противоопухолевыми лекарственными средствами:
- для изготовления агента, дифференцирующего опухолевую клетку в направлении нетрансформированного неопухолевого фенотипа для лечения опухолевых патологий;
- для изготовления лекарственного средства для лечения опухолевых патологий, связанных с ядерной аккумуляцией β-катенина;
- для изготовления лекарственного средства для лечения опухолевых патологий, связанных с инактивацией комплекса APC-GSK-3β;
- для изготовления лекарственного средства для лечения опухолевых патологий, связанных с увеличением S фазы опухолевого клеточного цикла;
- для изготовления лекарственного средства для лечения первичной опухоли или ее метастаза.
Примеры таких опухолевых патологий, связанных соответственно с ядерной аккумуляцией β-катенина, инактивацией комплекса APC-GSK-3β и увеличением S фазы опухолевого клеточного цикла, представляют собой: опухоли молочной железы, кожи (и, в частности, меланому), костей, головного мозга, щитовидной железы, головы и шеи, опухоли лимфатической системы, легких и мезотелия, рак пищевода, желудка, толстой кишки, толстой и прямой кишки, поджелудочной железы, печени, почек, мочеточников и мочевого пузыря, предстательной железы, эндометрия и яичников (со всеми другими органами брюшной полости).
Вышеуказанное лекарственное средство может быть введено системно (внутривенно или внутриартериально, внутримышечно, внутрибрюшинно, внутрь лимфатической системы, подкожно или перорально), внутриоболочечно, оно может быть использовано для местного применения (с трансдермальной абсорбцией или путем эндотрахеального закапывания) или может быть введено непосредственно в область опухоли путем прямой инъекции (местно-регионарного лечения).
В следующих примерах заявитель продемонстрировал как приготовление конъюгатов НА с противоопухолевыми лекарственными средствами, такими как SN38 (ONCOFID-S) и доксорубицин (ONCOFID-D), со степенью дериватизации от 1 до 20% масс./масс., позволяет получить производные ONCOFID, которые являются растворимыми и эффективными в водных растворах в концентрации от 2 до 15 мг/мл.
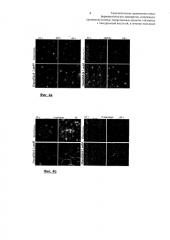
В частности, заявитель продемонстрировал при помощи экспериментальных исследований in vitro, проведенных с использованием опухолевых клеточных линий аденокарциномы толстой кишки и человеческой меланомы (необходимых для понимания механизма действия), совершенно неожиданное биологическое и фармакологическое поведение вышеприведенных биоконъюгатов. На основе этих данных можно сделать заключение, что блокирование клеточной пролиферации осуществляется посредством механизма, отличающегося от апоптотического действия референсного лекарственного средства, таким образом делая ONCOFID® лекарственным средством, обладающим новой терапевтической активностью и гораздо большей эффективностью, полученной для различных доз, для лечения новообразований, таких как опухоли молочной железы, кожи (и, в частности, меланома), костей, головного мозга, щитовидной железы и головы и шеи, опухоли лимфатической системы, легких и мезотелия, пищевода, желудка, толстой кишки, толстой и прямой кишки, поджелудочной железы, печени, почек, мочеточников и мочевого пузыря, предстательной железы, эндометрия и яичников (со всеми другими органами брюшной полости). Для демонстрации этого заявитель привел результаты исследований ex-vivo, полученных на эксплантированных тканях после введения in vivo конъюгатов, и результаты исследований in vivo, которые выявили удивительную способность ONCOFID® ингибировать опухоль.
ONCOFID® (как описано ранее) определяет новую группу биоконъюгатов, основанных на гиалуроновой кислоте (НА) и противоопухолевых лекарственных средствах, ковалентно связанных через спейсер, которая включает:
- антиметаболиты, такие как, например, аналоги фолиевой кислоты (например, метотрексат), аналоги пиримидина (например, 5-фторурацил и 1-β-D-арабино-фуранозил-цитозин (Ara-С));
- алкалоиды/природные продукты, такие как, например, винкристин и винбластин (алкалоиды барвинка), активный метаболит иринотекана: SN38, таксаны, такие как паклитаксел и доцетаксел;
- антибиотики и аналогичные продукты, такие как, например, доксорубицин и эпирубицин;
- модификаторы биологического ответа;
- дитерпеноиды;
- алкилирующие агенты, например нитрозомочевины;
- координационные комплексы платины, такие как, например, карбоплатин и цисплатин;
- синтетические гормоны и антигормоны, такие как, например, эстрадиол.
Для задач настоящего изобретения особенно подходят доксорубицин, паклитаксел и метаболит иринотекана SN38.
Гиалуроновая кислота, используемая в настоящем изобретении, имеет молекулярную массу, варьирующую от 400 до 3000000 Да, предпочтительно от 5000 до 1000000 Да, и еще более предпочтительно от 30000 до 500000 Да; она может быть экстрактивного, ферментативного или биосинтетического происхождения. Ковалентная связь со спейсером включает карбоциклическую группу D-глюкуроновой кислоты повторяющейся единицы полимера, в процентном содержании, варьирующем от 1 до 100% (степень замещения), которая образует сложноэфирную или амидную связь с функциональной группой выбранного молекулярного спейсера, который, таким образом, действует как спейсер между гиалуроновой кислотой и химиотерапевтическим лекарственным средством. Спейсерный агент состоит из алифатической, аралифатической, алициклической или гетероциклической цепи, линейной или разветвленной, с гетероатомами или без них, который включает гидроксильные, карбоксильные, карбонильные группы, аминогруппы (за исключением гидразидов и полипептидов), эпоксигруппы, хлорангидриды, тиолы, нитрилы, галогены, ангидриды, изоцианаты и изотиоцианаты; причем предпочтительны бромиды, йодиды и хлориды карбоновых кислот с С2-С10алифатической цепью, и, в частности, бромиды, такие как бромпропионовая кислота, броммасляная кислота, бромбутанол или бромпропанол. Степень замещения предпочтительно находится в диапазоне от 1 до 50% масс./масс. и еще более предпочтительно от 1 до 25%; для конъюгации с доксорубицином предпочтительно замещение от 3 до 20%, тогда как для SN38 от 1 до 15% масс./масс.
В частности, ONCOFID-P представляет собой конъюгат между НА и паклитакселем, ONCOFID-S представляет собой конъюгат между НА и SN38, ONCOFID-D представляет собой конъюгат между НА и доксорубицином, и ONCOFID-Pt представляет собой конъюгат между НА и цисплатином.
Более конкретно, ONCOFID-S представляет собой сложноэфирное производное НА (имеющее молекулярную массу 200 кДа) и SN38, ранее связанное со спейсером с четырьмя атомами углерода, таким как броммасляная кислота. Степень замещения может варьировать от 1 до 15% на основе мольного отношения, используемого для фаз синтеза.
Синтез ONCOFID-S хорошо описан в подробном описании и в примерах 1-2 патентной заявки РСТ WO 2007/014784.
ONCOFID-D представляет сложный эфир гиалуроновой кислоты со спейсером, такой как бромбутанол или бромпропанол, в свою очередь связанный с доксорубицином путем карбаминовой связи. Синтез ONCOFID-D также хорошо описан в подробном описании и в Примере 10 патентной заявки РСТ WO 2007/014784.
ONCOFID-P ранее был подробно описан в патентной заявке РСТ №WO 2004/035629.
Наконец, заявитель описывает изготовление различных водных фармацевтических композиций, в которых данные биоконъюгаты, как оказалось, являются особенно хорошо растворимыми (т.е. в присутствии β-циклодекстрина, глюкозы или липосом), но главным образом композиций, которые дают возможность для введения активных действующих начал в терапевтически активных дозах без проблем, связанных с биодоступностью/растворимостью рассматриваемых лекарственных средств, таким образом, внося вклад посредством новых химических/физических/терапевтических свойств, описанных выше и продемонстрированных ниже, в увеличение эффективности.
Некоторые примеры изготовления композиций ONCOFID приведены ниже для чисто иллюстративных и не ограничивающих объем изобретения задач вместе с некоторыми примерами исследований in vitro, ex vivo и in vivo, которые демонстрируют конкретное биологическое поведение описанных выше конъюгатов.
Пример 1. Получение эфирного производного гиалуроновой кислоты с ММ (молекулярной массой) 200 кДа и SN-38 со степенью замещения 8%
Первая фаза: 500 мг SN-38 растворяют в DMF (диметилформамид). Затем добавляют 0,8866 г EDC (1-этил-3-[3-диметиламинопропил]карбодиимид гидрохлорид), 0,7011 4-броммасляной кислоты и наконец 0,1163 г DMAP (диметиламинопиридина).
Взаимодействие контролируют при помощи TLC (тонкослойной хроматографии) (силикагель 60 F254) с использованием смеси СНCl3/СН3СN 60/40.
Приблизительно через 1 ч считают, что взаимодействие завершено, и добавляют 10 мл метанола, и смесь перемешивают в течение приблизительно 30 мин. Продукт затем осаждают в воде, фильтруют, добавляют к СНСl3 и промывают Н2O, слегка подкисленной HCl (рН приблизительно 4), при помощи делительной воронки.
Высушенные органические фазы позволяют получить желтоватый продукт, который очищают в гравитационной хроматографической колонке и элюируют градиентом от СНСl3 100% до СНCl3/СН3ОН 95:5.
Выделенный BrC4SN38 сушат в роторном испарителе и оставляют сушиться на ночь.
Вторая фаза: 1,4347 г НАТВА (200 кДа) (тетраалкиламмониевую или тетрабутиламмониевую соль гиалуроновой кислоты) загружают в трехгорлый стеклянный реактор, оснащенный рубашкой и магнитной мешалкой, и растворяют в 100 мл DMSO (диметилсульфоксид); смесь перемешивают до полного растворения, реактор термостатируют при 38°С.
380 мг промежуточного соединения BrC4SN38, растворенного в DMSO, добавляют к раствору НАТВА, и смесь оставляют перемешиваться в течение приблизительно 48 часов при 38°С.
В конце взаимодействия добавляют 14 мл насыщенного раствора NaBr, и смесь перемешивают в течение приблизительно 60 минут до полного обмена катионов TBA-Na и получения натрий-НА. Затем осуществляют осаждение этанолом; полученное твердое вещество выделяют путем фильтрования на Gooch 4 и переносят в стакан для последовательных промываний этанолом и наконец сушат в вакууме при 40°С.
Пример 2. Получение эфирного производного гиалуроновой кислоты с ММ 200 кДа и SN-38 со степенью замещения приблизительно 3,5%
Первая фаза: 199 мг SN-38 растворяют в 100 мл ACN (ацетонитрила) и к раствору добавляют 383 мг 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC), 258 мг 4-броммаслянной кислоты и 60 мг DMAP. Состояние в растворе контролируют при помощи TLC (неподвижная фаза диоксида кремния с флуоресцентным индикатором и элюентом хлороформ-ацетонитрил 60:40). Продукт выделяют путем удаления растворителя в вакуумном испарителе и очищают путем хроматографии на колонке диоксида кремния. Получающееся таким образом промежуточное соединение сушат при комнатной температуре в высоком вакууме и наконец взвешивают.
Вторая фаза: 160 мг промежуточного соединения BrC4SN38 растворяют в 20 мл NMP и затем добавляют к раствору НАТВА 1,2 г в 120 мл NMP, ранее термостатируемому при 38°С. Смесь оставляют при 38°С на 72 ч и затем разбавляют 5 мл воды и 8 мл насыщенного раствора бромида натрия. Смесь полностью оставляют перемешиваться в течение 1 часа для того, чтобы обеспечить замену натрия на ион ТВА. Продукт затем осаждают путем добавления по каплям этанола и наконец очищают путем отмываний в этаноле и сушат в вакууме при 40°С.
Пример 3. Получение эфирного производного гиалуроновой кислоты с ММ 200 кДа и доксорубицином со степенью замещения приблизительно 10%
Первая фаза: 770 мг гидрохлорида доксорубицина взвешивают и растворяют в 120 мл безводного DMF в присутствии 770 мкл триэтиламина, затем добавляют 560 мг 3-бромбутанола, ранее активированного N-гидроксисукцинимидом. Взаимодействие контролируют при помощи TLC (неподвижная фаза диоксида кремния с флуоресцентным индикатором и элюентом хлороформ-этанол 80:20), и считают, что оно завершено через 15 минут. Продукт осаждают в деминерализованной воде и выделяют путем фильтрования на Gooch 5. Твердый остаток добавляют к СНСl3, промывают Н2О, слегка подкисленной НСl (рН приблизительно 4), при помощи делительной воронки.
Высушенные органические фазы позволяют получить темно-красный продукт, который наносят в гравитационную хроматографическую колонку и элюируют градиентом от СНСl3 100% до СНСl3/СН3СН2OН 95:5 для очистки.
Выделенное промежуточное соединение BrC30Dox сушат в роторном испарителе и оставляют сушиться в течение ночи.
Вторая фаза: 964 мг НАТВА (200 кДа) загружают в трехгорлый стеклянный реактор, оборудованный рубашкой и магнитной мешалкой, и растворяют в 100 мл DMSO; смесь перемешивают до полного растворения, реактор термостатируют при 38°С.
550,5 мг промежуточного соединения BrC30Doxo, растворенного в DMSO, добавляют к раствору НАТВА; взаимодействие поддерживают при перемешивании в течение приблизительно 48 часов при 38°С.
В конце взаимодействия по каплям добавляют 8 мл насыщенного раствора NaBr, и смесь перемешивают в течение приблизительно 30 минут до полного обмена катионов TBA-Na и получения натрий-НА. Затем осуществляют осаждение этанолом; полученное твердое вещество выделяют путем фильтрования на Gooch 4 и переносят в стакан для последовательных промываний этанолом, и наконец сушат в вакууме при 40°С.
Пример 4
Получение эфирного производного гиалуроновой кислоты с ММ 200 кДа и платинового соединения со степенью замещения приблизительно 12%
200 мг цис-диамино(дихлор)платины (II) (0,666 ммоль) растворяют в 20 мл деминерализованной воды и приводят во взаимодействие в течение 6 ч при 60°С с двумя эквивалентами AgNO3 для превращения в диамин(динитрат)платину (II). Затем добавляют 140 мг бромянтарной кислоты (0,7 ммоль), и реакцию обмена лигандами осуществляют при 60°С в течение 24 ч. На фиг.3 представлена схема синтеза промежуточного соединения бромсукцинатдиаминоплатины. Промежуточное соединение синтеза осаждают и очищают для последующего взаимодействия с гиалуроновой кислотой.
240 мг Бромсукцинатдиаминоплатины (II) растворяют в 20 мл DMSO и медленно добавляют к раствору тетрабутиламмониевой соли гиалуроновой кислоты (НАТВА) в DMSO (1,750 г в 150 мл). Взаимодействие осуществляют при 38°С в течение 48 ч, после чего добавляют 14 мл насыщенного раствора NaBr при перемешивании в течение приблизительно 60 минут для полного обмена катионов TBA-Na и получения натрий-НА. Затем осуществляют осаждение этанолом; полученное твердое вещество выделяют путем фильтрования на Gooch 4 и промывают этанолом и наконец сушат в вакууме при 40°С. Содержание платины в конъюгате определяют при помощи способа ICP (индуктивно-связанной плазмы).
Пример 5. Изготовление раствора, основанного на ONCOFID-Pt, в глюкозатном растворе при 5% масс./об.
60 мг ONCOFID-Pt, полученного как описано в Примере 4, со степенью замещения по остаткам карбоновой кислоты от 3 до 15% масс./масс., растворяют в 29 мл водного раствора, содержащего 5% масс./об. глюкозы. Раствор оставляют перемешиваться на магнитной мешалке до полного растворения конъюгата; его затем фильтруют через стерилизующие фильтры из регенерированной целлюлозы (RC) с использованием шприца 0,22 мкм. Титр в растворе (3 мг/мл в ONCOFID) определяют при помощи спектрофотометрии до и после фильтрования для подтверждения полного превращения конъюгата после фильтрования.
Пример 6. Фармацевтический препарат, основанный на ONCOFID-S, в растворе β-циклодекстрина в концентрации 1,5% масс./об.
62 мг ONCOFID-S, полученного как описано ранее, со степенью замещения остатков карбоновой кислоты от 3 до 15% масс./масс., растворяют в 22 мл водного раствора, содержащего 1,5% масс./об. β-циклодекстрина. Раствор оставляют перемешиваться на магнитной мешалке до полного растворения конъюгата; его затем фильтруют через стерилизующие фильтры из регенерированной целлюлозы (RC) с использованием шприцов 0,22 мкм. Титр раствора (2,8 мг/мл в ONCOFID-S) определяют при помощи спектрофотометрии до и после фильтрования для подтверждения полной регенерации конъюгата после фильтрования.
Пример 7. Фармацевтический препарат, основанный на ONCOFID-S, в растворе глюкозы в концентрации 5% масс./об.
56 мг ONCOFID-S, полученного как описано ранее, со степенью замещения карбоксильных остатков от 3 до 15% масс./масс., растворяют в 20 мл водного раствора, содержащего 5% масс./об. глюкозы. Раствор оставляют перемешиваться на магнитной мешалке до полного растворения конъюгата; его затем фильтруют через стерилизующие фильтры из регенерированной целлюлозы (RC) с использованием шприца 0,22 мкм. Титр в растворе (2,8 мг/мл в ONCOFID-S) определяют при помощи спектрофотометрии до и после фильтрования для подтверждения полной регенерации конъюгата после фильтрования.
Пример 8. Фармацевтический препарат, основанный на ONCOFID-P, в растворе глюкозы в концентрации 5% масс./об.
100 мг ONCOFID-P, полученного как описано в Примерах 5, 6, 7, 9 и 10 в патенте WO 2004035629, растворяют в 20 мл водного рас