Аналоги природных дезоксирибонуклеозидтрифосфатов и рибонуклеозидтрифосфатов, содержащие репортёрные флуоресцентные группы, для использования в аналитической биоорганической химии
Иллюстрации
Показать всеНастоящее изобретение относится к аналитической биоорганической химии. Предложенные флуоресцентно-меченные дезоксирибонуклеозидтрифосфаты и рибонуклеозидтрифосфаты имеют общую формулу H-Л-Ф, где Н - модифицированный по конечному атому фосфора природный дезоксирибонуклеозидтрифосфат или рибонуклеозидтрифосфат, Л - линкерная группа, присоединенная к конечному атому фосфора и построенная на основе вторичных диаминов, Ф - репортерная флуоресцентная группа, присоединенная к линкеру посредством вторичной аминогруппы. При этом способ синтеза флуоресцентно-меченных нуклеотидов включает присоединение линкера к флуорофору, активацию трифосфатных групп путем превращения их в циклическую ангидридную форму, взаимодействие активированных трифосфатов с красителями, содержащими линкерную группу, и очистку целевых соединений. Предложенные флуоресцентно-меченные нуклеотиды могут быть использованы в методах одномолекулярного секвенирования, расширяя диапазон возможных условий его проведения. 3 з.п. ф-лы, 4 ил., 1 табл., 8 пр.
Реферат
Область техники
Изобретение относится к аналитической биоорганической химии, к области генной диагностики, в частности, для определения первичной последовательности нуклеиновых кислот (секвенирования).
Уровень техники
Методы секвенирования ДНК и РНК бурно развивались с момента их появления в 60-70-х годах XX века как важного раздела аналитической биоорганической химии и явились основой геномных исследований. Благодаря секвенированию определены и исследованы многие геномные последовательности и транскриптомы, изучены взаимодействия ДНК и белков [1]. Создание быстрых и дешевых методов секвенирования как можно меньшего количества ДНК является актуальной задачей. Одним из наиболее перспективных подходов является метод одномолекулярного секвенирования в режиме реального времени SMRT (single molecule real-time), разрабатываемый компанией Pacific Biosciences (США) [2]. Предложенный метод основан на проведении непрерывного синтеза одной молекулы ДНК с использованием гексафосфатов дезоксирибонуклеозидов, флуоресцентно-меченных четырьмя оптически различимыми флуорофорами, выполняющими роль репортерных групп. При этом необходимо, чтобы флуоресцентная метка была присоединена через некий линкер к терминальной части олигофосфатного фрагмента дезоксирибонуклеозида.
В настоящее время описано получение ряда нуклеотидов, флуоресцентно-меченных по фосфатному фрагменту. Общая схема синтеза включает два этапа:
1. Получение соединения линкер-олигофосфат-нуклеозид/дезоксинуклеозид. Для этого существуют два пути. В случае, если молекула должна содержать трифосфатный фрагмент, то линкер прикрепляют к коммерчески доступному природному трифосфату. Если требуется большее количество фосфатных звеньев, то сначала наращивают фосфатные звенья на одном из концов молекулы линкера и лишь затем связывают полученную молекулу с нужным трифосфатом.
2. Прикрепление к оставшемуся свободному концу линкера (как правило, это аминогруппа или спиртовый гидроксил) молекулы требуемого красителя. Для этого используют дорогостоящие коммерчески доступные красители, содержащие в своей структуре соответствующую высокореакционноспособную группу, как, например, -C(O)-O-Su (Su = сукцинимид).
В качестве линкеров используют аминоспиртовые фрагменты [3-5], диамины [6-8]. Цепь линкера может включать ненасыщенные связи [8], ароматические группы [8], участки полиэтиленгликоля [9-11], амидные группы [9, 12].
В качестве репортерных флуорофоров могут быть использованы фрагменты различной химической природы, активные в различных диапазонах длин волн, такие как: кумариновые соединения [10], родаминовые структуры [7, 8, 11, 13], производные флуоресцеина [8], а также цианиновые соединения [12, 14]. Родаминовые и флуоресцеиновые производные имеют обширную историю изучения и применения, обладают высоким квантовым выходом. Недостатком многих родаминовых и флуоресцеиновых красителей является существование в водных растворах различных равновесных форм, обладающих различными флуоресцентными характеристиками. На преобладание той или иной формы в растворе сильное влияние оказывает его pH [15, 16], что объясняется наличием в структуре красителей карбоксильной группы, способной в различной степени ионизироваться или замыкать либо спироамидный (для родамина), либо спиролактонный цикл (флуоресцеин в кислой среде):
Нейтральная спиролактонная форма не поглощает в видимой области спектра, тогда как в растворе при рН 12 флуоресцеин имеет максимальный квантовый выход 0,93 [17].
Наиболее близкими к предлагаемым соединениям являются меченые нуклеотиды, применяющиеся в методе одномолекулярного секвенирования [14], получаемые путем пятистадийного синтеза [18]. На первой стадии получают монофосфат из защищенного по аминогруппе 6-аминогексанола (Fmoc-HN-(CH2)6-OH, где Fmoc = 9-флуоренилметоксикарбонил) и хлорокиси фосфора. На второй стадии к имеющемуся фосфату присоединяют следующий фосфатный фрагмент реакцией с трибутиламмониевой солью фосфорной кислоты и 1,1-карбонилдиимидазолом. После необходимого удлинения фосфатной цепочки, связанной с линкером, продукт реакции обрабатывают триэтиламмониевой солью необходимого трифосфата, например, дГТФ (дезоксиаденозинтрифосфат) в присутствии 1,1-карбонилдиимидазола. При помощи водного раствора триэтиламина с полученного соединения снималается Fmoc-защита. На последнем этапе к полученному соединению (H2N-(СН2)6-O-гексафосфат-нуклеозид) привязывают требуемый флуорофор через амидную группировку. Для этого используют дорогостоящие коммерческие флуоресцентные красители с реакционноспособной сложноэфирной группой. Следует отметить, что на каждой стадии синтеза требуется очистка промежуточных соединений методом обращеннофазной высокоэффективной жидкостной хроматографии (ОФ ВЭЖХ). Суммарный выход в двух заключительных стадиях (введение в молекулу фрагмента трифосфат-дезоксирибонуклеозид, а затем флуорофора) составляет менее 7% от теоретического.
Таким образом, недостатком известных флуоресцентно-меченных нуклеотидов является сложность их синтеза, включающего несколько реакционных стадий с участием полифосфатов, достаточно легко гидролизующихся в присутствии воды, что обусловливает необходимость сложной и дорогостоящей очистки продуктов реакции на каждой стадии. Флуоресцентные метки в известном способе вводят с использованием дорогостоящих коммерческих реагентов, обычно применяемых не столько для синтеза новых соединений, сколько для окрашивания биополимеров (белки, полисахариды и др.) или живых клеток, что требует существенно меньшего расхода реагента.
Раскрытие изобретения
Техническим результатом заявляемого изобретения является снижение стоимости флуоресцентно-меченных нуклеотидов, пригодных для использования в аналитической биоорганической химии, в частности в методах одномолекулярного секвенирования, расширение диапазона возможных условий проведения анализа этим методом.
Предлагаемые флуоресцентно-меченные дезоксирибонуклеозидтрифосфаты и рибонуклеозидтрифосфаты имеют общую формулу Н-Л-Ф, где:
Н - модифицированный по конечному атому фосфора природный дезоксирибонуклеозидтрифосфат или рибонуклеозидтрифосфат,
Л - линкерная группа, присоединенная к конечному атому фосфора,
Ф - репортерная флуоресцентная группа.
Линкерная группа, построенная на основе вторичных диаминов, имеет формулу:
N,N′-диметил-1,3-диаминопропан (N2)
или может содержать третичную аминогруппу:
N1,N3-диметил-N1-[3-(метиламино)пропил]-1,3-пропандиамин (N3)
Флуоресцентная группа присоединена к линкеру посредством вторичной аминогруппы, а именно:
где пунктирной линией обозначено продолжение структуры линкера.
Новые флуоресцентно-меченные дезоксирибонуклеозидтрифосфаты и рибонуклеозидтрифосфаты получают при осуществлении следующего способа.
1. Присоединяют линкер к флуорофору путем использования красителей, содержащих активный атом галогена (хлор или бром).
2. Активацию дезоксирибонуклеозидтрифосфатов или рибонуклеозидтрифосфатов проводят путем превращения их в циклическую ангидридную форму воздействием на них дициклогексилкарбодиимида.
3. Осуществляют взаимодействие активированных дезоксирибонуклеозидтрифосфатов или рибонуклеозидтрифосфатов с красителями, содержащими линкерную группу.
4. Проводят очистку целевых соединений осаждением, промывкой органическими растворителями и хроматографированием.
В качестве модифицированных по конечному атому фосфора природных дезоксирибонуклеозидтрифосфатов или рибонуклеозидтрифосфатов выступают соединения из следующего списка: аденозин-5′-трифосфат (АТФ), гуанозин-5′-трифосфат (ГТФ), цитидин-5′-трифосфат (ЦТФ), уридин-5′-трифосфат (УТФ), 2′-дезоксиаденозин-5′-трифосфат (дАТФ), 2′-дезоксигуанозин-5′-трифосфат (дГТФ), 2′-дезоксицитидин-5′-трифосфат (дЦТФ) и тимидин-5′-трифосфат (ТТФ).
Линкерная группа присоединена к конечному атому фосфора посредством фосфамидной связи: , здесь пунктирными линиями показаны продолжение структуры трифосфатного фрагмента и линкера.
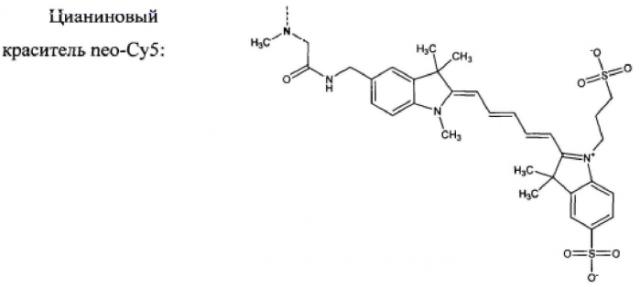
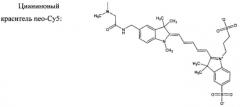
Репортерной флуоресцентной группой являются производные веществ из ряда триарилметановых (ксантеновых), цианиновых и нитробензофуразановых красителей: флуоресцеин, родамин Б, родамин 101, цианиновый краситель neo-Cy5 и 7-нитробензофуразан.
Краткое описание чертежей
Фиг. 1 - электрофореграмма, подтверждающая возможность получения полноразмерного продукта полимеризации ДНК при замене одного из нуклеозидтрифосфатов на его меченое производное (дАТФ-Су-5-N2);
Фиг. 2 - электрофореграмма, подтверждающая возможность получения полноразмерного продукта полимеризации ДНК при использовании только меченых нуклеозидтрифосфатов;
Фиг. 3 - схема для оценки возможной длины прочтения нуклеотидной последовательности при секвенировании ДНК с использованием меченых нуклеозидтрифосфатов;
Фиг. 4 - цифровой снимок флуоресценции полос ДНК в геле после электрофореза и окрашивания с наглядным результатом эксперимента по оценке длины прочтения нуклеотидной последовательности
Осуществление изобретения
Возможность использования новых меченых нуклеозидтрифосфатов в реакциях секвенирования, основанных на реакции синтеза ДНК, показана при проведении реакций удлинения праймеров с ДНК-зависимой ДНК-полимеразой и различными матрицами с использованием различных наборов, включающих как все 4 нуклеозидтрифосфата, меченных различными репортерными флуоресцентными группами, так и наборы, содержащие лишь один меченый нуклеозидтрифосфат.
Возможность осуществления способа иллюстрируют приведенные ниже примеры его проведения в лабораторных условиях. Примеры 1-4 описывают введение линкеров с концевой аминогруппой в различные флуоресцентные красители.
При этом в качестве прекурсоров используют коммерчески доступные красители типа родамина В, родамина 101 и флуоресцеина.
Пример 5 посвящен синтезу целевого продукта путем реакции полученных соединений с трифосфатными нуклеотидами. Примеры 6-8 показывают возможность использования новых меченых нуклеотидов в реакциях полимеризации, а именно при синтезе новых молекул ДНК с использованием существующих олиго- и полинуклеотидов в качестве матриц.
Пример 1
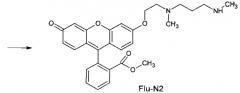
Синтез флуоресцентного красителя Flu-N2 (метиловый эфир O-{2-[(3-метиламинопропил)(метил)амино]этил} флуоресцеина) проводят по следующей схеме:
Прекурсор (Flu-Br - метиловый эфир О-[2-бромэтил] флуоресцеина) синтезируют по методике, опубликованной в [19]. Реакционную смесь из 0,153 г (0,338 ммоль) Flu-Br, 0,570 г (5,58 ммоль) N,N′-диметил-1,3-диаминопропана и 6 мл ацетонитрила перемешивают на магнитной мешалке при температуре 73-75°С в течение двух часов. После этого реакционную смесь выпаривают в вакууме водоструйного насоса до образования вязкой коричневой массы. Полученный остаток перемешивают с 3 мл хлористого метилена (ХМ) и 1,17 г 47%-ного водного раствора карбоната калия. Верхний коричневый слой ХМ отделяют от нижнего водного слоя, который, в свою очередь, экстрагируют ХМ (2×2 мл). Органические фазы объединяют и осушают безводным карбонатом калия. После отделения осушителя (фильтрование через бумажный фильтр) полученный раствор выпаривают досуха в вакууме водоструйного насоса. Остаток многократно растирают с н-гексаном. Растворитель отделяют от твердой фазы центрифугированием, и процедуру повторяют с новой порцией н-гексана. После высушивания твердого остатка в вакууме водоструйного насоса продукт подвергают флеш-хроматографической очистке на силикагеле. Элюент - изопропанол: 25%-ный водный триметиламин: хлористый метилен (объемное соотношение 90:10:5). Выход целевого продукта Flu-N2 составляет 0,0338 г или 21% от теоретического.
Пример 2
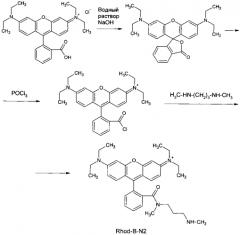
Получение флуоресцентного красителя Rhod-B-N2 (2-(3-(диэтиламино)-6-(диэтилимино)-6Н-ксантен-9-ил)-N-метил-N-(3-(метиламино)пропил бензамид) проводят по следующей схеме:
Синтез красителя Rhod-B-N2 проводят по аналогии с методикой из [20]. К перемешиваемому раствору основания родамина Б (1,00 г, 2,26 ммоль) в 1,2-дихлорэтане (12 мл) в течение пяти минут прибавляют 0,6 мл хлорокиси фосфора. Полученный раствор кипятят под обратным холодильником четыре часа. Реакционную смесь после охлаждения выпаривают в вакууме. Полученный неочищенный хлорангидрид родамина Б растворяют в 66 мл 1,2-дихлорэтана. После этого в течение 140 минут 4 мл приготовленного раствора вводят при помощи шприца в перемешиваемую при комнатной температуре смесь 2,20 г (21,5 ммоль) N,N′-диметил-1,3-диаминопропана и 3 мл 1,2-дихлорэтана. Через 17 часов к реакционной смеси прибавляют 3,5 г 32%-ного раствора карбоната калия. Органический слой отделяют, а водный экстрагируют хлористым метиленом (2×2 мл). После осушения объединенных органических фаз безводным карбонатом калия раствор выпаривают досуха в вакууме водоструйного насоса, а остаток многократно растирают с диэтиловым эфиром. После декантации раствора продукт заливают новой порцией эфира и растирание повторяют. Полученную темную розовато-фиолетовую массу высушивают в вакууме и затем очищают методом флеш-хроматографии на обращеннофазном С18-силикагеле. Элюент: H2O/CH3CN/HCOOH = 63,2/36,7/0,1 (объемное соотношение). Выход Rhod-B-N2 составляет 0.316 г (формиат) или 21% от теоретического.
Пример 3
Флуоресцентный краситель Rhod-101-N2, имеющий следующую структурную формулу:
синтезируют из внутренней соли родамина 101 аналогично синтезу красителя Rhod-B-N2.
К перемешиваемому раствору внутренней соли родамина 101 (1,11 г, 2,26 ммоль) в 1,2-дихлорэтане (12 мл) в течение пяти минут прибавляют 0,6 мл хлорокиси фосфора. Полученный раствор кипятят под обратным холодильником четыре часа. Реакционную смесь после охлаждения выпаривают в вакууме. Полученный неочищенный хлорангидрид родамина 101 растворяют в 66 мл 1,2-дихлорэтана. После этого в течение 140 минут 4 мл приготовленного раствора вводят при помощи шприца в перемешиваемую при комнатной температуре смесь 2,20 г (21,5 ммоль) N,N′-диметил-1,3-диаминопропана и 3 мл 1,2-дихлорэтана. Через 17 часов к реакционной смеси прибавляют 3,5 г 32%-ного раствора карбоната калия. Органический слой отделяют, а водный экстрагируют хлористым метиленом (2×2 мл). После осушения объединенных органических фаз безводным карбонатом калия раствор выпаривают досуха в вакууме водоструйного насоса, а остаток многократно растирают с диэтиловым эфиром. После декантации раствора продукт заливают новой порцией эфира и растирание повторяют. Полученную темную розовато-фиолетовую массу высушивают в вакууме и затем очищают методом флеш-хроматографии на обращеннофазном С18-силикагеле. Элюент: H2O/CH3CN/HCOOH = 63,2/36,7/0,1 (объемное соотношение). Выход конечного продукта Rhod-101-N2 (формиат) составляет 0,161 г или 10% от теоретического.
Пример 4
Получение флуоресцентного красителя Cy5-N2 проводят по следующей схеме:
Исходный краситель neo-Су5-Cl получают согласно опубликованной методике [21]. К раствору 0,173 г (0,242 ммоль) Neo-Cy5-Cl (калийная соль) в 4 мл дистиллированной воды добавляют 0,380 г (3,72 ммоль) N,N′-диметил-1,3-диаминопропана. Полученную реакционную смесь оставляют в атмосфере аргона при комнатной температуре в темном месте на 20 часов. После чего растворитель выпаривают на роторном испарителе при подогреве теплой водяной баней (40°С), а остаток выдерживают в вакууме масляного насоса в течение одного часа. Полученную темную липкую массу тщательно растирают с 5 мл сухого диоксана. После декантации диоксановой фазы процедуру повторяют дважды с использованием диэтилового эфира (2×5 мл). Оставшийся продукт растворяют в 3,5 мл метанола (нерастворимую часть отделяют центрифугированием) и переосаждают из 10 мл диоксана. Выпавший осадок отделяют от раствора центрифугированием и трижды промывают диэтиловым эфиром (3×5 мл). Высушенный на водоструйном насосе продукт подвергают флеш-хроматографической очистке на силикагеле. Сначала элюирование проводят смесью ледяная уксусная кислота/дистиллированная вода 1:10 (по объему), затем дистиллированной водой и в конце смесью дистиллированная вода/ метанол/триэтиламин 1:1:1 (по объему). Выход Cy5-N2 составляет 0,0538 г или 29,9% от теоретического.
Следует отметить, что использование в качестве прекурсоров недорогих коммерчески доступных красителей типа родамина В, родамина 101 и флуоресцеина не только не ухудшает свойств целевого продукта, но также расширяет диапазон кислотности среды, в котором возможно проведение секвенирования. Так в трех из пяти предложенных соединений (производные родаминовой и флуоресцеиновой структур) имеющиеся карбоксильные группы находятся либо в форме вторичных амидов, либо в сложноэфирной форме, что исключает возможность процессов замыкания-раскрытия спиролактонного/спироамидного цикла и соответствующих нежелательных изменений флуоресцентных свойств данных соединений в ходе секвенирования.
Синтез флуоресцентно-меченных нуклеозидтрифосфатов приведен в примере 5.
Пример 5
Для синтеза используют трифосфаты, полученные из Aldrich, в натриевой форме: тимидин-5′-трифосфат (ТТФ), 2′-дезоксиаденозин-5′-трифосфат (дАТФ), 2′-дезоксицитидин-5′-трифосфат (дЦТФ), 2′-дезоксигуанозин-5′-трифосфат (дГТФ) и красители, синтезированные, как описано выше - Flu-N2, Rhod-B-N2, Rhod-101-N2 и Cy5-N2, а также NBD-N2 и NBD-N3, полученные в соответствии с [22].
Натриевые соли трифосфатов превращают в триэтиламмониевые соли путем катионного обмена, пропуская раствор солей (100 мг в 5 мл деионизованной воды) через 5 мл катионита КУ-2-8 (ГОСТ 20298-74) в триэтиламониевой форме. Полученные растворы высушивают лиофильно и переосаждают из н-бутилового спирта в эфир для получения солей трифосфатов в виде порошка.
Активацию трифосфатов проводят путем перевода их в циклическую форму аналогично [23]. 10 мг сухой триэтиламмониевой соли трифосфата растворяют в 0,15 мл сухого ДМСО, затем добавляют 0,01 мл сухого пиридина. Вакуумируют при давлении 1 мм рт.ст. в течение 1 часа. После вакуумирования к соли трифосфата добавляют 18 мг дициклогексилкарбодиимида (ДСС), растворяют и выдерживают 1 час на шейкере. Выпавший осадок мочевины отфильтровывают.
Отфильтрованный раствор трифосфата в ДМСО смешивают с раствором красителя в метаноле и выдерживают 1 час на шейкере (табл. 1). Затем высаживают в 1% раствор LiCl в ацетоне, отмывают ацетоном, смесью ацетона с метанолом - 2:1 и сушат лиофильно. Конкретные загрузки реагентов для различных трифосфатов и красителей представлены в табл. 1.
Очистку полученных меченых трифосфатов проводят с помощью ВЭЖХ на хроматографе Милихром 02 с УФ детекцией (колонка 2,0×75 мм, ProntoSil 120-5-C18AQ). Объем пробы 50-70 мкл. Подвижная фаза: элюент А - буфер 20 мМ ацетат аммония (рН 5,5) (для ТТФ-Flu-N2 и дЦТФ-R-101-N2) или буфер 20 мМ формиат аммония (рН 7,5) (для АТФ-NBD-N2, АТФ-NBD-N3, дАТФ-RB-N2, дГТФ-RB-N2 и дАТФ-Су-5-N2); элюент Б - ацетонитрил. Градиент растворителей применяют в следующей последовательности: от 10% Б до 50% Б в течение 7,5 мин, затем 50% Б в течение 10,5 мин, со скоростью 0,150 мл/мин (температура колонки 35°С). УФ детектирование проводят на 220, 250, 264, 286, 360 нм. Времена удерживания для АТФ-NBD-N2 - 2,5 мин, АТФ-NBD-N3 - 3,5 мин, ТТФ-Flu-N2 - 5,5 мин; дАТФ-NBD-N3 - 4.6 мин; дЦТФ-R-101-N2 - 8 мин; дГТФ-RB-N2 - 8 мин; дАТФ-Су-5-N2 - 5 мин. Для подтверждения чистоты полученных фракций проводят аналитическое рехроматографирование.
Структуру полученных соединений подтверждают данными масс-спектрометрического анализа с прямым вводом вещества. Используют хромато-масс-спектрометр Agilent 6210 TOF LC/MS (времяпролетный жидкостной хроматограф/масс-спектрометр) в режиме электрораспыления.
Скорость потока подвижной фазы 0,1 мл/мин, в качестве подвижных фаз использовали 0,1% НСООН в воде (в режиме катионов) и 5 мМ NH4HCO3 в воде (в режиме анионов). Условия записи масс-спектров следующие: диапазон регистрируемых m/z от 100 до 2000, время сканирования 1 с, напряжение на капиляре 3500 В, температура газа 325°С, ток азота 5 л/мин. Пробы растворяют в деионизованной воде. Объем пробы 2 мкл.
Молекулярные массы соединений (m/z) составляют:
ТТФ-Flu-N2 (М - молекулярная масса соединения в форме кислоты) [М-Н]- вычислено: М 937,186; C38H44N4O18P3; найдено: М 937,189; вычислено: [М-2Н]2- 468,089; найдено: 468,082.
дЦТФ-Rhod-101-N2 (М - молекулярная масса соединения, с учетом элиминирования ОН- группы из дезоксирибоксильного фрагмента) [М]+ вычислено: 1008,322; C46H57N7O13P3; найдено: 1008,323.
дГТФ-Rhod-B-N2 (М - молекулярная масса соединения в форме кислоты) [М+Н]2+ вычислено: 508,665; C43H58N9O14P3; найдено: М 508,661.
дАТФ-Су-5-N2 (М - молекулярная масса соединения в форме кислоты) [М]- вычислено: 1213,305; C47H64N10O18P3S2; найдено: 1213,302; [М-2Н]2- вычислено: 606,149; найдено: М 606,145.
дАТФ-NBD-N3 (М - молекулярная масса соединения в форме кислоты) [М+Н]+ вычислено: 811,193; C25H39N11O14P3; найдено: М 811,190; [М-Н]- вычислено: 809,182; C25H37N11O14P3; найдено: 809,188.
АТФ-NBD-N2 (М - молекулярная масса соединения в форме кислоты) [М+Н]+ вычислено: 755,110; C21H30N10O15P3; найдено: М 755,111; [М-Н]- вычислено: 753,094; C21H28N10O15P3; найдено: М 753,092.
АТФ-NBD-N3 (М - молекулярная масса соединения в форме кислоты) [М+Н]+ вычислено: 826,184; C25H39N11O15P3; найдено: М 826,189; [М-Н]- вычислено: 824,168; C25H37N11O15P3; найдено: 824,158. [М-2Н]2- вычислено: 411,580; C25H36N11O15P3; найдено: М 411,582.
АТФ-Rhod-B-N2 (М - молекулярная масса соединения в форме кислоты) [М]+ вычислено: 1016,324; C43H57N9O14P3; найдено: 1016,326; [М+Н]2+ вычислено: 508,665; C43H58N9O14P3; найдено: 508,667. [М-2Н]- вычислено: 1014,308; C43H55N9O14P3; найдено: 1014,302.
Подтверждение применимости меченых нуклеозидтрифосфатов в качестве субстратов ДНК-полимеразы приведено в Примере 6.
Пример 6
Полимеразную цепную реакцию (ПЦР) проводят при использовании модельной ДНК-матрицы, меченого праймера, набора из трех природных (3 дНТФ) и одного меченого (дНТФ-Х) трифосфата. В полном наборе должны быть представлены все четыре дезоксинуклеозидтрифосфата. Например, если тестируется меченый ТТФ, то должны присутствовать природные дАТФ, дЦТФ и дГТФ.
Раствор меченого трифосфата предварительно обрабатывают термоинактивируемой щелочной фосфатазой. Для этого в реакционную смесь объемом 10 мкл, содержащую 3,2·10-4 М модифицированного дНТФ, 10 мМ Трис-HCl рН 8,5, 10 мМ MgCl2, 100 мМ NaCl, 1 мМ DTT, прибавляют 1 ед. акт. термолабильной щелочной фосфатазы и выдерживают в течение 17 ч при 25°С.
В реакционную смесь объемом 10 мкл, содержащую 3·10-5 М матрицы, 1·10-5М праймера, содержащего флуоресцентную метку (Су5), 2·10-4 М немодифицированных дНТФ, 1·10-4 М меченого дНТФ-Х, обработанного щелочной фосфатазой, 10 мМ Трис-HCl рН 8,8, 50 мМ KCl, 0,1% Tween 20, прибавляют 1 ед. акт. Taq-полимеразы. Выдерживают в течение 3 мин при 95°С, затем проводят реакцию при 50°С в течение 1 ч. Реакцию останавливают прибавлением 0,5 мл 2% раствора LiClO4 в ацетоне, центрифугируют 3 мин при 13200 об/мин, удаляют супернатант и промывают осадок 0,5 мл ацетона с повторным центрифугированием. Осадок растворяют в 5 мкл 95% формамида с лидерными красителями (0,05% бромфенолового синего и 0,05% ксиленцианола FF), полученные пробы анализируют с помощью денатурирующего электрофореза в 15% полиакриламидном геле.
После проведения денатурирующего 15% ПААГ электрофореза сканируют гель при длине волны возбуждения 635 нм и регистрируют флуоресценцию при длине волны 695 нм с помощью сканера Molecular Imager FX ProPlus (BioRad, США). Вывод о применимости меченого трифосфата делают на основании наличия в полосе геля специфического пятна, соответствующего по подвижности пятну полноразмерного продукта, получаемого в присутствии всех четырех немеченых трифосфатов.
Данные по меченому трифосфату дАТФ-Су-5-N2 показаны на Фиг. 1.
Дорожка 1 - реакция проведена, как описано в примере, дорожка 2 - реакция проведена в присутствии только ТТФ, дЦТФ, дГТФ, трифосфат А (меченый или немеченый) отсутствует, дорожка 3 - реакция проведена без матрицы, дорожка 4 - использованы только немеченые трифосфаты - ТТФ, дЦТФ, дГТФ и дАТФ. В дорожке 1 наблюдается такой же полноразмерный продукт, как и в дорожке 4, что свидетельствует о применимости трифосфата дАТФ-Су-5-N2 в реакции полимеризации ДНК Taq-полимеразой.
Подтверждение возможности получения полноразмерного продукта полимеризации ДНК при использовании только меченых трифосфатов приведено в Примере 7.
Пример 7.
ИТ TP проводят по следующей схеме:
Растворы меченых нуклеозидтрифосфатов ТТФ-Flu-N2, дАТФ-Су-5-N2, дЦТФ-Rhod-101-N2, дГТФ-Rhod-B-N2, дАТФ-NBD-N3 обрабатывают щелочной фосфатазой, как описано в примере 6. Готовят эквимолярные смеси четырех меченых трифосфатов следующего состава: ТТФ-Flu-N2, дАТФ-Су-5-N2, дЦТФ-Rhod-101-N2, nTTO-Rhod-B-N2 (смесь 1); ТТФ-Flu-N2, дАТФ-NBD-N3, дСТФ-Rhod-101-N2, дГТФ-Rhod-B-N2 (смесь 2). В реакционную смесь объемом 10 мкл, содержащую 3·10-5 М матрицы, 1·10-5 М праймера, меченого по 5′-концу остатком 32Р-фосфорной кислоты, по 1·10-4 М меченых дНТФ (концентрация 1·10-4 М по каждому трифосфату достигается добавлением определенного количества смеси 1 или 2), 10 мМ Трис-HCl рН 8,8, 50 мМ KCl, 0,1% Tween 20, прибавляют 1 ед. акт. Taq-полимеразы. Смесь выдерживают в течение 3 мин при 95°С, затем проводят реакцию при 50°С в течение 1 ч. Реакцию останавливают прибавлением 0,5 мл 2% раствора LiClO4 в ацетоне, центрифугируют 3 мин при 13200 об/мин, удаляют супернатант и промывают осадок 0,5 мл ацетона с повторным центрифугированием. Осадок растворяют в 5 мкл 95% формамида с лидерными красителями (0,05% бромфенолового синего и 0,05% ксиленцианола FF), полученные пробы анализируют с помощью денатурирующего электрофореза в 15% полиакриламидном геле, гель высушивают и радиоавтографируют.
На Фиг. 2. приведены результаты применения различных смесей меченых трифосфатов в качестве субстратов для Taq-полимеразы.
Дорожка 1 - реакция проведена со смесью 1, дорожка 2 - реакция проведена со смесью 2, дорожка 3 - реакция проведена без матрицы, дорожка 4 - реакция проведена с природными трифосфатами, не содержащими флуоресцентных меток.
В примере 8 дана оценка возможной длины прочтения нуклеотидной последовательности при секвенировании ДНК с использованием меченых трифосфатов.
Пример 8
Оценку возможной длины прочтения нуклеотидной последовательности при секвенировании ДНК с использованием меченых трифосфатов проводят по схеме, изображенной на Фиг. 3.
В качестве матрицы используют кольцевую одноцепочечную ДНК бактериофага М13. Проводят полимеризацию ДНК, используя только меченые трифосфаты (после предварительной обработки щелочной фосфатазой). В процессе реакции ДНК-полимераза достраивает вторую цепь ДНК. По завершении реакции удаляют оставшийся одноцепочечным участок с помощью S1 нуклеазы и оценивают длину оставшегося двуцепочечного участка с помощью электрофореза в присутствии набора стандартов длины двуцепочечной ДНК.
Для проведения реакции в реакционную смесь объемом 10 мкл, содержащую 4·10-8 М ДНК фага М13, 1·10-7 М праймера, по 1·10-4 М меченых дПТФ (ТТФ-Flu-N2, дАТФ-Су-5-N2, дЦТФ-Rhod-101-N2, дГТФ-Rhod-B-N2), обработанных щелочной фосфатазой, 10 мМ Трис-HCl рН 8,8, 50 мМ KCl, 0,1% Tween 20, прибавляют 1 ед. акт. Taq-полимеразы. Выдерживают в течение 3 мин при 95°С, затем проводят реакцию в течение 2 ч при 50°С. Из реакционной смеси отбирают аликвоту 5 мкл, прибавляют 0,5 мл 2% раствора LiClO4 в ацетоне, центрифугируют 3 мин при 13200 об/мин, удаляют супернатант и промывают осадок 0,5 мл ацетона с повторным центрифугированием. К оставшемуся объему прибавляют 5 мкл раствора, содержащего 80 мМ ацетата натрия, 600 мМ NaCl, 100 ед. акт. S1 нуклеазы, выдерживают 10 мин при 37°С и упаривают на вакуумном испарителе при 20°С. Полученные пробы растворяют в 10% водном глицерине с лидерными красителями (0,05% бромфенолового синего и 0,05% ксиленцианола FF) и анализируют с помощью нативного электрофореза в 6% полиакриламидном геле.
Гель окрашивают раствором этидия бромида (5 мкг/мл) и регистрируют флуоресценцию с помощью цифровой видеокамеры при возбуждении ультрафиолетовым излучением (λ=254 нм).
На Фиг. 4 приведен цифровой снимок флуоресценции полос ДНК в геле после электрофореза и окрашивания с наглядным результатом эксперимента по оценке длины прочтения нуклеотидной последовательности.
Дорожка 1 содержит набор стандартов длины двуцепочечной ДНК, дорожка 2 - реакция проведена, как описано в данном примере, включая обработку S1 нуклеазой, дорожка 3 - реакция проведена без последующей обработки S1 нуклеазой. Как видно по расположению пятна в дорожке 2 относительно стандарта в дорожке 1, длина продукта полимеризации достигает 3000 п.о.
Использование новых меченых нуклеотидов в реакциях секвенирования, показанных в приведенных выше примерах, не ограничивают сферу их применения.
Новые нуклеотиды, содержащие репортерные флуоресцентные группы, присоединенные к фосфатной части нуклеотидов, могут быть использованы в ряде других приложений аналитической биоорганической химии, в различных масштабных вариантах. В нанореакторах, представляющих собой безмодовые волноводы, при регистрации флуоресцентного сигнала от меченого трифосфата, удерживаемого иммобилизованным ферментом, таким как ДНК-полимераза, РНК-лигаза или полинуклеотидкиназа, наблюдение аналитического сигнала может свидетельствовать об эффективной гибридизации зонда с матрицей. В традиционном микроварианте аналитическим сигналом, возникающим в результате действия трифосфат-зависимых ферментов обмена нуклеиновых кислот, может являться изменение спектра флуоресценции в результате отщепления мононуклеотида от флуорофорсодержащего ди-(три-)фосфата. В этом случае возможно использование меченых полифосфатов с ДНК-полимеразами для оценки эффективности гибридизации с использованием праймера в качестве специфичного зонда, для микросеквенирования (выявления точечных мутаций). Также возможно выявление эффективности гибридизации тандемных зондов с помощью лигаз с использованием флуоресцентно-меченного АТФ.
Новые меченые нуклеозидтрифосфаты при невысокой стоимости обладают рядом преимуществ, одним из которых является исключение нежелательных изменений флуоресцентных свойств соединений при изменении условий проведения секвенирования.
Описание настоящего изобретения и его преимущества, изложенные выше, служат для более детальной иллюстрации сущности изобретения, но не для ограничения сфер его применения.
Источники информации
1. Shadt, Е.Е. A window into third-generation sequencing /. Shadt, E.E., Turner, S., Kasarskis, A. A. // Human Mol. Genet. - 2010. - V. 19. - N 2. - P. R227-R240.
2. Jonas Korlach. Real-Time DNA Sequencing from Single Polymerase / Jonas Korlach, Keith P. Bjornson, Bidhan P. Chaudhuri, et al. //Molecules Methods in Enzymology. - 2010. - Vol. 472. - Pages 431-455.
3. Заявка 2009/0018324 US A1. Labeled nucleotide analogs and uses therefor / Yue Xu, Jeffrey Wegener, Arek Bibillo; Заявл. 15.05.2008; Опубл. 15.01.2009.
4. Заявка 2011/0059450 US A1. Labeled nucleotide analogs and uses therefore / Yue Xu, Jeffrey Wegener, Arek Bibillo; Заявл. 09.07.2010, Опубл. 10.03.2011.
5. Заявка 2012/0028248 US A1. Engineered fluorescent dye labeled nucleotide analogs for DNA sequencing / Gene Shen, Paul Peluso, Arkadusz Bibillo. - Заявл. 25.05.2011; Опубл. 02.02.2012.
6. Заявка 2010/0317005 US A1. Modified nucleotides and methods for making and use same / Susan H. Hardin, Hongyi Wang, Brent A. Mulder, Nathan K. Agnew, Tommie L. Lincecum, JR. - Заявл. 15.05.2010, опубл. 20.05.2010.
7. Заявка 2009/014612 WO A2. Modified nucleotides, methods for making and using same / Wang, Hongyi, GAO, Xiaolian, YU, Peilin, Reddy, Mitsu S., Hardin, Susan H., Lincecum, Tommie, Jr., Williams, Amy, Deluge, Norha, Belosludtsev, Yuri, MENCHEN, Steve M., LAM, Joe Y.L., CHEN, Jer-Kang. - Заявл. 15.07.2008; опубл. 29.01.2009.
8. Shiv Kumar. Terminal phosphate labeled nucleotides: synthesis, applications, and linker effect on incorporation by dna polymerases / Shiv Kumar, Anup Sood, Jeffery Wegener et. al. // Nucleosides, Nucleotides, and Nucleic Acids. - 2005. - V. 24 (5-7). - Pp. 401-408.
9. Заявка 2011/0311964 US A1. Labeled reactants and their uses / Jeffrey Wegener, Jonas Korlach. - Заявл. 25.05.2011; опубл. 22.12.2011.
10. Патент 2010/057185 WO A1. Phospholink nucleotides for sequencing applications / Korlach, Jonas - Заявл. 17.11.2009; опубл. 22.12.2011.
11. Bambi Reynolds. Synthesis and stability of novel terminal phosphate-labeled nucleotides / Bambi Reynolds, Rachel Miller, John G. Williams, and Jon P. Anderson. // Nucleosides, Nucleotides, and Nucleic Acids - 2008 - V. 27 - Pp. 18-30.
12. Заявка 2013/0071849 US A1. Fret-labeled compounds and uses therefor / Xiangxu Kong, Gene Shen. - Заявл. 22.03.2012; опубл. 21.03.2013.
13. Заявка 2009100382 WO A1. Cis reactive oxygen quenchers integrated into linkers / Robin Emig, Xiangxu Kong, Geoffrey Otto, Gene Shen - Заявл. 06.02.2009; Опубл. 13.08.2009.
14. Real-Time DNA Sequencing from Single Polymerase Molecules // Science. - 2009. - Vol. 323. - no. 5910. - Pp. 133-138.
15. Monique M. Martin. The pH dependence of fluorescein fluorescence / Monique M. Martin and Lars Lindqvist // Journal of Luminescence. - 1975. - 10. - Pp. 381-390.
16. R.W. Ramette. Rhodamine В Equilibria /. R.W. Ramette, E.B. Sandell // J. Am. Chem. Soc. - 1956. - 78 (19). - Pp. 4872-4878.
17. G. Weber. Fluorescence excitation spectrum of organic compounds in solution. Part 1. - Systems with quantum yield independent of the exciting wavelength / G. Weber and F.W.J. Teale // Trans. Faraday Soc - 1958. - V. 54. - Pp. 640-648.
18. Jonas Korlach. Long, Processive enzymatic dna synthesis using 100% dye-labeled terminal phosphate-linked nucleotides / Jonas Korlach, Arek Bibillo, Jeffrey Wegener et. al. // Nucleosides, Nucleotides and Nucleic Acids - 2008. - V. 27. - Pp. 1072-1083.
19. Xiao-Lan Du. Design and synthesis of a novel fluorescent reagent, 6-oxy-(ethylpiperazine)-9-(2′-methoxycarbonyl) fluorescein, for carboxylic acids and its application in food samples using high-performance liquid chromatography/. Xiao-Lan Du, Hua-Shan Zhang, Ying-Hua Deng, Hong Wang // Journal of Chromatography. - 2008. - V. 1178. - Pp. 92-100.
20. Ji Young Kwon. A Highly Selective Fluorescent Chemosensor for Pb2+ / Ji Young Kwon, Yun Jung Jang, Yoon Ju Lee et. al. // J. Am. Chem. Soc. - 2005. - V. 127. - Pp. 10107-10111.
21. Alexei Toutchkine. Facile Synthesis of Thiol-Reactive Cy3 and Cy5 Derivatives with Enhanced Water Solubility / Alexei Toutchkine, Perihan Nalbant, and Klaus M. Hahn // Bioconjugate Chem. - 2002. - Vol. 13. - No. 3. - Pp. 387-391.
22. Danilovtseva E.N. New fluorescent derivatives of oligopropylamines /. Danilovtseva E.N., Verkhozina O.N., Zelinskiy S.N., Ivanov N.A., Tsiganov P. Yu., Basharina T.N., Annenkov V.V. // ARKIVOC. - 2013. - (iii): 266-281.
23. Зарытова В.Ф. Синтез алкилирующих производных - амидов аденозинтрифосфорной кислоты / Зарытова В.Ф., Кнорре Д.Г., Курбатов В.А., Лебедев А.В., Самуков В.В., Шишкин Г.В. // Биоорганическая химия. - 1975. - Т. 1. - №6. - С. 793-799.
1. Флуоресцентно-меченные дезоксирибонуклеозидтрифосфаты и рибонуклеозидтрифосфаты в качестве флуоресцентно-меченных нуклеотидов имеют следующую общую формулу:Н-Л-Ф,где Н - модифицированный по конечному атому фосфора природный дезоксирибонуклеозидтрифосфат или рибонуклеозидтрифосфат,Л - линкерная группа, присоединенная к конечному атому фосфора,Ф - репортерная флуоресцентная группа,в которых линкерная группа, построенная на основе вторичных диаминов, имеет формулу: N,N′-диметил-1,3-диаминопропан (N2)и может содержать третичную аминогруппу: N1,N3-диметил-N1-[3-(метиламино)пропил]-1,3-пропандиамин (N3),при этом флуоресцентная группа присоединена к линкеру посредством вторичной аминогруппы: где пунктирной линией обозначено продолжение структуры линкера,при этом способ получения флуоресцентно-меченных нуклеотидов осуществляют при помощи следующих последовательных стадий:- вначале присоединяют линкер к флуорофору путем использования красителей, содержащих активный атом галогена (хлор или бром);- затем проводят активацию трифосфатных групп путем превращения их в циклическую ангидридную форму воздействием дициклогексилкарбодиимида;- осуществляют взаимодействие активированных трифосфатов с красителями, содержащими линкерную группу;- проводят очистку целевых соединений осаждением, промывкой органическими растворителями и хроматографированием.
2. Флуоресцентно-меченные дезоксирибонуклеозидтрифосфаты и рибонуклеозидтрифосфаты по п. 1, в которых в качестве модифицированных по конечному атому фосфора природных дезоксирибонуклеозидтрифосфатов или рибонуклеозидтрифосфатов выбраны соединения из следующего списка: аденозин-5′-трифосфат (АТФ), гуанозин-5