4,4,4-трихлор-1-(4-хлорфенил)бутан-1,3-дион, обладающий анальгетической и противомикробной активностями
Иллюстрации
Показать всеИзобретение относится к новому соединению - 4,4,4-трихлор-1-(4-хлорфенил)бутан-1,3-диону формулы (1). Предложенное соединение обладает противомикробной и анальгетической активностями
. 2 табл., 4 пр.
Реферат
Изобретение относится к области органической химии, к новым биологически активным веществам класса 1-замещенных 4,4,4-трихлорбутан-1,3-дионов, а именно к 4,4,4-трихлор-1-(4-хлорфенил)бутан-1,3-диону (1), формулы:
обладающему противомикробной и анальгетической активностями, что позволяет предположить его использование в медицине в качестве лекарственного средства.
Аналогом по структуре заявляемому соединению является 4,4,4-трихлор-1-(2-тиеноил)-бутан-1,3-дион (2), проявляющий фунгицидную активность [Патент США US 3636214 A, 19720118 (1972)] формулы:
В качестве этанола сравнения анальгетической активности взят метамизол натрия [М.Д. Машковский, Лекарственные средства. - М.: Новая волна, 2010 - с. 164]. В качестве этанола сравнения противомикробной активности взяты фенилсалицилат и нистатин [М.Д. Машковский, Лекарственные средства. - М.: Новая волна, 2010 - с. 950, 913].
Задачей изобретения является поиск в ряду 1-замещенных 4,4,4-трихлорбутан-1,3-дионов веществ с выраженным анальгетическим действием, низкой токсичностью и противомикробной активностью
Поставленная задача достигается получением 4,4,4-трихлор-1-(4-хлорфенил)бутан-1,3-диону, который обладает анальгетической и противомикробной активностями.
Заявляемое соединение (1) синтезируют взаимодействием 1,1-диметокси-1-(4-хлорфенил)пропанас хлорангидридом трихлоруксусной кислоты в среде абсолютного хлороформа с последующим выделением целевого продукта известными методами по схеме.
Технический результат - расширение арсенала средств воздействия на живой организм.
Изобретение иллюстрируется следующими примерами:
Пример 1. Получение соединения (1). К охлажденному до 0°C раствору 0,13 моль 1,1-диметокси-1-(4-хлорфенил)пропана и 0,26 моль пиридина в 40 мл абсолютного хлороформа добавляют при перемешивании раствор 0,26 моль хлорангидрида трихлоруксусной кислоты в 30 мл абсолютного хлороформа. Реакционную смесь оставляли при перемешивании на 10-12 часов. По истечению времени добавляли 2М серной кислоты и перемешивали 2 часа при 80°C. Полученную смесь разделяли на делительной воронке, органической слой сушили сульфатом натрия. После удаления растворителя выпавший продукт перекристаллизовывали из гексана. Выход (86%). Т. пл. 69-71°C. (ИК спектр (ФСМ 1202, вазелиновое масло, ν, см-1): 1646, 1595, 1583, 1558 (O=C-C=C). Спектр ЯМР 1H, (VarianMercury 300 (300 MHz), ДМСО-d6, ГМДС, δ, м.д.): 6.76c (1Н, =CH), 7.45д (2Н, Ar), 7.86д (2Н, Ar), 14.19 уш. с (1Н, OH). Найдено, %: C 40.10, H 2.00. C10H6Cl4O2. Вычислено, %: C 82.04, H 2.02.
Полученное соединение (1) представляет собой бледно-желтое кристаллическое вещество, растворимое в хлороформе, ацетоне, не растворимое в воде.
Пример 2. Острая токсичность соединения (1). Острую токсичность (ЛД50, мг/мл) соединения (1) изучали на белых мышах (самках) массой 16-18 г при однократном внутрибрюшинном введении. За животными вели наблюдение в течение 10 суток, фиксируя поведение, интенсивность и характер двигательной активности, наличие и характер судорог, координацию движений, тонус скелетной мускулатуры, реакции на тактильные, звуковые и световые раздражители, частоту и глубину дыхательных движений, ритм сердечных сокращений, состояние волосяного и кожного покрова, окраску видимых слизистых оболочек, потребление воды и пищи, изменение массы тела.
Рассчитывали острую токсичность, соблюдая рекомендации государственного фармакологического комитета по изучению общетоксического действия биологически активных веществ [Методические рекомендации по изучению общетоксического действия фармакологических средств. Утв. 25,12,97 / Вестн. фармакоп. комитета. - 1998. - №1. - C. 27-32.]
Пример 3. Анальгетическая активность соединения (1). Анальгетическую активность соединения (1) изучали на беспородных мышах массой 18-22 г методом термического раздражения «горячая пластинка» [Radell Z.O., Selitto J.J. A method for measurement of analgesic activity on inflamed tissue. // Arch. Intermat. Pharmacodun. Etther. 1957. - Vol. 11. - №4 - S. 409-419].
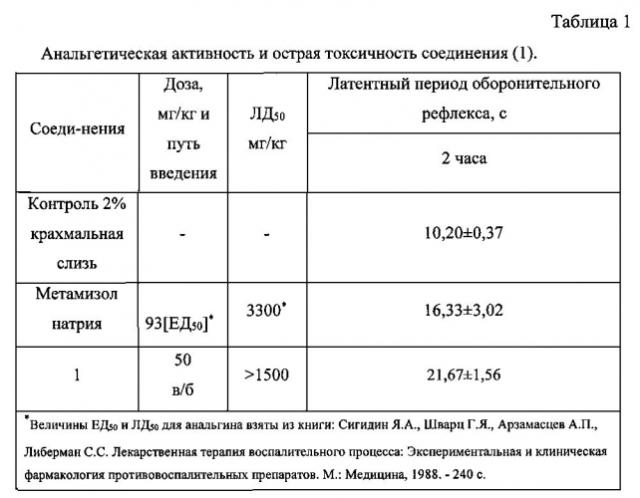
Исследуемое соединение вводили внутрибрюшинно в виде 2% крахмальной слизи в дозе 50 мг/кг за 0,5 ч до помещения животных на нагретую до 53,5°C металлическую пластинку. У интактных животных латентный период оборонительного рефлекса не превышает 10 сек. Показателем болевой чувствительности служила длительность пребывания животного на горячей пластинке до момента облизывания задних лапок, измеряемая в секундах. В качестве стандартного препарата использовали метамизолом натрия (анальгин) [М.Д. Машковский, Лекарственные средства - М.: Новая волна, 2010 - с. 164]. Результаты эксперимента представлены в таблице 1
Как видно из данных таблицы, заявляемое соединение увеличивает время оборонительного рефлекса на 21,67±1,57 с, что выше, чем у препарата сравнения метамизола натрия (16,33±3,02 с). При этом следует учесть, что испытуемая доза метамизола натрия (93 мг/кг) почти в 2 раза превосходит дозу соединения (I) (50 мг/кг). Согласно приведенным данным литературы, метамизол натрия по сравнению с предлагаемым соединением менее токсичен (ЛД50=3300 мг/мл). У соединения (1) для этой величины определено значение >1500 мг/мл.
Согласно классификации К.К. Сидорова, соединение (1) относится к малотоксичным [Измеров Н.Ф., Саноцкий И.В., Сидоров К.К. Параметры токсикометрии промышленных ядов. - М.Медицина, 1977. - с. 196], что делает его перспективным в качестве лекарственного препарата.
Пример 4. Противомикробная активность соединения (1).
Определение бактериостатической, бактерицидной и фунгицидной активности проводили методом двукратных серийных разведений в жидкой питательной среде [Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / Фисенко В.П. (ред.). - М.: ИИА Ремедиум, 2000. - С. 264-273]. Для всех исследуемых соединений были определены МИК (минимальные ингибирующие концентрации) и МБК (минимальная бактерицидная концентрация). Противомикробные свойства заявляемого соединения (1) изучали на 9-и музейных условно-патогенных штаммах микроорганизмов: Staphylococcus (St.) aureus, 906, St. epidermidis 52186, St. saprophyticusATCC 15305, Streptococcusfaecalis, 29212, Bacillussubtilis, 6633, Bacilluscereusvaranthracoides, 96, Escherichiacoli, 1257, Pseudomonasaeruginosa, ATCC27853, Salmonellaenteriditis, ATCC 13076, полученных в ФГБУ «Научный центр экспертизы средств медицинского применения» Минздравсоцразвития России и 3-х клинических (госпитальных) штаммах микроорганизмов: St. aureus, №154, St. haemolyticus, №156, St. cohnii, №160. Противогрибковое действие изучено на музейном штамме Candida (C.) albicans, ATCC 24433, полученном в ФГБУ «Научный центр экспертизы средств медицинского применения» Минздравсоцразвития России и 4-х клинических дрожжевых грибах - С. albicans, №23, С. parapsilosis, №19 и С. krusei, №16.
Посевы бактерий производили в рыбно-пептонный бульон (pH 7,2-7,4), посевы дрожжевых грибов в бульон Сабуро с различной концентрацией испытуемых соединений. Культуры выращивали в пробирках на скошенной агаризированной среде (мясопептонный агар и Сабуро). Для приготовления рабочей взвеси микробов производили смыв выросшей культуры изотоническим раствором хлорида натрия и устанавливали плотность микробной взвеси по стандарту мутности 5 единиц. Далее из полученной микробной взвеси (500 млн м. т./мл) готовили рабочий раствор бактерий с концентрацией 5 млн м. т./мл. Данную взвесь микробов вносили в количестве 0,1 мл в пробирки с серийными разведениями изучаемого препарата. Таким образом, микробная нагрузка при определении ПМА составила 2,5×105 м. т./мл. Изучаемое соединение в количестве 0,05 г растворяли в 5 мл диметилсульфоксида; 1 мл полученного разведения 1:100 соединяли с 4 мл мясопептонного бульона (1:500). Далее готовили ряд серийных разведений соединения с двукратно уменьшающей концентрацией.
Учет результатов контрольных и опытных пробирок учитывали после 18-20 часового (ингибирующее действие) и 7-суточного (бактерицидное действие) термостатирования при температуре 37±1°C - для бактерий, для дрожжевого грибка Candida - 48 часовая культура и 7-суточная. За действующую дозу принимали минимальную ингибирующую концентрацию (МИК) препарата в мкг/мл, которая задерживает рост бактериальных и дрожжевых культур. В случае непрозрачности исследуемых растворов соединений проводили обязательный высев на твердую скошенную питательную среду. Максимально испытанная концентрация соответствовала 1000 мкг/мл. Противомикробную (ингибирующую, бактерицидную, фунгицидную) активность оценивали по минимально действующей концентрации.
Эталоном сравнения служили известные в медицинской практике фенилсалицилат - противомикробное средство и нистатин противогрибковое средство.
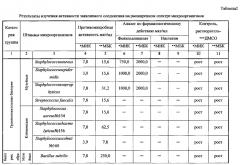
Результаты исследований по заявленному соединению (1) изложены в таблице 2.
Исследования заявляемого соединения изучали на 4-х группах микроорганизмов: грамотрицательные бактерии, грамположительные бактерии, грамположительные бактерии, образующие эндоспоры, и дрожжевые грибы (таблица 1).
Грамположительные бактерии
Исследовано воздействие заявляемого соединения на 4-х видах музейных штаммов и 3-х госпитальных культурах.
Анализ полученных данных показал, что предлагаемое соединение (1) проявляет выраженное ингибирующее и бактерицидное действие в отношение как музейных, так и госпитальных штаммов.
Заявленное соединение (1) ингибирует рост музейных штаммов Streptococcusfaecalis, St. aureus и госпитальной культуры St. aureus, 154 в концентрации 7,8 мкг/мл. Бактерицидные свойства в отношении вышеуказанных микроорганизмов выявлены в концентрации 15,6 мкг/мл, что активнее эталона по фармакологическому действию фенилсалицилата в 96 (ингибирующие свойства) и в 128 раз (бактерицидные свойства) соответственно.
Воздействие заявляемого соединения (1) на музейные штаммы St. epidermidis и St. saprophyticus наблюдалось в концентрации 3,9 мкг/мл и 7,8 мкг/мл, соответственно, т.е. в 256 и 128 раз активнее аналога по фармакологическому действию. Бактерицидное действие в отношение St. epidermidis достигнуто в концентрации 15,6 мкг/мл, гибель же St. saprophyticus выявлена в концентрации 31,2 мкг/мл. В сравнении с эталоном предлагаемое соединение превышает бактерицидное действие в 128 и 64 раза соответственно.
Заявляемое соединение (1) обладает ингибирующим действием в концентрации 3,9 мкг/мл в отношении клинического штамма St. cohnii, бактерицидное действие наступает от воздействия концентрации 7,8 мкг/мл. В отношении же госпитального штамма St. Haemolyticus эффект торможения наступает в концентрации 7,8 мкг/мл, губительное действие на культуру оказывает концентрация в 62,5 мкг/мл. Аналог по фармакологическому действию противомикробными свойствами в отношении этих микроорганизмов не обладает.
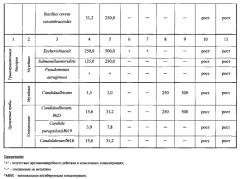
Грамположительные бактерии, образующие эндоспоры
Исследовано воздействие заявляемого соединения на 2-е музейные культуры. Из полученных данных следует, что соединение оказывает ингибирующие свойства, вызывающие торможение роста культуры в концентрации 7,8 мкг/мл в отношении Bacillussubtilis и в концентрации 31,2 мкг/мл в отношение Bacilluscereus. Бактерицидный эффект достигнут в концентрации 250,0 мкг/мл в отношение обеих культур. Препарат сравнения фенилсалицилат антимикробного действия не проявляет в отношении Bacillussubtilis и Bacilluscereus.
Грамотрицательные бактерии
Как видно из таблицы 1, воздействие заявляемого соединения на музейные штаммы менее активны. Противомикробные свойства в отношении Escherichiacoli были проявлены в следующих концентрациях: ингибирующий эффект в концентрации - 250,0 мкг/мл, бактерицидный - 500,0 мкг/мл. Рост культуры Salmonellaenteriditis тормозится в концентрации 125,0 мкг/мл, гибель наступает от концентрации вещества 250,0 мкг/мл. Предлагаемое соединение в испытанных концентрациях противомикробной активностью в отношении Pseudomonasaeruginosa не обладает. Эталон сравнения по фармакологическому действию фенилсалицилат не активен в отношении грамотрицательных бактерий.
Дрожжевые грибки
Данные таблицы 2 свидетельствуют, что заявленное соединение обладает высокой активностью в отношение музейного штамма С. albicans. Выявлена ингибирующая активность в концентрации 1,5 мкг/мл, бактерицидная концентрация составляет 2,0 мкг/мл. В сравнении с противогрибковым средством - нистатином, заявляемое соединение активнее в 166 (ингибирующее действие) и 250 (фунгицидное действие) раз, соответственно. Прототип по структуре формулы (2) этими свойствами не обладает.
Преимуществом предлагаемого соединения является его активность в отношении клинических дрожжевых грибков (С. albicans, 23, С. parapsilosisn С. krusei). Концентрация 3,9 мкг/мл заявляемого соединения обладает ингибирующим действием в отношении культуры С. parapsilosis, гибель грибка отмечена при воздействии концентрации 7,8 мкг/мл.
Торможение роста C. albicans, 23 и С. krusei наступает в концентрации 15,6 мкг/мл, а фунгицидный эффект достигнут в концентрации 31,2 мкг/мл в отношение обеих культур. Антигрибковые действия препарата сравнения нистатина на клинических культурах не изучены.
В связи с тем, что соединение формулы (1) обладает выраженными антимикробными и противогрибковыми свойствами в отношении широкого ряда как музейных, так и госпитальных штаммов микроорганизмов, они могут найти применение в практической медицине.
4,4,4-трихлор-1-(4-хлорфенил)бутан-1,3-дион (1), формулы: отличающийся тем, что обладает противомикробной и анальгетической активностями.