Ингибиторы апоптоза и их применение
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению антиапоптозных фрагментов белка DAXX, и может быть использовано в медицине для лечения острого инфаркта миокарда (AMI), церебрального инфаркта, при трансплантации органов, операциях на сердце, острых нарушениях кровообращения, реперфузионных повреждениях и ишемии. Получают биологически активные фрагменты из 17-24 последовательных аминокислот белка DAXX, включающих KKSRKEKKQTGSGPLG, а также их пептидомиметики и конъюгаты с проникающим в клетки пептидом. Изобретение позволяет эффективно ингибировать апоптоз клеток, в частности апоптоз клеток, опосредованный рецептором Fas. 12 н. и 10 з.п. ф-лы, 17 ил., 4 табл., 1 пр.
Реферат
Родственная заявка
Настоящая патентная заявка претендует на приоритет по Международной патентной заявке №PCT/IB2010/003158, поданной 18 ноября 2010 г., которая включена сюда путем ссылки во всей полноте.
Область техники, к которой относится изобретение
Изобретение имеет отношение к ингибиторам апоптоза и их применению, в частности в медицине.
Уровень техники
Коронарная болезнь сердца является ведущей причиной смертности во всем мире, что составляет 3,8 млн смертей у мужчин и 3,4 млн смертей у женщин в год. По мере старения популяции и распространения сопутствующих заболеваний (например, ожирения и метаболического синдрома), как в последние годы, огромное бремя для общественного здравоохранения, обусловленное ишемической болезнью сердца, вероятно будет еще больше возрастать (см. обзор в Yellon et al., N Engl J Med, 2007, 357: 1121-1135).
Коронарная болезнь сердца означает неспособность коронарного кровообращения обеспечить адекватное кровоснабжение сердечной мышцы и окружающей ткани. Наиболее распространенной причиной развития коронарной болезни сердца является скопление атероматозных бляшек (т.е. жировых отложений) в стенках коронарных артерий. Закупорка коронарных артерий ограничивает приток крови к сердцу, вызывает ишемию клеток миокарда (т.е. голодание клеток вследствие отсутствия кислорода) и может привести к гибели клеток миокарда, что называют инфарктом миокарда (MI) или острым инфарктом миокарда (AMI) - широко известным как сердечный приступ. AMI является ведущей причиной смертности как в Европе, так и в США, и остается распространенным (более 1,5 млн новых случаев за год в США) и вызывающим инвалидность (приводящим к сердечной недостаточности) заболеванием. Главным фактором, определяющим восстановление функции миокарда и смертность после AMI, является размер инфаркта. В настоящее время наиболее эффективным способом ограничения размера инфаркта является как можно более быстрая реперфузия пораженного миокарда при помощи коронарной ангиопластики или тромболиза и предотвращение повторной закупорки коронарной артерии с помощью антитромбоцитарной терапии. Реперфузия или восстановление притока крови в ишемический миокард достигается тромболитической терапией, растворяющей тромб, или расширением закупоренной артерии с помощью чрескожной коронарной ангиопластики. Реперфузия необходима для спасения клеток миокарда и сердечной функции в целом. Однако реперфузия запускает каскад событий, вызывающих "реперфузионное повреждение". Оно также возникает при восстановлении от кардиоплегической остановки сердца во время операции шунтирования. Реперфузионное повреждение характеризуется аритмией, дисфункцией эндотелия, вызывающей явление потери кровотока, и оглушением миокарда (обратимой потерей сократимости миокарда).
Кульминацией реперфузионного повреждения является апоптотическая гибель тех сердечных клеток, которые были жизнеспособными непосредственно перед реперфузией миокарда. Участие сильно зарегулированной формы гибели клеток при ишемии/ реперфузии миокарда может привести к появлению новых форм лечебного воздействия в фазе реперфузии. Однако сигнальные пути апоптоза, задействованные при ишемии/реперфузии миокарда, еще не полностью установлены in vivo.
Таким образом, поиск новых способов лечения для ингибирования апоптоза (т.е. "запрограммированной гибели клеток"), в частности для лечения инфаркта миокарда и реперфузионного повреждения, представляет реальный прорыв для защиты функции сердца и спасения жизней.
Сущность изобретения
Изобретение основывается на открытии того, что можно уменьшить апоптоз сердечных клеток после инфаркта миокарда путем ингибирования сигнального пути Fas. Рецептор Fas подвергается тримеризации при связывании с FasL (лигандом Fas) и индуцирует апоптоз через цитоплазматический домен, называемый DD (домен смерти), который взаимодействует с сигнальными адаптерами, такими как FAF-1 (связанный с Fas фактор-1), FADD (связанный с Fas домен смерти), DAXX (связанный с доменом смерти белок), FAP-1, FLASH (связанный с FLICE гигантский белок) и RIP (взаимодействующий с рецептором белок). DAXX и FADD независимо связываются с Fas и активируют различные пути апоптоза. DAXX может усиливать опосредованный Fas апоптоз путем активации каскада киназы JNK, который завершается фосфорилированием и активацией таких факторов транскрипции, как c-Jun. В противоположность этому FADD, через каскад сигнальных каспаз, запускает высвобождение митохондриальных проапоптотических факторов типа CytoC (цитохром-C) и SMAC (второго происходящего из митохондрий активатора каспаз), также называемого Diablo.
Авторы изобретения показали, что ингибирование взаимодействия рецептора Fas с DAXX (SEQ ID NO: 1) или FADD (SEQ ID NO: 8) приводит к сильному снижению апоптоза сердечных клеток после инфаркта миокарда. Кроме того, авторы настоящего изобретения неожиданно обнаружили, что небольшие фрагменты DAXX и FADD сохраняют антиапоптозную способность полных белков DAXX и FADD, соответственно.
Соответственно, настоящее изобретение касается пептидов, содержащих:
- фрагмент из 16, 17, 18, 19, 20, 21, 22, 23 или 24 последовательных аминокислотных остатков белка DAXX по SEQ ID NO: 1, причем данный фрагмент включает аминокислотную последовательность, приведенную в SEQ ID NO: 5, или
- фрагмент из 9, 10, 11, 12, 13, 14, 15, 16 или 17 последовательных аминокислотных остатков белка FADD по SEQ ID NO: 8, причем данный фрагмент включает аминокислотную последовательность, приведенную в SEQ ID NO: 12,
при этом данный пептид способен ингибировать апоптоз клеток.
В некоторых воплощениях антиапоптозный пептид по изобретению представлен фрагментом белка DAXX, состоящим из аминокислотной последовательности, приведенной в SEQ ID NO: 5. В других воплощениях антиапоптозный пептид по изобретению представлен фрагментом белка DAXX, состоящим из аминокислотной последовательности, приведенной в любой из SEQ ID NOs: 21-44.
В других воплощениях антиапоптозный пептид по изобретению представлен фрагментом белка FADD, состоящим из аминокислотной последовательности, приведенной в SEQ ID NO: 12 или SEQ ID NO: 9. В других воплощениях антиапоптозный пептид по изобретению представлен фрагментом белка FADD, состоящим из аминокислотной последовательности, приведенной в любой из SEQ ID NOs: 45-57.
В другом аспекте настоящее изобретение касается пептидомиметиков антиапоптозных пептидов по изобретению.
В следующем аспекте настоящим изобретением предусмотрены конъюгаты, включающие антиапоптозные пептиды или пептидомиметики по изобретению, соединенные с проникающим в клетку пептидом. Проникающий в клетку пептид может быть представлен Tat, RXR, Bpep или Pip2b.
В некоторых воплощениях проникающий в клетку пептид соединяется с пептидом или пептидомемитиком через линкер.
В некоторых воплощениях проникающий в клетку пептид выбирается из группы, состоящей из Tat, RXR, Bpep и Pip2b.
В частности, в некоторых предпочтительных воплощениях конъюгат состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60 или SEQ ID NO: 61.
В следующем аспекте настоящее изобретение касается фармацевтических композиций, содержащих по меньшей мере один фармацевтически приемлемый носитель или наполнитель и эффективное количество по меньшей мере одного пептида, или по меньшей мере одного пептидомиметика, или по меньшей мере одного конъюгата по изобретению.
В некоторых воплощениях фармацевтические композиции по изобретению дополнительно содержат по меньшей мере одно дополнительное биологически активное средство. В частности, биологически активное средство может быть выбрано из группы, состоящей из циклоспорина A, BH4 и их комбинаций.
В следующем аспекте настоящим изобретением предусмотрены пептиды, пептидомиметики, конъюгаты и фармацевтические композиции по изобретению для применения в способах лечения людей или животных, в частности для применения в способе ингибирования клеточного апоптоза у человека или животных.
В некоторых воплощениях пептиды, пептидомиметики, конъюгаты и фармацевтические композиции по изобретению применяются в способе лечения острого инфаркта миокарда (AMI), церебрального инфаркта, при трансплантации органов, операциях на сердце (экстракорпоральном кровообращении и временной окклюзии сосудов) или остром нарушении кровообращения (состоянии шока) у человека или животных.
В других воплощениях пептиды, пептидомиметики, конъюгаты и фармацевтические композиции по изобретению применяются в способе лечения ишемии, в частности сердечной ишемии, почечной ишемии, ишемического колита, брыжеечной ишемии, ишемии головного мозга, ишемии конечностей или кожи у человека или животных.
В следующих воплощениях пептиды, пептидомиметики, конъюгаты и фармацевтические композиции по изобретению применяются в способе лечения реперфузионного повреждения у человека или животных.
В родственном аспекте настоящим изобретением также предусмотрен способ лечения заболеваний, связанных с апоптозом у субъекта, который включает стадию: введения данному субъекту эффективного количества по меньшей мере одного пептида, или по меньшей мере одного пептидомиметика, или по меньшей мере одного конъюгата, или по меньшей мере одной фармацевтической композиции по изобретению.
В некоторых воплощениях способ дополнительно включает стадию введения данному субъекту по меньшей мере одного дополнительного биологически активного средства, выбранного из группы, состоящей из циклоспорина A, BH4 и их комбинаций.
Как указано выше, в этих способах лечения заболевание, связанное с апоптозом, может быть выбрано из группы, состоящей из острого инфаркта миокарда (AMI), церебрального инфаркта, трансплантации органов, операций на сердце, острых нарушений кровообращения, реперфузионного повреждения и ишемии.
Эти и другие цели, преимущества и особенности настоящего изобретения станут понятными рядовым специалистам после прочтения следующего подробного описания предпочтительных воплощений.
Краткое описание чертежей
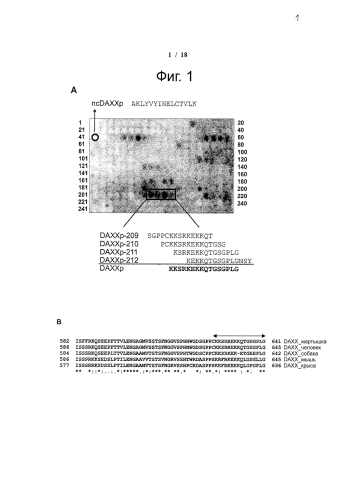
Фиг.1. Определение эпитопа DAXX методом SPOT-синтеза. (А) Аминокислотную последовательность DAXX нарезали на перекрывающиеся наборы пептидов (пепскан; 15-мерные пептиды со сдвигом в 3 аминокислоты) и анализировали методом ферментной блот-гибридизации. Черным прямоугольником выделены четыре наиболее ярких пятна с соответствующими последовательностями эпитопа. Условия инкубации: His-теговый внутриклеточный участок рецептора Fas [10 мкг/мл]; антитела: анти-His-(мышь) (Sigma H1029, 1:6000) / против мыши с HRP (Calbiochem 401207, 1:2000), время обработки: 1 мин. (В) Выравнивание последовательности DAXX человека, содержащей 16-мер KKSRKEKKQTGSGPLG (=DAXXp SEQ ID NO: 5), с последовательностями DAXX из других видов (мышь, крыса, собака (CANFA) и зеленая мартышка (CHLAE)).
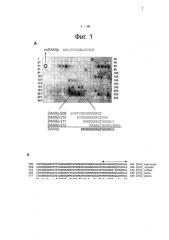
Фиг.2. Определение оптимальной длины эпитопа DAXX (=DAXXp) методом SPOT-синтеза. (А) Пептиды DAXXp-211 и DAXXp-209 (SEQ ID NO: 2 и SEQ ID NO: 3, соответственно) последовательно урезали на один аминокислотный остаток с N-конца, C-конца и одновременно с C-конца и N-конца и анализировали методом ферментной блот-гибридизации. Пятна, указанные стрелками, проявляли самые высокие интенсивности сигнала (BLU). Условия инкубации: His-теговый внутриклеточный участок рецептора Fas [10 мкг/мл]; антитела: анти-His-(мышь) (Sigma H1029, 1:6000)/против мыши с HRP (Calbiochem 401207, 1:2000), время обработки: 1 мин. (В) Выравнивание последовательностей двух пептидов DAXXp-211 и DAXXp-209, соответствующих наиболее ярким пятнам, для определения оптимальной последовательности пептидов DAXX.
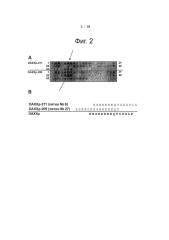
Фиг.3. Оценка подверженности Tat-DAXXp и Pip2b-DAXXp протеазам. (А) Определение стабильности конъюгатов Tat-DAXXp и Pip2b-DAXXp в эмбриональной бычьей сыворотке (FBS, BioWest) и (В) свежеприготовленной мышиной сыворотке (MS). Пептиды инкубировали с 20% сывороткой при 37°C в течение 0 ч, 1 ч, 2 ч, 4 ч, 8 ч, 24 ч и 48 ч, а затем 50 мкл инкубационной смеси осаждали в 100 мкл 10% дихлоруксусной кислоты (DCA) в H2O/CH3CN (50/50). Образцы смешивали и хранили при -20°C. Осажденные сывороточные белки разделяли центрифугированием (14000 об/мин, 10 мин) и анализировали супернатанты методом обратнофазовой HPLC (измерение площади пиков в mV×сек). При каждой обработке n≥2. После 2 ч инкубации в мышиной сыворотке более 70% пептидов оставались интактными, а через 24 ч все пептиды разлагались.
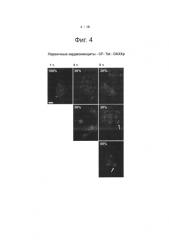
Фиг.4. Клеточное распределение зависит от времени инкубации. Первичные кардиомиоциты инкубировали с 1 мкМ раствором меченных CF конъюгатов Tat-DAXXp (зеленая флуоресценция) в течение 1 ч, 4 ч или 6 ч. Клеточные ядра окрашивали с помощью красителя Hoechst (синие). Белые полоски - 10 мкм. После 1-часовой инкубации внутриклеточное распределение CF-Tat-DAXXp проявляло точечный профиль в цитозоле (что характерно для эндосомной локализации пептидов после интернализации посредством эндоцитоза), а ядерная локализация не обнаруживалась. После 4-часовой инкубации оказалось, что CF-Tat-DAXXp может высвобождаться из эндосомных пузырьков, что дает более диффузный профиль окрашивания. Кроме того, наблюдалось и накопление в ядре. После более продолжительной инкубации (6 ч) CF-меченный пептид инкапсулировался в большие пузырьки (белые стрелки) и выводился из клеток.
Фиг.5. Оценка антиапоптозной активности CPPs и конъюгатов CPP in vitro. Последовательность операций и количественная оценка фрагментации ДНК в клетках C2C12 (A), первичных кардиомиоцитах (B), клетках H9c2 (С) и клетках NG108-15 (D). Данные нормировали к 100% по STS. Данные представляют средние значения ±SEM при n≥5. Клетки высеивали в 24-луночные планшеты и культивировали в течение ночи. На следующий день клетки инкубировали с STS отдельно или с STS+1 мкМ пептида (в OptiMEM) (концентрация STS и время инкубации для каждых клеток приведены на рисунке). После этого растворы удаляли, заменяли их полной средой и инкубировали еще 40 ч. После фазы регенерации клетки подвергали лизису и определяли фрагментацию ДНК согласно инструкциям производителя (набор для определения гибели клеток Cell Death detection ELISAPLUS kit фирмы Roche Diagnostics).
Фиг.6. Антиапоптозная активность вариантов последовательности Tat-DAXXp на первичных кардиомиоцитах. Как описано в подписи к фиг.5, различные аналоги последовательности DAXXp (см. табл.2) оценивали на антиапоптозные свойства против STS (набор Cell Death detection ELISAPLUS фирмы Roche Diagnostics). Ни один из аналогов не смог защитить первичные кардиомиоциты - факт, который подтверждает, что 16-мер DAXXp имеет оптимальную длину и последовательность для самого сильного кардиопротекторного действия.
Фиг.7. Сравнение DAXXp мыши/крысы с последовательностью DAXXp человека по антиапоптозной активности на клетках C2C12, первичных кардиомиоцитах и H9c2. Последовательность DAXXp мыши, конъюгированного с Tat (Tat-mDAXXp - SEQ ID NO: 61), которая идентична последовательности DAXXp крысы (см. фиг.1B), сравнивали с конструкцией человека (Tat-DAXXp) в отношении антиапоптозных свойств против STS (набор Cell Death detection ELISAPLUS фирмы Roche Diagnostics). Использовали клетки C2C12 и первичные кардиомиоциты мыши и клетки H9c2 крысы. Во всех клетках наблюдалось усиление антиапоптозного действия при использовании последовательности Tat-mDAXXp мыши вследствие мышиного или крысиного типа клеток.
Фиг.8. Определение FADDpl5 и его антиапоптозного действия на кардиомиоцитах. (A) Последовательность белка FADD нарезали на перекрывающиеся комплекты пептидов (пепскан; 15-мерные пептиды со сдвигом в 3 аминокислоты) и анализировали методом ферментной блот-гибридизации. Черным прямоугольником выделены три наиболее ярких пятна, а соответствующие последовательности эпитопа, номера пятен и интенсивности сигнала (BLU) приведены ниже. (B) Последовательность пептида FADDp-11 (=FADDp15=SEQ ID NO: 9) последовательно урезали на один аминокислотный остаток с C-конца, N-конца или одновременно с C-конца и N-конца и анализировали методом ферментной блот-гибридизации. Пятна, указанные стрелками, проявляли самые высокие интенсивности сигнала (BLU). Самый короткий эпитоп FADD (9-мер с последовательностью KRKLERVQS (=FADDp=SEQ ID NO: 12)) соответствовал пятну №24. Условия инкубации: His-теговый внутриклеточный участок рецептора Fas [10 мкг/мл]; антитела: анти-His-(мышь) (Sigma H1029, 1:6000) / против мыши с HRP (Calbiochem 401207, 1:2000), время обработки: 1 мин.
Фиг.9. Сравнение конструкций FADDp с Tat-DAXXp в отношении антиапоптозной активности на первичных кардиомиоцитах и на клетках H9c2. Количественная оценка фрагментации ДНК на первичных кардиомиоцитах (A) и клетках H9c2 (B). Данные нормировали к 100% STS. Данные представляют средние значения ±SEM при n≥5. Клетки высеивали в 24-луночные планшеты и культивировали в течение ночи. На следующий день клетки инкубировали с STS отдельно или с STS+1 мкМ пептида (в OptiMEM) (концентрация STS приведена на рисунке, а время инкубации приведено на фиг.5). После этого растворы удаляли, заменяли их полной средой и инкубировали еще 40 ч. После фазы регенерации клетки подвергали лизису и определяли фрагментацию ДНК согласно инструкциям производителя (набор для определения гибели клеток Cell Death detection ELISAPLUS фирмы Roche Diagnostics). Короткая последовательность Tat-FADDp оказалась менее эффективной, чем Tat-DAXXp, но более длинная Tat-FADDp 15 обладала равным (на H9c2) или более сильным антиапоптозным действием (на первичных кардиомиоцитах).
Фиг.10. Сравнение Tat-DAXXp и Tat-FADDp15 одних или в комбинации на первичных кардиомиоцитах и клетках H9c2. Инкубация с 0,5 мкМ Tat-DAXXp вместе с 0,5 мкМ Tat-FADDp15, как оказалось, дает такой же или даже больший антиапоптозный эффект по сравнению с одним только пептидом при 1 мкМ. Кроме того, инкубация с обоими пептидами при 1 мкМ давала наибольшую защиту при обоих типах клеток, свидетельствуя о том, что комбинация Tat-DAXXp и Tat-FADDp15 может оказаться перспективной для применения.
Фиг.11. Методика экспериментов in vivo. Мышей C57B16 подвергали хирургической операции ишемии миокарда с реперфузией (IR). Черной рамкой представлена продолжительность ишемии, которой подвергались мыши. По окончании операции для каждой методики проводили измерения размера инфаркта или гибели клеток (указано ↑). IR60': 40 мин ишемии, 60 мин реперфузии. IR24h: 40 мин ишемии и 24 ч реперфузии.
Фиг.12. Кардиопротекторные эффекты Tat-DAXXp (1 мг/кг в/в) на мышах, подвергавшихся IR60'. Определяли размер инфаркта (в % от зоны риска AR) и измеряли фрагментацию межнуклеосомной ДНК методом ELISA у мышей, подвергавшихся IR60' и обработанных Tat, Tat-DAXXp или Tat-scrDAXXp (1 мг/кг), а также DAXXp (10 мг/кг) (внутривенное введение (в/в) за 5 мин до реперфузии). Представлены средние значения ±SEM для:(A) площади зоны риска AR/массы LV (левого желудочка), (B) размера инфаркта (в % от площади зоны риска AR) и (C) отношения I/NI, соответствующего соотношению растворимых нуклеосом в ишемической части относительно неишемической части тканей LV. Статистический анализ проводили односторонним методом ANOVA с посткритерием Neuman-Keuls для множественных сравнений (программа GraphPad Prism). Значения P<0,05, P<0,01 и P<0,001 по сравнению с Tat-DAXXp отмечены как *, ** и *** соответственно. P=ns (не значимо, н.з.) для P>0,05.
Фиг.13. Доза-эффект для Tat-DAXXp и DAXXp на мышах, подвергавшихся IR60'. Определяли размер инфаркта (в % от зоны риска AR) и измеряли фрагментацию межнуклеосомной ДНК методом ELISA у мышей, подвергавшихся IR60' и обработанных Tat (1 мг/кг), Tat-DAXXp (0,1, 1 и 10 мг/кг) или DAXXp (0,1, 1 и 10 мг/кг) при внутривенном введении за 5 мин до реперфузии. Представлены средние значения ±SEM для: (A) площади зоны риска AR/массы LV (левого желудочка), (B) размера инфаркта (в % от площади зоны риска AR) и (C) отношения I/NI, соответствующего соотношению растворимых нуклеосом в ишемической части относительно неишемической части тканей LV.
Фиг.14. Кардиопротекторные эффекты Tat-DAXXp (1 мг/кг в/в) на мышах, подвергавшихся IR24h. Определяли размер инфаркта (в % от зоны риска AR) и измеряли фрагментацию межнуклеосомной ДНК методом ELISA у мышей, подвергавшихся IR24h и обработанных Tat, Tat-DAXXp или Tat-scrDAXXp (1 мг/кг), а также DAXXp (10 мг/кг) (в/в введение за 5 мин до реперфузии). Представлены средние значения ±SEM для: (A) площади зоны риска AR/массы LV (левого желудочка), (B) размера инфаркта (в % от площади зоны риска AR) и (C) отношения I/NI, соответствующего соотношению растворимых нуклеосом в ишемической части относительно неишемической части тканей LV. Статистический анализ проводили односторонним методом ANOVA с посткритерием Neuman-Keuls для множественных сравнений (программа GraphPad Prism). Значения P<0,05, P<0,01 и P<0,001 по сравнению с Tat-DAXXp отмечены как *, ** и ***, соответственно. P=ns (не значимо, н.з.) для P>0,05.
Фиг.15. Доза-эффект для Tat-DAXXp и DAXXp на мышах, подвергавшихся IR24h. Измеряли площадь зоны риска и размер инфаркта (в % от зоны риска AR) у мышей, подвергавшихся IR24h и обработанных Tat (1 мг/кг), Tat-DAXXp (0,1, 1 и 10 мг/кг) или DAXXp (0,1, 1 и 10 мг/кг) при внутривенном введении за 5 мин до реперфузии. Представлены средние значения ±SEM для: (А) площади зоны риска AR/массы LV (левого желудочка), (B) размера инфаркта (в % от площади зоны риска AR).
Фиг.16. Визуализация конструкций Tat-DAXXp в миокарде. Мышам во время реперфузии вводили 1 мг/кг конструкции CF-Tat-DAXXp (CF = карбоксифлуоресцеин). Через 2 ч после фиксации параформальдегидом (4% PFA в фосфатном буфере) делали срезы LV (20 мкм) на вибратоме. На конфокальных снимках в 2 мкм четко видно зеленое окрашивание в миоцитах, что свидетельствует о присутствии пептидной конструкции в цитозоле. Кружочками выделено присутствие пептидной конструкции в DAPI-положительном ядре, как это наблюдалось в нескольких случаях (масляная иммерсия, ×40).
Фиг.17. Предварительные данные о повреждении от холодовой ишемии/реперфузии при трансплантации почек. Смерть мозга и длительная холодовая ишемия являются главными причинами неблагоприятного долгосрочного исхода при трансплантации почек от умерших доноров, причем этот эффект еще больше усиливается при использовании растянутых критериев для доноров ("маргинальные органы"). Воздействие на воспаление трансплантатов при вызванном ишемией-реперфузией (IR) повреждении является привлекательной концепцией для улучшения исхода у таких трансплантатов. (A) Последовательность операций холодовой ишемии/реперфузии при трансплантации почек у крыс. После 24-часовой холодовой ишемии трансплантаты почек пересаживали ортотопически самцам-реципиентам LEW с использованием стандартных методов микрохирургии. Пептиды вводили сразу после реперфузии в виде одной в/в инъекции в дозе 1 мг/кг. Через три дня после трансплантации трансплантаты извлекали для анализа методом RT-ПЦР (n=3). (B) Тотальный препарат РНК подвергали обратной транскрипции в кДНК и проводили количественную RT-ПЦР в реальном времени на установке GeneAmp 5700 Sequence Detection System (Applied Biosystems, Weiterstadt, Германия). Реакции Taqman-ПЦР для ICAM-1, IFN-γ, TNF-α, интерлейкина (IL)-6 и bcl-2 (синтезирован на фирме Metabion, Martinsried, Германия) проводили в конечном объеме 25 мкл. Эти предварительные данные свидетельствуют, что в присутствии Tat-DAXXp происходит снижение экспрессии мРНК IFN-γ и ICAM-1 в трансплантатах почек через 3 дня после трансплантации.
Определения
По всему описанию используются некоторые термины, которые определены в следующих параграфах.
Термины "белок", "полипептид" и "пептид" в настоящем изобретении используются взаимозаменяемым образом и относятся к аминокислотным последовательностям различной длины либо в нейтральной форме (незаряженные), либо в виде солей, а также либо немодифицированные, либо модифицированные посредством гликозилирования, окисления боковых цепей или форфорилирования. В некоторых воплощениях аминокислотная последовательность представлена полноразмерным нативным белком. Однако в предпочтительных воплощениях аминокислотная последовательность представлена фрагментом полноразмерного белка. В других воплощениях аминокислотная последовательность модифицирована дополнительными заместителями, присоединенными к боковым цепям аминокислот, такими как гликозильные звенья, липиды или такие неорганические ионы, как фосфаты, а также модификации, связанные с химическим преобразованием цепей, как то: окислением сульфгидрильных групп. Таким образом, термин "белок" (или эквивалентные ему термины) охватывает аминокислотные последовательности полноразмерного нативного белка или его фрагмента при условии, что эти модификации существенно не изменяют его специфические свойства. В частности, термин "белок" охватывает изоформы белка, т.е. варианты, которые кодируются одним и тем же геном, но различаются по значениям pI, или м.в., или того и другого. Такие изоформы могут отличаться по аминокислотной последовательности (например, в результате альтернативного сплайсинга или ограниченного протеолиза) или же могут возникать при дифференциальной посттрансляционной модификации (например, гликозилировании, ацилировании, фосфорилировании).
Термин "аналог" в применении к белку или полипептиду означает такой пептид, который обладает сходной или идентичной функцией, что и белок или полипептид, но необязательно имеет аминокислотную последовательность, сходную или идентичную аминокислотной последовательности белка или полипептида, либо структуру, сходную или идентичную таковой у белка или полипептида. Предпочтительно, в контексте настоящего изобретения, аналог имеет аминокислотную последовательность, которая по меньшей мере на 30%, более предпочтительно по меньшей мере на 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99% идентична аминокислотной последовательности белка или полипептида. В некоторых предпочтительных воплощениях аналог белка имеет аминокислотную последовательность, которая по меньшей мере на 80% или по меньшей мере на 85%, предпочтительно по меньшей мере на 90% или наиболее предпочтительно по меньшей мере на 95% идентична аминокислотной последовательности белка.
Термин "фрагмент" в применении к белку или полипептиду означает такой пептид, который имеет аминокислотную последовательность из не менее 5 последовательных аминокислотных остатков и не более 30 последовательных аминокислотных остатков белка или полипептида, к примеру, из 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 последовательных аминокислотных остатков белка или полипептида, предпочтительно из 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 последовательных аминокислотных остатков белка или полипептида, более предпочтительно из 9, 10, 11, 12, 13, 14, 15, 16 или 17 последовательных аминокислотных остатков белка или полипептида. В контексте настоящего изобретения фрагмент белка или полипептида сохраняет функциональную активность полноразмерного белка или полипептида.
Термин "гомологичный" (или "гомологичность") в настоящем изобретении является синонимом термину "идентичность" и означает сходство последовательности между двумя полипептидными молекулами. Если какое-то положение в обеих сравниваемых последовательностях занимает один и тот же аминокислотный остаток, то соответствующие молекулы являются гомологичными по этому положению. В настоящем изобретении степень идентичности последовательностей означает сравнение между аминокислотными последовательностями и определяется путем сравнения двух оптимально выровненных последовательностей в окне сравнения, при этом часть аминокислотной последовательности в окне сравнения может содержать вставки или делеции (т.е. пробелы) в сравнении с контрольной последовательностью (не содержащей вставок или делеции) для оптимально выравнивания двух последовательностей. Степень можно рассчитать путем определения числа положений, по которым в обеих последовательностях находятся идентичные аминокислотные остатки, получая число совпадающих положений, деления числа совпадающих положений на общее число положений в окне сравнения и умножения результата на 100, получая степень идентичности последовательностей в процентах. С другой стороны, степень можно рассчитать путем определения числа положений, по которым в обеих последовательностях либо находятся идентичные аминокислотные остатки, либо аминокислотные остатки совмещаются с пробелами, получая число совпадающих положений, деления числа совпадающих положений на общее число положений в окне сравнения и умножения результата на 100, получая степень идентичности последовательностей в процентах. Специалистам должно быть известно, что существует много установленных алгоритмов для выравнивания двух последовательностей. Оптимальное выравнивание последовательностей для их сравнения может проводиться, например, с помощью алгоритма локальной гомологии Smith and Waterman, 1981, Adv. Appl. Math. 2:482, с помощью алгоритма выравнивания по гомологии Needleman and Wunsch, 1970, J. Mol. Biol. 48:443 методом поиска сходства Pearson and Lipman, 1988, Proc. Natl. Acad. Sci. USA 85:2444, используя компьютерные реализации этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в пакете программного обеспечения GCG Wisconsin Software Package) либо путем визуального осмотра (вообще см. Current Protocols in Molecular Biology, F.M. Ausubel et al., eds.. Current Protocols, a joint venture between Greene Publishing Associates, Inc. and John Wiley & Sons, Inc. (1995 Supplement) (Ausubel)). Примерами алгоритмов, подходящих для определения степени идентичности последовательностей, являются алгоритмы BLAST и BLAST 2.0, которые описаны в Altschul et al., 1990, J. Mol. Biol. 215: 403-410; и Altschul et al., 1977, Nucleic Acids Res. 3389-3402; соответственно.
Гомологичные аминокислотные последовательности имеют идентичные или сходные аминокислотные последовательности. В контексте настоящего изобретения сходные остатки представляет собой консервативные замены или "разрешенные точечные мутации" соответствующих аминокислотных остатков в контрольной последовательности. "Консервативные замены" остатков в контрольной последовательности являются такими заменами, которые физически или функционально сходны с соответствующим контрольным остатком, например, имеют сходный размер, форму, электрический заряд, химические свойства, включая способность к образованию ковалентных или водородных связей, и т.п. Особенно предпочтительны такие консервативные замены, которые соответствуют критериям, установленным для "разрешенных точечных мутаций" в Dayhoff et al. ("Atlas of Protein Sequence and Structure", 1978, Nat. Biomed. Res. Foundation, Washington, DC, Suppl. 3, 22: 354-352).
В контексте настоящего изобретения термин "лечение" применяется для характеристики способа, который предназначается для замедления или предупреждения возникновения заболевания, замедления или прекращения прогрессирования, обострения или ухудшения симптомов заболевания, для ослабления симптомов заболевания и/или излечения заболевания. Лечение может проводиться до возникновения заболевания для профилактического или предупреждающего действия. С другой стороны, оно может проводиться после возникновения заболевания для терапевтического действия.
Термин "субъект" в настоящем изобретении относится к людям или животным, в частности млекопитающим (например, приматам, собакам, кошкам, козам, лошадям, свиньям, мышам, крысам, кроликам и др.), которые могут быть поражены заболеванием, связанным с апоптозом, но могут и не страдать этим заболеванием. Во многих воплощениях настоящего изобретения субъектом является человек. В таких воплощениях субъект часто именуется "индивидом". Термин "индивид" не означает какой-то конкретный возраст, поэтому он охватывает детей, подростков и взрослых.
"Фармацевтическая композиция" определяется здесь как содержащая эффективное количество пептида по изобретению и по меньшей мере одного фармацевтически приемлемого носителя или наполнителя.
Термин "эффективное количество" в настоящем изобретении относится к такому количеству пептида, соединения, средства или композиции, которое достаточно для выполнения своего прямого назначения, например требуемого биологического ответа в клетках, ткани, системе или у субъекта. Например, в некоторых воплощениях настоящего изобретения назначением может быть: ингибирование, предотвращение или уменьшение апоптоза, такого, к примеру, как апоптоз, связанный с реперфузионным повреждением или трансплантацией органа; и/или предотвращение или лечение заболеваний, связанных с апоптозом.
Термин "фармацевтически приемлемый носитель или наполнитель" относится к такой среде носителя, которая не влияет на эффективность биологической активности активного ингредиента и практически не токсична для организма в той концентрации, при которой она вводится. Термин охватывает растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, изотонические средства и вещества, замедляющие всасывание, и др. Применение таких сред и средств для фармацевтически активных субстанций хорошо известно в данной области (например, см. "Remington's Pharmaceutical Sciences", E.W. Martin, 18th Ed., 1990, Mack Publishing Co.: Easton, PA, который включен сюда путем ссылки во всей полноте).
Раскрытие сущности изобретения
Как указано выше, настоящее изобретение имеет отношение к пептидам с антиапоптозными свойствами, которые применимы в качестве терапевтических средств при лечении и/или профилактике большого числа заболеваний, связанных с апоптозом.
Пептиды, ингибирующие апоптоз клеток
Пептиды по изобретению включают фрагменты DAXX и фрагменты FADD, которые проявляют антиапоптозную активность.
Термины "DAXX" и "белок DAXX" применяются здесь взаимозаменяемым образом. Они относятся к белку, который называется связанный со смертью белок 6 и у человека кодируется геном DAXX (RefSeq (mRNA): NM_001141969.1), локализованным в положении 21.3 короткого плеча (p) хромосомы 6. В предпочтительных воплощениях DAXX имеет аминокислотную последовательность, приведенную в SEQ ID NO: 1. Однако белок DAXX может быть представлен изоформой белка DAXX по SEQ ID NO: 1, поэтому он может иметь любую аминокислотную последовательность, кодируемую геном DAXX человека.
Термины "FADD" и "белок FADD" применяются здесь взаимозаменяемым образом. Они относятся к белку, который называется связанный с Fas белок с доменом смерти, который у человека кодируется геном FADD (RefSeq (mRNA): NM_003824.3), локализованным в положении 13.3 длинного плеча (q) хромосомы 11. В предпочтительных воплощениях FADD имеет аминокислотную последовательность, приведенную в SEQ ID NO: 8. Однако белок FADD может быть представлен изоформой белка FADD по SEQ ID NO: 8, поэтому он может иметь любую аминокислотную последовательность, кодируемую геном FADD человека.
Авторы изобретения показали, что пептиды, состоящие из аминокислотной последовательности, приведенной в SEQ ID NO: 5 ("DAXXp"), SEQ ID NO: 6 ("DAXXp-14") или SEQ ID NO: 2 ("DAXXp-15" = "DAXXp-211"), которые все являются фрагментами белка DAXX (SEQ ID NO: 1), взаимодействуют с рецептором Fas, но только DAXXp способен уменьшить клеточный апоптоз. Точно так же авторы изобретения обнаружили, что пептиды, состоящие из аминокислотной последовательности, приведенной в SEQ ID NO: 9 ("FADDp15") и SEQ ID NO: 12 ("FADDp"), которые оба являются фрагментами белка FADD (SEQ ID NO: 8), взаимодействуют с рецептором Fas и уменьшают клеточный апоптоз.
Итак, в одном предпочтительном воплощении антиапоптозный пептид по изобретению представлен фрагментом DAXX из 16 последовательных аминокислотных остатков, входящих в SEQ ID NO: 5. В другом предпочтительном воплощении антиапоптозный пептид по изобретению представлен фрагментом DAXX, состоящим из 17, 18, 19, 20, 21, 22, 23 или 24 последовательных аминокислотных остатков, входящих в аминокислотную последовательность, приведенную в SEQ ID NO: 5. Предпочтительно такой антиапоптозный пептид имеет аминокислотную последовательность, выбранную из группы, состоящей из:
| SEQ ID NO: 17 | (KKSRKEKKQTGSGPLGN), |
| SEQ ID NO: 18 | (KKSRKEKKQTGSGPLGNS), |
| SEQ ID NO: 19 | (KKSRKEKKQTGSGPLGNSY), |
| SEQ ID NO: 20 | (KKSRKEKKQTGSGPLGNSYV), |
| SEQ ID NO: 21 | (CKKSRKEKKQTGSGPLG), |
| SEQ ID NO: 22 | (PCKKSRKEKKQTGSGPLG), |
| SEQ ID NO: 23 | (PPCKKSRKEKKQTGSGPLG), |
| SEQ ID NO: 24 | (GPPCKKSRKEKKQTGSGPLG), |
| SEQ ID NO: 25 | (SGPPCKKSRKEKKQTGSGPLG), |
| SEQ ID NO: 26 | (CKKSRKEKKQTGSGPLGN), |
| SEQ ID NO: 27 | (CKKSRKEKKQTGSGPLGNS), |
| SEQ ID NO: 28 | (CKKSRKEKKQTGSGPLGNSY), |
| SEQ ID NO: 29 | (CKKSRKEKKQTGSGPLGNSYV), |
| SEQ ID NO: 30 | (PCKKSRKEKKQTGSGPLGN), |
| SEQ ID NO: 31 | (PCKKSRKEKKQTGSGPLGNS), |
| SEQ ID NO: 32 | (PCKKSRKEKKQTGSGPLGNSY), |
| SEQ ID NO: 33 | (PCKKSRKEKKQTGSGPLGNSYV), |
| SEQ ID NO: 34 | (PPCKKSRKEKKQTGSGPLGN), |
| SEQ ID NO: 35 | (PPCKKSRKEKKQTGSGPLGNS), |
| SEQ ID NO: 36 | (PPCKKSRKEKKQTGSGPLGNSY), |
| SEQ ID NO: 37 | (PPCKKSRKEKKQTGSGPLGNSYV), |
| SEQ ID NO: 38 | (GPPCKKSRKEKKQTGSGPLGN), |
| SEQ ID NO: 39 | (GPPCKKSRKEKKQTGSGPLGNS), |
| SEQ ID NO: 40 | (GPPCKKSRKEKKQTGSGPLGNSY), |
| SEQ ID NO: 41 | (GPPCKKSRKEKKQTGSGPLGNSYV), |
| SEQ ID NO: 42 | (SGPPCKKSRKEKKQTGSGPLGN), |
| SEQ ID NO: 43 | (SGPPCKKSRKEKKQTGSGPLGNS), и |
| SEQ ID NO: 44 | (SGPPCKKSRKEKKQTGSGPLGNSY). |
В одном предпочтительном воплощении антиапоптозный пептид по изобретению представлен фрагментом FADD из 9 последовательных аминокислотных остатков, входящих в SEQ ID NO: 12. В другом предпочтительном воплощении антиапоптозный пептид по изобретению представлен фрагментом FADD из 15 последовательных аминокислотных остатков, входящих в SEQ ID NO: 9. В след