Способ тестирования и контроль качества нуклеиновых кислот на подложке
Иллюстрации
Показать всеИзобретение относится к биохимии. Описан способ тестирования нуклеиновых кислот на подложке, включающий иммобилизацию одной или нескольких нуклеиновых кислот посредством сшивания, где каждая из иммобилизованных нуклеиновых кислот содержит участок нуклеотидов с одним видом оснований, получение меченых олигонуклеотидов, комплементарных указанному участку нуклеотидов, и определение показателя, отражающего состояние указанных нуклеиновых кислот. Изобретение дополнительно относится к набору для тестирования нуклеиновых кислот на подложке, содержащему матрицу нуклеиновых кислот, иммобилизованных на твердой подложке, где каждая из иммобилизованных нуклеиновых кислот содержит участок нуклеотидов с одним видом оснований, и меченый олигонуклеотид, комплементарный указанному участку нуклеотидов. Изобретение также относится к применению меченого олигонуклеотида, комплементарного участку нуклеотидов с одним видом оснований, для тестирования состояния нуклеиновых кислот, иммобилизованных на твердой подложке. 4 н. и 29 з.п. ф-лы, 6 ил., 5 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способу тестирования нуклеиновых кислот на подложке, включающему иммобилизацию одной или нескольких нуклеиновых кислот путем сшивания, где каждая из иммобилизованных нуклеиновых кислот содержит участок нуклеотидов с одним видом оснований, обеспечение меченых олигонуклеотидов, комплементарных указанному участку нуклеотидов и определение значения, указывающего на состояние указанных нуклеиновых кислот.
Настоящее изобретение, кроме того, относится к набору для тестирования нуклеиновых кислот на подложке, содержащему матрицу нуклеиновых кислот, иммобилизованных на твердой подложке, где каждая иммобилизованная нуклеиновая кислота содержит участок нуклеотидов с одним видом оснований, и меченый олигонуклеотид, комплементарный указанному участку нуклеотидов.
Изобретение также относится к применению меченого олигонуклеотида, комплементарного участку нуклеотидов с одним видом оснований, для тестирования состояния нуклеиновых кислот, иммобилизованных на твердой подложке.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Биочипы или биологические микроматрицы, в частности микроматрицы ДНК, стали важным инструментом в современной молекулярной биологии и медицине. Как правило, чипы состоят из упорядоченных рядов большого количества микроскопических точек молекул нуклеиновой кислоты, где каждая содержит небольшие количества конкретной последовательности нуклеиновой кислоты. Она может представлять собой, например, короткий участок гена или другой элемент ДНК, который используют в качестве захватывающих зондов для гибридизации с образцом кДНК или кРНК (мишень или зонд-мишень) в условиях связывания захватывающего зонда и соответствующей мишени. Гибридизацию захватывающего зонда с мишенью, как правило, обнаруживают и количественно определяют за счет основанной на флуоресценции детекции меченых флуорофором мишеней для определения относительного количества последовательностей нуклеиновой кислоты в мишени.
Технология микроматриц возникла на основе саузерн-блоттинга, когда к субстрату прикрепляют фрагментированные ДНК, а затем их анализируют с помощью зонда из известного гена или фрагмента. Использование коллекции определенных ДНК на матрицах для определения профиля экспрессии впервые было описано в 1987 году, и упорядоченную матрицу ДНК использовали для идентификации генов, экспрессию которых модулировал интерферон. Эти первые генные матрицы получали посредством нанесения кДНК на фильтровальную бумагу, используя наносящее стержневое устройство. Использование миниатюризованных микроматриц, в частности, для определения параметров генной экспрессии впервые опубликовано в 1990-е годы. Информация о первом эукариотическом геноме на микроматрице была опубликована в 1997 году.
Зонды из олигомеров нуклеиновых кислот долго использовали для детекции комплементарных последовательностей нуклеиновой кислоты в представляющей интерес последовательности нуклеиновой кислоты или зонде-мишени и их использовали для детекции экспрессии конкретных генов, например, при нозерн-блоттинге. В формате микроматрицы олигонуклеотидный зонд был иммобилизован на твердой подложке. Полученные таким способом матрицы олигонуклеотидов можно использовать для детекции комплементарных последовательностей-мишеней нуклеиновой кислоты, как описано в WO 89/10977 и WO 89/11548. В олигонуклеотидных микроматрицах зонды, как правило, представляют собой короткие последовательности, созданные для совпадения с частями последовательностей с известными или предсказанными открытыми рамками считывания.
Для получения таких микроматриц можно использовать различные подходы. Эти подходы включают печать с использованием высокоострых стержней, фотолитографии с использованием предварительно изготовленных шаблонов, фотолитография с использованием динамических микрозеркальных устройств, струйная печать (Lausted C et al., 2004, Genome Biology 5: R58) или электрохимия. Как правило, захватывающие зонды прикрепляют к твердой поверхности с помощью ковалентной связи с химическим матриксом. Например, такая твердая поверхность может иметь форму микроскопических бусин.
Фотолитографический способ используют для получения олигонуклеотидных матриц посредством синтеза последовательностей непосредственно на поверхности матрицы. Способ включает фотолитографический синтез на субстрате из диоксида кремния, причем использование световых и светочувствительных маскирующих средств для получения последовательности одного нуклеотида за один раз во всей матрице (Pease et al, 1994, PNAS 91: 5022-5026). У каждого подходящего зонда перед помещением матрицы в раствор одного нуклеотида селективно удаляют маскировку, затем проводят маскирующую реакцию и удаляют маскировку со следующего набора зондов в продукте с экспозицией других нуклеотидов. После нескольких повторов полностью конструируют последовательности каждого зонда. В зависимости от желаемой цели сконструированные таким образом олигонуклеотиды могут быть длиннее (например, 60-членными) или короче (например, 25-членными).
В точечных микроматрицах олигонуклеотидные зонды наносят в виде целых последовательностей, т.е. зонды синтезируют до нанесения на поверхность матрицы, а затем наносят на субстрат. При общем подходе используют матрицу из тонких стержней или игл, контролируемую роботизированным манипулятором, которую погружают в лунки, содержащие зонды ДНК, а затем наносят каждый зонд на предназначенные участки на поверхности матрицы, или струйное печатающее устройство, которое наносит вещество зонда посредством выброса капель. Полученная матрица зондов представляет параметры нуклеиновых кислот полученных захватывающих зондов и может взаимодействовать с комплементарными зондами-мишенями кДНК или кРНК, например, полученными из экспериментальных или клинических образцов. Кроме того, эти матрицы можно легко адаптировать для конкретных экспериментов, так как зонды и участки нанесения на матрице можно выбирать особым образом.
При получении микроматриц необходимо знать присутствует ли каждая точка на субстрате и может ли она гибридизоваться.
Контроль, регулирование и корректировка способов разметки точек и нанесения для получения микроматриц описаны, например, в GB 2355716.
Однако этот подход сфокусирован на самом способе печати и включает определение вибраций в струйном устройстве или неправильного функционирования оборудования, но не предоставляет раствора, который мог бы гарантировать правильное и эффективное нанесение капель на субстрат или который мог бы обеспечить контроль поведения капель после завершения печати. Такой способ контроля печати нельзя использовать для оценки качества нанесенных зондов. В частности невозможно определить, действительно ли присутствуют нанесенные захватывающие зонды нуклеиновой кислоты или способны ли они гибридизоваться с молекулами-мишенями.
Следовательно, существует необходимость в способе, обеспечивающем тестирование состояния и качества нуклеиновых кислот, нанесенных на подложку.
ЦЕЛИ И СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение связано с этой необходимостью и относится к средствам и способам, обеспечивающим иммобилизацию и последующее тестирование и контроль качества нуклеиновых кислот, нанесенных на подложку.
Таким образом, одной из задач настоящего изобретения является получение средств и способов, позволяющих контролировать поведение нанесенных нуклеиновых кислот после завершения печати и оценивать качество нанесенных зондов.
Указанную выше задачу осуществляют способом тестирования нуклеиновых кислот на подложке, включающим иммобилизацию одной или нескольких нуклеиновых кислот на твердой подложке посредством сшивания нагреванием, или световым излучением, или посредством химической иммобилизации, где каждая из иммобилизованных нуклеиновых кислот содержит участок нуклеотидов с одним видом оснований, обеспечение меченого олигонуклеотида, комплементарного участку нуклеотидов с одним видом оснований, где указанный меченый олигонуклеотид способен образовывать комплекс с каждой из иммобилизованных нуклеиновых кислот на участке нуклеотидов с одним видом оснований, и определение показателя, отражающего состояние указанных нуклеиновых кислот по количеству меченого олигонуклеотида, находящегося в комплексе с иммобилизованной нуклеиновой кислотой.
Преимуществом способа по настоящему изобретению является его дешевизна, возможность его применения и универсальность, что позволяет контролировать и проверять нанесенные нуклеиновые кислоты по простой и надежной схеме взаимодействия. Способ основан на наличии и использовании захватывающих нуклеотидных зондов, которые включают участок нуклеотидов с одним видом оснований. Такие нуклеиновые кислоты являются средством для эффективной иммобилизации на субстрате посредством указанного участка нуклеотидов с одним видом оснований, предпочтительно посредством сшивания нагреванием или световым излучением и в качестве дополнительного и независимого признака обеспечивают одинаковое и единообразное взаимодействие участка нуклеотидов с одним видом оснований и комплементарного олигонуклеотида. Таким образом, требуется только один тип олигонуклеотидов, который проще синтезировать, чем олигонуклеотиды, состоящие из нуклеотидов нескольких видов оснований, и это снижает общую стоимость схемы контроля качества. Благодаря тому, что олигонуклеотиды могут быть достаточно короткими, достигается дополнительное снижение стоимости. Таким образом, основное преимущество настоящего изобретения связано с возможностью осуществления непосредственной и простой проверки результата нанесения и процесса иммобилизации, в частности с возможностью проверки полной потери точек, неправильной мобилизации молекулы, например, вследствие природной деградации поверхности субстрата со временем, пропуска стадии иммобилизации или деградации или модификации ДНК, вследствие чего она не способна гибридизироваться. Кроме того, способ не является деструктивным и позволяет контролировать состояние нанесенных нуклеиновых кислот на субстрат, не влияя на эффективность производственного процесса. В предпочтительном варианте осуществления, кроме того, можно повторно использовать тестовые олигонуклеотиды после стадии промывки для последующих контрольных реакций. Такой порядок действий дополнительно снижает стоимость и время в контексте контроля нанесенных нуклеиновых кислот.
В конкретном аспекте настоящее изобретение относится к набору для тестирования нуклеиновых кислот на подложке. Указанный набор содержит матрицу нуклеиновых кислот, иммобилизованных на твердой подложке посредством сшивания нагреванием, или световым излучением, или посредством химической иммобилизации, где каждая из иммобилизованных нуклеиновых кислот содержит участок нуклеотидов с одним видом оснований, и меченый олигонуклеотид, комплементарный участку нуклеотидов с одним видом оснований, где указанный меченый олигонуклеотид способен образовывать комплекс с каждой из иммобилизованных нуклеиновых кислот на участке нуклеотидов с одним видом оснований.
В другом аспекте настоящее изобретение относится к применению меченого олигонуклеотида, комплементарного участку нуклеотидов с одним видом оснований, для тестирования состояния нуклеиновых кислот, иммобилизованных на твердой подложке посредством сшивания нагреванием, или световым излучением, или посредством химической иммобилизации, где каждая из иммобилизованных нуклеиновых кислот содержит участок нуклеотидов с одним видом оснований, и где указанный меченый олигонуклеотид способен образовывать комплекс с каждой из иммобилизованных нуклеиновых кислот в указанном участке нуклеотидов с одним видом оснований.
В предпочтительном варианте осуществления настоящего изобретения тестирование состояния нуклеиновых кислот включает определение показателя, отражающего количество меченого олигонуклеотида, находящегося в комплексе с указанной иммобилизованной нуклеиновой кислотой.
В дополнительном предпочтительном варианте осуществления настоящего изобретения нуклеиновая кислота для тестирования представляет собой одноцепочечную ДНК, РНК, ПНК, ЦНК, ГНК, ЗНК или АНК, их олигонуклеотид или любое их сочетание.
В другом предпочтительном варианте осуществления настоящего изобретения указанный участок нуклеотидов с одним видом оснований, включенный в нуклеиновые кислоты для тестирования, как указано выше, представляет собой участок из остатков тимина, урацила или гуанина.
В другом предпочтительном варианте осуществления настоящего изобретения длина указанного участка нуклеотидов с одним видом оснований, как указано выше, составляет приблизительно от 2 до приблизительно 100 нуклеотидов. В дополнительном особенно предпочтительном варианте осуществления длина указанного участка нуклеотидов с одним видом оснований составляет приблизительно 16 нуклеотидов.
В другом предпочтительном варианте осуществления настоящего изобретения указанное сшивание, используемое для иммобилизации одной или нескольких нуклеиновых кислот на твердой подложке, как указано выше, представляет собой сшивание световым излучением, проводимое при длине волны приблизительно 200-300 нм. В особенно предпочтительном варианте осуществления указанное сшивание световым излучением проводят при длине волны 254 нм.
В другом предпочтительном варианте осуществления настоящего изобретения указанное сшивание, используемое для иммобилизации одной или нескольких нуклеиновых кислот на твердой подложке, как указано выше, представляет собой сшивание световым излучением, проводимым при длине волны приблизительно 300-500 нм. В особенно предпочтительном варианте осуществления указанное сшивание световым излучением проводят при длине волны 365 нм.
В дополнительном предпочтительном варианте осуществления настоящего изобретения указанное сшивание, используемое для иммобилизации одной или нескольких нуклеиновых кислот на твердой подложке, как указано выше, представляет собой сшивание световым излучением, проводимым при длине волны приблизительно 200-300 нм или 300-500 нм, которое проводят с использованием количества энергии приблизительно от 0,1 Джоуль/см2 до приблизительно 10 Джоуль/см2.
В дополнительном предпочтительном варианте осуществления настоящего изобретения указанная химическая иммобилизация, используемая для иммобилизации одной или нескольких нуклеиновых кислот на твердой подложке, указанной выше, представляет собой связывание между модифицированной аминами нуклеиновой кислотой и соответствующей функциональной группой на твердой подложке. В особенно предпочтительном варианте осуществления указанная функциональная группа представляет собой эпоксигруппу, альдегидную, карбоксильную или NHS группу.
В другом предпочтительном варианте осуществления настоящего изобретения указанный участок нуклеотидов с одним видом оснований, как указано выше, расположен на 3'- или 5'-конце указанной нуклеиновой кислоты.
В дополнительном предпочтительном варианте осуществления настоящего изобретения нуклеиновая кислота для иммобилизации по изобретению имеет следующую формулу:
5'-Yn-Xm-Br-Xp-Zq-3',
где Y и Z представляют собой участки нуклеотидов с одним видом оснований, где Y и Z могут состоять из одного и того же или из различных видов оснований; X представляет собой спейсер, предпочтительно состоящий из нуклеотидов, лишенных азотистых оснований; B представляет собой последовательность более чем из одного вида оснований, а n, m, r, p и q представляют собой количества нуклеотидов в нуклеиновой кислоте, где можно использовать следующие условия: n, m, p, q, r >1; n, m, r > 1 и p, q=0; p, q, r >1 и n, m=0; n, q, r > 1 и m, p=0; n, r > 1 и m, p, q=0; q, r > 1 и n, m, p=0.
В дополнительном предпочтительном варианте осуществления настоящего изобретения указанный меченый олигонуклеотид, как указано выше, содержит флуоресцентную, радиоактивную или хемилюминесцентную метку.
В другом предпочтительном варианте осуществления настоящего изобретения указанная твердая подложка, как указано выше, содержит функциональные группы амина. В особенно предпочтительном варианте осуществления настоящего изобретения подложка, содержащая указанные функциональные группы амина, содержит первичные или вторичные амины.
В дополнительном особенно предпочтительном варианте осуществления настоящего изобретения подложка, содержащая указанные функциональные группы амина, содержит пористый субстрат. Даже в более предпочтительном варианте осуществления указанный выше пористый субстрат состоит из нейлона.
В дополнительном особенно предпочтительном варианте осуществления настоящего изобретения подложка, содержащая указанные функциональные группы амина, содержит непористый субстрат. Еще в одном более предпочтительном варианте осуществления настоящего изобретения указанный выше непористый субстрат состоит из стекла, покрытого поли-L-лизином вещества, нитроцеллюлозы, полистирола, циклического олефинового сополимера (COC), циклического олефинового полимера (COP), полипропилена, полиэтилена или поликарбоната.
В дополнительном предпочтительном варианте осуществления настоящего изобретения указанный меченый олигонуклеотид, комплементарный участку нуклеотидов с одним видом оснований, в указанном выше способе по настоящему изобретению получают для повторного использования на дополнительной стадии способа посредством повышения температуры выше температуры плавления указанного меченого олигонуклеотида.
В дополнительном аспекте настоящее изобретение относится к способу анализа нуклеиновых кислот, включающему стадии: (a) иммобилизации одной или нескольких нуклеиновых кислот на твердой подложке посредством сшивания нагреванием, или световым излучением, или посредством химической иммобилизации, где каждая из иммобилизованных нуклеиновых кислот содержит участок нуклеотидов с одним видом оснований; (b) получения меченого олигонуклеотида, комплементарного участку нуклеотидов с одним видом оснований, где указанный меченый олигонуклеотид способен образовывать комплекс с каждой из иммобилизованных нуклеиновых кислот на участке нуклеотидов с одним видом оснований; (c) детекции присутствия специфической последовательности, комплементарной последовательности внешнего участка нуклеотидов с одним видом оснований; и (d) определения показателя, отражающего состояние указанной нуклеиновой кислоты, по количеству меченого олигонуклеотида, комплементарного участку нуклеотидов с одним видом оснований, находящегося в комплексе с иммобилизованными нуклеиновыми кислотами. Предпочтительно стадии (b) и (c) проводят одновременно.
В еще одном предпочтительном варианте осуществления настоящего изобретения качество нуклеиновых кислот, иммобилизованных по настоящему изобретению, можно дополнительно тестировать в способе, включающем дополнительные стадии:
(i) получения по меньшей мере одного меченого тестового олигонуклеотида, комплементарного заранее определенному специфическому участку нуклеотидов вне участка нуклеотидов с одним видом оснований, где указанный меченый олигонуклеотид способен специфически образовывать комплекс с иммобилизованными нуклеиновыми кислотами, содержащими указанный специфический участок нуклеотидов; и
(ii) определения показателя, отражающего состояние указанных нуклеиновых кислот по присутствию указанного тестового олигонуклеотида, находящегося в комплексе с заранее определенным специфическим участком нуклеотидов вне участка нуклеотидов с одним видом оснований, иммобилизованных нуклеиновых кислот, содержащих указанный специфический участок нуклеотидов.
В еще одном предпочтительном варианте осуществления настоящего изобретения набор для тестирования нуклеиновых кислот на подложке, как указано выше, дополнительно содержит по меньшей мере один меченый тестовый олигонуклеотид, комплементарный заранее определенному специфическому участку нуклеотидов вне участка нуклеотидов с одним видом оснований, где указанный меченый олигонуклеотид способен явным образом образовывать комплекс с иммобилизованными нуклеиновыми кислотами, содержащими указанный специфический участок нуклеотидов.
В другом предпочтительном варианте осуществления настоящего изобретения в указанном способе анализа нуклеиновых кислот в указанном способе определения качества нуклеиновых кислот, иммобилизованных по настоящему изобретению и в указанном наборе для тестирования нуклеиновых кислот на подложке, как указано выше, указанный меченый тестовый олигонуклеотид, комплементарный заранее определенному участку нуклеотидов вне участка нуклеотидов с одним видом оснований, несет метку, которая оптически или химически отличается от метки олигонуклеотида, комплементарного участку нуклеотидов с одним видом оснований.
Эти и другие признаки, свойства и задачи по настоящему изобретению будут очевидны из приведенного ниже подробного описания, вместе с сопроводительными фигурами и примерами, которые демонстрируют принципы изобретения в качестве иллюстрации. Описание приведено только в качестве примера, не ограничивая объем изобретения.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
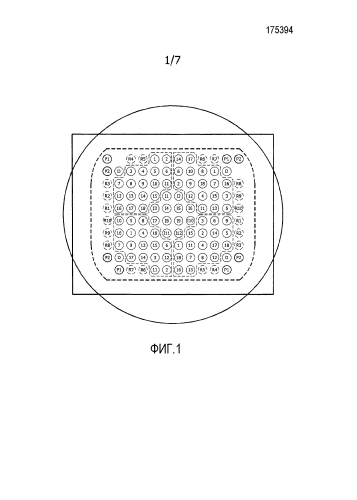
На фиг. 1 показан образец точечного шаблона, использованного в экспериментах, описанных в примерах.
На фиг. 2A представлена схема мембраны. Точки с 1 по 5 (номер указателя от 1 до 5) представляют немеченые точки для гибридизации. Все эти точки содержат концевой участок из 16 остатков тимина (T16), но части олигонуклеотидов для гибридизации содержат различную последовательность у каждой точки. Точка 6 (номер указателя 6) содержит олигонуклеотид с флуоресцентной меткой. Этот олигонуклеотид используют для нанесения координатной сетки и калибровки.
На фиг. 2B представлено изображение мембраны, схема которой перед гибридизацией представлена на фиг. 2A. На изображении показаны только сигналы от тех точек, которые содержат олигонуклеотиды с флуоресцентной меткой (номер указателя 6), как указано на фиг. 2A.
На фиг. 2C представлено изображение мембраны, представленной на фиг. 2B после гибридизации с контрольным зондом. Мембрану инкубировали с меченым A16-олигонуклеотидом. Отчетливо видны точки гибридизации. Сигналы от точек, которые содержат олигонуклеотиды с флуоресцентной меткой (номер указателя 6), как указано на фиг. 2A, дополнительно видны в виде точек большего размера.
На фиг. 2D представлено изображение мембраны, представленной на фиг. 2C, непосредственно после нагревания для удаления контрольных олигонуклеотидов с точек с захватывающими зондами. Точки гибридизации, которые были видны на фиг. 2C, больше не демонстрируют никакого сигнала. У изображения еще видны сигналы в тех точках, которые содержат олигонуклеотиды с флуоресцентной меткой (номер указателя 6), как указано на фиг. 2A.
На фиг. 3 представлено изображение мембраны после гибридизации с меченым антисмысловым олигонуклеотидом, комплементарным к части для гибридизации захватывающего зонда на точке номер 4 (номер указателя 4, как указано на фиг. 2A). Мембрану использовали до контрольной и тестовой гибридизации, как представлено на фиг. 2B-2D. Жирными прямоугольниками обозначены точки, демонстрирующие сигнал после гибридизации с меченым антисмысловым олигонуклеотидом, соответствующим точке номер 4, как указано на фиг. 2A. Изображение демонстрирует, что захватывающий зонд на мембране не поврежден в течение стадии контроля качества и еще может связываться с антисмысловым олигонуклеотидом.
На фиг. 4A представлена кривая гибридизации в реальном времени захватывающих олигонуклеотидов с отсутствием T-концевого участка и с T16-концевой участок, т.е. содержащих участок из 16 остатков тимидина. Олигонуклеотиды, содержащие T16-концевой участок, демонстрируют усиленные гибридизационные сигналы, которые рассматривают как результат большего восстановления.
Фиг. 4B демонстрирует нормализованное восстановление нанесенных захватывающих олигонуклеотидов, содержащих нуклеотиды T или A в виде функции от вида основания (T или A) и количества оснований (2, 4, 8, 16 или 32). Показано, что когда количество T увеличено с 2 до 32, восстановление можно увеличить в 3-4 раза.
На фиг. 5 представлены кривые разделения комплементарных гибридов, гибридов с одним несоответствием ((AG)-мутация) и двойным несоответствием ((AAGG)-мутация) для захватывающих зондов с 0, 4 и 16 T. Иммобилизация захватывающих зондов схематически изображена рядом с графиками. На фигуре показано, что по сравнению с несоответствующими зондами при увеличении температур плавления достигают увеличенной селективности комплементарных зондов.
На фиг. 6 показан эффект количества сайтов, лишенных азотистых оснований (0, 2, 4 или 8) на интенсивность гибридизации ампликонов из бактериальных видов с комплементарными, а также с несоответствующими захватывающими зондами.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы изобретения обнаружили, что можно определять поведение нанесенных нуклеиновых кислот после завершения печати и оценивать качество нанесенных зондов.
Хотя настоящее изобретение описано на примере конкретных вариантов осуществления, это описание не следует рассматривать как ограничивающее.
Перед подробным описанием иллюстративных вариантов осуществления настоящего изобретения приведены определения, которые важны для понимания настоящего изобретения.
Как используется в настоящей заявке и в прилагаемой формуле изобретения, если из контекста явно не следует иначе, то формы единственного числа также включают соответствующие формы множественного числа.
В контексте настоящего изобретения термины "около" и "приблизительно" означают интервал погрешности, под которым специалист в данной области должен понимать как интервал, в котором сохраняется возможность достижения технического результата рассматриваемого признака. Как правило, термин обозначает отклонение от указанного числового показателя на ±20%, предпочтительно ±15%, более предпочтительно ±10% и даже более предпочтительно ±5%.
Понятно, что термин "содержащий" не является ограничивающим. Для целей настоящего изобретения термин "состоит из" следует понимать, как предпочтительный вариант термина "содержащий". Если в настоящем документе группа определена, как содержащая по меньшей мере определенное количество вариантов осуществления, то это также обозначает группу, которая предпочтительно состоит только из этих вариантов осуществления.
Кроме того, термины "первый", "второй", "третий" или "(a)", "(b)", "(c)", "(d)" и тому подобное в описании и в формуле изобретения используют для возможности отличать сходные элементы и необязательно для описания последовательного или хронологического порядка. Понятно, что используемые таким образом термины являются взаимозаменяемыми при соответствующих условиях и что варианты осуществления изобретения, описываемые в настоящем документе, можно использовать для других последовательностей, а не только для описанных или приведенных в качестве примера в настоящем документе.
Если в заявке не указано иначе, как указано в настоящем документе ниже, в случае, если термины "первый", "второй", "третий" или "(a)", "(b)", "(c)", "(d)" и тому подобное относятся к стадиям способа или применения, между стадиями отсутствует временная связь или связи временных интервалов, т.е. стадии можно проводить одновременно или эти стадии могут быть разделены интервалами в несколько секунд, минут, часов, суток, недель, месяцев или даже лет.
Как указано выше, настоящее изобретение в одном из аспектов относится к способу тестирования нуклеиновых кислот на подложке, включающему (a) иммобилизацию одной или нескольких нуклеиновых кислот на твердой подложке посредством сшивания нагреванием, или световым излучением, или посредством химической иммобилизации, где каждая из иммобилизованных нуклеиновых кислот содержит участок нуклеотидов с одним видом оснований, (b) получения меченого олигонуклеотида, комплементарного участку нуклеотидов с одним видом оснований, где указанный меченый олигонуклеотид способен образовывать комплекс с каждой из иммобилизованных нуклеиновых кислот на участке нуклеотидов с одним видом оснований, и (c) определение показателя, отражающего состояние указанных нуклеиновых кислот по количеству меченого олигонуклеотида, находящегося в комплексе с иммобилизованной нуклеиновой кислотой.
Термин "иммобилизация нуклеиновой кислоты на подложке" относится к ассоциации молекул нуклеиновой кислоты с поддерживающим субстратом посредством межмолекулярных взаимодействий с расположением нуклеиновой кислоты в конкретной области поддерживающего субстрата и одновременным предотвращением отщепления нуклеиновых кислот, например, в процессе стадии промывки или химической гибридизации. Как правило, такие межмолекулярные взаимодействия основаны на ковалентных химических связях между структурными элементами или функциональными группами вещества подложки и иммобилизуемой нуклеиновой кислоты, например, соответствующими функциональными группами нуклеиновой кислоты, что известно специалисту в данной области.
Термин "твердая подложка" означает, что вещество подложки главным образом имеет нежидкую консистенцию и, таким образом, возможно точное и прослеживаемое расположение нуклеиновой кислоты на веществе подложки.
Термин "сшивание нагреванием или световым излучением" относится ко взаимодействию между указанным веществом подложки и указанной нуклеиновой кислотой за счет формирования межмолекулярных взаимодействий или связей, которые связывают два структурных элемента под действием или за счет энергии, обеспечиваемой источником энергии, такой как нагревание или световое излучение.
Как правило, сшивание нагреванием проводят сушкой и последующим прокаливанием молекул нуклеиновой кислоты на субстрате при определенных температурах. Полагают, что сушка и прокаливание приводят к прикреплению нуклеиновых кислот к субстрату за счет гидрофобного взаимодействия, хотя точная природа связывания до конца не ясна. Этот способ можно классифицировать как один из вариантов физической адсорбции. Термин "физическая адсорбция" относится к процессу, включающему стадии начального разделения и притяжения, посредством чего нуклеиновая кислота приближается к реакционноспособным группам, которые основаны на физических адсорбционных процессах. Адсорбция биологической молекулы, например нуклеиновой кислоты, на твердую подложку может происходить практически при любом веществе подложки, так как выявлено, что любое такое вещество подложки будет взаимодействовать почти с любой поверхностью. Как правило, уровень взаимодействия между веществом подложки и молекулами нуклеиновой кислоты изменяется в зависимости от природы и формы вещества подложки и размера и химических свойств нуклеиновых кислот. Как правило, взаимодействие представляет собой пятистадийную последовательность действий, включающую стадии (i) транспорта молекулы к поверхности, (ii) адсорбции на поверхность, (iii) перестройку адсорбированной молекулы, (iv) возможную десорбцию адсорбированной молекулы и (v) транспорта десорбированной молекулы от поверхности.
Хотя последовательность действий до некоторой степени подразумевает, что возможность десорбции является обязательной, как правило, связывание является необратимым в зависимости от размера молекулы. Термин "размер молекулы" в отношении адсорбционных взаимодействий относится к количеству присутствующих участков связывания. Хотя любой участок связывания в принципе в любой момент может диссоциировать от поверхности субстрата, эффект большого количества участков связывания заключается в том, что молекула как целое остается связанной. Прилагая энергию в форме тепла, например, при температуре приблизительно от 40 до 150°C, предпочтительно от 50 до 120°C, более предпочтительно от 60 до 110°C, даже более предпочтительно от 70 до 100°C, а наиболее предпочтительно от 80 до 90°C, физическую адсорбцию молекулы нуклеиновой кислоты с веществом подложки можно усилить и время, необходимое для эффективной иммобилизации, можно уменьшить. Сшивание нагреванием можно проводить в течение любого подходящего периода времени, известного специалисту в данной области, например от 2 минут до 12 часов, предпочтительно от 10 минут до 8 часов, более предпочтительно от 30 минут до 6 часов, даже более предпочтительно от 45 минут до 4 часов, даже более предпочтительно от 1 часа до 3 часов, а наиболее предпочтительно в течение 2 часов. Сшивание нагреванием или прокаливание можно проводить любыми подходящими средствами, известными специалисту в данной области, например посредством сушильной камеры или печи. В дополнение к температуре также до подходящих значений, известных специалисту в данной области, можно регулировать другие параметры, такие как влажность, аэрация или вентиляция. Сшивание нагреванием или прокаливание также можно комбинировать с другими формами иммобилизации, такими как сшивание световым излучением или химическая иммобилизация.
Сшивание световым излучением проводят, используя световое излучение с типичной длиной волны, например, в диапазоне от 150 до 550 нм, для молекул нуклеиновой кислоты, предпочтительно в диапазоне от 200 до 500 нм для индукции взаимодействий между молекулами и веществом подложки. Как правило, индуцированное взаимодействие между молекулами и веществом подложки представляет собой ковалентное связывание нуклеиновой кислоты с веществом. Например, сшивание световым излучением можно проводить и использованием УФ-излучения. Сшивание посредством УФ-излучения является одним из простейших путей для обеспечения ковалентного связывания вещества подложки с зондом нуклеиновой кислоты. Как правило, связывание происходит между основаниями молекул нуклеиновой кислоты, например остатками тимина, гуанина, аденина, цитозина или урацила, которые реагируют с соответствующими и подходящими функциональными химическими группами в веществе подложки, как известно специалисту в данной области.
Присутствие и количество функциональных химических групп на или в веществе подложки можно контролировать и регулировать подходящими способами химической активации. Например, такие способы активации могут обеспечивать специфически локализованные функциональные группы на или в веществе подложки и облегчать специфическое взаимодействие между нуклеиновыми кислотами и веществом относительно этих локализованных функциональных групп.
Присутствие и количество функциональных химических групп на или в веществе подложки также может влиять на ориентацию и подвижность иммобилизованных нуклеиновых кислот. Например, присутствие большего количества функциональных групп может приводить к иммобилизации по различным точкам молекулы нуклеиновой кислоты. Кроме того, наличие соответствующих реакционноспособных элементов в молекуле нуклеиновой кислоты можно использовать для контроля ориентации молекулы нуклеиновой кислоты на веществе подложки, например, для иммобилизации по головной или концевой области или 5'- или 3'-области молекулы нуклеиновой кислоты или для иммобилизации только по центральной области или по центральной и концевым областям одновременно.
Дополнительный параметр, имеющий значение при сшивании молекулы нуклеиновой кислоты с веществом подложки посредством светового излучения, представляет собой количество энергии, используемой для излучения. Как правило, специалист в данной области может определить подходящую и оптимальную дозу излучения, следуя указаниям, предоставляемым производителями излучающего оборудования. Например, общую используемую для субстрата дозу можно рассчитать по формуле D=P•T, где D представляет собой общую используемую для субстрата дозу в мДж/см2, P представляет собой энергию светового излучения, используемую для