Антитело против cmet и его применение для определения и диагностики рака
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к антителу или его функциональному фрагменту, которые способны связывается с cMet. Также раскрыты мышиная гибридома, способная секретировать указное антитело, нуклеиновая кислота, которая экспрессирует указанное антитело и набор для прогнозирования эффективности лечения онкогенного расстройства, включающий указанное антитело. Раскрыты способ обнаружения cMet-экспрессирующей опухоли, способ диагностики cMet-экспрессирующей опухоли, способ определения прогноза развития cMet-экспрессирующей опухоли и способ прогнозировая эффективности лечения онкогенного расстройства, с помощью заявленного анти-cMet-антитела. Изобретение обладает способностью специфически связывается с c-Met, что позволяет эффективно лечить заболевания, ассоциированные с экспрессией полипептида c-Met. 10 н. и 12 з.п. ф-лы, 12 ил., 6 табл., 4 пр.
Реферат
Данное изобретение относится к области прогнозирования и/или диагностики пролиферативного заболевания у пациента. В частности, изобретение относится к новому антителу, способному специфически связываться с человеческим рецептором cMet, а также к аминокислотной и нуклеиновокислотной последовательностям, которые кодируют это антитело. Изобретение также включает применение указанного антитела и соответствующие способы для определения и диагностики патологических гиперпролиферативных онкогенных расстройств, связанных с экспрессией cMet. В некоторых воплощениях расстройства являются онкогенными расстройствами, связанными с повышенной экспрессией полипептида cMet по сравнению с нормой, или любой другой патологией, связанной со сверхэкспрессией cMet. Наконец, изобретение включает продукты и/или композиции или наборы, включающие по меньшей мере такое антитело для прогнозирования или диагностики некоторых видов рака.
Агенты, нацеленные на рецептор тирозинкиназы (RTK), такие как ингибиторы трастузумаб, цетуксимаб, бевацизумаб, иматиниб и гефитиниб, продемонстрировали интерес нацеливания на этот класс белков для лечения отдельных видов рака.
cMet является прототипным членом подсемейства RTK, которое также включает RON и SEA. Семейство RTK cMet структурно отличается от других семейств RTK и является единственным известным высоко аффинным рецептором для фактора роста гепатоцитов (HGF), также называемого рассеивающим фактором (SF) [D.P. Bottaro et al., Science 1991, 251:802-804; L. Naldini et al., Eur. Mol. Biol. Org. J. 1991, 10:2867-2878]. cMet и HGF широко экспрессированы в различных тканях, и их экспрессия, как правило, ограничена клетками эпителиального и мезенхимального происхождения, соответственно [M.F. Di Renzo et al., Oncogene 1991, 6:1997-2003; E. Sonnenberg et al., J. Cell. Biol. 1993, 123:223-235]. Они оба необходимы для нормального развития млекопитающих, и было показано, что особенно важны в миграции клеток, морфогенной дифференциации и организации трехмерных трубчатых структур, а также росте и ангиогенезе [F. Baldt et al., Nature 1995, 376:768-771; С.Schmidt et al., Nature. 1995:373:699-702; Tsarfaty et al., Science 1994, 263:98-101]. Так как было показано, что контролируемое регулирование cMet и HGF играет важную роль в развитии млекопитающих, поддержании и репарации тканей [Nagayama Т, Nagayama M, Kohara S, Kamiguchi H, Shibuya M, Katoh Y, Itoh J, Shinohara Y., Brain Res. 2004, 5;999(2):155-66; Tahara Y, Ido A, Yamamoto S, Miyata Y, Uto H, Hori T, Hayashi K, Tsubouchi H., J Pharmacol Exp Ther. 2003, 307(1):146-51], нарушение их регуляции вовлечено в прогрессию раков.
Нарушенная сигнализация, управляемая несоответствующей активацией cMet, является одним из наиболее частых изменений, наблюдаемых в человеческих раках, и играет важнейшую роль в развитии опухолей и метастазов [Birchmeier et al., Nat. Rev. Mol. Cell Biol. 2003, 4:915-925; L. Trusolino and Comoglio P. M., Nat Rev. Cancer. 2002, 2(4):289-300].
Несоответствующая активация cMet может возникнуть путем лиганд-зависимого и лиганд-независимого механизмов, которые включают сверхэкспрессию cMet и/или паракринную или аутокринную активацию, или через усиление функции мутации [J.G. Christensen, Burrows J. and Salgia R., Cancer Latters. 2005, 226:1-26]. Тем не менее, олигомеризация cMet-рецептора, в присутствии или в отсутствие лиганда, необходима для регуляции аффинности связывания и кинетики связывания киназы с АТФ и тирозин-содержащими пептидными субстратами [Hays JL, Watowich SJ, Biochemistry, 2004 Aug 17, 43:10570-8]. Активированный cMet привлекает эффекторы сигналинга к своему мультидоковому сайту, расположенному в цитоплазматическом домене, приводя к активации нескольких ключевых сигнальных путей, в том числе Ras-MAPK, PI3K, Src и Stat3 [Gao CF, Vande Woude GF, Cell Res. 2005, 15(1):49-51; Furge KA, Zhang YW, Vande Woude GF, Oncogene. 2000, 19(49):5582-9]. Эти пути имеют важное значение для пролиферации опухолевых клеток, инвазии и ангиогенеза и для уклонения от апоптоза [Furge KA, Zhang YW, Vande Woude GF, Oncogene, 2000, 19(49):5582-9; Gu H, Neel BG, Trends Cell Biol. 2003 Mar, 13(3):122-30; Fan S, Ma YX, Wang JA, Yuan RQ, Meng Q, Cao Y, Laterra JJ, Goldberg ID, Rosen EM, Oncogene. 2000 Apr 27, 19(18):2212-23]. Кроме того, уникальным аспектом cMet-сигналинга по сравнению с другими RTK является его взаимодействие с фокальными комплексами адгезии и некиназными связывающими партнерами, такими как а6(34-интегрины [Trusolino L, Bertotti A, Comoglio PM, Cell. 2001, 107:643-54], CD44v6 [Van der Voort R, Taher ТЕ, Wielenga VJ, Spaargaren M, Prevo R, Smit L, David G, Hartmann G, Gherardi E, Pals ST, J Biol Chem. 1999, 274(10):6499-50б], плексин В1 или семафорины [Giordano S, Corso S, Conrotto P, Artigiani S, Gilestro G, Barberis D, Tamagnone L, Comoglio PM, Nat Cell Biol. 2002, 4(9):720-4; Conrotto P, Valdembri D, Corso S, Serini G, Tamagnone L, Comoglio PM, Bussolino F, Giordano S, Blood. 2005, 105(11):4321-9; Conrotto P, Corso S, Gamberini S, Comoglio PM, Giordano S, Oncogene. 2004, 23:5131-7], которые также могут увеличить сложность регуляции клеточной функции этим рецептором. Наконец, последние данные показывают, что cMet может быть вовлечен в устойчивость опухоли к гефитинибу или эрлотинибу, подтверждая, что сочетание соединения, нацеленного и на EGFR, и на cMet, может быть весьма интересным [Engelman JA at al., Science, 2007, 316:1039-43].
В последние несколько лет много различных стратегий было разработано для ослабления cMet-сигналинга в линиях раковых клеток. Эти стратегии включают i) нейтрализующие антитела против cMet или HGF/SF [Сао В, Su Y, Oskarsson M, Zhao P, Kort EJ, Fisher RJ, Wang LM, Vande Woude GF, Proc Natl Acad Sci USA. 2001, 98(13):7443-8; Martens Т, Schmidt NO, Eckerich C, Fillbrandt R, Merchant M, Schwall R, Westphal M, Lamszus K, Clin Cancer Res. 2006, 12(20):6144-52] или применение HGF/SF-антагониста NK4 для предотвращения связывания лиганда с cMet [Kuba К, Matsumoto К, Date К, Shimura H, Tanaka M, Nakamura T, Cancer Res., 2000, 60:6737-43], ii) малые ингибиторы АТФ-связывающих сайтов с cMet, которые блокируют киназную активность [Christensen JG, Schreck R, Burrows J, Kuruganti P, Chan E, Le P, Chen J, Wang X, Ruslim L, Blake R, Lipson KE, Ramphal J, Do S, Cui JJ, Cherrington JM, Mendel DB, Cancer Res. 2003, 63:7345-55], iii) разработанный SH2-доменный полипептид, который препятствует доступу к мультидоковому сайту, и РНКи или рибозим, которые уменьшают экспрессию рецептора или лиганда. Большинство из этих подходов отображают селективное ингибирование cMet, приводящее к ингибированию опухоли и показывающее, что cMet может представлять интерес для терапевтического вмешательства при раке.
Данное изобретение призвано обеспечить по меньшей мере одним реагентом, который может быть использован в качестве диагностического или прогностического биомаркера для обнаружения и/или мониторинга онкогенных расстройств, особенно тех, которые характеризуются экспрессией cMet, или тех, которые опосредованы ненормальной экспрессией cMet.
О предыдущих попытках разработать полезное антитело, которое может быть использовано в качестве диагностического и прогностического инструмента, не сообщалось. Описанные в данном документе антитела являются новыми антителами, которые отвечают этим критериям.
Другие особенности и преимущества изобретения будут очевидны из подробного описания и примеров, приведенных ниже.
В первом аспекте предметом изобретения является выделенное антитело или один из его функциональных фрагментов или производных, которое связывается с рецептором cMet (cMet), предпочтительно человеческим cMet, с высокой аффинностью, и поэтому может быть полезным в способах диагностики патологических гиперпролиферативных онкогенных расстройств, опосредованных экспрессией cMet.
Выражение «функциональный фрагмент(ы) и/или производное(ые)» подробно будет определено позже в данном описании.
Здесь следует понимать, что изобретение не связано с антителами в их природной форме, т.е. они не находятся в их природной среде, но они могут быть выделены или получены путем очистки из природных источников, либо получены путем генетической рекомбинации или путем химического синтеза, и что они могут содержать неприродные аминокислоты, как будет описано далее.
В частности, в соответствии с другим аспектом изобретения предполагается выделенное антитело или один из его функциональных фрагментов или производных, способных специфически связываться с cMet, при этом указанное антитело характеризуется тем, что оно включает по меньшей мере одну область, определяющую комплементарность (CDR), выбранную из CDR, содержащих аминокислотную последовательность SEQ ID №№1-12 или 29-39, или по меньшей мере одну CDR, последовательность которой по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентична последовательности 1-12 или 29-39 после оптимального выравнивания.
Понятие «функциональный фрагмент» антитела обозначает, в частности, фрагмент антитела, такой как фрагменты Fv, scFv (sc обозначает одну цепь), Fab, F(ab')2, Fab', scFv-Fc, или димерные антитела, или любой фрагмент, время полужизни которого было увеличено. Такие функциональные фрагменты будут подробно описаны ниже в данном описании.
Понятие «производное соединение» или «производное» антитела обозначает, в частности, белок, состоящий из пептидного остова и по меньшей мере одной CDR исходного антитела для того, чтобы он сохранил свою способность быть распознанным. Такие производные соединения, хорошо известные специалистам в данной области, будут описаны более подробно в данном описании.
Более предпочтительно, изобретение содержит антитела, их производные соединения или функциональные фрагменты в соответствии с данным изобретением, полученные путем генетической рекомбинации или химического синтеза.
В соответствии с предпочтительным воплощением антитело изобретения или его производные соединения или функциональные фрагменты характеризуются тем, что они состоят из моноклонального антитела.
Под «моноклональным антителом» понимается антитело, происходящее из почти однородной популяции антитела. Более конкретно, отдельные антитела популяции идентичны, за исключением нескольких возможных природных мутаций, которые могут быть найдены в минимальных пропорциях. Другими словами, моноклональное антитело состоит из однородного антитела, полученного при выращивании одного клона клеток (например, гибридомы, эукариотической клетки-хозяина, трансфицированной молекулой ДНК, кодирующей однородное антитело, прокариотической клетки-хозяина, трансфицированной молекулой ДНК, кодирующей однородное антитело, и т.д.) и, как правило, характеризуется тяжелыми цепями одного и только одного класса и подкласса, и легкими цепями только одного типа. Моноклональные антитела высоко специфичны и направлены против одного антигена. Кроме того, в отличие от препаратов поликлональных антител, которые обычно включают различные антитела, направленные против различных детерминант, или эпитопов, каждое моноклональное антитело направлено против одного эпитопа антигена.
Следует понимать, что изобретение не связано с антителами в их природной форме, т.е. они взяты не из их природной среды, а выделены или получены путем очистки из природных источников или получены путем генетической рекомбинации или химического синтеза и, следовательно, они могут нести неприродные аминокислоты, как будет описано ниже.
В первом и предпочтительном воплощении изобретения CDR антитела будут определены в соответствии с системой нумерации IMGT.
Уникальная нумерация IMGT была создана для сравнения вариабельных доменов независимо от антигенного рецептора, типа цепи или вида [Lefranc M.-P., Immunology Today 18, 509 (1997) / Lefranc M.-P., The Immunologist, 7, 132-136 (1999) / Lefranc, M.-P., Pommie, С., Ruiz, M., Giudicelli, V., Foulquier, E., Truong, L, Thouvenin-Contet, V. and Lefranc, Dev. Comp. Immunol., 27, 55-77 (2003)]. В уникальной нумерации IMGT консервативные аминокислоты всегда занимают одну и ту же позицию, например цистеин 23 (1-CYS), триптофан 41 (CONSERVED-TRP), гидрофобная аминокислота 89, цистеин 104 (2-CYS), фенилаланин или триптофан 118 (J-PHE или J-TRP). Уникальная нумерация IMGT предусматривает стандартизированное разграничение каркасных областей (FR1-IMGT: позиции 1-26, FR2-IMGT: 39-55, FR3-IMGT: 66-104 и FR4-IMGT: 118-128) и областей, определяющих комплементарность: CDR1-IMGT: 27-38, CDR2-IMGT: 56-65 и CDR3-IMGT: 105-117. Т.к. разрывы представляют собой незанятые позиции, то длины CDR-IMGT (показаны в скобках и разделены точками, например [8.8.13]) становятся важной информацией. Уникальная нумерация IMGT используется в 2D-графическом представлении, обозначенном как IMGT Colliers de Perles [Ruiz, M. and Lefranc, M.-P., Immunogenetics, 53, 857-883 (2002) / Kaas, Q. and Lefranc, M.-P., Current Bioinformatics, 2, 21-30 (2007)], и в 3D-структурах в IMGT/3Dstructure-DB [Kaas, Q., Ruiz, M. and Lefranc, M.-P., T cell receptor and MHC structural data. Nucl. Acids. Res., 32, D208-D210 (2004)].
Существует три CDR тяжелой цепи и три CDR легкой цепи. Термин «CDR» в единственном или множественном числе применяется здесь для обозначения, в зависимости от случая, одного или более или даже всех этих участков, которые содержат большинство аминокислотных остатков, ответственных за аффинное связывание антитела с антигеном или эпитопом, который оно распознает.
Более конкретно, в соответствии с первым аспектом изобретение относится к выделенному, антителу или функциональному фрагменту или его производному, способному специфически связываться с cMet-белком, состоящему из i) тяжелой цепи, содержащей по меньшей мере одну из следующих CDR-H1, CDR-H2 и CDR-H3, как они определены в соответствии с системой нумерации IMGT, где CDR-H1 включает последовательность SEQ ID №55, CDR-H2 включает последовательность SEQ ID №56, и CDR-Н3 включает последовательность SEQ ID №57; и/или ii) легкой цепи, содержащей по меньшей мере одну из следующих CDR-L1, CDR-L2 и CDR-L3, как они определены в соответствии с системой нумерации IMGT, где CDR-L1 включает последовательность SEQ ID №58, CDR-L2 включает последовательность SEQ ID №59, и CDR-L3 включает последовательность SEQ ID №60.
В предпочтительном воплощении данное изобретение направлено на выделенное антитело или функциональный фрагмент или его производное, способное специфически связываться с cMet-белком, отличающееся тем, что оно состоит из i) тяжелой цепи, содержащей по меньшей мере следующие три CDR: CDR-H1, CDR-H2 и CDR-H3, как они определены в соответствии с системой нумерации IMGT, где CDR-H1 включает последовательность SEQ ID №55, CDR-H2 включает последовательность SEQ ID №56, и CDR-H3 включает последовательность SEQ ID №57; и/или ii) легкой цепи, содержащей по меньшей мере следующие три CDR: CDR-L1, CDR-L2 и CDR-L3, как они определены в соответствии с системой нумерации IMGT, где CDR-L1 включает последовательность SEQ ID №58, CDR-L2 включает последовательность SEQ ID №59, и CDR-L3 включает последовательность SEQ ID №60.
Для ясности консенсусные последовательности SEQ ID №№55-60 изобретения приведены в следующей таблице 1.
| Таблица 1 | ||
| SEQ ID № | Последовательность (IMGT) | |
| CDR-H1 | 55 | GYX1X2TSX3YX4 |
| CDR-H2 | 56 | INX5X6X7GX8X9 |
| CDR-H3 | 57 | X10RX11X12X13X14X15X16X17Y |
| CDR-L1 | 58 | X18X19X20X21X22Y |
| CDR-L2 | 59 | X23X24S |
| CDR-L3 | 60 | QQX25NSX26PX27T |
| C: | |||
| X1: S или Т | X2: I или F | Х3: А или - | X4: F или W |
| X5: Y или Р | X6: D или S | X7: - или N | X8: Т или R |
| Х9: N или Т | Х10: Т или А | Х11: D или R | X12: R или V |
| X13: Т или G | X14: F или Y | X15: А или L | X16: - или М |
| X17: - или D | X18: Q или - | Х19: R или S | Х20: I или S |
| X21: Y или V | Х22: N или S | Х23: Y или D | Х24: А или Т |
| Х25: S или W | X26: W или N | Х27: L или Р | |
| «-» - обозначение для «утерянных» (делеция аминокислотного остатка в этой позиции). |
В соответствии с конкретным воплощением антитело изобретения или один из его функциональных фрагментов или производных характеризуется тем, что включает тяжелую цепь со следующими тремя CDR, как они определены в соответствии с IMGT: соответственно CDR-H1, CDR-H2 и CDR-H3, где CDR-H1 включает последовательность SEQ ID №7, CDR-H2 включает последовательность SEQ ID №2, и CDR-H3 включает последовательность SEQ ID №8.
В соответствии с конкретным воплощением антитело изобретения или один из его функциональных фрагментов или производных характеризуется тем, что включает легкую цепь со следующими тремя CDR, как они определены в соответствии с IMGT: соответственно CDR-L1, CDR-L2 и CDR-L3, где CDR-L1 включает последовательность SEQ ID №4, CDR-L2 включает последовательность SEQ ID №5, и CDR-L3 включает последовательность SEQ ID №6.
В соответствии с конкретным воплощением антитело изобретения или один из его функциональных фрагментов или производных характеризуется тем, что включает тяжелую цепь со следующими тремя CDR, как они определены в соответствии с системой нумерации IMGT: соответственно CDR-H1, CDR-H2 и CDR-H3, где CDR-H1 включает последовательность SEQ ID №29, CDR-H2 включает последовательность SEQ ID №30, и CDR-H3 включает последовательность SEQ ID №31.
В соответствии с конкретным воплощением антитело изобретения или один из его функциональных фрагментов или производных характеризуется тем, что включает легкую цепь, включающую следующие три CDR, как они определены в соответствии с системой нумерации IMGT: соответственно CDR-L1, CDR-L2 и CDR-L3, где CDR-L1 включает последовательность SEQ ID №32, CDR-L2 включает последовательность SEQ ID №33, и CDR-L3 включает последовательность SEQ ID №34.
Другими словами, изобретение также может быть описано как антитело или один из его функциональных фрагментов или производных, которое характеризуется тем, что включает тяжелую цепь, выбранную из группы, состоящей из:
а) тяжелой цепи, включающей следующие три CDR, как они определены в соответствии с системой нумерации IMGT: соответственно CDR-H1 с последовательностью SEQ ID №7, CDR-H2 с последовательностью SEQ ID №2 и CDR-H3 с последовательностью SEQ ID №8; и
б) тяжелой цепи, включающей следующие три CDR, как они определены в соответствии с системой нумерации IMGT: соответственно CDR-H1 с последовательностью SEQ ID №29, CDR-H2 с последовательностью SEQ ID №30 и CDR-H3 с последовательностью SEQ ID №31.
Изобретение также может быть описано как антитело или один из его функциональных фрагментов или производных, которое характеризуется тем, что включает легкую цепь, выбранную из группы, состоящей из:
а) легкой цепи, включающей следующие три CDR, как они определены в соответствии с системой нумерации IMGT: соответственно CDR-L1 с последовательностью SEQ ID №4, CDR-L2 с последовательностью SEQ ID №5 и CDR-L3 с последовательностью SEQ ID №6; и
б) легкой цепи, включающей следующие три CDR, как они определены в соответствии с системой нумерации IMGT: соответственно CDR-L1 с последовательностью SEQ ID №32, CDR-L2 с последовательностью SEQ ID №33 и CDR-L3 с последовательностью SEQ ID №34.
В другом воплощении области, определяющие комплементарность, или CDR, означают гипервариабельные области тяжелых и легких цепей иммуноглобулинов, как они определены Кабат и соавт. (Kabat et al., Sequences of proteins of immunological interest, 5th Ed., U.S. Department of Health and Human Services, NIH, 1991, и более поздние издания). Существует три CDR тяжелой цепи и три CDR легкой цепи. Термин «CDR» в единственном или множественном числе применяется здесь для обозначения, в зависимости от случая, одного или более или даже всех этих участков, которые содержат большинство аминокислотных остатков, ответственных за аффинное связывание антитела с антигеном или эпитопом, который оно распознает.
В соответствии с другим конкретным воплощением антитело изобретения или один из его функциональных фрагментов или производных характеризуется тем, что включает тяжелую цепь со следующими тремя CDR, как они определены в соответствии с Кабат: соответственно CDR-H1, CDR-H2 и CDR-H3, где CDR-H1 включает последовательность SEQ ID №9, CDR-H2 включает последовательность SEQ ID №10, и CDR-H3 включает последовательность SEQ ID №3.
В соответствии с другим конкретным воплощением антитело изобретения или один из его функциональных фрагментов или производных характеризуется тем, что включает легкую цепь со следующими тремя CDR, как они определены в соответствии с Кабат: соответственно CDR-L1, CDR-L2 и CDR-L3, где CDR-L1 включает последовательность 11, CDR-L2 включает последовательность 12, и CDR-L3 включает последовательность 6.
В соответствии с другим конкретным воплощением антитело изобретения или один из его функциональных фрагментов или производных характеризуется тем, что включает тяжелую цепь со следующими тремя CDR, как они определены в соответствии с системой нумерации Кабат: соответственно CDR-H1, CDR-H2 и CDR-H3, где CDR-H1 включает последовательность SEQ ID №35, CDR-H2 включает последовательность SEQ ID №36, и CDR-H3 включает последовательность SEQ ID №37.
В соответствии с другим конкретным воплощением антитело изобретения или один из его функциональных фрагментов или производных характеризуется тем, что включает легкую цепь со следующими тремя CDR, как они определены в соответствии с системой нумерации Кабат: соответственно CDR-L1, CDR-L2 и CDR-L3, где CDR-L1 включает последовательность SEQ ID №38, CDR-L2 включает последовательность SEQ ID №39, и CDR-L3 включает последовательность SEQ ID №34.
Еще один способ определить CDR антител в соответствии с изобретением может состоять в определении общих остатков для каждой CDR в соответствии с IMGT и Кабат.
В соответствии с другим воплощением антитело изобретения или один из его функциональных фрагментов или производных характеризуется тем, что включает тяжелую цепь, включающую по меньшей мере одну из трех CDR-последовательностей SEQ ID №№1, 2 или 3 или по меньшей мере одну последовательность, которая по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентична последовательности SEQ ID №№1, 2 или 3 после оптимального выравнивания.
В частности, антитело изобретения или один из его функциональных фрагментов или производных характеризуется тем, что включает легкую цепь, включающую по меньшей мере одну из трех CDR-последовательностей SEQ ID №№4, 5 или 6 или по меньшей мере одну последовательность, которая по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентична последовательности SEQ ID №№4, 5 или 6 после оптимального выравнивания.
Предпочтительным образом, антитело изобретения или один из его функциональных фрагментов или производных характеризуется тем, что включает тяжелую цепь со следующими тремя CDR, соответственно CDR-H1, CDR-H2 и CDR-H3, где:
- CDR-H1 включает последовательность SEQ ID №1, 7, 9, 29 или 35 или последовательность, которая по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентична последовательности SEQ ID №1, 7, 9, 29 или 35 после оптимального выравнивания;
- CDR-H2 включает последовательность SEQ ID №2, 10, 30 или 36 или последовательность, которая по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентична последовательности SEQ ID №2, 10, 30 или 36 после оптимального выравнивания; и
- CDR-H3 включает последовательность SEQ ID №3, 8, 31 или 37 или последовательность, которая по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентична последовательности SEQ ID №3, 8, 31 или 37 после оптимального выравнивания.
Еще более предпочтительно антитело изобретения или один из его функциональных фрагментов или производных характеризуется тем, что включает легкую цепь со следующими тремя CDR, соответственно CDR-L1, CDR-L2 и CDR-L3, где:
- CDR-L1 включает последовательность SEQ ID №4, 11, 32 или 38 или последовательность, которая по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентична последовательности SEQ ID №4, 11, 32 или 38 после оптимального выравнивания;
- CDR-L2 включает последовательность SEQ ID №5, 12, 33 или 39 или последовательность, которая по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентична последовательности SEQ ID №5, 12, 33 или 39 после оптимального выравнивания; и
- CDR-L3 включает последовательность SEQ ID №6 или 34 или последовательность, которая по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентична последовательности SEQ ID №6 или 34 после оптимального выравнивания.
В еще одном воплощении изобретение также может быть описано как антитело или его функциональный фрагментов или производное, которое характеризуется тем, что выбрано из группы, состоящей из:
а) антитела или его функционального фрагмента или производного, состоящего из:
- тяжелой цепи, включающей следующие три CDR, как они определены в соответствии с IMGT: соответственно CDR-H1 с последовательностью SEQ ID №7, CDR-H2 с последовательностью SEQ ID №2 и CDR-H3 с последовательностью SEQ ID №8; и
- легкой цепи, включающей следующие три CDR, как они определены в соответствии с IMGT: соответственно CDR-L1 с последовательностью SEQ ID №4, CDR-L2 с последовательностью SEQ ID №5 и CDR-L3 с последовательностью SEQ ID №6; и
б) антитела или его функционального фрагмента или производного, состоящего из:
- тяжелой цепи, включающей следующие три CDR, как они определены в соответствии с IMGT: соответственно CDR-H1 с последовательностью SEQ ID №29, CDR-H2 с последовательностью SEQ ID №30 и CDR-H3 с последовательностью SEQ ID №31.
- легкой цепи, включающей следующие три CDR, как они определены в соответствии с IMGT: соответственно CDR-L1 с последовательностью SEQ ID №32, CDR-L2 с последовательностью SEQ ID №33 и CDR-L3 с последовательностью SEQ ID №34.
В данном описании термины «полипептиды», «полипептидные последовательности», «пептиды» и «белки», применяемые по отношению к соединениям антителам или их последовательностям, являются взаимозаменяемыми.
Здесь следует понимать, что изобретение не относится к антителам в природной форме, т.е. они взяты не из их природной среды, а выделены или получены путем очистки из природных источников, либо получены путем генетической рекомбинации, либо путем химического синтеза, и, таким образом, они могут содержать неприродные аминокислоты, как будет описано ниже.
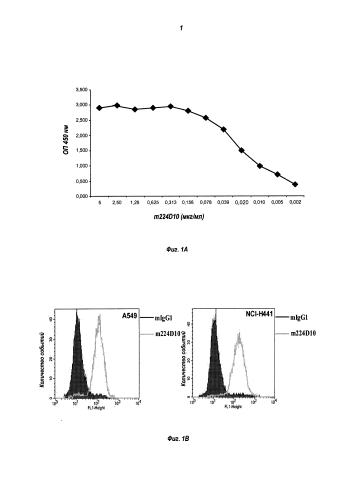
Для большей ясности, необходимо понимать, что в следующем описании, и в частности в таблицах 3а и , CDR антитела, называемого 224D10, будут определены по нумерации IMGT, нумерации Кабата и общей нумерации.
Общая нумерация объединяет остаточные части каждой CDR, которые являются общими для CDR, определенных в соответствии с системами нумерации IMGT и Кабата.
Система нумерации IMGT определяет CDR в соответствии с IMGT-системой, как определено выше, в то время как система нумерации Кабата определяет CDR в соответствии с системой Кабата, как определено выше.
В частности, CDR-H1 содержит SEQ ID №1 (TSAYF) в общей системе нумерации, SEQ ID №7 (GYSITSAYF) в системе нумерации IMGT и SEQ ID №9 (TSAYFWS) в системе нумерации Кабата.
CDR-H2 содержит SEQ ID №2 (INYDGTN) в общей системе нумерации и системе нумерации IMGT и SEQ ID №10 (FINYDGTNNYNPSLKN) в системе нумерации Кабата.
CDR-H3 содержит SEQ ID №3 (DRTFAY) в общей системе нумерации и системе нумерации Кабата, в то время как в системе нумерации IMGT он содержит SEQ ID №8 (TRDRTFAY).
Для легкой цепи, CDR-L1 содержит SEQ ID №4 (QRIYNY) в общей системе нумерации и системе нумерации IMGT и SEQ ID №11 (RASQRIYNYLH) в системе нумерации Кабата.
Что касается CDR-L2, он содержит SEQ ID №5 (YAS) в общей системе нумерации и системе нумерации IMGT и SEQ ID №12 (YASQSIS) в системе нумерации Кабата.
Наконец, CDR-L3 содержит SEQ ID №6 (QQSNSWPLT) в каждой из трех систем нумерации.
То же самое специалист в данной области легко сделает для антитела 221С9.
Параллельно с этим, для большей ясности, необходимо понимать, что в последующем описании, и в частности в таблице 3b и 4b, CDR антитела, называемого 221С9, будут определены по нумерации IMGT и нумерации Кабата.
В контексте данного изобретения «процент идентичности» двух нуклеиновокислотных или аминокислотных последовательностей обозначает процент идентичных нуклеотидов или аминокислотных остатков в двух сравниваемых последовательностях, полученный после оптимального выравнивания; этот процент чисто статистический, и различия между двумя последовательностями распределяются случайным образом по всей их длине. Сравнение двух нуклеиновокислотных или аминокислотных последовательностей традиционно проводится путем сравнения этих последовательностей после выравнивания их оптимальным образом; указанное сравнение может осуществляться по сегментам или с помощью «окна сравнения». Оптимальное выравнивание последовательностей для сравнения может быть осуществлено, в дополнение к ручному, с помощью алгоритма локальной гомологии Смита-Уотермана (1981) [Ad. App. Math. 2:482], с помощью алгоритма локальной гомологии Нидлмана-Вунша (1970) [J. Mol. Biol. 48:443], с помощью способа поиска сходства Пирсона и Липмана (1988) [Proc. Natl. Acad. Sci. USA 85:2444) или с помощью компьютерного программного обеспечения с использованием этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в пакете программного обеспечения Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WI, либо с помощью программного обеспечения для сравнения BLAST NR или BLAST Р).
Процент идентичности двух нуклеиновокислотных или аминокислотных последовательностей определяют путем сравнения двух последовательностей, выровненных оптимальным образом, при этом сравниваемая нуклеиновокислотная или аминокислотная последовательность может включать добавления или делеции по сравнению с референсной последовательностью для оптимального выравнивания этих двух последовательностей. Процент идентичности рассчитывается путем определения числа позиций, в которых нуклеотид или аминокислотный остаток идентичен в двух последовательностях, деления этого количества идентичных позиций на общее количество позиций в окне выравнивания и умножения полученного результата на 100, чтобы получить процент идентичности этих двух последовательностей.
Например, программа BLAST «BLAST 2 sequences» (Tatusova et al, "Blast 2 sequences - a new tool for comparing protein and nucleotide sequences", FEMS Microbiol, 1999, Lett. 174:247-250), доступная на сайте http://www.ncbi.nlm.nih.gov/gorf/bl2.html, может быть использована с параметрами по умолчанию (в частности, с параметрами «штраф за открытие делеции»: 5 и «штраф за удлинение делеции»: 2; выбранной матрицей будет, например, матрица «BLOSUM 62», предложенная в программе); процентная идентичность двух сравниваемых последовательностей рассчитывается непосредственно в программе.
Среди аминокислотных последовательностей, имеющих по меньшей мере 80%, предпочтительно 85%, 90%, 95% и 98% идентичность с референсной аминокислотной последовательностью, предпочтительными примерами являются те, которые содержат референсную последовательность, определенные модификации, в частности делецию, добавление или замену по меньшей мере одной аминокислоты, усечение или удлинение. В случае замены одной или более последовательных или непоследовательных аминокислот предпочтительными являются такие замены, в которых замененные аминокислоты заменены «эквивалентными» аминокислотами. Выражение «эквивалентные аминокислоты» используется здесь для обозначения любых аминокислот, которые могут быть заменены одной из структурных аминокислот, но без значительной модификации биологических активностей соответствующих антител и таких специфических примеров, какие будут определены позже.
Эквивалентные аминокислоты могут быть определены либо на основании их структурной гомологии с аминокислотами, которые они заменяют, либо по результатам сравнительных анализов биологической активности различных антител, на которую они способны.
В качестве неограничивающего примера приведенная ниже таблица 2 показывает замены, возможные без получения значительной модификации биологической активности соответствующего модифицированного антитела; обратные замены, разумеется, также возможны в тех же условиях.
| Таблица 2 | |
| Исходный остаток | Замена(ы) |
| Ala (A) | Val, Gly, Pro |
| Arg (R) | Lys, His |
| Asn (N) | Gln |
| Asp (D) | Glu |
| Cys (C) | Ser |
| Gln (Q) | Asn |
| Glu (G) | Asp |
| Gly (G) | Ala |
| His (H) | Arg |
| Ile (I) | Leu |
| Leu (L) | Ile, Val, Met |
| Lys (K) | Arg |
| Met (M) | Leu |
| Phe (F) | Tyr |
| Pro (P) | Ala |
| Ser (S) | Thr, Cys |
| Thr (T) | Ser |
| Trp (W) | Tyr |
| Tyr (Y) | Phe, Trp |
| Val (V) | Leu, Ala |
Специалистам в данной области известно, что на текущем уровне техники наибольшая вариабельность (по длине и составу) среди шести CDR находится в трех CDR тяжелой цепи и, в частности, в CDR-H3 этой тяжелой цепи.
В конкретном воплощении данное изобретение относится к мышиному антителу или его производным соединениям или функциональным фрагментам.
Другое воплощение изобретения раскрывает антитело 224D10 или один из его функциональных фрагментов или производных, содержащих тяжелую цепь с тремя следующими CDR, основанными на «общем» определении CDR:
- CDR-H1 последовательности SEQ ID №1 или последовательности, по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентичной после оптимального выравнивания последовательности SEQ ID №1;
- CDR-H2 последовательности SEQ ID №2 или последовательности, по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентичной после оптимального выравнивания последовательности SEQ ID №2; и
- CDR-H3 последовательности SEQ ID №3 или последовательности, по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентичной после оптимального выравнивания последовательности SEQ ID №3; и
легкую цепь с тремя следующими CDR:
- CDR-L1 последовательности SEQ ID №4 или последовательности, по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентичной после оптимального выравнивания последовательности SEQ ID №4;
- CDR-L2 последовательности SEQ ID №5 или последовательности, по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентичной после оптимального выравнивания последовательности SEQ ID №5; и
- CDR-L3 последовательности SEQ ID №6 или последовательности, по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентичной после оптимального выравнивания последовательности SEQ ID №6.
Еще одно воплощение изобретения раскрывает антитело 224D10 или один из его функциональных фрагментов или производных, содержащих тяжелую цепь с тремя следующими CDR, основанными на системе нумерации IMGT:
- CDR-H1 последовательности SEQ ID №7 или последовательности, по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентичной после оптимального выравнивания последовательности SEQ ID №7;
- CDR-H2 последовательности SEQ ID №2 или последовательности, по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентичной после оптимального выравнивания последовательности SEQ ID №2; и
- CDR-H3 последовательности SEQ ID №8 или последовательности, по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентичной после оптимального выравнивания последовательности SEQ ID №8; и
легкую цепь с тремя следующими CDR:
- CDR-L1 последовательности SEQ ID №4 или последовательности, по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентичной после оптимального выравнивания последовательности SEQ ID №4;
- CDR-L2 последовательности SEQ ID №5 или последовательности, по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентичной после оптимального выравнивания последовательности SEQ ID №5; и
- CDR-L3 последовательности SEQ ID №6 или последовательности, по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентичной после оптимального выравнивания последовательности SEQ ID №6.
Еще одно воплощение изобретения раскрывает антитело 224D10 или или один из его функциональных фрагментов или производных, содержащих тяжелую цепь с тремя следующими CDR, основанными на системе нумерации Кабата:
- CDR-H1 последовательности SEQ ID №9 или последовательности, по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентичной после оптимального выравнивания последовательности SEQ ID №9;
CDR-H2 последовательности SEQ ID №10 или последовательности, по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентичной после оптимального выравнивания последовательности SEQ ID №10; и
- CDR-H3 последовательности SEQ ID №3 или последовательности, по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентичной после оптимального выравнивания последовательности SEQ ID №3;и
легкую цепь с тремя следующими CDR:
- CDR-L1 последовательности SEQ ID №11 или последовательности, по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентичной после оптимального выравнивания последовательности SEQ ID №11;
- CDR-L2 последовательности SEQ ID №12 или последовательности, по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентичной после оптимального выравнивания последовательности SEQ ID №12; и
- CDR-L3 последовательности SEQ ID №6 или последовательности, по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98% идентичной после оптимального выравнивания последовательности SEQ ID №6.
Антитело 224D10 или один из его функциональных фрагментов или производных в соответствии с изобретением характеризуется тем, что содержит в соответствии с «общей» системой нумерации:
- тяжелую цепь, содержащую CDR-H1 последовательности SEQ ID №1, CDR-H2 последовательности SEQ ID №2 и CDR-H3 последовательности SEQ ID №3; и
- легкую цепь, содержащую CDR-L1 последовательности SEQ ID №4, CDR-L2 последовательности SEQ ID №5 и CDR-L3 последовательности SEQ ID №6.
В другом воплощении антитело 224D10 или один из его функциональных фрагментов или производных в соответствии с изобретением характеризуется тем, что содержит в соответствии с системой нумерации IMGT:
- тяжелую цепь, содержащую CDR-H1 последовательности SEQ ID №7, CDR-H2 последовательности SEQ ID №2 и CDR-H3 пос