Способ детекции проникновения углеродных нанотрубок в биологическую ткань
Иллюстрации
Показать всеИзобретение относится к области нанотехнологий и молекулярной биологии. Предложен способ детекции проникновения углеродных нанотрубок (УНТ) в биологическую ткань, геном клеток которой содержит промотор гена теплового шока, сшитый с кодирующей областью дрожжевого транскрипционного фактора Gal4, и генетическую репортерную конструкцию UAS-GFP. Вывод о наличии или отсутствии проникновения отдельных УНТ в ткань образца делают на основе распределения флуоресценции в клетках образца. Изобретение обеспечивает эффективную детекцию проникновения УНТ в биологическую ткань. 3 ил., 3 пр.
Реферат
Изобретение относится к области нанотехнологий, а также молекулярной биологии, а именно к исследованию и анализу углеродных наноструктур, содержащихся в биологическом материале, и может быть использовано для детекции углеродных нанотрубок проникающих в различные биологические ткани.
В последние годы наноматериалы получают все большее применение в индустрии, и необходимость исследования их биологического действия обусловлена вопросами безопасности. С другой стороны ожидается, что контролируемое воздействие наночастиц на клетки или организмы в целом может быть использовано для создания новых медицинских методов лечения заболеваний [Омельянчук Л.В., Гурова О.А., Окотруб А.В. Генотоксическое действие неорганических наночастиц на клетку. // Российские нанотехнологий 2014. Т. 9, N 3-4. С. 90-97]. Проникновение наночастиц в клетку изучают двумя способами: 1. при помощи флуоресцентно меченых наноматериалов и визуального наблюдения во флуоресцентном микроскопе [Kam N.W., Liu Z., Dai Н. // Angew. Chem. Int. Ed. Engl. 2006. V. 45. P. 577-581.], 2. с помощью электронной микроскопии [Asharani P.V., Xinyi N., Hande M.P., Valiyaveettil S. // Nanomedicine. 2010. V. 5. N 1. P. 51-64]. Первый способ требует высоких концентраций наноматериалов, для того, чтобы флуоресцентный сигнал можно было наблюдать. Кроме того, для введения флуоресцентной метки, поверхность наночастицы должна подвергаться химической модификации, а это, как видно из наших исследований, искажает картину проникновения наноматериалов в клетки. При втором способе наноматериалы в клетке потенциально можно видеть в виде единичной частицы. Однако процедура приготовления срезов биологических тканей для электронной микроскопии трудоемка и число клеток, которые можно исследовать при высоком разрешении микроскопа столь невелико, требование по разрешению определяется размерами частицы, что исследование широкого набора различных наноматериалов этим способом не представляется возможным хотя бы из соображений высокой стоимости анализа.
Поиск более простых способов детекции проникновения углеродных нанотрубок в биологическую ткань для создания новых медицинских методов лечения заболеваний является актуальным. Так известно изобретение «Детектирование углеродных нанотрубок с помощью микроволнового нагревания» заявка [US №2013259085. Detection of Carbon Nanotubes by Microwave-Induced Heating], опубл. 2013.10. 03, МПК G01N 25/00, где детекцию в биологических образцах (тканях) осуществляют путем сравнения количества тепла при нагреве в микроволновом диапазоне ткани содержащей нанотрубки и ткани в отсутствие нанотрубок. Выделяющееся тепло измеряют с помощью термопары, которую вводят непосредственно в ткань образца. Заметим, что этот способ не позволяет видеть распределение нанотрубок по ткани, кроме того способ является достаточно сложным, так для предотвращения возгорания образца требуется дополнительная продувка азотом и не ясно можно ли в этих условиях достаточно точно обеспечить равный теплоотвод в опыте с трубками и контроле без трубок.
Наиболее близким по технической сущности прототипом является статья [Е. Miyako, Т. Deguchi, Y. Nakajima, М. Yudasaka, Y. Hagihara, M. Horie, M. Shichiri, Y. Higuchi, F. Yamashita, M. Hashida, Y, Shigeri, Y. Yoshida, S. Iijima «Photothermic regulation of gene expression triggered by laser-induced carbon nanohorns» PNAS 2012 vol. 109 no. 19 p. 7523-7528]. Она посвящена решению задачи управления экспрессией гена с помощью лазерного луча и в качестве примера рассмотрен случай индукции экспрессии GFP в тканях трансгенной рыбы Medaka, содержащей конструкцию olphsp70.1-hRluc-Venus, т.е. промотор hsp70 и вариант GFP, называемый Venus, при введении в ее организм нанохорнов и нагревании лазером в области прозрачности ткани (Рис. 2C, 1-6). Заметим, однако, что в статье рассматривается управление экспрессией гена только одного вида углеродного наноматериала (нанохорнов) и не проводились исследования проникновения наночастиц в разные ткани Medaka, кроме того представленные в статье данные не позволяют оценить чувствительность метода - не ясно, детектируют ли они проникновение единичного - нанохорна, поскольку наблюдаемая окраска hs-GFP (Venus) у них достаточно равномерна по тканям и не видно единичных GFP положительных клеток. Такая конструкция, которую используют в статье, менее чувствительна, чем предлагаемая в изобретении.
Задача изобретения: найти способ детектирования проникновения углеродных наноматериалов в клетку с использованием генетических конструкций с техническим результатом позволяющим повысить как чувствительность детекции, так и позволяющим видеть распределение нанотрубок в ткани, а также способ позволяет качественно оценить наличие и уровень проникновения углеродных нанотрубок (УНТ) в исследуемых образцах.
Технический результат достигается тем, что в способе детекции проникновения углеродных нанотрубок в биологическую ткань, в которой геном клеток, входящих в биологическую ткань содержит промотор гена теплового шока, сшитый с кодирующей областью дрожжевого транскрипционного фактора Gal4, и генетическую репортерную конструкцию UAS-GFP, включающий добавление в биологическую ткань углеродных нанотрубок, нагревание образца биологической ткани инфракрасным излучением, после чего проводят детекцию проникновения нанотрубок путем визуального наблюдения индукции экспрессии репортерной конструкции, регистрируемой по флуоресценции наработанного белка GFP в клетках образца, где на основе распределения флуоресценции в клетках образца делают вывод о наличии или отсутствии проникновения отдельных углеродных нанотрубок в ткань образца.
Отличительные признаки изобретения:
- геном клеток, входящих в биологическую ткань содержит промотор гена теплового шока, сшитый с кодирующей областью дрожжевого транскрипционного фактора Gal4, и генетическую репортерную конструкцию UAS-GFP,
- добавление в биологическую ткань углеродных нанотрубок,
- на основе распределения флуоресценции в клетках образца делают вывод о наличии или отсутствии проникновения отдельных углеродных нанотрубок в ткань образца.
Принцип действия предлагаемого способа детектирования проникновения наноматериалов основан на высоком уровне поглощения света углеродными наноматериалами - углеродными нанотрубками (УНТ). Для нагревания углеродных наноматериалов - нанотрубок (УНТ) используют инфракрасное излучение (ИК) с длиной волны в «области прозрачности» биологических тканей. При этом инфракрасное излучение локально разогревает участок клетки, где расположена проникшая в клетку нанотрубка; в результате этого в клетке срабатывает механизм запуска реакции теплового шока, который является естественной стрессовой реакцией клетки на повреждающий фактор. Включение реакции теплового шока, регистрируют по индукции экспрессии генетического репортера (генетической репортерной конструкции UAS-GFP), которая, в свою очередь, регистрируется по наличию флуоресценции GFP в клетках органа, наблюдаемого, например, под флуоресцентным микроскопом. Если изучаемый орган содержит клетки в которые проникли нанотрубки и клетки не содержащие нанотрубок, то в органе будет наблюдаться свечение только части клеток. Что позволяет видеть дифференциальное распределение нанотрубок по ткани (проникновение отдельных нанотрубок в разные ткани).
Использование двух конструкций: P{w[+mC]=GAL4-Hsp70.PB}89-2-1 и P{w[+mC]=UAS-GFP.nls}8 - система hs-Gal4; UAS-GFP более чувствительна за счет использования промежуточного транскрипционного фактора Gal4 усиливающего сигнал, что позволяет повысить чувствительность способа и возможность видеть проникновение отдельных нанотрубок в разные ткани образца, что невозможно в рамках прототипа. При этом плотность мощности для нагревания нанотрубок ИК лазером, проникающих в ткани исследуемого образца составляет 10-100 мВт на квадратный миллиметр, а для ИК лампы 10-20 мВт, что является оптимальным при использовании инфракрасного излучение (ИК) с длиной волны λ~600-1100 нм, которая соответствует «области прозрачности» биологических тканей", и было найдено экспериментальным путем.
Детекцию осуществляют следующим образом: личинок Drosophila melanogaster, содержащий в геноме две конструкции: P{w[+mC]=GAL4-Hsp70.PB}89-2-1 и P{w[+mC]=UAS-GFP.nls}8 подвергают действию наночастиц - УНТ, добавленных в корм, затем нагревают инфракрасным светом лазера или лампы в прозрачной кювете с плотностью мощности 10-100 мВт на квадратный миллиметр для лазера или 10-20 мВт на квадратный миллиметр для лампы в течение 30-40 мин. Через несколько часов, после того, как в результате активации промотора теплового шока Hsp70 наработается GFP репортер, из личинок извлекают органы и наблюдают в них свечение GFP репортера. (Одна из генетических конструкций представляет собой промотор одного из генов теплового шока (Hsp70), сшитый с кодирующей областью дрожжевого транскрипционного фактора Gal4. Вторая конструкция представляет собой UAS дрожжевой промотор дрожжей, на который способен связываться с Gal4, сшитый с кодирующей областью зеленого флуоресцентного белка GFP.) Флуоресценцию GFP можно видеть во флуоресцентном микроскопе. В результате облучения, разогрева нанотрубок и передачи тепла клетке, происходит ее нагрев и нарабатывается белок Gal4, далее он садится на промотор UAS, с которого далее нарабатывается белок GFP, который видно во флуоресцентном микроскопе. Уровень проникновения нанотрубок осуществляют путем визуального наблюдения индукции экспрессии генетического репортера путем наличия флюоресценции, например, во флуоресцентном микроскопе и на основе анализа полученных изображений делают вывод о наличии или отсутствии проникновения углеродных наноматериалов - нанотрубок (УНТ) прошлом в клетки и/или образцы биологической ткани.
Пример 1.
Партию личинок Drosophila melanogaster всего 30 особей, по 5 особей в одной кювете, содержащих в геноме две конструкции: 1) промотор одного из генов теплового шока (Hsp70) сшитый с кодирующей областью дрожжевого транскрипционного фактора Gal4 (драйверная конструкция) - P{w[+mC]=GAL4-Hsp70.PB}89-2-1 и 2) репортерную конструкцию P{w[+mC]=UAS-GFP.nls}8 подвергают действию или кормят кормом в течение 2 дней, в который добавлены многослойные окисленные УНТ длиной ~1.5 мкм, при этом концентрация УНТ в корме составляла 32 мкг на мл. Далее личинок в прозрачной кювете нагревают инфракрасным излучением лазера (λ=1063 нм) с плотностью мощности 20 мВт на квадратный миллиметр в течение 30 мин. Через 3 часа, после того, как в результате активации промотора теплового шока Hsp70 наработается GFP репортер из личинок извлекают имагинальные диски, и наблюдают в них наличие флуоресценции GFP репортера во флуоресцентном микроскопе, по которой делают качественный вывод о наличии УНТ в ткани образца.
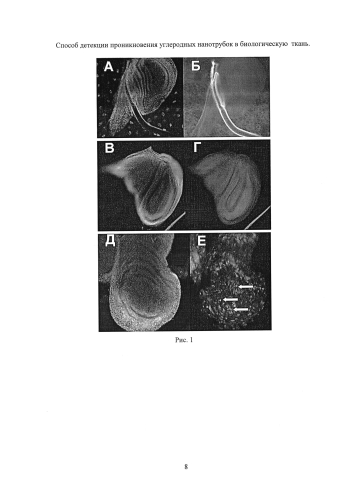
На Рис. 1 приведены результаты эксперимента с окисленными УНТ длиной ~1.5 мкм:
(А, Б) Контроль 1 - крыловой имагинальный диск личинки третьего возраста, которая содержалась на корме с УНТ без облучения ИК (А - изображение диска с окрашенными ядрами (DAPI), Б - флуоресценция диска в канале GFP. GFP сигнал отсутствует).
(В, Г) Контроль 2 - крыловой имагинальный диск личинки третьего возраста, которая содержалась на корме без УНТ, но была облучена ИК лазером. GFP сигнал отсутствует.
(Д, Е) Опыт - крыловой имагинальный диск личинки третьего возраста, которых кормили УНТ и облучили ИК лазером. Видна флуоресценция части клеток имагинального диска (некоторые из них показаны стрелками), которая свидетельствует о том, что УНТ прошли через стенку кишечника, внедрились в некоторые клетки имагинального диска и вызвали активацию GFP репортера.
Пример 2.
Партию личинок Drosophila melanogaster всего 30 особей, по 5 особей в одной кювете, содержащих в геноме две конструкции: 1) промотор одного из генов теплового шока (Hsp70) сшитый с кодирующей областью дрожжевого транскрипционного фактора Gal4 (драйверная конструкция) - P{w[+mC]=GAL4-Hsp70.PB}89-2-1 и 2) репортерную конструкцию P{w[+mC]=UAS-GFP.nls}8 подвергают действию или кормят кормом, содержащим многослойные УНТ длиной ~100 мкм, в течение 2 дней, при этом концентрация УНТ в корме составляла 32 мкг/мл. Далее личинок в прозрачной кювете нагревают инфракрасным излучением лазера (λ=1063 нм) с плотностью мощности 20 мВт на квадратный миллиметр в течение 30 мин. Через 3 часа, после того, как в результате активации промотора теплового шока Hsp70 наработается GFP репортер из личинок извлекают имагинальные диски и наблюдают в них наличие флуоресценции GFP репортера во флуоресцентном микроскопе, по которой делают качественный вывод о наличии УНТ в ткани образца.
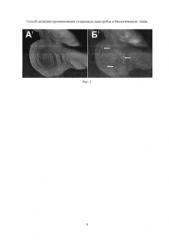
На Рис. 2 (А1, Б1) приведены результаты эксперимента. Крыловой имагинальный диск личинки третьего возраста, которая содержалась с УНТ и была нагрета (обработана) ИК лазером. Видна флуоресценция части клеток имагинального диска (некоторые из них показаны стрелками), которая свидетельствует о том, что УНТ прошли через стенку кишечника, внедрились в некоторые клетки имагинального диска и вызвали активацию GFP репортера.
Пример 3.
Партию личинок Drosophila melanogaster всего 30 особей, по 5 особей в одной кювете, содержащих в геноме две конструкции: 1) промотор одного из генов теплового шока (Hsp70) сшитый с кодирующей областью дрожжевого транскрипционного фактора Gal4 (драйверная конструкция) - P{w[+mC]=GAL4-Hsp70.PB}89-2-1 и 2) репортерную конструкцию P{w[+mC]=UAS-GFP.nls}8 подвергают действию или кормят кормом в течение 2 дней, в который добавлены многослойные модифицированные УНТ длиной ~100 мкм, при этом концентрация УНТ в корме составляла 32 мкг на мл. Далее личинок в прозрачной кювете нагревают инфракрасным излучением инфракрасной лампы со спектром излучения в диапазоне λ~600-1000 нм и плотностью мощности 10 мВт на квадратный миллиметр в течение 30 мин. Через 3 часа, после того, как в результате активации промотора теплового шока Hsp70 наработается GFP репортер из личинок извлекают имагинальные диски, и наблюдают в них наличие флуоресценции GFP репортера во флуоресцентном микроскопе, по которой делают качественный вывод о наличии УНТ в клетках и/или ткани образца.
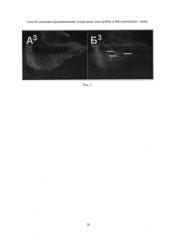
На Рис. 3 (А3, Б3) приведены результаты эксперимента. Обозначения те же, что и на Рис. 1. Крыловой имагинальный диск личинки третьего возраста, которая содержалась с УНТ и была облучена инфракрасным излучением ИК лампы. Видна флуоресценция части клеток имагинального диска (некоторые из них показаны стрелками), которая свидетельствует о том, что УНТ прошли через стенку кишечника, внедрились в некоторые клетки имагинального диска и вызвали активацию GFP репортера.
Приведенные примеры демонстрируют, что в тканях личинок, которых кормили УНТ, регистрируется свечение отдельных клеток органа, это означает, что клетки различаются по количеству нанотрубок, которые в них проникли. Эффект теплового шока вызывается либо отдельными нанотрубками, либо их агломератами. Наиболее вероятно, что эффект теплового шока в наших условиях наблюдается когда в клетке формируется агломерат, содержащий около 100 нанотрубок. В сравнении с прототипом наш метод чувствительнее на несколько порядков (от 102 до 108 раз). Кроме того, из экспериментальных данных следует, что свечение отдельных клеток органа личинок, которых кормили УНТ, появляется вне зависимости от длины и химического состояния поверхности УНТ.
Способ детекции проникновения углеродных нанотрубок в биологическую ткань, в которой геном клеток, входящих в биологическую ткань, содержит промотор гена теплового шока, сшитый с кодирующей областью дрожжевого транскрипционного фактора Gal4, и генетическую репортерную конструкцию UAS-GFP, включающий добавление в биологическую ткань углеродных нанотрубок, нагревание образца биологической ткани инфракрасным излучением, после чего проводят детекцию проникновения нанотрубок путем визуального наблюдения индукции экспрессии репортерной конструкции, регистрируемой по флуоресценции наработанного белка GFP в клетках образца, где на основе распределения флуоресценции в клетках образца делают вывод о наличии или отсутствии проникновения отдельных углеродных нанотрубок в ткань образца.